مشبك كيميائي
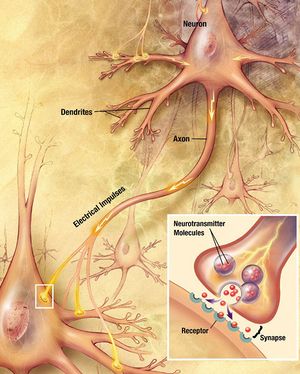
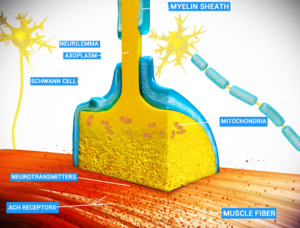
المشابك الكيميائية هي وصلات بيولوجية يمكن من خلالها إرسال إشارات الخلايا العصبية إلى بعضها البعض وإلى الخلايا غير العصبية مثل تلك الموجودة في العضلات أو الغدد . تسمح المشابك الكيميائية للخلايا العصبية بتشكيل دوائر داخل الجهاز العصبي المركزي . إنها ضرورية للحسابات البيولوجية التي تكمن وراء الإدراك والفكر. إنها تسمح للجهاز العصبي بالاتصال والتحكم في أنظمة الجسم الأخرى.
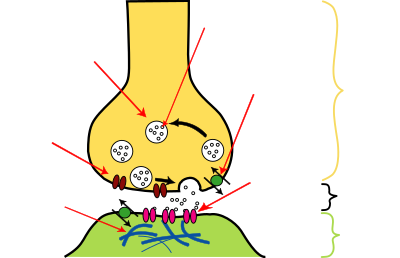
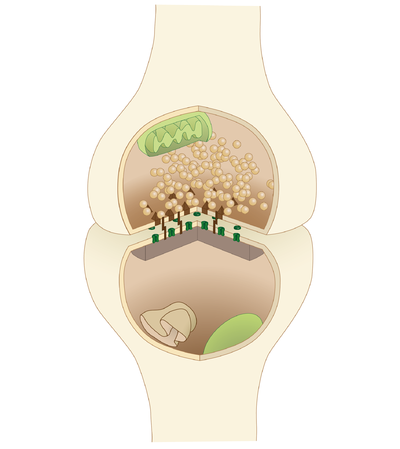
في المشابك الكيميائية ، تطلق إحدى الخلايا العصبية جزيئات الناقل العصبي في مساحة صغيرة ( الشق المشبكي ) مجاورة لعصبون آخر. يتم احتواء الناقلات العصبية داخل أكياس صغيرة تسمى الحويصلات المشبكية ، ويتم إطلاقها في الشق المشبكي عن طريق الإيماس. ثم ترتبط هذه الجزيئات بمستقبلات الناقل العصبي في الخلية ما بعد المشبكي. أخيرًا ، يتم مسح الناقلات العصبية من المشبك من خلال إحدى الآليات المحتملة العديدة بما في ذلك التحلل الأنزيمي أو إعادة الامتصاص بواسطة ناقلات محددة إما على الخلية قبل المشبكية أو على بعض خلايا الدبق العصبية الأخرى لإنهاء عمل الناقل العصبي.
تشير التقديرات إلى أن دماغ الإنسان البالغ يحتوي على ما بين 10 14 إلى 5 × 10 14 (100-500 تريليون) مشابك عصبية.[1] يحتوي كل مليمتر مكعب من القشرة المخية على ما يقرب من مليار ( مقياس قصير ، أي 10 9 ) منهم..[2] تم تقدير عدد نقاط الاشتباك العصبي في القشرة المخية البشرية بشكل منفصل بـ 0.15 كوادريليون (150 تريليون)[3]
اطلق السير تشارلز شرنگتون كلمة "المشبك" عام 1897.[4] المشابك الكيميائية ليست هي النوع الوحيد من المشابك البيولوجية: توجد أيضًا مشابك كهربائية ومناعية . ومع ذلك ، بدون محدد ، يشير مصطلح "المشبك" عادة إلى المشبك الكيميائي..
البنية
| بنية مشبك كيميائي نمطي |
|---|
| التمييز ما قبل وما بعد المشبك[5] |
|---|
| "يرتبط العصبون بالعصبون عن طريق المشبك. تدفقات الإشارة في اتجاه واحد، من العصبون قبل المشبكي إلى العصبون بعد المشبكي عبر المشبك الذي يعمل كموهن متغير". [5] اختصاراً، تحدد بدائية الإشارة المعنية اتجاه تدفق الإشارة.[5] |
نقاط الاشتباك العصبي هي وصلات وظيفية بين الخلايا العصبية ، أو بين الخلايا العصبية وأنواع أخرى من الخلايا.[6][7] ينتج عن الخلية العصبية النموذجية عدة آلاف من نقاط الاشتباك العصبي ، على الرغم من وجود بعض الأنواع التي تنتج أقل بكثير.[8] تربط معظم نقاط الاشتباك العصبي المحاور بالتغصنات,[9][10] ولكن هناك أيضًا أنواع أخرى من التوصيلات ، بما في ذلك محور عصبي بجسم خلية ,[11][12] محور عصبي إلى محور عصبي,[11][12] و التغصنات إلى التغصنات.[10] تكون نقاط الاشتباك العصبي بشكل عام صغيرة جدًا بحيث لا يمكن التعرف عليها باستخدام مجهر ضوئي باستثناء النقاط التي يبدو أن أغشية خليتين تتلامس فيها ، ولكن يمكن تصور عناصرها الخلوية بوضوح باستخدام المجهر الإلكتروني.
تمرر المشابك الكيميائية المعلومات بشكل مباشر من خلية ما قبل المشبك إلى خلية ما بعد المشبك وبالتالي فهي غير متماثلة في الهيكل والوظيفة. الطرف المحوري قبل المشبكي ، أو الحبة المشبكية ، هي منطقة متخصصة داخل محور الخلية قبل المشبكية تحتوي على نواقل عصبية محاطة بأغشية صغيرة مرتبطة بأغشية تسمى الحويصلات المتشابكة (بالإضافة إلى عدد من الهياكل والعضيات الداعمة الأخرى ، مثل المتقدرة و شبكية إندوبلازمية ). ترسو الحويصلات المشبكية في غشاء البلازما قبل المشبكي في مناطق تسمى المناطق النشطة .
على النقيض من ذلك ، توجد منطقة من الخلية ما بعد المشبكية تحتوي على مستقبلات ناقل عصبي ؛ بالنسبة لنقاط الاشتباك العصبي بين اثنين من الخلايا العصبية ، يمكن العثور على منطقة ما بعد المشبك على التغصنات أو جسم الخلية. مباشرة خلف الغشاء بعد المشبكي يوجد مركب متقن من البروتينات المترابطة تسمى كثافة ما بعد المشبكي (PSD).
تشارك البروتينات في PSD في ترسيخ مستقبلات الناقلات العصبية والاتجار بها وتعديل نشاط هذه المستقبلات. غالبًا ما توجد المستقبلات و PSDs في نتوءات متخصصة من العمود التغصني الرئيسي تسمى العمود الفقري التغصني .
يمكن وصف المشابك العصبية بأنها متماثلة أو غير متماثلة. عند فحصها تحت المجهر الإلكتروني ، تتميز المشابك غير المتماثلة بحويصلات دائرية في الخلية قبل المشبكية ، وكثافة بارزة بعد المشبكي. المشابك غير المتماثلة عادة ما تكون مثيرة. على النقيض من ذلك ، فإن المشابك المتماثلة لها حويصلات مسطحة أو مستطيلة ، ولا تحتوي على كثافة بارزة بعد المشبكي. المشابك المتماثلة عادة ما تكون مثبطة.
الشق المشبكي - يسمى أيضًا بالفجوة المشبكية - هو فجوة بين الخلايا السابقة والخلايا بعد المشبكية والتي تبلغ حوالي 20 نانومتر (0.02 ميكرومتر).[5] يسمح الحجم الصغير للشق بزيادة تركيز الناقل العصبي وخفضه بسرعة.[13]
إن المشبك الشريطي عبارة عن مشابك كيميائية (أو كهربائية) تتكون عندما يتشابك محور عصبون مع التغصنات الخاصة به.
التأشير في المشابك الكيميائية
نظرة عامة
فيما يلي ملخص لتسلسل الأحداث التي تحدث في انتقال متشابك من الخلايا العصبية قبل المشبكي إلى خلية ما بعد المشبكي. يتم شرح كل خطوة بمزيد من التفاصيل أدناه. لاحظ أنه باستثناء الخطوة الأخيرة ، قد تعمل العملية بأكملها فقط بضع مئات من الميكروثانية ، في أسرع نقاط الاشتباك العصبي.[14]
- تبدأ العملية بموجة من الإثارة الكهروكيميائية تسمى كمون الفعل ينتقل على طول غشاء الخلية قبل المشبكية ، حتى يصل إلى المشبك.
- يؤدي نزع الاستقطاب الكهربائي للغشاء عند المشبك إلى فتح قنوات قابلة للنفاذ إلى أيونات الكالسيوم.
- تتدفق أيونات الكالسيوم عبر الغشاء قبل المشبكي ، مما يزيد بسرعة تركيز الكالسيوم في الداخل.
- ينشط تركيز الكالسيوم العالي مجموعة من البروتينات الحساسة للكالسيوم مرتبطة بالحويصلات التي تحتوي على مادة كيميائية ناقل عصبي .
- تغير هذه البروتينات شكلها ، مما يتسبب في اندماج أغشية بعض الحويصلات "المجتزأة" مع غشاء الخلية قبل المشبكي ، وبالتالي فتح الحويصلات وإلقاء محتويات الناقل العصبي في الشق المشبكي ، وهو المساحة الضيقة بين أغشية ما قبل المشبكي وما خلايا بعد المشبكي.
- ينتشر الناقل العصبي داخل الشق. يفلت بعضها ، لكن بعضها يرتبط بجزيئات المستقبلات الكيميائية الموجودة على غشاء الخلية ما بعد المشبكي.
- يؤدي ارتباط الناقل العصبي إلى تنشيط جزيء المستقبل بطريقة ما. هناك عدة أنواع من التنشيط ممكنة ، كما هو موضح بمزيد من التفصيل أدناه. على أي حال ، هذه هي الخطوة الأساسية التي تؤثر بها العملية المشبكية على سلوك الخلية ما بعد المشبكي.
- بسبب الاهتزاز الحراري ، فإن حركة الذرات ، التي تهتز حول مواضع توازنها في مادة صلبة بلورية ، تنفصل جزيئات الناقل العصبي في النهاية عن المستقبلات وتنجرف بعيدًا.
- يتم إعادة امتصاص الناقل العصبي بواسطة الخلية قبل المشبكية ، ثم يتم إعادة تعبئته لاطلاقه فيما بعد ، أو يتم تكسيره استقلابيا.
إطلاق الناقل العصبي
يتم تحفيز إطلاق ناقل عصبي من خلال وصول نبضة عصبية (أو كمون الفعل ) وتحدث من خلال عملية إفراز خلوي سريعة غير معتادة ( إيماس). داخل محطة العصب قبل المشبكي ، يتم توطين الحويصلات التي تحتوي على ناقل عصبي بالقرب من الغشاء المشبكي. ينتج عن كمون الفعل القادم تدفق أيونات الكالسيوم من خلال قنوات أيونات انتقائية تعتمد على الجهد والكالسيوم عند الشوط السفلي لكمون الفعل (تيار الذيل).[15] ثم ترتبط أيونات الكالسيوم ببروتينات سينابتوتاجمين الموجودة داخل أغشية الحويصلات المشبكية ، مما يسمح للحويصلات بالاندماج مع الغشاء قبل المشبكي.[16] اندماج الحويصلة هو عملية عشوائية تؤدي إلى فشل متكرر في النقل المتشابك في نقاط الاشتباك العصبي الصغيرة جدًا التي تعتبر نموذجية للجهاز العصبي المركزي . المشابك الكيميائية الكبيرة (مثل الوصل العصبي العضلي ) ، من ناحية أخرى ، لها احتمال إطلاق متشابك 1. يتم تحفيز اندماج الحويصلة بفعل مجموعة من البروتينات في طرف ما قبل المشبكي المعروف باسم SNAREs . بشكل عام ، يسمى مجمع البروتين أو الهيكل الذي يتوسط في الالتحام ودمج الحويصلات قبل المشبكية بالمنطقة النشطة..[17] تم استرداد الغشاء الذي تمت إضافته بواسطة عملية الاندماج لاحقًا عن طريق الالتقام الخلوي وإعادة تدويره لتشكيل حويصلات جديدة مليئة بالناقلات العصبية..
تم العثور على استثناء للاتجاه العام لإطلاق الناقل العصبي عن طريق الاندماج الحويصلي في خلايا مستقبلات النوع الثاني من براعم الذوق في الثدييات. هنا يتم تحرير الناقل العصبي ثلاثي فوسفات الأدنوسين مباشرة من السيتوبلازم إلى الشق المشبكي عبر قنوات الجهد.[18]
ربط المستقبل
ترتبط المستقبلات الموجودة على الجانب الآخر من الفجوة المشبكية بجزيئات الناقل العصبي. يمكن أن تستجيب المستقبلات بإحدى الطريقتين العامتين. أولاً ، قد تفتح المستقبلات قنوات أيونية ذات بوابات لجينية مباشرة في غشاء الخلية بعد المشبكي ، مما يتسبب في دخول الأيونات أو الخروج منها وتغيير كمونات الغشاء المحلي.[14] يسمى التغيير الناتج في الجهد بكمون ما بعد المشبكي . بشكل عام ، تكون النتيجة مثيرة في حالة التيارات المزيلة للاستقطاب ، ومثبطة في حالة التيارات المفرطة الاستقطاب . يعتمد ما إذا كان المشبك مثيرًا أو مثبطًا على نوع (أنواع) القناة الأيونية التي تنقل تيار (تيارات) ما بعد المشبكي ، والتي بدورها هي وظيفة لنوع المستقبلات والناقل العصبي المستخدم في المشبك. الطريقة الثانية التي يمكن للمستقبل من خلالها التأثير على إمكانات الغشاء هي عن طريق تعديل إنتاج الرسائل الكيميائية داخل الخلايا العصبية بعد المشبكية. يستطيع هؤلاء المرسال الثانيون بعد ذلك تضخيم الاستجابة المثبطة أو الاستثارة للنواقل العصبية.[14]
النهاية
بعد أن يرتبط جزيء الناقل العصبي بجزيء المستقبل ، يجب إزالته للسماح للغشاء بعد المشبكي بالاستمرار في ترحيل EPSPs و / أو IPSPs اللاحقة . يمكن أن تحدث هذه الإزالة من خلال عملية واحدة أو أكثر:
- قد ينتشر الناقل العصبي بعيدًا بسبب التذبذبات الحرارية لكل منهما والمستقبل ، مما يجعله متاحًا للاستقلاب خارج الخلية العصبية أو إعادة امتصاصه.[19]
- قد تؤدي الإنزيمات الموجودة في الغشاء تحت المشبكي إلى تعطيل / استقلاب الناقل العصبي.
- قد تضخ مضخات الاسترداد بشكل فعال الناقل العصبي مرة أخرى إلى محطة المحوار قبل المشبكي لإعادة المعالجة وإعادة الإصدار بعد كمون فعل لاحق.[19]
قوة المشبك
تم تعريف قوة المشبك من قبل السير برنارد كاتز على أنها نتاج احتمال إطلاق (قبل المشبكي) ، والحجم الكمي q (استجابة ما بعد المشبكي لإطلاق حويصلة ناقل عصبي واحد ، "كم") ، و ن ، العدد من مواقع الاطلاق. يشير مصطلح "الاتصال الأحادي" عادةً إلى عدد غير معروف من المشابك الفردية التي تربط بين عصبون ما قبل المشبكي وخلايا عصبية ما بعد المشبكي. يمكن أن يكون اتساع الكمونات ما بعد المشبكي (PSPs) منخفضًا من 0.4 مللي فولت إلى 20 مللي فولت.[20] يمكن تعديل سعة PSP بواسطة التعديلات العصبية أو يمكن أن تتغير نتيجة للنشاط السابق. يمكن أن تكون التغييرات في القوة المشبكية قصيرة المدى ، وتستمر من ثوانٍ إلى دقائق ، أو طويلة المدى (تقوية طويلة المدى ، أو LTP) ، وتدوم لساعات. يُعتقد أن التعلم والذاكرة ناتجان عن تغييرات طويلة المدى في قوة التشابك ، عبر آلية تُعرف باسم اللدونة المشبكية.
إزالة تحسس المستقبل
إن إزالة حساسية مستقبلات ما بعد المشبكي هو انخفاض في الاستجابة لنفس منبه الناقل العصبي. وهذا يعني أن قوة المشبك قد تتضاءل في الواقع مع وصول سلسلة من كمونات الفعل في تتابع سريع - وهي ظاهرة تؤدي إلى ما يسمى بالاعتماد على التردد للمشابك. يستغل الجهاز العصبي هذه الخاصية لأغراض حسابية ، ويمكنه ضبط نقاط الاشتباك العصبي من خلال وسائل مثل فسفرة البروتينات المعنية.
لدونة مشبكية
يمكن تغيير الإرسال المتشابك من خلال النشاط السابق. تسمى هذه التغييرات اللدونة المشبكية وقد تؤدي إما إلى انخفاض فعالية المشبك ، وتسمى بالانخفاض ، أو زيادة في الفعالية ، تسمى التقوية. يمكن أن تكون هذه التغييرات طويلة الأجل أو قصيرة الأجل. تشمل أشكال اللدونة قصيرة المدى الاجهاد المشبكي أو الانخفاض وزيادة التشابك العصبي . تشمل أشكال اللدونة طويلة الأمد الانخفاض طويل الأمد والتقوية طويلة الأمد . يمكن أن تكون اللدونة المشبكية إما متجانسة المشبك (تحدث في مشبك واحد) أو مغايرة المشبك (تحدث في نقاط الاشتباك العصبي المتعددة).
اللدونة المشبكية المتجانسة=
اللدونة المشبكية المتجانسة (أو التعديل المتماثل أيضًا) هي تغيير في القوة المشبكية التي تنتج عن تاريخ النشاط في مشابك معينة. يمكن أن ينتج هذا عن تغيرات في الكالسيوم قبل المشبكي وكذلك التغذية المرتدة على مستقبلات ما قبل المشبكي ، أي شكل من أشكال إشارات الأوتوكرين . يمكن أن تؤثر اللدونة المتجانسة المشبكية على عدد الحويصلات ومعدل تجديدها أو يمكن أن تؤثر على العلاقة بين إطلاق الكالسيوم والحويصلة. يمكن أيضًا أن تكون اللدونة المتماثلة المشبكية ذات طبيعة ما بعد المشبكي. يمكن أن يؤدي إما إلى زيادة أو نقصان في قوة التشابك.
أحد الأمثلة على ذلك هو الخلايا العصبية للجهاز العصبي الودي (SNS) ، التي تطلق نورإپينفرين ، والتي ، إلى جانب التأثير على مستقبلات ما بعد المشبكي ، تؤثر أيضًا على مستقبلات α2 الأدرينالية قبل المشبكية ، مما يمنع إطلاق المزيد من النورإپينفرين..[21] تم استخدام هذا التأثير مع الكلونيدين لأداء تأثيرات مثبطة على SNS.
اللدونة المشبكية الغير متجانسة
اللدونة غير المتجانسة (أو التعديل غير المتجانس أيضًا) هي تغيير في القوة المشبكية ينتج عن نشاط الخلايا العصبية الأخرى. مرة أخرى ، يمكن أن تغير اللدونة عدد الحويصلات أو معدل تجديدها أو العلاقة بين إطلاق الكالسيوم والحويصلة. بالإضافة إلى ذلك ، يمكن أن يؤثر بشكل مباشر على تدفق الكالسيوم. يمكن أيضًا أن تكون اللدونة غير المتجانسة ذات طبيعة ما بعد المشبكية ، مما يؤثر على حساسية المستقبلات.
أحد الأمثلة مرة أخرى هو الخلايا العصبية للجهاز العصبي الودي ، التي تطلق النورإپينفرين ، والتي ، بالإضافة إلى ذلك ، تولد تأثيرًا مثبطًا على النهايات قبل المشبكية للخلايا العصبية في الجهاز العصبي اللاودي .[21]
تكامل المدخلات المشبكية
بشكل عام ، إذا كان المشبك الاستثاري قويًا بدرجة كافية ، فإن كمونات الفعل في الخلايا العصبية قبل المشبكية ستطلق كمون فعل في خلية ما بعد المشبك. في كثير من الحالات ، لن تصل كمونات ما بعد المشبك المثيرة (EPSP) إلى العتبية لاستنباط جهد فعل. عندما تطلق كمونات افعمل من العديد من الخلايا العصبية قبل المشبكية في وقت واحد ، أو إذا اشتعلت نيران عصبون قبل المشبكي بتردد عالٍ بما يكفي ، يمكن أن تتداخل EPSP وتجمعها. إذا تداخل عدد كافٍ من عناصر EPSP ، فيمكن أن يصل EPSP المجموع الي العتبية لبدء كمون الفعل. تُعرف هذه العملية باسم التجميع ، ويمكن أن تكون بمثابة مرشح تمرير عالي للخلايا العصبية..[22]
من ناحية أخرى ، يمكن للخلايا العصبية قبل المشبكية التي تطلق ناقلًا عصبيًا مثبطًا ، مثل GABA ، أن تسبب كمونات ما بعد المشبك المثبطة (IPSP) في الخلايا العصبية بعد المشبكية ، مما يرفع جهد الغشاء بعيدًا عن العتبية ، مما يقلل من استثارته ويجعلها أكثر صعوبة بالنسبة الخلايا العصبية لبدء كمون الفعل. إذا تداخل IPSP مع EPSP ، يمكن لـ IPSP في كثير من الحالات منع الخلايا العصبية من إطلاق كمون فعل. بهذه الطريقة ، قد يعتمد إخراج الخلايا العصبية على مدخلات العديد من الخلايا العصبية المختلفة ، وقد يكون لكل منها درجة مختلفة من التأثير ، اعتمادًا على قوة ونوع المشبك مع تلك العصبون. أجرى جون إكلز بعض التجارب المبكرة المهمة حول التكامل المشبكي ، والتي حصل عليها على جائزة نوبل في علم وظائف الأعضاء أو الطب في عام 1963.
نقل الحجم
عندما يتم إطلاق ناقل عصبي عند المشبك ، فإنه يصل إلى أعلى تركيز له داخل المساحة الضيقة للشق المشبكي ، ولكن من المؤكد أن بعضه ينتشر بعيدًا قبل إعادة امتصاصه أو تفكيكه. إذا انتشر بعيدًا ، فإن لديه القدرة على تنشيط المستقبلات الموجودة إما في نقاط الاشتباك العصبي الأخرى أو على الغشاء بعيدًا عن أي مشابك. يُعرف النشاط خارج المشبكي للناقل العصبي باسم انتقال الحجم.[23] من الثابت أن مثل هذه الآثار تحدث إلى حد ما ، لكن أهميتها الوظيفية كانت منذ فترة طويلة موضع جدل.[24]
يشير العمل الأخير إلى أن نقل الحجم قد يكون هو النمط السائد للتفاعل لبعض الأنواع الخاصة من الخلايا العصبية. في القشرة الدماغية لدى الثدييات، فئة من الخلايا العصبية تسمى خلايا الدبق العصبي يمكن أن تمنع الخلايا العصبية القشرية الأخرى المجاورة عن طريق اطلاق الناقل العصبي GABA في الحيز خارج الخلية..[25] على نفس المنوال ، يعمل GABA المنطلق من الخلايا العصبية في الحيز خارج الخلية أيضًا على الخلايا النجمية المحيطة ، مع إعطاء دور لنقل الحجم في التحكم في التوازن الأيوني والناقل العصبي.[26] ما يقرب من 78 ٪ من خلايا الخلايا العصبية لا تشكل نقاط الاشتباك العصبي الكلاسيكية. قد يكون هذا أول مثال نهائي على اتصال الخلايا العصبية كيميائيًا حيث لا توجد نقاط الاشتباك العصبي الكلاسيكية.[25]
العلاقة بالمشبك الكهربي
المشبك الكهربائي هو رابط موصل كهربائيًا بين خليتين عصبيتين متجاورتين تتشكلان في فجوة ضيقة بين الخلايا قبل المشبكية وخلايا ما بعد المشبك ، والمعروفة باسم موصل الفجوة. عند موصلات الفجوة ، تقترب الخلايا من حوالي 3.5 نانومتر من بعضها البعض ، بدلاً من مسافة 20 إلى 40 نانومتر[27][28] على عكس المشابك الكيميائية ، فإن كمونات ما بعد المشبك في المشابك الكهربائية لا تنتج عن فتح القنوات الأيونية بواسطة الناقلات الكيميائية ، ولكن بالأحرى عن طريق الاقتران الكهربائي المباشر بين كلا العصبونات. المشابك الكهربائية أسرع من المشابك الكيميائية.[13] تم العثور على المشابك الكهربائية في جميع أنحاء الجهاز العصبي ، بما في ذلك في شبكية العين ، والنواة المهادية الشبكية ، والقشرة المخية الحديثة ، وفي الحصين .[29] بينما تم العثور على المشابك الكيميائية بين كل من الخلايا العصبية المثيرة والمثبطة ، فإن المشابك الكهربائية توجد بشكل شائع بين الخلايا العصبية المثبطة المحلية الأصغر. يمكن أن توجد المشابك الكهربائية بين محورين ، اثنين من التشعبات ، أو بين محور عصبي والتغصنات.[30][31] في بعض الأسماك والبرمائيات ، يمكن العثور على المشابك الكهربائية داخل نفس طرف المشبك الكيميائي ، كما هو الحال في خلايا ماوثنر .[32]
التأثير على الأدوية
واحدة من أهم سمات المشابك الكيميائية هي أنها موقع عمل غالبية عقاقير نفسية المفعول . تتأثر نقاط الاشتباك العصبي بالعقاقير مثل الكورار و ستريكنين و كوكاين و مورفين والكحول و ثنائي إيثيلاميد حمضِ الليسرجيك والعديد من الأدوية الأخرى. هذه الأدوية لها تأثيرات مختلفة على الوظيفة المشبكية ، وغالبًا ما تقتصر على المشابك التي تستخدم ناقلًا عصبيًا معينًا. على سبيل المثال ، كورار هو السم الذي يمنع أستيل كولين من إزالة استقطاب الغشاء بعد المشبكي ، مما يسبب الشلل . يمنع الإستركنين التأثيرات المثبطة للناقل العصبي الگلايسين ، مما يجعل الجسم يلتقط ويتفاعل مع المنبهات الأضعف والتي تم تجاهلها سابقًا ، مما يؤدي إلى تقلصات عضلية لا يمكن السيطرة عليها. يعمل المورفين على نقاط الاشتباك العصبي التي تستخدم الناقلات العصبية للإندورفين ، ويزيد الكحول من التأثيرات المثبطة للناقل العصبي GABA . يتداخل ثنائي إيثيل أميد حمض الليسرجيك مع المشابك التي تستخدم الناقل العصبي السروتونين . يمنع الكوكايين امتصاص الدوپامين وبالتالي يزيد من آثاره.
التاريخ والتسمية
خلال الخمسينيات من القرن الماضي ، لاحظ برنارد كاتز وبول فات التيارات المتشابكة التلقائية المصغرة عند الموصل العصبي العضلي للضفدع.[citation needed] بناءً على هذه الملاحظات ، طوروا "الفرضية الكمية" التي هي الأساس لفهمنا الحالي لإطلاق الناقل العصبي كإخراج خلوي (إيماس) والذي حصل كاتز جائزة نوبل في الفيسيولوجيا أو الطب في عام 1970.[citation needed] في أواخر الستينيات ، طور ريكاردو ميليدي وكاتز الفرضية القائلة بأن تدفق أيونات الكالسيوم الناجم عن إزالة الاستقطاب يؤدي إلى الاخراج الخلوي (إيماس).
صاغ السير تشارلز شرنگتون كلمة "المشبك" وأعطى شيرينجتون تاريخ الكلمة في رسالة كتبها إلى جون فولتون:
'I felt the need of some name to call the junction between nerve-cell and nerve-cell... I suggested using "syndesm"... He [ Sir Michael Foster ] consulted his Trinity friend Verrall, the Euripidean scholar, about it, and Verrall suggested "synapse" (from the Greek "clasp").'–Charles Scott Sherrington[4]
انظر أيضاً
الهوامش
- ^ Drachman D (2005). "Do we have brain to spare?". Neurology. 64 (12): 2004–5. doi:10.1212/01.WNL.0000166914.38327.BB. PMID 15985565.
- ^ Alonso-Nanclares L, Gonzalez-Soriano J, Rodriguez JR, DeFelipe J (September 2008). "Gender differences in human cortical synaptic density". Proc. Natl. Acad. Sci. U.S.A. 105 (38): 14615–9. Bibcode:2008PNAS..10514615A. doi:10.1073/pnas.0803652105. PMC 2567215. PMID 18779570.
- ^ Brain Facts and Figures Washington University.
- ^ أ ب Cowan, W. Maxwell; Südhof, Thomas C.; Stevens, Charles F. (2003). Synapses. JHU Press. p. 11. Retrieved 9 June 2020.
- ^ أ ب ت ث Widrow, Bernard; Kim, Youngsik; Park, Dookun; Perin, Jose Krause (2019). "Nature's Learning Rule". Artificial Intelligence in the Age of Neural Networks and Brain Computing. Elsevier. pp. 1–30. doi:10.1016/b978-0-12-815480-9.00001-3. ISBN 978-0-12-815480-9.
- ^ Rapport, Richard L. (2005). Nerve Endings: The Discovery of the Synapse. W. W. Norton & Company. pp. 1–37. ISBN 978-0-393-06019-5.
- ^ Squire, Larry R.; Floyd Bloom; Nicholas Spitzer (2008). Fundamental Neuroscience. Academic Press. pp. 425–6. ISBN 978-0-12-374019-9.
- ^ Hyman, Steven E.; Eric Jonathan Nestler (1993). The Molecular Foundations of Psychiatry. American Psychiatric Pub. pp. 425–6. ISBN 978-0-88048-353-7.
- ^ Smilkstein, Rita (2003). We're Born to Learn: Using the Brain's Natural Learning Process to Create Today's Curriculum. Corwin Press. p. 56. ISBN 978-0-7619-4642-7.
- ^ أ ب Lytton, William W. (2002). From Computer to Brain: Foundations of Computational Neuroscience. Springer. p. 28. ISBN 978-0-387-95526-1. Axons connecting dendrite to dendrite are dendrodendritic synapses. Axons which connect axon to dendrite are called axodendritic synapses
- ^ أ ب
Garber, Steven D. (2002). Biology: A Self-Teaching Guide. John Wiley and Sons. p. 175. ISBN 978-0-471-22330-6.
synapses connect axons to cell body.
- ^ أ ب Weiss, Mirin; Dr Steven M. Mirin; Dr Roxanne Bartel (1994). Cocaine. American Psychiatric Pub. p. 52. ISBN 978-1-58562-138-5. Retrieved 2008-12-26. Axons terminating on the postsynaptic cell body are axosomatic synapses. Axons that terminate on axons are axoaxonic synapses
- ^ أ ب Kandel 2000, p. 182
- ^ أ ب ت Bear, Conners, Paradiso (2007). Neuroscience: exploring the brain. Philadelphia, PA: Lippincott Williams & Wilkins. pp. 113–118.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Llinás R, Steinberg IZ, Walton K (1981). "Relationship between presynaptic calcium current and postsynaptic potential in squid giant synapse". Biophysical Journal. 33 (3): 323–351. Bibcode:1981BpJ....33..323L. doi:10.1016/S0006-3495(81)84899-0. PMC 1327434. PMID 6261850.[dead link]
- ^ Chapman, Edwin R. (2002). "Synaptotagmin: A Ca2+ sensor that triggers exocytosis?". Nature Reviews Molecular Cell Biology (in الإنجليزية). 3 (7): 498–508. doi:10.1038/nrm855. ISSN 1471-0080. PMID 12094216.
- ^ Craig C. Garner and Kang Shen. Structure and Function of Vertebrate and Invertebrate Active Zones. Structure and Functional Organization of the Synapse. Ed: Johannes Hell and Michael Ehlers. Springer, 2008.
- ^ Romanov, Roman A.; Lasher, Robert S.; High, Brigit; Savidge, Logan E.; Lawson, Adam; Rogachevskaja, Olga A.; Zhao, Haitian; Rogachevsky, Vadim V.; Bystrova, Marina F.; Churbanov, Gleb D.; Adameyko, Igor; Harkany, Tibor; Yang, Ruibiao; Kidd, Grahame J.; Marambaud, Philippe; Kinnamon, John C.; Kolesnikov, Stanislav S.; Finger, Thomas E. (2018). "Chemical synapses without synaptic vesicles: Purinergic neurotransmission through a CALHM1 channel-mitochondrial signaling complex". Science Signaling. 11 (529): eaao1815. doi:10.1126/scisignal.aao1815. ISSN 1945-0877. PMC 5966022. PMID 29739879.
- ^ أ ب Sherwood L., stikawy (2007). Human Physiology 6e: From Cells to Systems
- ^ Díaz-Ríos M, Miller MW (June 2006). "Target-specific regulation of synaptic efficacy in the feeding central pattern generator of Aplysia: potential substrates for behavioral plasticity?". Biol. Bull. 210 (3): 215–29. doi:10.2307/4134559. JSTOR 4134559. PMID 16801496.
- ^ أ ب Rang, H.P.; Dale, M.M.; Ritter, J.M. (2003). Pharmacology (5th ed.). Edinburgh: Churchill Livingstone. p. 129. ISBN 978-0-443-07145-4.
- ^ Bruce Alberts; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter, eds. (2002). "Ch. 11. Section: Single Neurons Are Complex Computation Devices". Molecular Biology of the Cell (4th ed.). Garland Science. ISBN 978-0-8153-3218-3.
{{cite book}}: External link in|chapterurl=|chapterurl=ignored (|chapter-url=suggested) (help) - ^ Zoli M, Torri C, Ferrari R, et al. (1998). "The emergence of the volume transmission concept". Brain Res. Brain Res. Rev. 26 (2–3): 136–47. doi:10.1016/S0165-0173(97)00048-9. PMID 9651506.
- ^ Fuxe K, Dahlström A, Höistad M, et al. (2007). "From the Golgi-Cajal mapping to the transmitter-based characterization of the neuronal networks leading to two modes of brain communication: wiring and volume transmission" (PDF). Brain Res Rev. 55 (1): 17–54. doi:10.1016/j.brainresrev.2007.02.009. hdl:10447/9980. PMID 17433836.
- ^ أ ب Oláh S, Füle M, Komlósi G, et al. (2009). "Regulation of cortical microcircuits by unitary GABA-mediated volume transmission". Nature. 461 (7268): 1278–81. Bibcode:2009Natur.461.1278O. doi:10.1038/nature08503. PMC 2771344. PMID 19865171.
- ^ Rózsa M, Baka J, Bordé S, Rózsa B, Katona G, Tamás G, et al. (2015). "Unitary GABAergic volume transmission from individual interneurons to astrocytes in the cerebral cortex" (PDF). Brain Structure and Function. 222 (1): 651–659. doi:10.1007/s00429-015-1166-9. PMID 26683686.
- ^ Kandel 2000, p. 176
- ^ Hormuzdi 2004
- ^ Connors BW, Long MA (2004). "Electrical synapses in the mammalian brain". Annu. Rev. Neurosci. 27 (1): 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Veruki ML, Hartveit E (December 2002). "Electrical synapses mediate signal transmission in the rod pathway of the mammalian retina". J. Neurosci. 22 (24): 10558–66. doi:10.1523/JNEUROSCI.22-24-10558.2002. PMC 6758447. PMID 12486148.
- ^ Bennett MV, Pappas GD, Aljure E, Nakajima Y (March 1967). "Physiology and ultrastructure of electrotonic junctions. II. Spinal and medullary electromotor nuclei in mormyrid fish". J. Neurophysiol. 30 (2): 180–208. doi:10.1152/jn.1967.30.2.180. PMID 4167209.
- ^ Pereda AE, Rash JE, Nagy JI, Bennett MV (December 2004). "Dynamics of electrical transmission at club endings on the Mauthner cells". Brain Res. Brain Res. Rev. 47 (1–3): 227–44. CiteSeerX 10.1.1.662.9352. doi:10.1016/j.brainresrev.2004.06.010. PMID 15572174.
المصادر
- Carlson, Neil R. (2007). Physiology of Behavior (9th ed.). Boston, MA: Pearson Education. ISBN 978-0-205-59389-7.
{{cite book}}: Invalid|ref=harv(help) - Kandel, Eric R.; Schwartz, James H.; Jessell, Thomas M. (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 978-0-8385-7701-1.
{{cite book}}: Invalid|ref=harv(help) - Llinás R, Sugimori M, Simon SM (April 1982). "Transmission by presynaptic spike-like depolarization in the squid giant synapse". Proc. Natl. Acad. Sci. U.S.A. 79 (7): 2415–9. Bibcode:1982PNAS...79.2415L. doi:10.1073/pnas.79.7.2415. PMC 346205. PMID 6954549.
- Llinás R, Steinberg IZ, Walton K (1981). "Relationship between presynaptic calcium current and postsynaptic potential in squid giant synapse". Biophysical Journal. 33 (3): 323–352. Bibcode:1981BpJ....33..323L. doi:10.1016/S0006-3495(81)84899-0. PMC 1327434. PMID 6261850.
- Bear, Mark F.; Connors, Barry W.; Paradiso, Michael A. (2001). Neuroscience: Exploring the Brain. Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-3944-3.
- Hormuzdi, SG; Filippov, MA; Mitropoulou, G; Monyer, H; Bruzzone, R (March 2004). "Electrical synapses: a dynamic signaling system that shapes the activity of neuronal networks". Biochim Biophys Acta. 1662 (1–2): 113–137. doi:10.1016/j.bbamem.2003.10.023. PMID 15033583.
{{cite journal}}: Invalid|ref=harv(help) - Karp, Gerald (2005). Cell and Molecular Biology: concepts and experiments (4th ed.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-471-46580-5.
- Nicholls, J.G.; Martin, A.R.; Wallace, B.G.; Fuchs, P.A. (2001). From Neuron to Brain (4th ed.). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-439-3.
وصلات خارجية
- Synapse Review for Kids
- Synapses Biologymad.com (2004)
- Synapse – Cell Centered Database
- Atlas of Ultrastructure Neurocytology A great electron microscope picture gallery assembled by Kristen Harris' lab of synapses and other neuronal structures.