بورتزوميب
 | |
 | |
| البيانات السريرية | |
|---|---|
| الأسماء التجارية | ڤالكاد Valcade، شموبورت Chemobort من سيتوجن فارما |
| أسماء أخرى | PS-341 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a607007 |
| License data |
|
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | تحت الجلد، في الوريد |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية |
|
| بيانات الحركية الدوائية | |
| ارتباط الپروتين | 83% |
| الأيض | الكبد، CYP extensively involved |
| Elimination half-life | 9 إلى 15 ساعة |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| PDB ligand | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.125.601 |
| Chemical and physical data | |
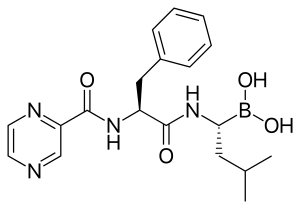
| التركيب | C19H25BN4O4 |
| الكتلة المولية | 384.237 گ/مول |
| 3D model (JSmol) | |
| |
| |
| (verify) | |
البورتزوميب Bortezomib (BAN، INN وUSAN؛ يُسوق تجارياً تحت اسم ڤـِلكاد Velcade من تكدا أونكولوجي؛ شـِموبورت Chemobort من سيتوجين وبورتـِكاد Bortecad من كاديلا هيلثكير)، هو دواء مضاد للسرطان ومثبط پروتيزوم دوائي من الخط الأول للاستخدام البشري. الپروتيزومات Proteasome هي مركبات خلوية تعمل على تكسير الپروتينات. في بعض حالات السرطان، تتكسر الپروتينات التي تعمل بشكل طبيعي على قتل الخلايا السرطانية بشكل سريع. يعوق البورتزوميب هذه العملية ويسمح لهذه الپروتينات بقتل الخلايا السرطانية. الدواء معتمد في الولايات المتحدة وأوروپا لعلاج الورم النقوي المتعدد multiple myeloma المنتكس ولمفومة خلية الوشاح mantle cell lymphoma.[1][2][3] في حالات الورم النقوي المتعدد، تم الحصول على استجابات سريرية كاملة لدى المرضى الذين يعانون من المرض المقاوم للأدوية أو سريع التطور.
الأصل والتطوير
تم تخليق البورتزوميب في الأصل عام 1995 في ميوجينكس. أُختبر الدواء (PS-341) في تجربة سريرية محدودة من مرحلة واحدة على مرضى مصابين بالورم النقوي المتعدد multiple myeloma. بدأت التجارب السريرية على الدواء في أكتوبر 1999 بواسطة ميلنيوم للأدوية.
في مايو 2003، بعد سبع سنوات من التخليق الأولي للدواء، أُعتمد البورتزيوميب (يُسوق تحت اسم ڤـِلكاد بواسطة ميلنيوم للأدوية) في الولايات المتحدة من قبل ادارة الغذاء والدواء لاستخدامه لعلاج الورم النقوي المتعدد، اعتماداً على نتائج المرحلة الثانية من التجربة السريرية SUMMIT.[4] في 2008 أُعتمد البورتزوميب من قبل ادارة الغذاء والدواء كعلاج أولي للمرضى المصابين بالورم النقوي المتعدد.[5]
لاحقاً في أغسطس 2014، اعتمد وادارة الغذاء والدواء الڤـِلكاد لاعادة علاج المرضى البالغين المصابين بالورم النقوي المتعدد[6] الذين أظهروا استجابات سابقة للعلاج بالڤـِلكاد وعاد إليهم المرض بعد ستة أشهر على الأقل من انتهاء العلاج السابق.
علم الأدوية
التركيب
الدواء هو ثنائي الپپتيد N-protected dipeptide ويمكن كتابته بالصيغة Pyz-Phe-boroLeu، الذي يعني حمض كربوكسيلي حمض كربوكسيلي، فنايلألانين phenylalanine وليوسين Leucine مع حمض البورونيك boronic acid بدلاً من الحمض الكربوكسيلي. تُكتب الپپتيدات N-terminus إلى C-terminus، ويستخدم هذا التقليد هنا على الرغم من أن "C-terminus" هو حمض بورونيك بدلاً من الحمض الكربوكسيلي.
آلية العمل
ترتبط ذرة البورون في روابط البروتزوميب بموقع تحفيز الپروتيزوم 26S 26S proteasome[7] بتقارب وتخصص بالغين. في الخلايا الطبيعية، يُنظم الپروتيزوم تعبير الپروتين ووظائفه بإضعاف الپروتينات المتوبكنة، وتعمل أيضاً على تنظيف خلايا الپروتينات الغير طبيعية أو المتجمعة. تدعم البيانات السريرية وما قبل السريرية دورها في المحافظة على النمط الظاهري اللا متناهي للخلايا النقوية، وتدعم بيانات زراعة الخلية والطعم الغيروي نفس الوظيفة في سرطانات الأورام الصلبة. في حين أنه من المرجح امتلاكه آليات متعددة، فإن تثبيط الپروتيزوم قد يحول دون إضعاف عوامل الاسماتة، ومن ثم يحفز موت الخلية المبرمج في الخلايا الورمية. وُجد مؤخراً أن البورتزوميب يتسبب في تغير سريع وملحوظ في مستويات الپپتيدات الخلوية التي تنتجها الپروتيزومات.[8] أظهرت بعض الپپتيدات الخلوية نشاطاً حيوياً، ومن ثم فإن تأثير البورتزوميب على مستويات الپپتيدات الخلوية قد يساهم الآثار الحيوية و/أو الجانبية للدواء.
الديناميكية الدوائية
بعد الحقن تحت الجلد، تصل أعلى مستويات للپلازما إلى ~25-50 nM وتستمر هذه المستويات لمدة 1-2 ساعة. بعد الحقن في الوريد، تصل أعلى مستويات للپلازما إلى ~500 nM لكنها تستمر لخمس دقائق فقط، بعدها تنخفض مستويات الپلازما بشكل سريع حيث ينتشر الدواء في الأنسجة (خجم الانتشار هو ~500 L).[9][10] توفر كلا الطريقتين تعرضًا متساويًا للدواء وكفاءة علاجية مقارنة بشكل عام. يصل عمر النصف للدواء إلى 9-15 ساعة ويتم التخلص من الدواء بصفة أساسية عن طريق الأيض الكبدي.[11]
تقاس الديناميكية الدوائية Pharmacodynamics عن طريق قياس تثبيط الپروتيزوم في خلايا الدم المحيطية وحيدة الخلية. تقارن الحساسية الأكبر بكثير لخطوط الخلية النقوية وخطوط خلية الوشاح بتثبيط الپروتيزوم مع خلايا الدم المحيطية وحيدة الخلية ومعظم خطوط الخلايا السرطانية الأخرى غير مفهومة بشكل جيد.
التكلفة
في المملكة المتحدة، لم يوصي المعهد الوطني للصحة وتفوق الرعاية بالڤـِلكاد في البداية، في أكتوبر 2006، بسبب تكلفته التي تقارب 18.000 جنيه إسترليني لكل مريض، وبسبب الدراسات التي أظهرها المعهد الوطني للصحة وتفوق الرعاية والتي أفادت بأنه يمكنه فقط زيادة عمر الحياة المتوقع بمتوسط ستة أشهر في فترة العلاج القياسية.[12] إلا أن الشركة قد اقترحت لاحقاً تقليل التكلفة المرتبطة بالأداء للورم النقوي المتعدد،[13] ووجد هذا الأمر قبولاً.[14]
الآثار الجانبية
ارتبط البورتزوميب [[اعتلال الأعصاب المحيطية|باعتلال الأعصاب المحيطية peripheral neuropathy في 30% من الحالات؛ وأحياناً ما يكون مؤلماً. قد يصبح هذا أكثر سوءاً لدى المرضى المصابين اعتلال الأعصاب المحيطية قبل تلقي العلاج. بالإضافة إلى ذلك، يتسبب كبت نقى العظم myelosuppression في الإصابة بقلة العدلات neutropenia وقد يحدث أيضاً قلة في الصفيحات thrombocytopenia مما يستدعي الحد من الجرعات. ومع ذلك، فإن هذه الآثار الجانبية عادة ما تكون معتدلة بالنسبة لزراعة نقى العظم bone marrow transplantation وخيارات العلاج الأخرى للمرضى في المراحل المتقدمة من المرض. يرتبط البورتزوميب بمعدل مرتفع من الهربس النطاقي shingles،[15] على الرغم من أن الأسيكلوڤير acyclovir الوقائي قد يقلل من خطر الإصابة بهذا المرض.[16] كما ظهرت حالات التهاب الكلى الخلالي الحاد.[17]
وتعتبر التأثيرات على القناة الهضمية والوهن asthenia من أكثر الآثار الجانبية شيوعاً للبورتزوميب.[18]
التفاعلات الدوائية
epigallocatechin gallate الذي يوجد خلاصة الشاي الأخضر، الذي من المتوقع أن يكون له أثر تآزري، وُجد أنه يقلل من تأثير البورتزوميب في أنبوب الاختبار.[19]
الفعالية العلاجية
في تجربتين سريريتين من مرحلتين، على مجموعتين (تجربتي SUMMIT وCREST ثبتت فعالية البورتزوميب 1.3 مگ/م2 (مع أو بدون الدكسامثازون dexamethasone المعطى بالحقن تحت الجلد على مدار 1، 4، 8 يوم، واليوم الـ11 من دورة مدتها 21 يوم بحد أقصى ثمان دورات لدى المرضى الذين سبق علاجهم والمصابين بالورم النقوي المتعدد المنتكس/المقاوم للأدوية.[20] وأظهرت تجربة APEX من ثلاث مراحل تفوق البورتزوميب 1.3 مگ/م2 على نظام العلاج بالدكسامثازون بجرعات عالية (أي TTP المتوسط 6.2 vs 3.5 شهر، و1-عام 80% vs 66%).[20]
الاستخدام التجريبي
تم تجربة البورتزوميب لعلاج الذئبة الحمامية المجموعية systemic lupus erythematosus وتبين أنه يقلل من نشاط المرض وعدد خلايا الپلازما، إلا أن 7 من بين 12 حالة جرى استباعدها بسبب الآثار الجانبية، وكانت بعضها حادة.[21] جرى دراسة البورتزوميب لعلاج رفض الأجسام المضادة للكلى المزروعة. وتوصلت إحدى الدراسات إلى أن استخدام جرعة عالية من الگلوبولين المناعي الوريدي بالاشتراك مع علاج يعتمد على البورتزوميب قد يكون مفيداً، خاصة عند مقارنته بإحدى المجموعات التاريخية للمرضى الذين عولجوا بالگلوبولين المناعي الوريدي، الپلازمافريسس، والريتوكسيماب منخفض الجرعة. [22]
انظر أيضاً
- إيكسازوميب، مثبط پروتيزومي يستخدم عن طريق الفم.
المصادر
- ^ Takimoto CH, Calvo E. "Principles of Oncologic Pharmacotherapy" in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management: A Multidisciplinary Approach. 11 ed. 2008.
- ^ House, Douglas W. (2014-10-09). "FDA clears Velcade label expansion". Seeking Alpha.
- ^ Haberfeld, H, ed. (2016). Austria-Codex (in German). Vienna: Österreichischer Apothekerverlag.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ Adams J, Kauffman M (2004). "Development of the Proteasome Inhibitor Velcade (Bortezomib)". Cancer Invest. 22 (2): 304–11. doi:10.1081/CNV-120030218. PMID 15199612.
- ^ "U.S. Department of Health and Human Services". fda.gov. June 23, 2008.
- ^ "Millenium: The Takeda Oncology Company". .millennium.com. 2014-08-08.[dead link]
- ^ Bonvini P, Zorzi E, Basso G, Rosolen A (2007). "Bortezomib-mediated 26S proteasome inhibition causes cell-cycle arrest and induces apoptosis in CD-30+ anaplastic large cell lymphoma". Leukemia. 21 (4): 838–42. doi:10.1038/sj.leu.2404528. PMID 17268529.
- ^ Gelman JS, Sironi J, Berezniuk I, Dasgupta S, Castro LM, Gozzo FC, Ferro ES, Fricker LD (2013). "Alterations of the intracellular peptidome in response to the proteasome inhibitor bortezomib". PLOS ONE. 8 (1): e53263. doi:10.1371/journal.pone.0053263. PMC 3538785. PMID 23308178.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Reece DE, Sullivan D, Lonial S, Mohrbacher AF, Chatta G, Shustik C, Burris H 3rd, Venkatakrishnan K, Neuwirth R, Riordan WJ, Karol M, von Moltke LL, Acharya M, Zannikos P, Keith Stewart A (2011). "Pharmacokinetic and pharmacodynamic study of two doses of bortezomib in patients with relapsed multiple myeloma". Cancer Chemother Pharmacol. 67: 57–67. doi:10.1007/s00280-010-1283-3. PMC 3951913.
- ^ Voorhees PM, Dees EC, O'Neil B, Orlowski RZ (2003). "The proteasome as a target for cancer therapy". Clin Cancer Res. 9 (17): 6316–25. PMID 14695130.
- ^ Moreau P, Pylypenko H, Grosicki S, Karamanesht I, Leleu X, Grishunina M, Rekhtman G, Masliak Z, Robak T, Shubina A, Arnulf B, Kropff M, Cavet J, Esseltine DL, Feng H, Girgis S, van de Velde H, Deraedt W, Harousseau JL (2011). "Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: a randomised, phase 3, non-inferiority study". The Lancet Oncology. 12: 431–40. doi:10.1016/s1470-2045(11)70081-x.
- ^ "NHS watchdog rejects cancer drug". BBC News UK. 2006-10-20. Retrieved 2009-08-14.
- ^ "Summary of VELCADE Response Scheme" (PDF). Archived from the original (PDF) on 2009-04-19. Retrieved 2009-08-14.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "More Velcade-Style Risk-Sharing In The UK?". Euro Pharma Today. 2009-01-21. Archived from the original on 2011-07-10. Retrieved 2009-08-14.
{{cite web}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ^ Oakervee HE, Popat R, Curry N, et al. (2005). "PAD combination therapy (PS-341/bortezomib, doxorubicin and dexamethasone) for previously untreated patients with multiple myeloma". Br J Haematol. 129 (6): 755–62. doi:10.1111/j.1365-2141.2005.05519.x. PMID 15953001.
- ^ Pour L.; Adam Z.; Buresova L.; et al. (2009). "Varicella-zoster virus prophylaxis with low-dose acyclovir in patients with multiple myeloma treated with bortezomib". Clinical Lymphoma & Myeloma. 9 (2): 151–3. doi:10.3816/CLM.2009.n.036. PMID 19406726.
- ^ "Bortezomib-induced acute interstitial nephritis". Nephrol. Dial. Transplant. 30 (7): 1225–1229. 2015. doi:10.1093/ndt/gfv222.
- ^ Highlights Of Prescribing Information Archived فبراير 19, 2009 at the Wayback Machine
- ^ Golden, EB; Lam, PY; Kardosh, A; Gaffney, KJ; Cadenas, E; Louie, SG; Petasis, NA; Chen, TC; Schönthal, AH (4 June 2009). "Green tea polyphenols block the anticancer effects of bortezomib and other boronic acid-based proteasome inhibitors". Blood. 113 (23): 5927–37. doi:10.1182/blood-2008-07-171389. PMID 19190249.
- ^ أ ب Curran M, McKeage K (2009). "Bortezomib: A Review of its Use in Patients with Multiple Myeloma". Drugs. 69 (7): 859–888. doi:10.2165/00003495-200969070-00006. PMID 19441872. Archived from the original on 2011-10-08. Retrieved 2010-03-26.
{{cite journal}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ^ Alexanter T; et al. (2015). "The proteasome inhibitior bortezomib depletes plasma cells and ameliorates clinical manifestations of refractory systemic lupus erythematosus". Ann Rheum Dis. 74: 1474–8. doi:10.1136/annrheumdis-2014-206016. PMC 4484251. PMID 25710470.
- ^ Nils Lachmann, Michael Duerr, Constanze Schönemann, Axel Pruß, Klemens Budde, and Johannes Waiser, “Treatment of Antibody-Mediated Renal Allograft Rejection: Improving Step by Step,” Journal of Immunology Research, vol. 2017, Article ID 6872046, 9 pages, 2017. https://doi.org/10.1155/2017/6872046.
وصلات خارجية
- [1]
- Myeloma patients campaigning for access to a life prolonging cancer drug
- Millennium Pharmaceuticals website on Velcade
- Multiple Myeloma Research Foundation article on Velcade
- International Myeloma Foundation article on Velcade
- U.S. Food and Drugs Administration on Velcade
- Dedicated website for European audience
- Articles with dead external links from July 2017
- CS1 maint: unflagged free DOI
- CS1 errors: unsupported parameter
- Template:drugs.com link with non-standard subpage
- Drugs with non-standard legal status
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Articles without KEGG source
- Drug has EMA link
- كاربوكساميدات
- أحماض البورونيك
- پيرازينات
- مستقبلات الپروتيزوم
- أدوية يتيمة
- پروپانامیدات
