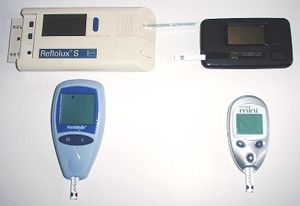
مراقبة گلوكوز الدم
| مراقبة گلوكوز الدم Blood glucose monitoring | |
|---|---|
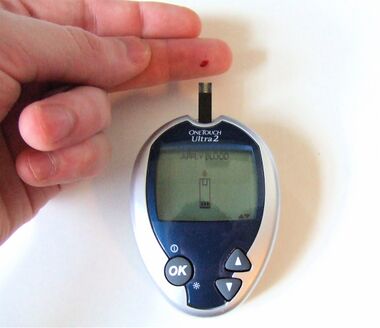 اختبار گلوكوز الدم، صورة توضح حجم العينة المطلوبة في معظم أجهزة القياس الحديثة.
ICD10 = | |
| MeSH | D015190 |
مراقبة گلوكوز الدم، هي طريقة لاختبار تركيز الگلوكوز في الدم (سكر الدم). وهي هامة للغاية بشكل خاص في ضبط نسبة السكر لمرضى السكري، ويتم الاختبار عادة من خلال وخز الجلد (غالباً الإصبع) للحصول على قطرة دم، ثم استخدام أشرطة اختبار نشطة كيميائياً. وهناك تقنيات مختلفة تستخدمها الشركات المختلفة المنتجة لتلك الأجهزة، لكن أغلبها يقيس الخواص الكهربية للدم، ويستخدم ذلك لتحديد مستوى الجلوكوز في الدم. ويُسمى هذا الاختبار عادةً باختبار گلوكوز الشعيرات الدموية.
ينصح الأطباء مرضى السكري باستعمال هذا النظام لمراقبة مستوى السكر في الدم خلال اليوم. معظم مرضى سكري النمط الثاني يقومون بقياس مستوى السكر مرة واحدة -على الأقل- يومياً. ويُفضل لمرضى السكري الذين يستخدمون الأنسولين (جميع مرضي سكري النمط الأول ومعظم مرضى سكري النمط الثاني) أن يقوموا بقياس سكر الدم عدة مرات في اليوم، (4-8 مرات لمرضى النمط الأول، ومرتين أو أكثر لمرضى النمط الثاني)،[1] وذلك لتقدير كفاءة الجرعة السابقة للأنسولين والمساعدة في تحديد الجرعة التالية.
الغرض
مراقبة جلوكوز الدم يبين تباين وتغير مستوى السكر في دم الأشخاص، ويساعد في تحديد الوجبات والأنشطة ومواعيد جرعات الدواء.[2]
ويسمح الاختبار أيضا بالاستجابة السريعة لارتفاع سكر الدم hyperglycemia أو نقص سكر الدم hypoglycemia. ويتضمن ذلك ضبط النظام الغذائي والتمارين الرياضية وضبط جرعة الأنسولين.
أجهزة قياس گلوكوز الدم
جهاز قياس سكر الدم هو جهاز إلكتروني لقياس مستوى الگلوكوز في الدم. حيث توضع قطرة صغيرة من الدم على "شريحة اختبار" (تُستخدم لمرة واحدة) ويظهر قياس مستوى السكر على شاشة رقمية خلال ثوانٍ.
ولكون هذه الأجهزة تحتاج نقطة صغيرة من الدم فذلك يعني تقليل الوقت والجهد المطلوب للقياس، وبالتالي يسهل للمرضى قياس مستوى السكر عدة مرات في اليوم. وبالرغم من أن تكلفة أجهزة قياس السكر تبدو مرتفعة، إلا أنها لا تُقارن بميزة تجنب تكلفة مُضاعفات السكري.
مراقبة الگلوكوز المستمرة
يحدد جهاز مراقبة الگلوكوز المستمر مستويات الگلوكوز بصفة مستمرة (كل بضعة دقائق). وتتألف الأجهزة التقليدية من:
- مستشعر گلوكوز للاستعمال مرة واحدة يوضع تحت الجلد مباشرة، والذي يتم ارتداؤه لبضعة أيام حتى الاستبدال.
- وصلة من المستشعر إلى جهاز إرسال غير مغروس الذي يتصل بمستقبل راديوي.
- مستقبل لإكتروني يلبس مثل الپيجر (أو مضخمة الإنسولين) الذي يظهر مستويات الگلوكوز المحدثة بشكل مستمر، فضلاً عن مراقبته اتجاهات ارتفاع وانخفاض مستويات الگلوكوز .
تقيس أجهزة مراقبة الگلوكوز المستمرة تركيزات الگلوكوز في عينة من السائل الخلالي (خارج الخلية). وترجع أوجه قصور هذه الأجهزة إلى الحقائق التالية:
- وجوب معايرة الأنظمة المستمرة بقياس نسبة الگلوكوز في الدم بالطرق التقليدية (باستخدام التكنولوجيا الحالية) وبالتالي تتطلب كل من نظام قياس الگلوكوز المستمر و"وخزالإصبع" من وقت لآخر.
- تختل مستويات الگلوكوز في السائل الخلالي قيم گلوكوز الدم، لذلك يحتاج المرضى إلى القياسات التقليدية بوخز الإصبع للمعايرة (عادةً مرتين يوماً) وينصح باستخدام قياسات وخز الإصبع للتأكد من نقص سكر الدم أو ارتفاعه قبل اتخاذ الإجراءات التصحيحية.
رصدت حالات تأخر مدتها حوالي خمس دقائق عن الزمن المناقش أعلاه.[3][4][5] ألبغ بعض مستخدمي الأنظمة المختلفة عن فترات تأخير تصل إلى 10-15 دقيقة. هذا الوقت المتأخر ضئيل عندما تكون مستويات سكر الدم ثابتة نسبياً. ومع ذلك، فإن مستويات سكر الدم، عندما تتغير بسرعة، قد تظهر قراءات طبيعية على أجهزة قياس الگلوكوز المستمرة بينما يعاني المريض بالفعل من أعراض مستوى ارتفاع گلوكوز الدم عن النطاقات الطبيعية وقد يكون بحاجة إلى علاج. يوصى المرضى الذين يستخدمون أجهزة قياس الگلوكوز المستمرة بالنظر في القيم المطلقة لمستوى گلوكوز الدم المعطاة من الجهاز بالإضافة إلى أي اتجاه لمستويات گلوكوز الدم. على سبيل المثال، عند قراءة مستوى 100 ملگ/د.ل. على جهاز قياس گلوكوز الدم المستمر فعليهم عدم اتخاذ أي إجراء إذا كان مستوى گلوكوز الدم ثابتاً لعدة قراءات، في حين يوصى المريض المصاب الذي لديه نفس المستوى للگلوكوز في الدم، لكن مع انخفاض مستوى گلوكوز الدم بشكل حاد خلال فترة زمنية قصيرة، بإجراء اختبار الوخز بالإصبع للتحقق من نقص سكر الدم.
تسمح المراقبة المستمرة بفحص كيفية تأثر مستوى گلوكوز الدم بالإنسولين، التمارين الرياضية، الطعام، والعوامل الأخرى. قد تكون البيانات الإضافية مفيدة في تصحيح جرعة الإنسولين بالنسبة لكميات الطعام وعلاج فرط سكر الدم. وقد تساعد المراقبة خلال الفترات التي تراقب عادة فيها (مثل المراقبة ليلاً) قد يساعد في تحديد المشكلات في جرعة الإنسولين (مثل المستويات القاعدية لمستخدمي مضخة الغنسولين أو مستويات الإنسولين طويل المدى للمرضى الذين يعتمدون على حقن الإنسولين). وقد تكون أجهزة المراقبة مزودة أيضاً بأجهزة إنذار لمرضى فرط أو نقص سكر الدم ليتمكن المريض من إتخاذ الإجراء المناسب (بعد عمل فحص بوخز الإصبع، عند الضرورة) حتى في حالة عدم شعوره بالأعراض في كلا الحالتين. في حين أن هذه التكنولوجيا تعتبر محدودة، فقط أظهرت الدراسات أن المرضى الذين يستخدمون أجهزة مراقبة مستمرة يعانون من انخفاض نسبة سكر الدم وكذلك من انخفاض مستويات الهموگلوبين الگلايكوزيلاتي.[6][7][8][9]
في الوقت الحالي، لا تدخل أجهزة مراقبة گلوكوز الدم المستمرة تلقائياً ضمن التأمين الصحي في الولايات المتحدة كما يحدث مع معظم أجهزة مستلزمات مرض السكري الأخرى (مثل أجهزة اختبار الگلوكوز القياسية، الإنسولين، وحتى مضخات الإنسولين). وع ذلك، فمع زيادة عدد شركات التأمين التي تغطي مستلزمات مراقبة الگلوكوز المستمرة (سواء أجهزة الاستقبال أو الاستشعار للاستعمال مرة واحدة) على أساس الحالات الفردية إذا أبدى المريض والطبيب احتياجاً خاصاً لاستخدامها. يتفاقم الافتقار إلى التغطية التأمينية بسبب الاستبدال المتكرر لأجهزة الاستشعار للاستعمال مرة واحدة. بعض حصلت بعض أجهزة الاستشعار على موافقة ادارة الغذاء والدواء الأمريكية للاستخدام أقل من 7 و3 أيام، (على الرغم من أن نفس المرضى يرتدون أجهزة استشعار لفترات أطول من الفترة الموصى بها)، وبالمثل، فإن أجهزة القياس المستقبلة لها عمر افتراضي محدد (أقل من سنتين وأقل من 6 أشهر). ويعتبر هذا عاملاً مؤثراً على الاستيعاب البطيء لأجهزة الاستشعار التي تم تسويقها في الولايات المتحدة.
جرى مناقشة المبادئ والتاريخ والتطورات الأخيرة لتشغيل أجهزة الاستشعار الكهروكيميائية للگلوكوز ضمن مراجعة كيميائية لجوسف وانگ.[10]
الغرسات الحيوية لاستشعار الگلوكوز
أظهرت الأبحاث التي أجريت على استخدام شرائط الاختبار أن الإصابات الذاتية اللازمة تعمل كحاجز نفسي يمنع المرضى من التحكم الكافي في مستوى الگلوكوز.[بحاجة لمصدر] نتيجة لذلك، يصابون فالأمراض الثانوية الناجمة عن ارتفاع مستويات الگلوكوز. يمكن تحقيق تحسن كبير في علاج مرض السكري بواسطة جهاز استشعار قابل للزرع يقوم بمراقبة مستويات السكر في الدم بشكل مستمر داخل الجسم ونقل البيانات المقاسة إلى الخارج. سيوفر الجهاز على المريض عبء فحص الدم المنتظم، الذي بدلاً من ذلك يتبع مسار مستويات الگلوكوز على جهاز ذكي مثل جهاز الحاسوب المحمول أو الهاتف الذكي.
لا ينبغي بالضرورة قياس تركيزات الگلوكوز في الأوعية الدموية، ولكنها قد تقاس في السوائل الخلالية، حيث توجد بنفس المستويات - مع فارق زمني مدته بضع دقائق - بسبب اتصالها بالشعيرات الدموية. ومع ذلك فإن مخطط التحقق من الگلوكوز الإنزيمي يستخدم في شرائط الاختبار للاستخدام مرة واحدة غير مناسب بشكل مباشر للمزروعات. إحدى المشكلات الرئيسية ناتجة عن تباين الإمداد بالأكسجين، والذي يحوله الگلوكوز إلى لاكتون گلوكونو وH2O2 بواسطة إنزيم أوكسيداز الگلوكونو. ولأن غرس أجهزة الاستشعار في الجسم يرافقه نمو النسيج المغلف، [11] يُقلل انتشار الأكسجين إلى منطقة التفاعل بشكل مستمر. يؤدي توافر الأكسجين المتناقص إلى انحراف قراءة المستشعر، مما يتطلب إعادة معايرة متكررة باستخدام الوخز بالإصبع وشرائط الاختبار.
تتمثل إحدى الطرق لاستشعار الگلوكوز على المدى الطويل في قياس وتعويض تركيز الأكسجين المحلي المتغير.[12] بينما تستطبل الطرق الأخرى تفاعل أوكسيداز الگلوكوز المزعج بتفاعل استشعار معكوس، والمعروف بمقايسة الألفة affinity assay. وُضع هذا المخطط في الأصل بواسطة شولتز وسيمز عام 1978.[13] وقد تم التحقيق من عدد من مقايسات الألفة المختلفة،[14][15][16] بواسطة المقايسات الفلورية الأكثر شيوعاً.[17][18][19] سمحت تكنولوجيا الأنظمة الكهروميكانيكية الصغرى مؤخراً ببدائل أصغر وأكثر ملاءمة للتحقق الفلوري، عن طريق قياس اللزوجة.[20] أظهرت الأبحاث التي أجريت على أجهزة الاستشعار المعتمدة على الألفة أن التغليف بواسطة أنسجة الجسم لا يسبب انحراف إشارة الاستشعار، ولكنه يتسبب فقط في تأخر زمني للإشارة مقارنة بالقياس المباشر في الدم.[21]
التقنيات الغير توغلية
هناك بعض التقنيات الجديدة لمراقبة مستويات گلوكوز الدم لا تتطلب الدخول للدم من أجل قراءة مستوى الگلوكوز. وتشمل التقنيات الغير توغلية الفحص بواسطة مطيافية الأشعة تحت الحمراء القريبة،[22] ultrasound[23] ومطيافية العزل الكهربائي.[24] قد تعفي هذه التقنية مرضى السكري من اختبار وخز الإصبع من أجل الحصول على قطرة دم لاختبار گلوكوز الدم.
معظم الطرق الغير توغلية قيد التطوير هي طرق مراقبة الگلوكوز المستمرة وتوفر ميزة توفير معلومات إضافية بين تقنية وخز الإصبع التقليدية، وقياسات مستوى گلوكوز الدم، وعلى مدار الفترات الزمنية التي لا تتوفر فيها قياسات وخز الإصبع (أي أثناء النوم).
الفعالية
لمرضى سكري النمط الثاني، فأهمية مراقبة والتكرار الأمثل للمراقبة ليست واضحة. لم تجد دراسة 2011 أي دليل على أن مراقبة مستوى گلوكوز الدم تؤدي إلى نتائج أفضل للمريض في الممارسة الفعلية.[25] وجدت التجارب العشوائية ذات الشواهد أن المراقبة الذاتية لگلوكوز الدم لا تحسن الهموگلوبين الگلايكوزيلاتي (HbA1c) بين "مرضى سكري النمط الثاني الذين يعالجون الأنسولين الخاضعين لرقابة جيدة"[26] أو تؤدي إلى تغييرات كبيرة في نوعية الحياة.[27] ومع ذلك، فقد أظهر التحليل التلوي الأخير لـ47 تجربة عشوائية ذات شواهد تضم 7677 مريض أن تدخل إدارة الرعاية الذاتية يحسن التحكم في مستوى سكر الدم لدى مرضى السكري، مع انخفاض يقدر بنحو 0.36% (95% CI ، 0.21-0.51) في قيم الهموگلوبين الگلايكوزيلاتي.[28] علاوة على ذلك، فقد أظهر إحدى الدراسات الحديثة أن المرضى الذين يوصفون بأنهم "غير متحكمين بمرض السكري" (مُعرف في دراسة مستويات HbA1C بعد فترة 90 يوم من مراقبة ذاتية السباعية لگلوجوز الدم (SMBG) مع الحد من المخاطر النسبية بنسبة 0.18% (95% CI، 0.86–2.64%، p<.001).[29] بغض النظر عن القيم المختبرية أو غيرها من المتغيرات العددية، فالغرض السريري هو تحسين نوعية الحياة ونتائج علاج مرضى السكري. وشملت دراسة حديثة 12 تجربة عشوائية والنتائج التي تم تقييمها في 3259 مريض. استنتج الباحثون من خلال تحليل نوعي أن المراقبة الذاتية السباعية لگلوجوز الدم لنوعية الحياة لم تظهر أي تأثير على رضا المريض أو نوعية حياة المرضى ذات الصلة بالصحة. علاوة على ذلك، فقد توصلت نفس الدراسة إلى أن مرضى السكري النمط الثاني الذين تم تشحيهم قبل عام من بدء المراقبة الذاتية السباعية لگلوجوز الدم، ممن لا يعالجون بالإنسولين، قد عانوا من انخفاض ضئيل إحصائياً في مستوى الهموگلوبين الگلايكوزيلاتي بنسبة 0.3% (95% CI، -0.4 – -0.1) خلال ستة أشهر من المتابعة، وانخفاض ضئيل إحصائياً بنسبة 0.1% (95% CI، -0.3 – 0.04) خلال 12 شهراً من المتابعة. بالمقابل، عانى المرضى الذين تم تشخيصهم حديثاً انخفاضاً هاماً من الناحية الإحصائية بنسبة 0.5% (95% CI ، -0.9 - -0.1) خلال 12 شهراً من المتابعة.[30] ووجدت دراسة حديثة أن استراتيجية العلاج الغير توغلي لخفض مستويات سكر الدم (أقل من 6%) في المرضى المصابين بخطر الإصابة بمرض قلبي وعائي إضافي يعتبر ضرراً أكثر من كونه فائدة.[31] بالنسبة لمرضى السكري النمط الثاني الذين لا يعالجون بالإنسولين، فإن ممارسة التمارين الرياضية والالتزام بنظام غذائي هي الوسائل الأفضل.[بحاجة لمصدر] مراقبة گلوكوز الدم، في هذه الحالة، هو ببساطة أداة لتقييم نجاح النظام الغذائي وممارسة الرياضة. لا يحتاج مرضى السكري من النمط 2 المعتمدين على الأنسولين إلى مراقبة مستوى سكر الدم لديهم بشكل متكرر مثل مرضى السكري من النمط الأول.
توصيات
نشر المعهد الوطني للصحة وتفوق الرعاية بالمملكة المتحدة توصيات محدثة لمرض السكري في 30 مايو 2008، والتي أوصت بأن المراقبة الذاتية لمستويات گلوكوز الپلازما للأشخاص المشخصين حديثاً بمرض السكري النمط الثاني ينبغي دمجها في عملية الادارة الذاتية المنظم.[32] تم تحديث التوصيات في أغسطس 2015 للأطفال والشباب المصابين بمرض السكري النمط الأول. أنظر الدليل التوجيهي للمعهد الوطني للصحة وتفوق الرعاية لمراقبة گلوكوز الدم المستمرة.[بحاجة لمصدر]
الجمعية الأمريكية لمرض السكري (ADA)، والتي تنشر أدلة توجيهية تجسد أحدث الحالات في هذا المجال، جرى مؤخراً تحديث "معايير الرعاية الطبية" في يناير 2019 للإقرار بأن المراقبة الذاتية الروتينية لمستوى گلوكوز الدم للمرضى الذين لا يستخدمون الإنسولين لها فائدة سريرية إضافية محدودة.[33]
المصادر
- ^
{{cite web}}: Empty citation (help) - ^ MedlinePlus > Blood glucose monitoring Archived 22 يناير 2010 at the Wayback Machine Update Date: 6/17/2008. Updated by: Elizabeth H. Holt, MD, PhD. In turn citing: American Diabetes Association. Standards of medical care in diabetes" Diabetes Care 2008; 31: S12–54.
- ^ Wentholt Iris M.; Vollebregt Marit A.; Hart Augustus A.; Hoekstra Joost B.; DeVries J. Hans (2005). "Comparison of a Needle-Type and a Microdialysis Continuous Glucose Monitor in Type 1 Diabetic Patients". Diabetes Care. 28 (12): 2871–76. doi:10.2337/diacare.28.12.2871.
- ^ Steil G.M.; Rebrin K. Mastrototaro; Bernaba B.; Saad M.F. (2003). "Determination of Plasma Glucose During Rapid Glucose Excursions with a Subcutaneous Glucose Sensor". Diabet. Technol. Ther. 5 (1): 27–31. doi:10.1089/152091503763816436. PMID 12725704.
- ^ Wilhelm B.; Forst S.; Weber M.M.; Larbig M.; Pfûtzner A.; Forst T. (2006). "Evaluation of CGMS During Rapid Blood Glucose Changes in Patients with Type 1 Diabetes". Diabet. Technol. Ther. 8 (2): 146–55. doi:10.1089/dia.2006.8.146. PMID 16734545.
- ^ Garg S.; Zisser H.; Schwartz S.; Baile T.; Kaplan R.; Ellis S.; Jovanovic L. (2006). "Improvement in Glycemic Excursions With a Transcutaneous, Real-Time Continuous Glucose Sensor". Diabetes Care. 29 (1): 44–50. doi:10.2337/diacare.29.1.44. PMID 16373894.
- ^ Deiss D.; Bolinder J.; Riveline J-P.; Battelino T.; Bose E.; Tubiana-Rufi N.; Kerr D.; Phillip M. (2006). "Improved glycemic control in poorly controlled patients with type 1 diabetes using real-time continuous glucose monitoring". Diabetes Care. 29 (12): 2730–32. doi:10.2337/dc06-1134. PMID 17130215.
- ^ Mastrototaro, J.J., Cooper, K.W., Soundararajan, G., Sanders, J.B., and Shah, R.B. Adv Ther. 2006 Sep–Oct; 23(5): 725–32قالب:Title?
- ^ Garg S.; Jovanovic L (Dec 2006). "Relationship of fasting and hourly blood glucose levels to HbA1c values: safety, accuracy, and improvements in glucose profiles obtained using a 7-day continuous glucose sensor". Diabetes Care. 29 (12): 2644–49. doi:10.2337/dc06-1361. PMID 17130198.
- ^ Wang Joseph (2008). "Electrochemical Glucose Biosensors". Chemical Reviews. 108 (2): 814–25. doi:10.1021/cr068123a. PMID 18154363.
- ^ M. Frost; M.E. Meyerhoff (2006). "Sensors: Tackling Biocompatibility". Anal. Chem. 78 (21): 7370–77. doi:10.1021/ac069475k.
- ^ D.A. Gough; L.S. Kumosa; T.L. Routh; J.T. Lin; J.Y. Lucisano (2010). "Function of an Implantated Tissue Glucose Sensor for More than 1 Year in Animals". Science Translat. Med. 2 (42): 42ra53. doi:10.1126/scitranslmed.3001148. PMC 4528300. PMID 20668297.
- ^ J. Schultz; G. Sims (1979). "Affinity sensors for individual metabolites". Biotechnol. Bioeng. Symp. (9): 65–71.
- ^ R. Ballerstädt; R. Ehwald (1994). "Suitability of aqueous dispersions of dextran and Concanavalin A for glucose sensing in different variants of the affinity sensor". Biosens. Bioelectron. 9 (8): 557–67. doi:10.1016/0956-5663(94)80048-0.
- ^ Y. Zhao; S. Li; A. Davidson; B. Yang; Q. Wang; Q. Lin (2007). "A MEMS viscometric sensor for continuous glucose monitoring". J. Micromech. Microeng. 17 (12): 2528–37. Bibcode:2007JMiMi..17.2528Z. doi:10.1088/0960-1317/17/12/020.
- ^ R. Ballerstadt; A. Kholodnykh; C. Evans; A. Boretsky; M. Motamedi; A. Gowda; R. McNichols (2007). "Affinity-Based Turbidity Sensor for Glucose Monitoring by Optical Coherence Tomography: Toward the Development of an Implantable Sensor". Anal. Chem. 79 (18): 6965–74. doi:10.1021/ac0707434. PMID 17702528.
- ^ D.L. Meadows; J.S. Schultz (1993). "Design, manufacture and characterization of an optical fiber glucose affinity sensor based on an homogeneous fluorescence energy transfer assay system". Anal. Chim. Acta. 280: 21–30. doi:10.1016/0003-2670(93)80236-E.
- ^ R. Ballerstad; A. Polak; A. Beuhler; J. Frye (2004). "In vitro long-term performance study of a near-infrared fluorescence affinity sensor for glucose monitoring". Biosens. Bioelectron. 19 (8): 905–14. doi:10.1016/j.bios.2003.08.019. PMID 15128110.
- ^ J. K. Nielsen; J. S. Christiansen; J. S. Kristensen; H. O. Toft; L. L. Hansen; S. Aasmul; K. Gregorius (2009). "Clinical Evaluation of a Transcutaneous Interrogated Fluorescence Lifetime-Based Microsensor for Continuous Glucose Reading". J. Diab. Sci. Technol. 3 (1): 99–109. doi:10.1177/193229680900300111. PMC 2769858. PMID 20046654.
- ^ M. Birkholz; K.-E. Ehwald; T. Basmer; P. Kulse; et al. (2013). "Sensing glucose concentrations at GHz frequencies with a fully embedded Biomicro-electromechanical system (BioMEMS)". J. Appl. Phys. 113 (24): 244904–244904–8. Bibcode:2013JAP...113x4904B. doi:10.1063/1.4811351. PMC 3977869. PMID 25332510.
- ^ P. Diem; L. Kalt; U. Haueter; L. Krinelke; R. Fajer; B. Reihl; U. Beyer (2004). "Clinical Performance of a Continuous Viscosimetric Affinity Sensor for Glucose". Diab. Technol. Therap. 6 (6): 790–99. doi:10.1089/dia.2004.6.790. PMID 15684631.
- ^ http://edn.com/design/medical/4422840/Non-invasive-blood-glucose-monitoring-using-near-infrared-spectroscopy
- ^ "Ultrasound could provide lancet-less method for measuring blood glucose". Diabets.co.uk. Diabetes Digital Media Ltd. Retrieved 27 April 2017.
- ^ Donimirska, Monika. "Non-Invasive Blood Glucose Monitoring Devices Market Volume Analysis, size, share and Key Trends 2017–2027". military-technologies.net. BlackBird. Retrieved 27 April 2017.
- ^ Sidorenkov G, Haaijer-Ruskamp FM, de Zeeuw D, Bilo H, Denig P (June 2011). "Relation between quality-of-care indicators for diabetes and patient outcomes: a systematic literature review" (PDF). Med Care Res Rev. 68 (3): 263–89. doi:10.1177/1077558710394200. PMID 21536606.
- ^ Farmer A, Wade A, Goyder E, et al. (2007). "Impact of self monitoring of blood glucose in the management of patients with non-insulin treated diabetes: open parallel group randomised trial". BMJ. 335 (7611): 132. doi:10.1136/bmj.39247.447431.BE. PMC 1925177. PMID 17591623.
- ^ Young, Laura A.; Buse, John B.; Weaver, Mark A.; Vu, Maihan B.; Mitchell, C. Madeline; Blakeney, Tamara; Grimm, Kimberlea; Rees, Jennifer; Niblock, Franklin (August 7, 2017). "Glucose Self-monitoring in Non-Insulin-Treated Patients With Type 2 Diabetes in Primary Care Settings: A Randomized Trial". JAMA Internal Medicine. 177 (7): 920–929. doi:10.1001/jamainternmed.2017.1233. ISSN 2168-6114. PMC 5818811. PMID 28600913.
- ^ Minet, L.; Møller, S.; Vach, W.; Wagner, L.; Henriksen, J. E. (2010). "Mediating the effect of self-care management intervention in type 2 diabetes: A meta-analysis of 47 randomised controlled trials". Patient Education and Counseling. 80 (1): 29–41. doi:10.1016/j.pec.2009.09.033. PMID 19906503.
- ^ Khamseh, M. E.; Ansari, M.; Malek, M.; Shafiee, G.; Baradaran, H. (2011). "Effects of a structured self-monitoring of blood glucose method on patient self-management behavior and metabolic outcomes in type 2 diabetes mellitus". Journal of Diabetes Science and Technology. 5 (2): 388–93. doi:10.1177/193229681100500228. PMC 3125933. PMID 21527110.
- ^ Malanda, U. L. L.; Welschen, L. M.; Riphagen, I. I.; Dekker, J. M.; Nijpels, G.; Bot, S. D. (2012). Malanda, Uriëll L (ed.). "Self-monitoring of blood glucose in patients with type 2 diabetes mellitus who are not using insulin". The Cochrane Library. 1: CD005060. doi:10.1002/14651858.CD005060.pub3. hdl:1871/48558. PMID 22258959.
- ^ Gerstein, H. C.; M. E. Miller; et al. (2008). "Effects of intensive glucose lowering in type 2 diabetes". The New England Journal of Medicine. 358 (358(24)): 2545–59. doi:10.1056/NEJMoa0802743. PMC 4551392. PMID 18539917.
- ^ "Clinical Guideline: The management of type 2 diabetes (update)".
- ^ Association, American Diabetes (2019-01-01). "Summary of Revisions: Standards of Medical Care in Diabetes—2019". Diabetes Care (in الإنجليزية). 42 (Supplement 1): S4–S6. doi:10.2337/dc19-Srev01. ISSN 0149-5992. PMID 30559226.
- CS1 errors: empty citation
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from March 2014
- Articles with unsourced statements from April 2017
- Articles with unsourced statements from November 2015
- تحاليل دم
- اختبارات متعلقة بمرض السكري
- علاج الإنسولين
- Activity trackers
- مراقبة طبية