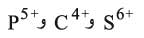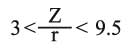التحليل المائي
الحلمهة Hydrolysis أو الحلمأة أو التحليل المائي في الكيمياء العضوية على إنه التفاعل الذي يتم بين مركب كيميائي والماء فيؤدي إلى انكسار الرابطة الكيميائية في جزيء الماء إلى أيون الهيدروجين (بروتون) والهيدروكسيل. .
يستعمل هذا التفاعل لتغيير الروابط الكيميائية في البوليميرات. كما إنه تفاعل هام لدى تشكيل المواد السيراميكية عبر عملية الصل-جل .
الأنواع
حلمهة النتريل إلى حمض كربوكسيلي و أمونياك
R-C≡N + 2H2O → R-COOH + NH3
+R-C≡N + 2H2O + H+ → R-COOH + NH4
حلمهة الأملاح مع الماء
حلمهة الإسترات والأميدات
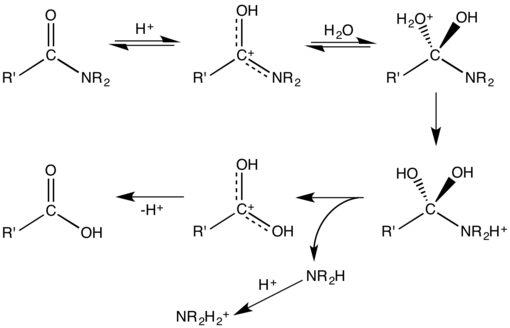
Acid–base-catalysed hydrolyses are very common; one example is the hydrolysis of amides or esters. Their hydrolysis occurs when the nucleophile (a nucleus-seeking agent, e.g., water or hydroxyl ion) attacks the carbon of the carbonyl group of the ester or amide. In an aqueous base, hydroxyl ions are better nucleophiles than polar molecules such as water. In acids, the carbonyl group becomes protonated, and this leads to a much easier nucleophilic attack. The products for both hydrolyses are compounds with carboxylic acid groups.
Perhaps the oldest commercially practiced example of ester hydrolysis is saponification (formation of soap). It is the hydrolysis of a triglyceride (fat) with an aqueous base such as sodium hydroxide (NaOH). During the process, glycerol is formed, and the fatty acids react with the base, converting them to salts. These salts are called soaps, commonly used in households.
In addition, in living systems, most biochemical reactions (including ATP hydrolysis) take place during the catalysis of enzymes. The catalytic action of enzymes allows the hydrolysis of proteins, fats, oils, and carbohydrates. As an example, one may consider proteases (enzymes that aid digestion by causing hydrolysis of peptide bonds in proteins). They catalyze the hydrolysis of interior peptide bonds in peptide chains, as opposed to exopeptidases (another class of enzymes, that catalyze the hydrolysis of terminal peptide bonds, liberating one free amino acid at a time).
However, proteases do not catalyze the hydrolysis of all kinds of proteins. Their action is stereo-selective: Only proteins with a certain tertiary structure are targeted as some kind of orienting force is needed to place the amide group in the proper position for catalysis. The necessary contacts between an enzyme and its substrates (proteins) are created because the enzyme folds in such a way as to form a crevice into which the substrate fits; the crevice also contains the catalytic groups. Therefore, proteins that do not fit into the crevice will not undergo hydrolysis. This specificity preserves the integrity of other proteins such as hormones, and therefore the biological system continues to function normally.
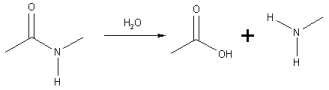
Upon hydrolysis, an amide converts into a carboxylic acid and an amine or ammonia (which in the presence of acid are immediately converted to ammonium salts). One of the two oxygen groups on the carboxylic acid are derived from a water molecule and the amine (or ammonia) gains the hydrogen ion. The hydrolysis of peptides gives amino acids.
Many polyamide polymers such as nylon 6,6 hydrolyze in the presence of strong acids. The process leads to depolymerization. For this reason nylon products fail by fracturing when exposed to small amounts of acidic water. Polyesters are also susceptible to similar polymer degradation reactions. The problem is known as environmental stress cracking.
ATP
حلمهة روابط الأميد
في حلمهة أميد إلى حمض كربوكسيلي و أمين أو أمونيا.
حلمهة عديدات السكريد
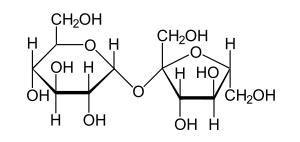
Monosaccharides can be linked together by glycosidic bonds, which can be cleaved by hydrolysis. Two, three, several or many monosaccharides thus linked form disaccharides, trisaccharides, oligosaccharides, or polysaccharides, respectively. Enzymes that hydrolyze glycosidic bonds are called "glycoside hydrolases" or "glycosidases".
The best-known disaccharide is sucrose (table sugar). Hydrolysis of sucrose yields glucose and fructose. Invertase is a sucrase used industrially for the hydrolysis of sucrose to so-called invert sugar. Lactase is essential for digestive hydrolysis of lactose in milk; many adult humans do not produce lactase and cannot digest the lactose in milk.
The hydrolysis of polysaccharides to soluble sugars can be recognized as saccharification.[1] Malt made from barley is used as a source of β-amylase to break down starch into the disaccharide maltose, which can be used by yeast to produce beer. Other amylase enzymes may convert starch to glucose or to oligosaccharides. Cellulose is first hydrolyzed to cellobiose by cellulase and then cellobiose is further hydrolyzed to glucose by beta-glucosidase. Ruminants such as cows are able to hydrolyze cellulose into cellobiose and then glucose because of symbiotic bacteria that produce cellulases.
الكيميائي الروسي گوتليب كيرشهوف (1764-1883) قام بعمل هام في دراسة حلمهة النشا عديدة السكريد إلى سكر (گلوكوز).
حلمهة أكوا الأيونات المعدنية
 مقالة مفصلة: الأيونات المعدنية في محلول مائي
مقالة مفصلة: الأيونات المعدنية في محلول مائي
Metal ions are Lewis acids, and in aqueous solution they form metal aquo complexes of the general formula M(H
2O)
nm+
.[2][3] The aqua ions undergo hydrolysis, to a greater or lesser extent. The first hydrolysis step is given generically as
Thus the aqua cations behave as acids in terms of Brønsted–Lowry acid–base theory. This effect is easily explained by considering the inductive effect of the positively charged metal ion, which weakens the O−H bond of an attached water molecule, making the liberation of a proton relatively easy.
The dissociation constant, pKa, for this reaction is more or less linearly related to the charge-to-size ratio of the metal ion.[4] Ions with low charges, such as Na+
are very weak acids with almost imperceptible hydrolysis. Large divalent ions such as Ca2+, Zn2+, Sn2+ and Pb2+ have a pKa of 6 or more and would not normally be classed as acids, but small divalent ions such as Be2+ undergo extensive hydrolysis. Trivalent ions like Al3+ and Fe3+ are weak acids whose pKa is comparable to that of acetic acid. Solutions of salts such as BeCl
2 or Al(NO
3)
3 in water are noticeably acidic; the hydrolysis can be suppressed by adding an acid such as nitric acid, making the solution more acidic.
Hydrolysis may proceed beyond the first step, often with the formation of polynuclear species via the process of olation.[4] Some "exotic" species such as Sn
3(OH)2+
4[5] are well characterized. Hydrolysis tends to proceed as pH rises leading, in many cases, to the precipitation of a hydroxide such as Al(OH)
3 or AlO(OH). These substances, major constituents of bauxite, are known as laterites and are formed by leaching from rocks of most of the ions other than aluminium and iron and subsequent hydrolysis of the remaining aluminium and iron.
حلمهة الحموض والأسس (القواعد) مع الماء
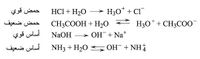
تكون الحلمهة تامة مع الحموض والأسس القوية، وتكون محدودة أو متوازنة مع الحموض والأسس الضعيفة في تشردها (تأينها) في الماء، إذ تعطي هذه التفاعلات الصفات الحمضية أو الأساسية للمحلول بإنتاج الشوارد الحمضية H3O+ أو الشوارد الأساسية OH-:
حلمهة تفاعل الأملاح مع الماء
يمكن لكل شق أو لكل شاردة (أيون) من شوارد الملح أن تخضع لتفاعل الحلمهة بتماسها مع الماء اعتماداً على قوة هذه الشاردة كحمض أو كأساس، وبالتالي نستطيع أن نميز ما يأتي:
أ ـ إذا كان الملح مشتقاً من حمض ضعيف وأساس قوي:
مثال خلات الصوديوم تُفسر آلية التفاعل مع الماء على نحو يتشرد فيه هذا الملح تشرداً تاماً في الماء معطياً شوارد الخلات وشوارد الصوديوم بالإضافة إلى تشرد الماء نفسه. وترتبط شوارد الخلات بشوارد الهدروجين الناتجة أصلاً عن تشرد الماء معطية حمض الخل. وبما أن شوارد الهدروجين قد استهلكت نتيجة هذا الارتباط مع شاردة الخلات، فإن جزيئات جديدة من الماء تتشرد من جديد إلى شوارد هدروكسيل وشوارد هدروجين لإعادة التوازن. وهذا يؤدي إلى تزايد شوارد الهدروكسيل التي ستظهر في التفاعل وتغدو طبيعة هذا الملح في الماء أساسية قوية لتحرر شوارد الهدروكسيل في الوسط المائي:
أما شوارد الصوديوم هنا فلن تعاني من فعل الحلمهة لأنها مشتقة من هدروكسيد قوي.
ب ـ إذا كان الملح مشتقاً من حمض قوي وأساس قوي لن يحدث أي تفاعل حلمهة مثل كلوريد الصوديوم (ملح الطعام) لأن هذا الملح يتشرد كلياً في الماء ولأن شوارده Na+ و Cl- مشتقة أصلاً وعلى التتابع من هدروكسيد قوي (أساس قوي NaOH) وحمض قوي HCl، وبالتالي فإن محلوله يكون معتدلاً.
جـ ـ إذا كان الملح مشتقاً من حمض ضعيف وأساس ضعيف:
يخضع هذا الملح، وبالتالي شوارده، لتفاعل الحلمهة بعملية تعويض، وسيكون تفاعلاً خاصاً ومحدوداً أي متوازناً ومعتدلاً، مثال خلات الأمونيوم CH3COONH4 حيث تخضع الشاردتان للتفاعل مع الماء على نحو مماثل لما ذكر في آلية الفقرة أ:
د ـ إذا كان الملح مشتقاً من حمض قوي وأساس ضعيف:
يخضع كذلك هذا الملح لتفاعل الحلمهة، ويكون محلوله من طبيعة حمضية مثل كلور الأمونيوم المشتق من حمض كلور الماء القوي وهدروكسيد الأمونيوم الأساس الضعيف. وتقوم الشاردة بدور الحمض الضعيف وتتفاعل مع الماء محررة شوارد الهدرونيوم التي تدل على الطبيعة الحمضية:
في حين لن تخضع الشاردة Cl‑ لتفاعل الحلمهة لأنها مشتقة من الحمض القوي.
وتجدر الإشارة إلى أن بعض الأملاح خارج نطاق التصنيف السابق تخضع لفعل حلمهة شبه تام كالهدريدات والنتريدات والكربيدات والسيليسيدات والفسفيدات المعدنية، وكذلك هاليدات اللامعادن، ونذكر بعضاً من هذه الأمثلة: تفاعل حلمهة كربيد الكالسيوم لإنتاج الأستلين:
وكذلك حلمهة نتريد المغنزيوم:
وكذلك في حالة هدريد الليثيوم:
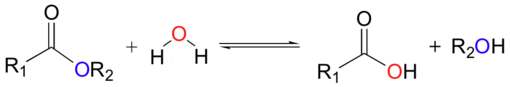
وتخضع المركبات العضوية أيضاً لتفاعلات الحلمهة ونسوق على سبيل المثال لا الحصر: هاليدات الأغوال وأكاسيد الإتيرات والأستيرات والغلوكوزيدات والبروتينات. ونذكر أن خاصة حلمهة أستر، ما هو إلا التفاعل العكسي لأسترة الغول:
وتقود الحلمهة في حالة الأجسام الدسمة في أثناء التحضيرات الصناعية، إلى الغلسيرول والحموض الدسمة ستياريك (الشموع).
وتكون تفاعلات الحلمهة في المركبات العضوية ذات الطبيعة المشتركة بطيئة، وإن إضافة كمية قليلة من الحمض أو الأساس سيسرع التفاعل ضمن آلية الوساطة حمض - أساس. وأخيراً نذكر تفاعلات الحلمهة الهامة للغليكوزيدات والبروتينات في العضوية الحية بفعل الأنزيمات النوعية في عدد من العمليات الحيوية الكيمياوية والتي تمثل إحداها عملية الهضم.
بما أن ثابت توازن الحلمهة محدود، فيمكن التعبير عن درجة الحلمهة بـ h على أنها الجزء من الحمض أو الأساس الذي يتفاعل مع الماء في أثناء التوازن. فإذا عبرنا عن الملح بـ AB كناتج عن الحمض الضعيف HA (مثل CH3COONa) فإن ثابت توازن الحلمهة للتفاعل الآتي:
يعطى بالعلاقة الآتية:
واعتماداً على ثابت توازن أو تشرد الماء Kw = [H+] [OH-] وثابت تشرد الحمض (Ka)HA:
وبالتبديل يغدو ثابت توازن الحلمهة:
ويمكن مناقشة الأمر نفسه في حالة حلمهة الملح AB المشتق من الأساس الضعيف BOH (حالة الملح NH4Cl):
ويصبح ثابت توازن الحلمهة:
حيث يشير Kb إلى ثابت توازن القاعدة BOH.
وأخيراً درجة الحلمهة للملح AB المشتق من حمض وأساس ضعيفين:
يعطى حينها ثابت توازن الحلمهة بالعلاقة:
عدم قابلية عكس الحلمهة تحت الظروف الفيزيولوجية
في الظروف الفيزيولوجية (مثل المحاليل المائية المخففة), a hydrolytic cleavage reaction, in which the concentration of a metabolic precursor is low (on the order of 10−3 to 10−6 molar), is essentially thermodynamically irreversible. ومثال ذلك:
- A + H2O → X + Y
Assuming that x is the final concentration of products, and that C is the initial concentration of A, and W = [H2O] = 55.5 molar, then x يمكن حسابها بالمعادلة:
افترض أن Kd×W = k:
ولذلك
For a value of C = 0.001 molar, and k = 1 molar, x/C > 0.999. Less than 0.1% of the original reactant would be present once the reaction is complete.
This theme of physiological irreversibility of hydrolysis is used consistently in metabolic pathways, since many biological processes are driven by the cleavage of روابط الفوسفات الناري اللامائي.
آلية الحلمهة
يمكن أن تلخص آلية الحلمهة للتفاعلات التي ذكرت اعتماداً على نظرية لويس حيث يكون الكاتيون Mn+ مستقبلاً للإلكترونات ويقوم مقام الحمض، في حين يقوم جزيء الماء بدور المانح للإلكترونات من خلال الأزواج الإلكترونية الحرة غير الرابطة حول ذرة الأكسجين، ويقوم هنا بدور الأساس. واعتماداً على الحقل الكهربائي فإن الشاردة Mn+ تجذب إلى محيطها جزيئات الماء ثنائية القطب بفعل الكهرباء الساكنة. فإذا كان الحقل الكهربائي ضعيفاً تتحول الشاردة Mn+ إلى شاردة محلحلة ion solvate، وتكون معظم أملاح هذه الشاردة ذوابة في الماء. (شاردة الصوديوم مثلاً):
أما إذا كان الحقل الكهربائي للشاردة Mn+ قوياً، فإن التجاذب سيكون فعالاً، وتنتقل الرابطة M-O من النوع الكهربائي الساكن (الشاردي) إلى النوع المشترك مع تشوه القيمة الإلكترونية المحيطة بذرة الأكسجين، وبالمقابل فإن الصفة الشاردية للرابطة O-H تزداد (انتقال الزوج الإلكتروني للرابطة نحو ذرة الأكسجين) وبالتالي تنفصل هذه الرابطة في المُحل المُشرِّد وهو هنا الماء مع تحرر البروتونات أو شوارد الهدرونيوم:
وتكون الهدروكسيدات المتشكلة عادة ضعيفة الذوبان في شروط الماء العادي (n4<Ph<10). وأخيراً إذا كان الحقل الكهربائي الذي تخلقه Mn+ حولها قوياً جداً؛ فإن التجاذب يصبح أكثر فاعلية وتتشرد بعض الروابط O-H في M(OH)2 لتعطي أنيونيات (شوارد سالبة) أكسجينية مثل:
الموافقة للشوارد الافتراضية:
الكمون الشاردي
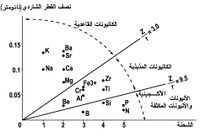
تتعلق قوة جذب الشاردة الموجبة Mn+ لجزيء الماء بشحنة هذه الشاردة وبنصف قطرها r. فكلما كانت الشحنة كبيرة ونصف القطر صغيراً، ازدادت قوة التجاذب. وبتقريب أولي تتناسب قوة الجذب مع الذي يدعى بالكمون الشاردي. لقد تم تصنيف الشوارد اعتماداً على المخطط Z= f (r) إلى ثلاثة أقسام، توافق ثلاثة أنواع من تفاعلات الحلمهة، تقع ضمن ثلاث مناطق (أو مجالات) تبعاً لـهذا الـمخطط (1):
ـ المنطقة الأولى I توافق النسبة الأقل من 3 مثل الكاتيونات المميهة المهاجرة Na+ و Ca2+ و Mg2+ (التفاعل 1) والتي توجد في حوض الرسوبيات لتشكيل الجير الدولومي المُميِّز للصخور الرسوبية. وينتمي لهذه المجموعة شوارد البوتاسيوم والروبيديوم (نصف القطر نحو 0.148 نانومتر) وشاردة السيزيوم ( 0.164 = rنانومتر) ويكون كمونها الشاردي أقل من الواحد. ولا تميل هذه الشوارد - على العكس من غيرها - لفعل الحلحلة إذ تتمتع بنصف قطر مُقْنَع (مضاد للاحتباس anti-stores) وهي مهاجرة بفعل ذوبانية أملاحها، ولدى وصولها البحر تُمتص على الرسوبيات. وبما أنها غير محاطة بجزيئات الماء فيصغر نصف قطرها كثيراً. إن هذا التقسيم يشرح لماذا تكون الرسوبيات البحرية غنية بالبوتاسيوم وفقيرة بالصوديوم (وسطياً)، وعلى العكس من ذلك في حالة ماء البحر حيث 4563-15.
ـ المنطقة الثانية II حيث:
تضم هذه المنطقة الشوارد المترسبة على شكل هدروكسيدات في شروط pH الماء الطبيعي (التفاعل 2). وتبقى الشوارد Ti4+, Fe3+, Al3+ إلخ.. في مكانها خلال عملية التحول، حيث يغدو فيها السيليس فقيراً بسبب الذوبانية التي تتأثر بالطقس الحار والرطب (Si4+ على حدود المنطقتين II وIII من المخطط). وهكذا يتشكل الكاولينيت والبوكسيت.
ـ المنطقة الثالثة  تحتوي هذه المنطقة على الشوارد الأكسجينية المهاجرة مثل
تحتوي هذه المنطقة على الشوارد الأكسجينية المهاجرة مثل ![]() حيث توجد في حوض الرسوبيات وفق شروط pH وكمون الأكسدة والإرجاع لترسيب شواردة المنطقة I على شكل الجير والأباتيت والجبس وغيرها (تفاعل 3).[6]
حيث توجد في حوض الرسوبيات وفق شروط pH وكمون الأكسدة والإرجاع لترسيب شواردة المنطقة I على شكل الجير والأباتيت والجبس وغيرها (تفاعل 3).[6]
انظر أيضاً
المصادر
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةsaccharification - ^ Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. ISBN 978-0853120278.
- ^ Richens, D. T. (1997). The Chemistry of Aqua Ions: Synthesis, Structure, and Reactivity: A Tour through the Periodic Table of the Elements. Wiley. ISBN 0-471-97058-1.
- ^ أ ب Baes, Charles F.; Mesmer, Robert E. (1976). The Hydrolysis of Cations. New York: Wiley. ISBN 9780471039853.
- ^ Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ عبد المجيد البلخي. "الحلمهة". الموسوعة العربية.

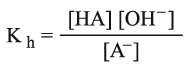
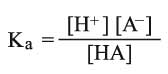
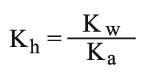
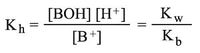
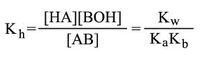
![{\displaystyle K_{d}={\frac {\left[X\right]\left[Y\right]}{\left[H_{2}O\right]\left[A\right]}}}](https://www.marefa.org/api/rest_v1/media/math/render/svg/b8fea205c065386d62449014cdc8b36d8cb12857)