سرطان الپنكرياس
| سرطان البنكرياس | |
|---|---|
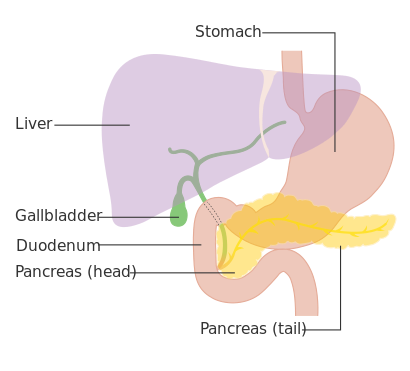 | |
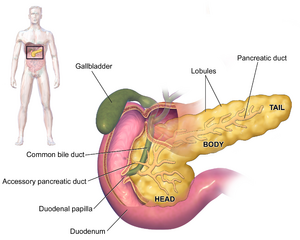
| رسم تخطيطي يوضح موضع البنكرياس خلف المعدة (وهو شفاف في هذا الرسم). | |
| التخصص | طب الجهاز الهضمي، طب الكبد، علم الأورام |
| الأعراض |
|
| البداية المعتادة | بعد سن 40 [2] |
| عوامل الخطر |
|
| الطريقة التشخيصية |
|
| الوقاية | عدم التدخين، التقليل من تناول الكحوليات، الحفاظ على الوزن الصحي، تقليل تناول اللحوم الحمراء[5] |
| العلاج | [1] |
| Prognosis | معدل البقاء لخمس سنوات 6%[6] |
| التردد | 393.800 (2015)[7] |
| الوفيات | 411.600 (2015)[8] |
سرطان الپنكرياس أو ورم المعثكلة (إنگليزية: Pancreatic cancer)، هو نوع من أنواع السرطان، ينشأ عندما تبدأ خلايا الپنكرياس، وهو عضو غدي خلف المعدة، في التكاثر خارج نطاق السيطرة وتشكيل كتلة. تتمتع هذه الخلايا السرطانية بالقدرة على غزو أجزاء أخرى من الجسم.[9] هناك أنواع عديدة معروفة من سرطان البنكرياس.[10]
السرطانة الغدية البنكرياسية، الأكثر شيوعاً، تصيب حوالي 90% من الحالات،[11] يستخدم مصطلح "سرطان البنكرياس" أحيانًا للإشارة إلى هذا النوع فقط.[10] تبدأ هذه السرطانات الغدية داخل الجزء الذي ينتج الإنزيمات الهاضمة في البنكرياس.[10] يمكن أن تنشأ أيضًا عدة أنواع أخرى من السرطان، والتي تمثل مجتمعة غالبية الأورام السرطانية غير الغدية، من هذه الخلايا.[10] حوالي 1-2٪ من حالات سرطان البنكرياس هي أورام الغدد العصبية الصماء، والتي تنشأ من إنتاج هرمونات خلايا البنكرياس.[10] تعتبر هذه بشكل عام أقل عدوانية من سرطان البنكرياس الغدي.[10]
قد تشمل علامات وأعراض النوع الأكثر شيوعًا من سرطان البنكرياس اصفرار الجلد، ألم البطن أو الظهر، فقدان الوزن غير المبرر، لون البراز الفاتح، البول الداكن، وفقدان الشهية.[1] عادةً لا تظهر أي أعراض في المراحل المبكرة من المرض، والأعراض المحددة غير كافية للإشارة إلى أن سرطان البنكرياس لا يتطور عادةً حتى يصل المرض إلى مرحلة متقدمة.[1][2] بحلول وقت التشخيص، غالبًا ما يكون سرطان البنكرياس قد انتشر إلى أجزاء أخرى من الجسم.[10][12]
نادرًا ما يحدث سرطان البنكرياس قبل سن الأربعين، ويحدث أكثر من نصف حالات سرطان البنكرياس الغدي لدى من تزيد أعمارهم عن 70 عامًا.[2] تشمل عوامل الخطر للإصابة بسرطان البنكرياس تدخين التبغ والبدانة والسكري وبعض الحالات الوراثية النادرة.[2] حوالي 25٪ من الحالات مرتبطة بالتدخين،[3] و5-10٪ مرتبطة بالجينات الموروثة.[2] عادة ما يتم تشخيص سرطان البنكرياس من خلال مجموعة من تقنيات التصوير الطبي مثل الموجات فوق الصوتية أو التصوير المقطعي المحوسب واختبارات الدم وفحص عينات الأنسجة (الخزعة).[3][4] ينقسم المرض إلى مراحل، من المبكرة (المرحلة 1) إلى المتأخرة (المرحلة 4).[12] لو يثبت الفحص فعالية عامة السكان.[13]
خطر الإصابة بسرطان البنكرياس أقل بين غير المدخنين، والأشخاص الذين يحافظون على الوزن الصحي ويحدون من استهلاكهم اللحوم الحمراء أو اللحوم المصنعة؛[5] ومع ذلك، فإن الخطر أكبر بالنسبة للرجال، خاصة بين الذين يتناولون كميات كبيرة جدًا من اللحوم الحمراء.[14] ينخفض خطر إصابة المدخنين بالمرض إذا توقفوا عن التدخين وتقريباً تعود إلى تلك التي لدى باقي السكان بعد 20 عاماً.[10]
يمكن علاج سرطان البنكرياس عن طريق الجراحة، العلاج الإشعاعي، العلاج الكيميائي، الرعاية التلطيفية أو الجمع بين هذه الوسائل.[1] تعتمد خيارات العلاج جزئياً على مرحلة السرطان.[1] الجراحة هي العلاج الوحيد لسرطانة البنكرياس الغدية،[12] وقد تُجرى أيضاً لتحسين جودة الحياة دون وجود إحتمالية للشفاء.[1][12] هناك حاجة أحيانًا إلى تناول أدوية لعلاج الآلم وتحسين الهضم.[12] يوصى بالرعاية التلطيفية المبكرة حتى لأولئك الذين يتلقون علاجًا يهدف الشفاء.[15]
عام 2015، تسببت سرطانات البنكرياس بجميع أنواعها في وفاة 411.600 شخص على مستوى العالم.[8] سرطان البنكرياس هو خامس أكثر أسباب الوفاة شيوعًا بالسرطان في المملكة المتحدة،[16] والثالث في الولايات المتحدة.[17] يحدث المرض غالبًا في العالم المتقدم، حيث ظهرت حوالي 70٪ من الحالات الجديدة عام 2012.[10] عادة ما يكون مآل سرطان البنكرياس الغدي سيء للغاية؛ بعد التشخيص، يعيش 25٪ من الأشخاص لمدة عام و5٪ يعيشون لخمس سنوات.[6][10] بالنسبة للسرطانات التي يتم تشخيصها مبكرًا، يرتفع معدل البقاء لخمس سنوات لحوالي 20٪.[18] مآل سرطانات الغدد الصم العصبية أفضل؛ بعد خمس سنوات من التشخيص، يبقى 65٪ من الذين تم تشخيصهم على قيد الحياة، على الرغم من أن البقاء على قيد الحياة يختلف اختلافًا كبيرًا اعتمادًا على نوع الورم.[10]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الأنواع
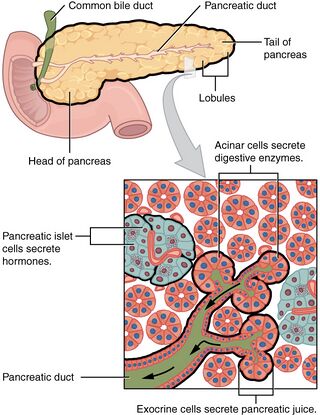
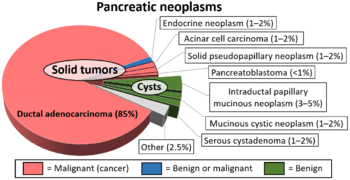
تقسم أنواع هذا الورم حسب مصدر كل نوع، فهناك أورام تنبع من الغدد القنوية أو الغدد الصماء أو الخلايا العنبية. وهذا التقسيم معتمد من منظمة الصحة العالمية.
- أورام من الغدد القنوية للبنكرياس Exocrine Glands
- أورام حميدة
- ورم حميد الخلايا الغددية المتحوصلة مع إفرازات مصلية Serous cystadenoma
- ورم حميد الخلايا الغددية المتحوصلة مع إفرازات مخاطية Mucinous cystadenoma
- ورم حميد الخلايا الغددية مع إفرازات مخاطية من داخل الخلايا الناتئة Intraductal papillary-mucinous adenoma
- ورم حميد ا لخلايا الضخمة المتحوصلة البالغة Mature cystic teratoma
- أورام متوسطة
- أورام متحوصلة مع إفرازات مخاطية مع تضخم متوسط Mucinous cystic tumor with moderate dysplasia
- ورم حميد الخلايا الغددية مع إفرازات مخاطية من داخل الخلايا الناتئة مع تضخم متوسط Intraductal papillary-mucinous adenoma with moderate dysplasia
- ورم الخلايا الناتئة الكاذبة الصلبة Solid-pseudopappillary tumor
- أورام خبيثة
- ورم خبيث الغدد القنوية Ductal Adenocarcinoma
- ورم الخلايا الضخمة الشبيهة بالخلايا الكلسية Oseoclast-like giant cell tumor
- ورم خبيث الغدد الخارجية المتحوصلة مع إفرازات مصلية Serous cystadenocarcinoma
- ورم خبيث الخلايا الغددية المتحوصلة مع إفرازات مخاطية Mucinous cystadenocarcinoma
- ورم خبيث الخلايا الغددية مع إفرازات مخاطية من داخل الخلايا الناتئة Intraductal pappillary-mucinous carcinoma
- ورم الخلايا العنبية Acinar cell carcinoma
- ورم الخلايا المكونة للبنكرياس Pancreablastoma
- ورم خبيث الخلايا الناتئة الكاذبة الصلبة Solid-psuedopapillary carcinoma
- أورام أخرى
- أورام من الغدد الصماء للبنكرياس Endocrine Glands
- أورام حميدة
- ورم حميد جيد التميز Well-differentiated adenoma
- ورم Insulinoma
- ورم حميد عديم العمل Nonfunctioning adenoma
- أورام متوسطة
- ورم غير غازية للأوعية وجيدة التميز Well-differentiated nonangioinvasive tumor
- ورم Insolinoma
- ورم Gastrinoma
- ورم حميد عديم العمل Nonfunctioning adenoma
- أورام منخفضة الخباثة
- ورم خبيث جيد أو متوسط التميز Well to moderately differentiated carcinoma
- أورام عالية الخباثة High-grade malignant
- ورم خبيث منعدم التميز Poorly differentiated carcinoma
- أورام غير ظهارية Nonepithelial
- أورام الأنسجة الرخوة الحميدة Benign soft tissue tumors
- أورام الأنسجة الرخوة الخبيثة Malignant soft tissue tumors
- أورام ليمفاوية خبيثة Malignant lymphomas
السرطانات الإفرازية
الغدد العصبية الصماء
الأعراض والعلامات
نظرًا لأن سرطان البنكرياس عادة لا يسبب أعراضًا يمكن التعرف عليها في مراحله المبكرة، فعادةً لا يتم تشخيص المرض حتى ينتشر خارج البنكرياس نفسه.[4] هذا هو أحد الأسباب الرئيسية لمعدلات البقاء الضعيفة بشكل عام. يستثنى من ذلك هي وظائف PanNETs، حيث يمكن أن يؤدي الإفراط في إنتاج الهرمونات النشطة المختلفة إلى ظهور أعراض (تعتمد على نوع الهرمون).[20]
مع الأخذ في الاعتبار أن المرض نادرًا ما يتم تشخيصه قبل سن الأربعين، تشمل الأعراض الشائعة لسرطان البنكرياس الغدي التي تحدث قبل التشخيص ما يلي:
- ألم في الجزء العلوي من البطن أو الظهر، وغالبًا ما ينتشر من حول المعدة إلى الظهر. يمكن أن يشير موقع الألم إلى الجزء الذي يوجد فيه الورم في البنكرياس. قد يكون الألم أسوأ في الليل وقد يزداد بمرور الوقت ليصبح شديدًا ومتواصلًا.[21] قد تنخفض شدة الألم قليلاً عن طريق الانحناء للأمام. في المملكة المتحدة، يُشخص حوالي نصف الحالات الجديدة من سرطان البنكرياس بعد زيارة قسم الطوارئ في المستشفى بسبب الألم أو اليرقان. لدى ما يصل إلى ثلثي الأشخاص، يكون ألم البطن هو العرض الرئيسي، حيث يصاحب اليرقان 46٪ من الإجمالي، و13٪ يعانون من اليرقان دون ألم.[12]
- اليرقان، لون أصفر ينتشر في بياض العين أو الجلد، مع أو بدون ألم، وربما يصاحبه لون البول الداكن، يحدث ذلك عندما يتسبب سرطان في رأس البنكرياس في انسداد القناة الصفراوية المشتركة لأنها تمر عبر البنكرياس.[22]
- فقدان الوزن غير المبرر، إما من فقدان الشهية، أو فقدان وظيفة الإفرازات الخارجية مما يؤدي إلى عسر الهضم.[12]
- قد يضغط الورم على الأعضاء المجاورة ويعطل عمليات الهضم ويصعب على المعدة إفراغ محتواها مما قد يسبب الغثيان والشعور بالامتلاء. تؤدي الدهون غير المهضومة إلى رائحة كريهة، براز دهني يصعب التخلص منه.[12] الإمساك هو عرض شائع أيضًا.[23]
- ما لا يقل عن 50٪ من المصابين بسرطان البنكرياس الغدي مصابون بالسكري في وقت التشخيص.[2] في حين أن مرض السكري طويل الأمد هو عامل خطر معروف لسرطان البنكرياس (انظر عوامل الخطر)، يمكن أن يسبب السرطان نفسه مرض السكري، وفي هذه الحالة يمكن اعتبار ظهور مرض السكري مؤخرًا علامة مبكرة على المرض.[24] الأشخاص الذين تزيد أعمارهم عن 50 عامًا والذين يصابون بمرض السكري معرضون بمعدل ثمانية أضعاف للإصابة بسرطان البنكرياس الغدي في غضون ثلاث سنوات، وبعد ذلك ينخفض الخطر النسبي.[12]
نتائج أخرى
- متلازمة تروسو - حيث تتشكل جلطات الدم تلقائيًا في الأوعية الدموية البابية (تجلط الوريد البابي)، الأوردة العميقة للأطراف (تجلط الأوردة العميقة)، أو الأوردة السطحية (تجلط الأوردة السطحية) في أي مكان من الجسم - قد تترافق مع سرطان البنكرياس، وتوجد في حوالي 10٪ من الحالات.[3]
- أفيد عن ارتباط الاكتئاب السريري بسرطان البنكرياس في حوالي 10-20٪ من الحالات، ويمكن أن يكون عائقًا أمام الإدارة المثلى للمرض. يظهر الاكتئاب أحيانًا قبل تشخيص السرطان، مما يشير إلى أنه قد يكون ناتجًا عن بيولوجيا المرض.[3]
تشمل المظاهر الشائعة الأخرى للمرض الضعف والتعب بسهولة، جفاف الفم، مشكلات النوم، وكتلة البطن الملموسة.[23]
أعراض الانتشار
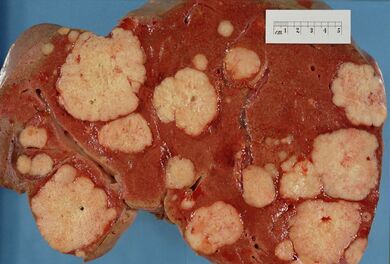
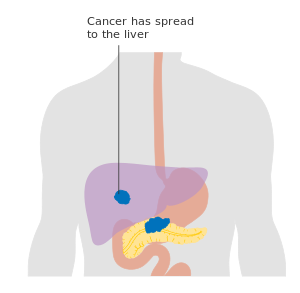
قد يؤدي انتشار سرطان البنكرياس إلى أعضاء أخرى (الورم الخبيث) إلى ظهور أعراض أيضًا. عادةً ما ينتشر سرطان البنكرياس الغدي أولاً إلى العقدة الليمفاوية القريبة، ثم إلى الكبد أو إلى التجويف البريتوني، الأمعاء الغليظة، أو الرئتين.[3] من غير الشائع أن ينتشر سرطان البنكرياس إلى المخ.[25]
قد تكون سرطانات البنكرياس أيضًا سرطانات ثانوية انتشرت من أجزاء أخرى من الجسم. هذا غير شائع، يوجد في حوالي 2٪ فقط من حالات سرطان البنكرياس. سرطان الكلى هو إلى حد بعيد أكثر أنواع السرطانات انتشارًا إلى البنكرياس، يليه سرطان القولون والمستقيم، ثم سرطانات الجلد، الثدي، والرئة. يمكن إجراء الجراحة على البنكرياس في مثل هذه الحالات، سواء على أمل الشفاء أو لتخفيف الأعراض.[26]
عوامل الخطر
يعتبر هذا المرض مرضا غير معديا، لا يوجد سبب علمي واضح يبرر حدوث ورم البنكرياس، ونادرا ما يتمكن أحد الإطباء من معرفة سبب إصابة شخص وعدم إصابة شخص أخر مر بنفس الظروف. اظهرت الابحاث ان الأفراد الذين يعانون من عوامل الخطر عرضة للإصابة بسرطان البنكرياس أكثر من غيرهم. عوامل الخطر هي أية عامل، ظرف / أو مؤشر يزيد من فرصة إصابة الشخص بالمرض. حددت الدراسات عوامل الخطر التالية:[27]
- العمر : احتمال تطور حالة سرطان النكرياس يزداد مع العمر. معظم سرطانات البنكرياس تصيب اشخاص فوق سن 60.
- التدخين : مدخنوا السجائر عرضة لتطوير خلابا بنكرياس سرطانية مرتين أو ثلاث مرات أكثر من الغير مدخنين
- السكري : سرطان البنكرياس يصيب الأفراد المصابين بالسكري أكثر من الأفراد الغير مصابين بالسكري
- الذكورة : الرجال أكثر عرضة للإصابة من النساء
- الأصول الأفريقية : أظهر الأفارقة الأمريكيون حسب الدراسات معدل إصابات بسرطان البنكرياس أعلى بكثير من الأمريكيين من اصول آسيوية أو اسبانيه.
- تاريخ الأسرة : خطر الإصابة بسرطان البنكرياس هو 3 أمثال الخطر الإعتيادي لدى الأفراد الذين ظهر المرض لدى الأم، الأب، الأخت، أو الأخ لديهم. أيضا تاريخ الإصابة في الأسرة المباشرة بسرطان القولون أو سرطان المبيض يزيد من خطر الاصابة بسرطان البنكرياس.
- التهاب البنكرياس المزمن : تشير بعض الادله بأن الحالات المصابة بالتهاب البنكرياس المزمن قد يزيد من خطر الاصابة بسرطان البنكرياس.
- أكل اللحوم بكثرة
- البدانة
- التعرض إلى مبيدات حشرية، أو لألوان أو مواد كيميائية
- سبب وراثي: كطفرة في الإِرْثَات (الجينات) المثبطة للأورام إنگليزية: tumor suppressor genes مثل مورثة/جينBRCA2 [28]
عوامل غبر مؤكدة:
- شرب الكحوليات أو القهوة بكثرة قد يؤدي إلى الإصابة بهذا المرض ولكنه لم يتم اثبات ذلك إلى الآن.
التشخيص
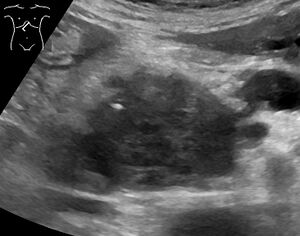
لا تظهر أعراض السرطان الغدي البنكرياسي عادة في المراحل المبكرة من المرض، كما أنها ليست مميزة للمرض بشكل فردي.[3][12][22] تختلف الأعراض عند التشخيص وفقًا لموقع السرطان في البنكرياس، والذي يقسمه علماء التشريح (من اليسار إلى اليمين في معظم المخططات) إلى الرأس السميك، والرقبة، والجسم المستدق المنتهي في الذيل.
بغض النظر عن مكان الورم، فإن أكثر الأعراض شيوعًا هو فقدان الوزن غير المبرر، والذي قد يكون كبيرًا. تعاني أقلية كبيرة (بين 35٪ و47٪) من الأشخاص الذين تم تشخيص إصابتهم بالمرض من الغثيان أو القيء أو الشعور بالضعف. عادةً ما تسبب الأورام في رأس البنكرياس اليرقان والألم وفقدان الشهية والبول الداكن والبراز ذو اللون الفاتح. عادة ما تسبب الأورام في الجسم والذيل الألم أيضًا.[22]
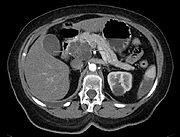
تُستخدم تقنيات التصوير الطبي، مثل التصوير المقطعي المحوسب والتنظير بالموجات فوق الصوتية لتأكيد التشخيص وللمساعدة في تحديد ما إذا كان يمكن إزالة الورم جراحيًا ("قابلية الاستئصال").[12] في تباين التصوير الطبقي المحوسب، يظهر سرطان البنكرياس عادةً زيادة تدريجية في امتصاص الأشعة، بدلاً من الانجراف السريع كما يظهر في البنكرياس الطبيعي أو الاغتسال المتأخر كما يظهر في التهاب البنكرياس المزمن.[29] يمكن أيضًا استخدام التصوير بالرنين المغناطيسي والتصوير المقطعي بالإصدار البوزيتروني،[2] وقد يكون تصوير الپنكرياس والقنوات الصفراوية بالرنين المغناطيسي مفيدًا في بعض الحالات.[22] الموجات فوق الصوتية على البطن أقل حساسية ولا تظهر الأورام الصغيرة، ولكن يمكنها تحديد السرطانات التي انتشرت في الكبد وتراكم السوائل في التجويف البريتوني (الاستسقاء).[12] يمكن استخدامها لإجراء فحص أولي سريع ورخيص قبل التقنيات الأخرى.[30]
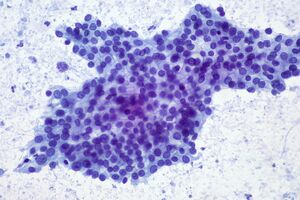
يمكن استخدام الخزعة بواسطة خزعة بالإبرة، التي يتم توجيهها غالبًا بالموجات فوق الصوتية بالمنظار، حيث يكون هناك عدم يقين بشأن التشخيص، لكن التشخيص النسيجي ليس مطلوبًا عادةً لإزالة الورم عن طريق جراحة.[12]
اختبار وظائف الكبد يمكن أن يُظهر مجموعة من النتائج التي تدل على انسداد القناة الصفراوية (ارتفاع البيليروبين المترافق، γ-گلوتاميل ترانسپپتيداز ومستويات الفوسفاتيز القلوي). CA19-9 (مستضد الكربوهيدرات 19.9) هو أحد دلالات الأورام الذي غالبًا ما يرتفع في سرطان البنكرياس. ومع ذلك، فإنه يفتقر إلى الحساسية والنوعية، لأسباب ليس أقلها أن 5٪ من الأشخاص يفتقرون إلى مستضد لويس (أ) ولا يمكنهم إنتاج CA19-9. لديه حساسية 80٪ وخصوصية 73٪ في الكشف عن سرطان البنكرياس الغدي، ويستخدم لمتابعة الحالات المعروفة بدلاً من التشخيص.[2][12]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
علم التشريح المرضي
| نوع السرطان | الحدوث النسبي[11] | نتائج الفحص المجهري[11] | صورة مجهرية | علامات كيمياء الأنسجة المناعية [11] | التعديلات الجينية[11] |
|---|---|---|---|---|---|
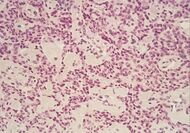
| السرطانة الغدية القنوية الپنكرياسية (PDAC) | 90% | الغدد والتنسج الليفي | 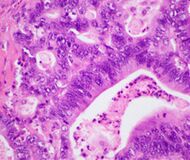 |
||
| سرطانة الخلايا العنيبية الپنكرياسية (ACC) | 1% إلى 2% | المظهر الحبيبي | 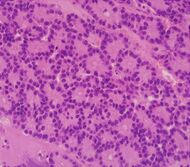
|
||
| السرطان الغدي الحرشفي | 1% إلى 4%[31] | مزيج من الخلايا الشبه-غدية والخلايا الحرشفية الظهارية. | 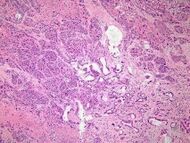 |
إيجابي لـ:
Negative for: |
|
| الورم الأصم العصبي الپنكرياسي | 5% | أعشاش متعددة للخلايا السرطانية | الورم گاستريني | ||
| مقارنة لما قبل السرطان: | |||||
| ما قبل السرطان: ورم مخاطي حليمي داخل قناة الپنكرياس (IPMN) |
3% | الخلايا الظهارية المخاطية.[32] النمو داخل قنوات الپنكرياس.[33] | 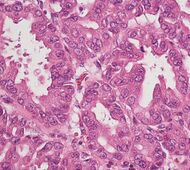
|
||
مراحل المرض
السرطانات الإفرازية
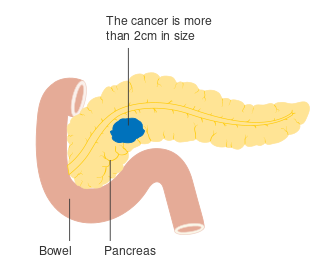
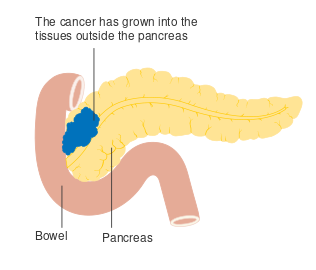
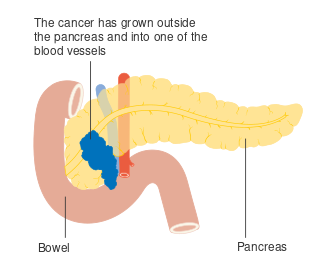
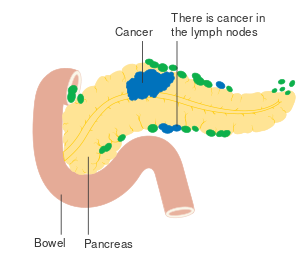
- مراحل سرطان البنكرياس (تصنيف TNM)
تقنيات حديثة
في 30 نوفمبر 2022، أعلنت شركة هيروتسو بيو ساينس للتكنولوجيا الحيوية عن طويرها أول اختبار فحص مبكر في العالم لسرطان البنكرياس باستخدام أنوف الديدان الاسطوانية القوية.
أطلقت الشركة في نوفمبر اختبار N-NOSE plus Pancreas، للتسويق مباشرة للمستهلكين في اليابان بهدف تقديم الاختبار إلى الولايات المتحدة بحلول عام 2023. يرسل المستخدمون عينة بول من خلال كيس بريد خاص إلى المختبر، حيث يتم وضعها في طبق بتري مع نوع من الديدان الاسطوانية. تقول الشركة إن الديدان لديها حواس شمية أقوى بكثير من الكلاب، وهي تتبع أنفها نحو الخلايا السرطانية.[34]
هذا يجعل الحيوانات التي يبلغ طولها ميليمتراً واحداً أداة تشخيصية قوية، كما يقول مؤسس الشركة ورئيسها التنفيذي تاكاكي هيروتسو، الذي كان يبحث عنها منذ 28 عامًا. وقالت هيروتسو لرويترز "المهم للغاية في الكشف المبكر عن السرطان وهذه الأنواع من الأمراض هو القدرة على استشعار كميات ضئيلة للغاية." "وعندما يتعلق الأمر بذلك، أعتقد أن الآلات لا تحظى بفرصة ضد القدرات التي تمتلكها الكائنات الحية."
أطلقت هيرتسو بايو أول اختبار للمستهلك N-NOSE في يناير 2020 والتي ادعت قدرته على معرفة ما إذا كان المستخدمون معرضون لخطر الإصابة بالسرطان أم لا. أجرى حوالي 250000 شخص الاختبار الأصلي، وحصل حوالي 5%-6% على قراءات عالية الخطورة.
في الإصدار الأخير، قامت الشركة بتعديل الشفرة الجينية للديدان الاسطوانية بحيث تسبح بعيدًا عن عينات سرطان البنكرياس. بدأت هيروتسو بايو بسرطان البنكرياس بسبب صعوبة التشخيص وسرعة التقدم. في السنوات القادمة، تتوقع الشركة إجراء اختبارات مستهدفة لسرطان الكبد، وكذلك سرطان عنق الرحم والثدي.
تبلغ تكلفة مجموعة اختبار البنكرياس ما يصل إلى 70 ألف ين (505 دولار) ، وهي مكلفة نسبيًا لإجراء اختبار تشخيصي في اليابان، التي لديها نظام رعاية صحية مؤمم وأسعار ثابتة للأدوية والإجراءات. قالت هيروتسو إن السعر، إلى جانب الإعلانات التلفزيونية التي تستخدم رسومًا كاريكاتورية للديدان والبنكرياس، جزء من عملية بناء علامة تجارية، مضيفًا أن السعر قد ينخفض مع زيادة توزيع الشركة.
قال ماساهيرو كامي، رئيس معهد أبحاث الحوكمة الطبية في طوكيو، إن الإيجابيات الكاذبة يمكن أن تفوق عدد الحالات الفعلية لسرطان البنكرياس، مما يجعل النتائج "غير قابلة للاستخدام". تعارض الشركة أن دقة N-NOSE تقف بشكل جيد ضد الاختبارات التشخيصية الأخرى والمقصود منها أن تكون أدوات الفحص المبكر التي يمكن أن توجه المرضى إلى مزيد من الاختبارات والعلاج في وقت أقرب.
على الرغم من أنه كان يدرس الديدان الاسطوانية لعقود من الزمن وتشكل أساس شركته، يقول هيروتسو إنه ليس لديه أي صلة خاصة بالمخلوقات. وقال "أشعر أنني يجب أن أعطي الجواب بأنني أحب الديدان الاسطوانية وأجدها لطيفة، لكن هذا ليس هو الحال على الإطلاق". حقًا، أنا فقط أفكر فيهم على أنهم مواد بحثية وليس أكثر".
الوقاية
بجانب ن الإقلاع عن التدخين، توصي جمعية السرطان الأمريكية بالحفاظ على وزن صحي وزيادة استهلاك الفواكه والخضروات والحبوب الكاملة، مع تقليل استهلاك اللحوم الحمراء واللحوم المصنعة، على الرغم من لا يوجد دليل ثابت على أن هذا سوف يمنع أو يقلل من سرطان البنكرياس على وجه التحديد.[35]
خلصت مراجعة بحثية عام 2014 إلى أن هناك دليلًا على أن استهلاك الحمضيات والكركمين قلل من خطر الإصابة بسرطان البنكرياس، في حين أنه من المحتمل أن يكون هناك تأثير مفيد من تناول الحبوب الكاملة، الفولات، السيلينيوم والأسماك غير المقلية.[36]
في عموم السكان، لا يعتبر فحص المجموعات الكبيرة فعالاً وقد يكون ضارًا اعتبارًا من عام 2019،[37] على الرغم من أن التقنيات الحديثة، وفحص المجموعات المستهدفة بإحكام، يتم تقييمها.[38][39] ومع ذلك، يوصى بالفحص المنتظم بـ MRI/CT للأشخاص المعرضين لخطر كبير من الجينات الموروثة.[4][30][39][40]
يقال إن استخدام الأسپرين يقلل من خطر الإصابة بسرطان البنكرياس. [41] [42]
علاج المرض
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
السرطان الإفرازي
التقييم الأساسي الذي يتم إجراؤه بعد التشخيص هو ما إذا كان الاستئصال الجراحي للورم ممكنًا (انظر المراحل، لأن هذا هو العلاج الوحيد لهذا السرطان. تعتمد إمكانية إجراء الاستئصال الجراحي أم لا على مدى انتشار السرطان. يعد الموقع الدقيق للورم أيضًا عاملاً هاماً، ويمكن أن يُظهر التصوير المقطعي المحوسب مدى ارتباطه بالأوعية الدموية الرئيسية التي تمر بالقرب من البنكرياس. يجب أيضًا تقييم الصحة العامة للشخص، على الرغم من أن العمر في حد ذاته لا يمثل عقبة أمام الجراحة.[3]
من المرجح أن يتم تقديم العلاج الكيميائي، وبدرجة أقل، العلاج الإشعاعي لمعظم الأشخاص، سواء كانت الجراحة ممكنة أم لا. ينصح المتخصصون بأن تكون إدارة سرطان البنكرياس في أيدي فريق متعدد التخصصات بما في ذلك المتخصصين في العديد من جوانب علم الأورام، وبالتالي، من الأفضل إجراؤها في المراكز الكبيرة.[2][3]
الجراحة
الجراحة بقصد العلاج ممكنة فقط في حوالي خمس (20٪) من الحالات الجديدة.[12] بالرغم من أن التصوير المقطعي المحوسب يساعد، إلا أنه من الناحية العملية قد يكون من الصعب تحديد ما إذا كان يمكن إزالة الورم بالكامل ("قابليته للاستئصال")، وقد يتضح فقط أثناء الجراحة أنه لا يمكن إزالة الورم بنجاح دون الإضرار بالأنسجة الحيوية الأخرى. تعتمد إمكانية إجراء الاستئصال الجراحي أم لا على عوامل مختلفة، بما في ذلك المدى الدقيق للتجاور التشريحي الموضعي مع الأوعية الدموية الوريدية أو الشرايينية أو تداخلها،[2] بالإضافة إلى الخبرة الجراحية والتفكير الدقيق في التعافي المتوقع بعد الجراحة.[43][44] عمر الشخص ليس في حد ذاته سببًا لعدم إجراء الجراحة، ولكن حالة الأداء العامة يجب أن تكون كافية لإجراء عملية كبرى.[12]
إحدى السمات الخاصة التي تم تقييمها هي الوجود المشجع، أو الغياب المحبط، لطبقة أو مستوى واضح من الدهون مما يخلق حاجزًا بين الورم والأوعية.[3] تقليديا، يُجرى تقييم لقرب الورم من الأوعية الدموية الوريدية أو الشرايين الرئيسية، من حيث "الدعامة" (تُعرَّف على أنها الورم الذي لا يلامس أكثر من نصف محيط الأوعية الدموية دون أي دهون لفصله)، "الغلاف" (عندما الورم يرفق معظم محيط الوعاء)، أو تورط كامل للأوعية.[45] قد يكون الاستئصال الذي يتضمن أقسامًا مغلفة من الأوعية الدموية ممكنًا في بعض الحالات،[46][47] خاصة إذا كان العلاج المساعد الجديد التمهيدي ممكنًا،[48][49][50] استخدام العلاج الكيميائي[44][45][51] و/أو العلاج الإشعاعي.[45]
حتى عندما يبدو أن العملية كانت ناجحة، غالبًا ما توجد خلايا سرطانية حول حواف (الهوامش") النسيج الذي جرى إزالته، عندما يفحصها أخصائي علم الأمراض مجهريًا (سيُجرى ذلك دائمًا)، مشيرًا إلى لم يزال السرطان بالكامل.[2] علاوة على ذلك، عادة لا تظهر الخلايا الجذعية السرطانية بالمجهر، وإذا كانت موجودة فقد تستمر في التطور والانتشار.[52][53] لذلك يمكن إجراء تنظير البطن الاستكشافي (إجراء جراحي صغير موجه بالكاميرا) للحصول على فكرة أوضح عن نتيجة العملية الكاملة.[54]
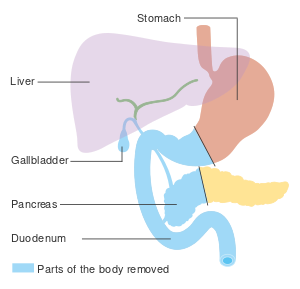
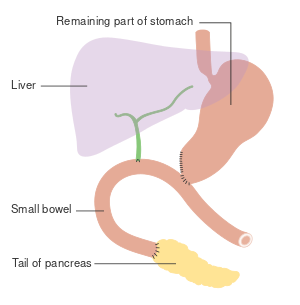
بالنسبة للسرطانات التي تصيب رأس البنكرياس، فإن عملية ويپل هو العلاج الجراحي الأكثر شيوعًا. تعتبر هذه عملية كبرى تتضمن إزالة رأس البنكرياس ومنحنى الاثني عشر معًا ("استئصال البنكرياس والاثني عشر")، وإجراء تحويل التلفافي للطعام من المعدة إلى اللفائفي ("gastro-jejunostomy") وربط حلقة من اللفائفي إلى القناة الكيسية لتصريف الصفراء ("cholecysto-jejunostomy").
لا يمكن إجراؤها إلا إذا كان من المرجح أن ينجو الشخص من الجراحة الكبيرة وإذا كان السرطان موضعيًا دون غزو الهياكل المحلية أو انتشار النقائل. وبالتالي، لا يمكن إجراؤها إلا في حالات قليلة. يمكن استئصال سرطانات ذيل البنكرياس باستخدام إجراء يُعرف باسم استئصال البنكرياس البعيد، والذي غالبًا ما يستلزم أيضًا استئصال الطحال.[2][3]
على الرغم من أن الجراحة العلاجية لم تعد تستلزم ارتفاع معدلات الوفيات التي حدثت حتى الثمانينيات، إلا أن نسبة عالية من الأشخاص (حوالي 30-45٪) لا يزالون بحاجة إلى العلاج من مرض ما بعد الجراحة لا يسببه السرطان نفسه. المضاعفات الأكثر شيوعًا للجراحة هي صعوبة إفراغ المعدة.[3] يمكن أيضًا استخدام إجراءات جراحية محددة أكثر محدودية لتخفيف الأعراض (انظر الرعاية التلطيفية): على سبيل المثال، إذا كان السرطان يغزو أو يضغط على الاثني عشر أو القولون. في مثل هذه الحالات، قد تتغلب جراحة المجازة على الانسداد وتحسن نوعية الحياة ولكن لا يُقصد بها أن تكون علاجًا.[12]
العلاج الكيميائي
بعد الجراحة، يمكن تقديم العلاج الكيميائي المساعد باستخدام الجيمسيتابين أو 5-FU إذا كانت حالة الشخص الصحية حالة الأداء لائقة بشكل كافي، بعد فترة تعافي من شهرين إلى شهرين.[4][30] بالنسبة للأشخاص غير المناسبين للجراحة العلاجية، يمكن استخدام العلاج الكيميائي لإطالة العمر أو تحسين جودة الحياة.[3] قبل الجراحة، يمكن استخدام العلاج الكيميائي المساعد الجديد أو العلاج الكيميائي الإشعاعي في الحالات التي تعتبر "قابلة للاستئصال" (انظر المراحل) لتقليل السرطان إلى مستوى قد تكون الجراحة مفيدة. في حالات أخرى، يظل العلاج المساعد الجديد مثيرًا للجدل، لأنه يؤخر الجراحة.[3][4][55]
اعتمدت إدارة الغذاء والدواء الأمريكية الجيمسيتابين عام 1997، بعد تجربة سريرية أفادت عن تحسن في نوعية الحياة وتحسن لمدة خمسة أسابيع في متوسط مدة البقاء لدى الأشخاص المصابين بسرطان البنكرياس المتقدم.[56] كان هذا أول دواء للعلاج الكيميائي اعتمده قبل إدارة الغذاء والدواء بشكل أساسي لنقطة نهاية تجربة سريرية غير قابلة للبقاء.[57] كان العلاج الكيميائي باستخدام الجيمسيتابين وحده هو المعيار لعشر سنوات تقريبًا، حيث فشل عدد من التجارب التي اختبرته مع أدوية أخرى في إظهار نتائج أفضل بشكل ملحوظ. ومع ذلك، عُثر على مزيج الجيمسيتابين مع الإرلوتينيب لزيادة معدل البقاء على قيد الحياة بشكل متواضع، وعام 2005 حاز الإرلوتينيب على ترخيص إدارة الغذاء والدواء الأمريكية لاستخدامه لعلاج سرطان البنكرياس.[58]
وجد أن نظام العلاج الكيميائي FOLFIRINOX باستخدام أربعة عقاقير أكثر فعالية من الجيمسيتابين، لكن مع آثار جانبية كبيرة، وبالتالي فهو مناسب فقط للأشخاص الذين يتمتعون بحالة أداء جيدة. هذا ينطبق أيضًا على الپاكليتاكسيل المرتبط بالپاروتين (ناب-پاكليتاكسيل) ، الذي اعتمده إدارة الغذاء والدواء الأمريكية عام 2013 للاستخدام مع الجيمسيتابين لعلاج سرطان البنكرياس.[59] بحلول نهاية 2013، اعتبر كل من FOLFIRINOX وناب-پاكليتاكسيل مع الجيمسيتابين بمثابة خيارات جيدة لأولئك القادرين على تحمل الآثار الجانبية، وظل الجيمسيتابين خيارًا فعالًا لأولئك الذين لم يفعلوا ذلك. يُنتظر إجراء تجربة مباشرة بين الخيارين الجديدين، وتستمر التجارب التي تحقق في الاختلافات الأخرى. ومع ذلك، فإن التغييرات التي حدثت في السنوات القليلة الماضية أدت إلى زيادة معدل البقاء على قيد الحياة لبضعة أشهر فقط.[56] غالبًا ما تُجرى التجارب السريرية للحصول على علاجات مساعدة جديدة.[4]
العلاج الإشعاعي
كان دور العلاج الإشعاعي كعلاج مساعد بعد الجراحة العلاجية المحتملة مثيرًا للجدل منذ الثمانينيات.[3] في أوائل العقد الأول من القرن الحادي والعشرين، أظهرت مجموعة الدراسة الأوروپية لأبحاث سرطان البنكرياس (ESPAC) تفوقًا إنذاريًا للعلاج الكيميائي المساعد على العلاج الكيميائي الإشعاعي.[60][61][4] توصي الجمعية الأوروپية لعلم الأورام بأن العلاج الإشعاعي المساعد يجب أن يستخدم فقط للأشخاص المسجلين في التجارب السريرية.[30] ومع ذلك، هناك ميل مستمر للأطباء في الولايات المتحدة ليكونوا أكثر استعدادًا لاستخدام العلاج الإشعاعي المساعد من أولئك الموجودين في أوروپا. اختبرت العديد من التجارب السريرية مجموعة متنوعة من مجموعات العلاج منذ الثمانينيات، لكنها فشلت في تسوية الأمر بشكل قاطع .[3][4]
قد يشكل العلاج الإشعاعي جزءًا من العلاج لمحاولة تقليص الورم إلى حالة قابلة للاستئصال، لكن استخدامه على الأورام غير القابلة للاكتشاف يظل مثيرًا للجدل نظرًا لوجود نتائج متضاربة من التجارب السريرية. النتائج الأولية لتجربة واحدة، تم تقديمها عام 2013، "قللت بشكل ملحوظ من الحماس" لاستخدامها في الأورام المتقدمة موضعياً.[2]
الأورام الصماء العصبية الپنكرياسيية
علاج الأورام الصماء العصبية الپنكرياسيية (PanNETs)، بما في ذلك الأنواع الخبيثة الأقل شيوعًا، قد يتضمن عددًا من الأساليب.[62][63][64][65] بعض الأورام الصغيرة أقل من 1 سم. التي تُكتشف بالمصادفة، على سبيل المثال عند إجراء فحص بالأشعة المقطعية لأغراض أخرى، يمكن أن يتبعها انتظار يقظ.[62] يعتمد هذا على المخاطر المقدرة للجراحة والتي تتأثر بموقع الورم ووجود مشكلات طبية أخرى.[62] يمكن استئصال الأورام الموجودة داخل البنكرياس فقط (الأورام الموضعية)، أو الأورام ذات النقائل المحدودة، على سبيل المثال في الكبد، عن طريق الجراحة. يعتمد نوع الجراحة على مكان الورم ودرجة انتشاره إلى الغدد الليمفاوية.[66] بالنسبة للأورام الموضعية، قد يكون الإجراء الجراحي أقل شمولاً بكثير من أنواع الجراحة المستخدمة لعلاج سرطان البنكرياس الغدي الموصوف أعلاه، ولكن بخلاف ذلك تكون الإجراءات الجراحية مماثلة لتلك الخاصة بأورام الغدد الصماء. يختلف نطاق النتائج المحتملة اختلافًا كبيرًا؛ تتمتع بعض الأنواع بمعدل بقاء مرتفع للغاية بعد الجراحة بينما البعض الآخر لديها مآل سيء. نظرًا لندرة كل هذه المجموعة، تؤكد الإرشادات أنه يجب إجراء العلاج في مركز متخصص.[66][67] يمكن النظر في استخدام زراعة الكبد في حالات معينة من الأورام الخبيثة في الكبد.[68]
بالنسبة للأورام الوظيفية، يمكن لفئة نظير السوماتوستاتين، مثل الأوكتريوتيد، تقليل الإنتاج المفرط للهرمونات.[66] قد يُبطيء النريوتيد من نمو المرض.[69] إذا كان الورم غير قابل للإزالة الجراحية ويسبب أعراضًا، يمكن أن يقلل العلاج الموجه باستخدام الإيڤروليموس أو السونيتينيب الأعراض ويبطئ تقدم المرض.[67][70][71] لا يُعد العلاج الكيميائي القياسي السام للخلايا فعالًا جدًا بشكل عام مع الأورام الصماء العصبية الپنكرياسيية، لكن يمكن استخدامه عندما تفشل العلاجات الدوائية الأخرى في منع تقدم المرض،[67] أو في سرطانات الأورام الصماء العصبية الپنكرياسيية سيئة التمايز.[72]
يستخدم العلاج الإشعاعي أحيانًا إذا كان هناك ألم بسبب الامتداد التشريحي ، مثل ورم خبيث للعظام. تمتص بعض الأورام الصماء العصبية الپنكرياسيية أنواعًا معينة من الپپتيد أو الهرمونات، وقد تستجيب الأورام الصماء العصبية الپنكرياسيية هذه للعلاج النووي باستخدام پپتيدات أو هرمونات الإيوبنگوان (اليود-131-MIBG).[73][74][75][76] يمكن أيضًا استخدام الاستئصال بالترددات الراديوية (RFA) والاستئصال بالتجميد وإنسداد الشريان الكبدي.[77][78]
الرعاية التلطيفية
Palliative care is medical care which focuses on treatment of symptoms from serious illness, such as cancer, and improving quality of life.[79] Because pancreatic adenocarcinoma is usually diagnosed after it has progressed to an advanced stage, palliative care as a treatment of symptoms is often the only treatment possible.[80]
Palliative care focuses not on treating the underlying cancer, but on treating symptoms such as pain or nausea, and can assist in decision-making, including when or if hospice care will be beneficial.[81] Pain can be managed with medications such as opioids or through procedural intervention, by a nerve block on the celiac plexus (CPB). This alters or, depending on the technique used, destroys the nerves that transmit pain from the abdomen. CPB is a safe and effective way to reduce the pain, which generally reduces the need to use opioid painkillers, which have significant negative side effects.[3][82]
Other symptoms or complications that can be treated with palliative surgery are obstruction by the tumor of the intestines or bile ducts. For the latter, which occurs in well over half of cases, a small metal tube called a stent may be inserted by endoscope to keep the ducts draining.[22] Palliative care can also help treat depression that often comes with the diagnosis of pancreatic cancer.[3]
Both surgery and advanced inoperable tumors often lead to digestive system disorders from a lack of the exocrine products of the pancreas (exocrine insufficiency). These can be treated by taking pancreatin which contains manufactured pancreatic enzymes, and is best taken with food.[12] Difficulty in emptying the stomach (delayed gastric emptying) is common and can be a serious problem, involving hospitalization. Treatment may involve a variety of approaches, including draining the stomach by nasogastric aspiration and drugs called proton-pump inhibitors or H2 antagonists, which both reduce production of gastric acid.[12] Medications like metoclopramide can also be used to clear stomach contents.
إحصائيات
| المرحلة السريرية | البقاء لخمس سنوات بالولايات المتحدة (%) لتشخيص الفترة 1992–1998 | |
|---|---|---|
| سرطان البنكرياس الإفرازي | علاج أورام الغدد الصم العصبية بالجراحة | |
| IA / I | 14 | 61 |
| IB | 12 | |
| IIA / II | 7 | 52 |
| IIB | 5 | |
| III | 3 | 41 |
| IV | 1 | 16 |
انتشار المرض
عام 2015، تسببت سرطانات البنكرياس بجميع أنواعها في وفاة 411.600 شخص على مستوى العالم.[8] وفي 2014، كان من المتوقع أن تُشخص إصابة ما يقرب من 46.000 شخص في الولايات المتحدة بسرطان البنكرياس ووفاة 40.000 شخص بسببه.[2] على الرغم من أن سرطان البنكرياس يمثل 2.5٪ فقط من الحالات الجديدة، إلا أنه مسؤول عن 6٪ من وفيات السرطان سنوياً.[84] وهو سابع أعلى سبب للوفاة من السرطان في جميع أنحاء العالم.[10] يعد سرطان البنكرياس خامس أكثر أسباب الوفاة شيوعًا بالسرطان في المملكة المتحدة،[16] والثالث في الولايات المتحدة.[17]
يحتل سرطان البنكرياس عالميًا المرتبة 11 بين أكثر أنواع السرطانات شيوعًا بين النساء والمرتبة 12 الأكثر شيوعًا عند الرجال.[10] تحدث غالبية الحالات المسجلة في البلدان المتقدمة.[10] لدى الأشخاص من الولايات المتحدة متوسط خطر مدى الحياة حوالي 1 من 67 (أو 1.5٪) من المصابين بالمرض،[85] أعلى قليلة من الرقم في المملكة المتحدة.[86] سرطان البنكرياس أكثر شيوعاً بين الرجال عنه بين النساء،[2][10] على الرغم من أن الاختلاف في المعدلات قد تقلص خلال العقود الأخيرة، مما يعكس على الأرجح الزيادات السابقة انتشار التدخين بين الإناث. في الولايات المتحدة، تزيد مخاطر الأمريكان الأفارقة بنسبة تزيد عن 50٪ عن البيض، ولكن المعدلات في أفريقيا وشرق آسيا أقل بكثير من تلك الموجودة في أمريكا الشمالية أو أوروپا. تتمتع كل من الولايات المتحدة ووسط وشرق أوروپا والأرجنتين وأوروگواي بمعدلات عالية.[10]
التاريخ
الاكتشاف والتشخيص
يُنسب أول اكتشاف لسرطان البنكرياس إلى العالم الإيطالي من القرن الثامن عشر جوڤاني باتيستا مورگاني، الأب التاريخي لعلم الأمراض التشريحي، الذي ادعى أنه تعقب عدة حالات من السرطان في البنكرياس. كان العديد من الأطباء في القرنين الثامن عشر والتاسع عشر متشككين في وجود المرض، بالنظر إلى المظهر المماثل لالتهاب البنكرياس. نُشرت بعض تقرير حالة في عشرينيات وثلاثينيات القرن التاسع عشر، وتم تسجيل تشخيص حقيقي لمرض الأنسجة في النهاية من قبل الطبيب الأمريكي جيكوب مينديز دا كوستا، الذي شكك أيضًا في موثوقية تفسيرات مورگاني. بحلول بداية القرن العشرين، أصبح سرطان رأس البنكرياس تشخيصًا راسخًا.[87]
فيما يتعلق بالتعرف على PanNETs، اقترح احتمال الإصابة بسرطان الخلايا الجزيرية في البداية عام 1888. أفيد عن أول حالة فرط الأنسولين بسبب ورم من هذا النوع عام 1927. التعرف على نوع لا يفرز الأنسولين من PanNET يُنسب عمومًا إلى الجراحين الأمريكيين، ر.م. زولينجر وهـ. إ. إليسون، الذي أعطى أسمائهم لمتلازمة زولينجر إليسون، بعد افتراض وجود ورم في البنكرياس يفرز الگاسترين في تقرير عن حالتين من القرحة الهضمية الشديدة الغير معتادة نُشرت عام 1955.[87] عام 2010، أوصت منظمة الصحة العالمية بأن يشار إلى PanNETs باسم "الغدد الصماء العصبية" بدلاً من أورام "الغدد الصماء".[88]
يُكشف عن الأورام الصغيرة محتملة التسرطن للعديد من سرطانات البنكرياس بمعدلات متزايدة بشكل كبير عن طريق التصوير الطبي الحديث. أحد أنواع الأورام المخاطية الحليمية داخل القناة وصفه الباحثون اليابانيون لأول مرة عام 1982. ولوحظ عام 2010 ما يلي: "بالنسبة للعقد التالي، لم يول إيلاء اهتمام كبير لهذا التقرير؛ ومع ذلك، على مدى السنوات الـ 15 اللاحقة، كان هناك انفجار فعلي في التعرف على هذا الورم".[89]
الجراحة
أُجريت أول عملية استئصال جزئي للبنكرياس والاثني عشر أفاد بها الجراح الإيطالي أليساندرو كوديڤيلا عام 1898، لكن المريض نجا فقط 18 يومًا قبل تعرضه للمضاعفات. تعرضت العمليات المبكرة للخطر جزئيًا بسبب الاعتقاد الخاطئ بأن الناس يتوفون إذا أزيلت الاثني عشر، وكذلك في البداية، إذا توقف تدفق عصارة البنكرياس. في وقت لاحق، ساد الاعتقاد، عن طريق الخطأ أيضًا، أن القناة البنكرياسية يمكن ببساطة ربطها دون آثار ضارة خطيرة؛ في الواقع، غالبًا ما تنحل لاحقًا. عام 1907-1908، بعد بعض العمليات غير الناجحة التي قام بها جراحون آخرون، تمت تجربة الإجراءات التجريبية على الجثث من قبل الجراحين الفرنسيين.[90]
عام 1912 كان الجراح الألماني ڤالتر كوش أول من قام بإزالة أجزاء كبيرة من الاثني عشر والبنكرياس معًا ("كتلة"). كان هذا في بريسلاو، ڤروتسواف، پولندا حالياً. عام 1918، ثبت في العمليات التي أجريت على الكلاب أنه من الممكن البقاء على قيد الحياة حتى بعد الإزالة الكاملة للاثنى عشر، ولكن لم تُعلن مثل هذه النتيجة في الجراحة البشرية حتى عام 1935، عندما نشر الجراح الأمريكي ألن أولدفاذر ويپل نتائج سلسلة من ثلاث عمليات في مستشفى كولومبيا المشيخية بنيويورك. أزيل الاثنى عشر بالكامل لمريض واحد فقط، لكنه نجا لمدة عامين قبل أن يموت من ورم خبيث في الكبد.
كانت العملية الأولى غير مخطط لها، حيث اكتشف السرطان في غرفة العمليات فقط. أنار نجاح ويپل الطريق إلى المستقبل، لكن العملية ظلت صعبة وخطيرة حتى العقود الأخيرة. نشر العديد من التحسينات على إجرائها، بما في ذلك أول إزالة كاملة للاثني عشر عام 1940، لكنه أجرى فقط ما مجموعه 37 عملية جراحية.[90]
الاكتشاف في أواخر الثلاثينيات أن ڤيتامين ك منع النزيف مع اليرقان، وتطوير نقل الدم كعملية يومية، وكلاهما أدى إلى تحسين البقاء على قيد الحياة بعد الجراحة،[90] لكن حوالي 25٪ من الناس لم يغادروا المستشفى أحياء حتى أواخر السبعينيات.[91] في السبعينيات، كتبت مجموعة من الجراحين الأمريكيين حثوا فيها على أن الإجراء خطير للغاية ويجب التخلي عنه. منذ ذلك الحين تحسنت النتائج في المراكز الكبيرة بشكل كبير، وغالبًا ما تكون الوفيات الناتجة عن العملية أقل من 4٪.[92]
عام 2006 نُشر تقرير عن سلسلة من 1000 عملية استئصال للبنكرياس والاثني عشر متتالية قام بها جراح واحد من مستشفى جونز هوپكنز بين عامي 1969 و2003. وزاد معدل هذه العمليات بشكل مطرد خلال هذه الفترة، مع ثلاثة منها فقط قبل عام 1980، وانخفض متوسط وقت إجراء العملية من 8.8 ساعة في السبعينيات إلى 5.5 ساعة في العقد الأول من القرن الحادي والعشرين، وكانت الوفيات في غضون 30 يومًا أو في المستشفى 1٪ فقط.[90][91] أظهرت سلسلة أخرى من 2050 عملية جراحية في مستشفى مساتشوستس العام بين عامي 1941 و2011 صورة مماثلة من التحسن.[93]
اتجاهات البحث
تتضمن الأبحاث في المراحل المبكرة حول سرطان البنكرياس دراسات حول علم الوراثة والاكتشاف المبكر والعلاج في مراحل السرطان المختلفة والاستراتيجيات الجراحية والعلاجات المستهدفة، مثل تثبيط عوامل النمو والعلاجات المناعية واللقاحات.[94][95][96][97][98]حمض الصفراء قد يكون له دور في التسرطن في سرطان البنكرياس.[99]
السؤال الرئيسي هو توقيت الأحداث مع تقدم المرض وتطوره- لا سيما دور مرض السكري،[95][24] وكيف ومتى ينتشر المرض.[100] إن المعرفة بأن الظهور الجديد لمرض السكري يمكن أن يكون علامة مبكرة للمرض يمكن أن يسهل التشخيص في الوقت المناسب والوقاية إذا كان من الممكن تطوير استراتيجية فحص عملية.[95][24][101] تهدف تجربة السجل الأوروپي لالتهاب الپنكرياس الوراثي وسرطان الپنكرياس العائلي (EUROPAC) إلى تحديد ما إذا كان الفحص المنتظم مناسبًا للأشخاص الذين لديهم تاريخ عائلي للمرض.[102]
يتم تقييم الجراحة الكاشفة (تنظير البطن) بدلاً من إجراء ويپل، لا سيما من حيث وقت الشفاء.[103] التثقيب الكهربائي اللاعكسي هو أسلوب جديد نسبيًا الاجتثاث مع إمكانية خفض مستوى البقاء وإطالة فترة بقاء الأشخاص المصابين بأمراض متقدمة موضعياً، خاصة بالنسبة للأورام القريبة من الأوعية المحيطة بالبنكرياس دون التعرض لخطر الإصابة بصدمات الأوعية الدموية.[104][105]
الجهود جارية لتطوير عقاقير جديدة، بما في ذلك تلك التي تستهدف الآليات الجزيئية لظهور السرطان،[106][107] الخلايا الجذعية،[53] والتكاثر الخلوي.[107][108] هناك نهج آخر يتضمن استخدام العلاج المناعي، مثل الڤيروسات المحللة للأورام.[109] الآليات المحددة-گالكتين للبيئة الدقيقة للورم قيد الدراسة.[110]
انظر أيضاً
- سرطان الجهاز الهضمي
- شبكة حراك سرطان الپنكرياس (منظمة في الولايات المتحدة)
- حراك سرطان الپنكرياس (منظمة في المملكة المتحدة)
- مؤسسة لوستگارتن لأبحاث سرطان الپنكرياس (منظمة في الولايات المتحدة)
- قائمة الأشخاص المشخصين بسرطان الپنكرياس
- تكرار الإصابة بسرطان الپنكرياس
مرئيات
| تقرير عن استخدام للديدان الاسطوانية للكشف المبكر عن سرطان البنكرياس، نوفمبر 2022. |
|---|
المصادر
- ^ أ ب ت ث ج ح خ "Pancreatic Cancer Treatment (PDQ®) Patient Version". National Cancer Institute. National Institutes of Health. 17 April 2014. Archived from the original on 5 July 2014. Retrieved 8 June 2014.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط Ryan DP, Hong TS, Bardeesy N (September 2014). "Pancreatic adenocarcinoma". The New England Journal of Medicine. 371 (11): 1039–49. doi:10.1056/NEJMra1404198. PMID 25207767.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH (September 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. 63 (5): 318–48. doi:10.3322/caac.21190. PMC 3769458. PMID 23856911.
- ^ أ ب ت ث ج ح خ د ذ Vincent A, Herman J, Schulick R, Hruban RH, Goggins M (أغسطس 2011). "Pancreatic cancer" (PDF). Lancet. 378 (9791): 607–20. doi:10.1016/S0140-6736(10)62307-0. PMC 3062508. PMID 21620466. Archived from the original (PDF) on 12 يناير 2015.
- ^ أ ب "Can pancreatic cancer be prevented?". American Cancer Society. 11 June 2014. Archived from the original on 13 November 2014. Retrieved 13 November 2014.
- ^ أ ب "Cancer Facts & Figures 2010" (PDF). American Cancer Society. 2010. Archived from the original (PDF) on 14 يناير 2015. Retrieved 5 ديسمبر 2014. See p. 4 for incidence estimates, and p. 19 for survival percentages.
- ^ Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease and Injury Incidence and Prevalence Collaborators) (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ أ ب ت Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (GBD 2015 Mortality and Causes of Death Collaborators) (October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ "What is Cancer? Defining Cancer". National Cancer Institute, National Institutes of Health. 7 March 2014. Archived from the original on 25 June 2014. Retrieved 5 December 2014.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط World Cancer Report. World Health Organization. 2014. Chapter 5.7. ISBN 978-92-832-0429-9.
- ^ أ ب ت ث ج Unless otherwise specified in boxes, reference is: Pishvaian MJ, Brody JR (March 2017). "Therapeutic Implications of Molecular Subtyping for Pancreatic Cancer". Oncology. 31 (3): 159–66, 168. PMID 28299752.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ Bond-Smith G, Banga N, Hammond TM, Imber CJ (May 2012). "Pancreatic adenocarcinoma". BMJ. 344 (may16 1): e2476. doi:10.1136/bmj.e2476. PMID 22592847. S2CID 206894869.
- ^ "Draft Recommendation Statement: Pancreatic Cancer: Screening – US Preventive Services Task Force". www.uspreventiveservicestaskforce.org. Retrieved 11 February 2019.
- ^ Larsson, S. C.; Wolk, A. (2012). "Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies". British Journal of Cancer. 106 (3): 603–607. doi:10.1038/bjc.2011.585. PMC 3273353. PMID 22240790.
- ^ Bardou M, Le Ray I (December 2013). "Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies". Best Practice & Research. Clinical Gastroenterology. 27 (6): 881–92. doi:10.1016/j.bpg.2013.09.006. PMID 24182608.
- ^ أ ب "Cancer facts and figures – Why we exist – Pancreatic Cancer Research Fund". www.pcrf.org.uk. Retrieved 5 April 2019.
- ^ أ ب "Pancreatic Cancer – Cancer Stat Facts". SEER (in الإنجليزية). Retrieved 4 April 2019.
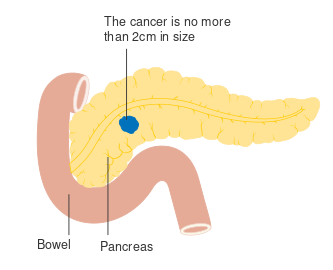
- ^ "Pancreatic Cancer Treatment (PDQ®) Health Professional Version". National Cancer Institute. National Institutes of Health. 21 February 2014. Archived from the original on 22 October 2014. Retrieved 24 November 2014. "The highest cure rate occurs if the tumor is truly localized to the pancreas; however, this stage of disease accounts for less than 20% of cases. In cases with localized disease and small cancers (<2 cm) with no lymph-node metastases and no extension beyond the capsule of the pancreas, complete surgical resection is still associated with a low actuarial five-year survival rate of 18% to 24%."
- ^ Wang Y, Miller FH, Chen ZE, Merrick L, Mortele KJ, Hoff FL; et al. (2011). "Diffusion-weighted MR imaging of solid and cystic lesions of the pancreas". Radiographics. 31 (3): E47-64. doi:10.1148/rg.313105174. PMID 21721197.
{{cite journal}}: CS1 maint: multiple names: authors list (link)
Diagram by Mikael Häggström, M.D. - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSol PanNET - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةTobias - ^ أ ب ت ث ج De La Cruz MS, Young AP, Ruffin MT (April 2014). "Diagnosis and management of pancreatic cancer". American Family Physician. 89 (8): 626–32. PMID 24784121.
- ^ أ ب Alberts SR, Goldberg RM (2009). "Chapter 9: Gastrointestinal tract cancers". In Casciato DA, Territo MC (eds.). Manual of clinical oncology. Lippincott Williams & Wilkins. pp. 188–236. ISBN 978-0-7817-6884-9.
- ^ أ ب ت Pannala R, Basu A, Petersen GM, Chari ST (January 2009). "New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer". The Lancet. Oncology. 10 (1): 88–95. doi:10.1016/S1470-2045(08)70337-1. PMC 2795483. PMID 19111249.
- ^ "Chapter 15; Pancreas" (PDF). Manual for Staging of Cancer (2nd ed.). American Joint Committee on Cancer. pp. 95–98. Archived (PDF) from the original on 29 نوفمبر 2014. See p. 95 for citation regarding "... lesser degree of involvement of bones and brain and other anatomical sites."
- ^ Sperti C, Moletta L, Patanè G (October 2014). "Metastatic tumors to the pancreas: The role of surgery". World Journal of Gastrointestinal Oncology. 6 (10): 381–92. doi:10.4251/wjgo.v6.i10.381. PMC 4197429. PMID 25320654.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "ACS :: What Are the Risk Factors for Cancer of the Pancreas?". Retrieved 2007-12-13.
- ^ Efthimiou E, Crnogorac-Jurcevic T, Lemoine NR, Brentnall TA (2001). "Inherited predisposition to pancreatic cancer". Gut. 48 (2): 143–7. PMID 11156628.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Piraka C, Scheiman JM (September 2011). "New diagnostic imaging modalities for pancreatic disease". Current Opinion in Gastroenterology. 27 (5): 475–80. doi:10.1097/MOG.0b013e328349e30c. PMID 21743318. S2CID 38963685.
- ^ أ ب ت ث Seufferlein T, Bachet JB, Van Cutsem E, Rougier P (October 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33–40. doi:10.1093/annonc/mds224. PMID 22997452.
- ^ Skafida E, Grammatoglou X, Glava C, Zissis D, Paschalidis N, Katsamagkou E, et al. (February 2010). "Adenosquamous carcinoma of the pancreas: a case report". Cases Journal. 3 (1): 41. doi:10.1186/1757-1626-3-41. PMC 2825199. PMID 20205828.
- ^ Diana Agostini-Vulaj. "Pancreas – Exocrine tumors / carcinomas – Intraductal papillary mucinous neoplasm (IPMN)". Pathology Outlines. Topic Completed: 1 July 2018. Revised: 9 March 2020
- ^ Adsay V, Mino-Kenudson M, Furukawa T, Basturk O, Zamboni G, Marchegiani G, et al. (January 2016). "Pathologic Evaluation and Reporting of Intraductal Papillary Mucinous Neoplasms of the Pancreas and Other Tumoral Intraepithelial Neoplasms of Pancreatobiliary Tract: Recommendations of Verona Consensus Meeting". Annals of Surgery. 263 (1): 162–77. doi:10.1097/SLA.0000000000001173. PMC 4568174. PMID 25775066.
- ^ "Japanese biotech firm uses tiny worms in test for pancreatic cancer". رويترز. 2022-11-30. Retrieved 2022-12-01.
- ^ "Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section". American Cancer Society. 20 August 2012. Archived from the original on 4 November 2014. Retrieved 4 November 2014.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةPericleous - ^ Owens DK, Davidson KW, Krist AH, Barry MJ, Cabana M, Caughey AB, et al. (August 2019). "Screening for Pancreatic Cancer: US Preventive Services Task Force Reaffirmation Recommendation Statement". JAMA. 322 (5): 438–44. doi:10.1001/jama.2019.10232. PMID 31386141.
- ^ He XY, Yuan YZ (August 2014). "Advances in pancreatic cancer research: moving towards early detection". World Journal of Gastroenterology. 20 (32): 11241–48. doi:10.3748/wjg.v20.i32.11241. PMC 4145762. PMID 25170208.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Okano K, Suzuki Y (August 2014). "Strategies for early detection of resectable pancreatic cancer". World Journal of Gastroenterology. 20 (32): 11230–40. doi:10.3748/wjg.v20.i32.11230. PMC 4145761. PMID 25170207.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Goggins M, Overbeek KA, Brand R, Syngal S, Del Chiaro M, Bartsch DK, et al. (January 2020). "Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium". Gut. 69 (1): 7–17. doi:10.1136/gutjnl-2019-319352. PMC 7295005. PMID 31672839.
- ^ Rosenzweig, Allison (2017-01-18). "Can Aspirin Reduce Your Risk of Pancreatic Cancer? - Pancreatic Cancer Action Network". Pancan.org. Retrieved 2022-08-07.
- ^ Sun, J.; Li, Y.; Liu, L.; Jiang, Z.; Liu, G. (2019). "Aspirin use and pancreatic cancer risk: A systematic review of observational studies - PubMed". Medicine. Pubmed.ncbi.nlm.nih.gov. 98 (51): e18033. doi:10.1097/MD.0000000000018033. PMC 6940047. PMID 31860953.
- ^ Gurusamy KS, Kumar S, Davidson BR, Fusai G (February 2014). "Resection versus other treatments for locally advanced pancreatic cancer". The Cochrane Database of Systematic Reviews. 2 (2): CD010244. doi:10.1002/14651858.CD010244.pub2. PMID 24578248.
- ^ أ ب Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J (December 2011). "Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis". Annals of Surgery. 254 (6): 882–93. doi:10.1097/SLA.0b013e31823ac299. PMID 22064622. S2CID 42685174.
- ^ أ ب ت "Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015" (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 4 December 2014. Retrieved 26 December 2014.
- ^ Alamo JM, Marín LM, Suarez G, Bernal C, Serrano J, Barrera L, et al. (October 2014). "Improving outcomes in pancreatic cancer: key points in perioperative management". World Journal of Gastroenterology. 20 (39): 14237–45. doi:10.3748/wjg.v20.i39.14237. PMC 4202352. PMID 25339810.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Lopez NE, Prendergast C, Lowy AM (August 2014). "Borderline resectable pancreatic cancer: definitions and management". World Journal of Gastroenterology. 20 (31): 10740–51. doi:10.3748/wjg.v20.i31.10740. PMC 4138454. PMID 25152577.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M (July 2014). "Neoadjuvant strategies for pancreatic cancer". World Journal of Gastroenterology. 20 (28): 9374–83. doi:10.3748/wjg.v20.i28.9374 (inactive 31 July 2022). PMC 4110569. PMID 25071332.
{{cite journal}}: CS1 maint: DOI inactive as of يوليو 2022 (link) CS1 maint: unflagged free DOI (link) - ^ Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J (April 2010). "Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages". PLOS Medicine. 7 (4): e1000267. doi:10.1371/journal.pmed.1000267. PMC 2857873. PMID 20422030.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Christians KK, Evans DB (June 2015). "Additional support for neoadjuvant therapy in the management of pancreatic cancer". Annals of Surgical Oncology. 22 (6): 1755–58. doi:10.1245/s10434-014-4307-0. PMID 25519932.
- ^ Tsvetkova EV, Asmis TR (August 2014). "Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?". Current Oncology. 21 (4): e650–7. doi:10.3747/co.21.2006. PMC 4117630. PMID 25089113.
- ^ Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY (February 2015). "Pancreatic cancer stem cells: new insight into a stubborn disease". Cancer Letters. 357 (2): 429–37. doi:10.1016/j.canlet.2014.12.004. PMID 25499079.
- ^ أ ب Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, et al. (August 2014). "Cancer stem cells: involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics". World Journal of Gastroenterology. 20 (31): 10790–801. doi:10.3748/wjg.v20.i31.10790. PMC 4138459. PMID 25152582.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR (July 2016). "Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer". The Cochrane Database of Systematic Reviews. 2016 (7): CD009323. doi:10.1002/14651858.CD009323.pub3. PMC 6458011. PMID 27383694.
- ^ Heinemann V, Haas M, Boeck S (October 2013). "Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer". Annals of Oncology. 24 (10): 2484–92. doi:10.1093/annonc/mdt239. PMID 23852311.
- ^ أ ب Thota R, Pauff JM, Berlin JD (January 2014). "Treatment of metastatic pancreatic adenocarcinoma: a review". Oncology. 28 (1): 70–74. PMID 24683721.
- ^ Ryan DP (8 يوليو 2014). "Chemotherapy for advanced exocrine pancreatic cancer: Topic 2475, Version 46.0" (subscription required). UpToDate. Wolters Kluwer Health. Archived from the original on 8 ديسمبر 2014. Retrieved 18 نوفمبر 2014.
- ^ "Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride". National Cancer Institute. National Institutes of Health. 3 يوليو 2013. Archived from the original on 29 نوفمبر 2014. Retrieved 5 ديسمبر 2014.
- ^ Borazanci E, Von Hoff DD (September 2014). "Nab-paclitaxel and gemcitabine for the treatment of patients with metastatic pancreatic cancer". Expert Review of Gastroenterology & Hepatology. 8 (7): 739–47. doi:10.1586/17474124.2014.925799. PMID 24882381. S2CID 31633898.
- ^ Neoptolemos, Jp; Dunn, Ja; Stocken, Dd; Almond, J; Link, K; Beger, H; Bassi, C; Falconi, M; Pederzoli, P; Dervenis, C; Fernandez-Cruz, L (November 2001). "Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial". The Lancet (in الإنجليزية). 358 (9293): 1576–1585. doi:10.1016/S0140-6736(01)06651-X. PMID 11716884. S2CID 23803289.
- ^ Neoptolemos, John P.; Stocken, Deborah D.; Friess, Helmut; Bassi, Claudio; Dunn, Janet A.; Hickey, Helen; Beger, Hans; Fernandez-Cruz, Laureano; Dervenis, Christos; Lacaine, François; Falconi, Massimo (2004-03-18). "A Randomized Trial of Chemoradiotherapy and Chemotherapy after Resection of Pancreatic Cancer". New England Journal of Medicine (in الإنجليزية). 350 (12): 1200–1210. doi:10.1056/NEJMoa032295. ISSN 0028-4793. PMID 15028824.
- ^ أ ب ت "Neuroendocrine tumors, NCCN Guidelines Version 1.2015" (PDF). National Comprehensive Cancer Network, Inc. NCCN). 11 November 2014. Retrieved 25 December 2014.
- ^ Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, et al. (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors". Neuroendocrinology. 95 (2): 120–34. doi:10.1159/000335587. PMID 22261872. S2CID 6985904.
- ^ Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, et al. (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes". Neuroendocrinology. 95 (2): 98–119. doi:10.1159/000335591. PMC 3701449. PMID 22261919.
- ^ Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, et al. (2012). "ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary". Neuroendocrinology. 95 (2): 157–76. doi:10.1159/000335597. PMID 22262022. S2CID 2097604.
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةpmid22997445 - ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةBurns2012 - ^ Rossi RE, Massironi S, Conte D, Peracchi M (January 2014). "Therapy for metastatic pancreatic neuroendocrine tumors". Annals of Translational Medicine. 2 (1): 8. doi:10.3978/j.issn.2305-5839.2013.03.01. PMC 4200651. PMID 25332984.
- ^ Nick Mulcahy (17 December 2014). "FDA Approves Lanreotide for Neuroendocrine Tumors". Medscape Medical News. WebMD LLC. Archived from the original on 18 January 2015. Retrieved 25 December 2014.
- ^ Everolimus Approved for Pancreatic Neuroendocrine Tumors Archived 16 يوليو 2016 at the Wayback Machine The ASCO Post. 15 May 2011, Volume 2, Issue 8
- ^ National Cancer Institute. Cancer Drug Information. FDA Approval for Sunitinib Malate Archived 5 يناير 2015 at the Wayback Machine. Pancreatic Neuroendocrine Tumors
- ^ Text is available electronically (but may require free registration) See: Benson AB, Myerson RJ, Sasson AR (2010). Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach (13th ed.). ISBN 978-0-615-41824-7. Archived from the original on 15 May 2011.
- ^ Gulenchyn KY, Yao X, Asa SL, Singh S, Law C (May 2012). "Radionuclide therapy in neuroendocrine tumours: a systematic review". Clinical Oncology. 24 (4): 294–308. doi:10.1016/j.clon.2011.12.003. PMID 22221516.
- ^ Vinik AI (November 2014). "Advances in diagnosis and treatment of pancreatic neuroendocrine tumors". Endocrine Practice. 20 (11): 1222–30. doi:10.4158/EP14373.RA. PMID 25297671.
- ^ Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP (March 2010). "Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors". Seminars in Nuclear Medicine. 40 (2): 78–88. doi:10.1053/j.semnuclmed.2009.10.004. PMID 20113677.
- ^ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G (August 2014). "Peptide receptor radionuclide therapy for advanced neuroendocrine tumors". Thoracic Surgery Clinics. 24 (3): 333–49. doi:10.1016/j.thorsurg.2014.04.005. hdl:11392/2378236. PMID 25065935.
- ^ Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E (June 2015). "Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors". Cancer Chemotherapy and Pharmacology. 75 (6): 1099–114. doi:10.1007/s00280-014-2642-2. PMID 25480314. S2CID 39434924.
- ^ Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, et al. (August 2015). "Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group". Annals of Surgical Oncology. 22 (8): 2685–99. doi:10.1245/s10434-014-4145-0. PMID 25366583. S2CID 8129133.
- ^ "Palliative or Supportive Care". American Cancer Society. 2014. Archived from the original on 21 August 2014. Retrieved 20 August 2014.
- ^ Buanes TA (August 2014). "Pancreatic cancer-improved care achievable". World Journal of Gastroenterology. 20 (30): 10405–18. doi:10.3748/wjg.v20.i30.10405. PMC 4130847. PMID 25132756.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "If treatment for pancreatic cancer stops working". American Cancer Society. 11 June 2014. Archived from the original on 22 October 2014. Retrieved 20 August 2014.
- ^ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA (March 2011). Arcidiacono PG (ed.). "Celiac plexus block for pancreatic cancer pain in adults". The Cochrane Database of Systematic Reviews. 2019 (3): CD007519. doi:10.1002/14651858.CD007519.pub2. PMC 6464722. PMID 21412903.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةcancer.org - ^ Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ (2007). "Cancer statistics, 2007". CA: A Cancer Journal for Clinicians. 57 (1): 43–66. doi:10.3322/canjclin.57.1.43. PMID 17237035. S2CID 22305510.
- ^ "What are the key statistics about pancreatic cancer?". American Cancer Society. 11 June 2014. Archived from the original on 11 November 2014. Retrieved 11 November 2014.
- ^ "Pancreatic cancer statistics". Cancer Research UK. Archived from the original on 18 December 2014. Retrieved 18 December 2014.; "In 2010, in the UK, the lifetime risk of developing pancreatic cancer is 1 in 73 for men and 1 in 74 for women", noting "The lifetime risk ... has been calculated ... using the 'Current Probability' method; this is a different method used from most other cancer sites since the possibility of having more than one diagnosis of pancreatic cancer over the course of their lifetime is very low"
- ^ أ ب Busnardo AC, DiDio LJ, Tidrick RT, Thomford NR (November 1983). "History of the pancreas". American Journal of Surgery. 146 (5): 539–50. doi:10.1016/0002-9610(83)90286-6. PMID 6356946.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةnomenclature - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSilberman2010 - ^ أ ب ت ث Are C, Dhir M, Ravipati L (June 2011). "History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers". HPB. 13 (6): 377–84. doi:10.1111/j.1477-2574.2011.00305.x. PMC 3103093. PMID 21609369.
- ^ أ ب Cameron JL, Riall TS, Coleman J, Belcher KA (July 2006). "One thousand consecutive pancreaticoduodenectomies". Annals of Surgery. 244 (1): 10–5. doi:10.1097/01.sla.0000217673.04165.ea. PMC 1570590. PMID 16794383.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةDeVita2011 - ^ Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, et al. (September 2012). "Evolution of the Whipple procedure at the Massachusetts General Hospital". Surgery. 152 (3 Suppl 1): S56-63. doi:10.1016/j.surg.2012.05.022. PMC 3806095. PMID 22770961.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةReznik2014 - ^ أ ب ت "What's new in pancreatic cancer research and treatment?". American Cancer Society. 2019. Retrieved 2 May 2019.
- ^ "Pancreatic cancer research". Cancer Research UK. Archived from the original on 18 February 2014. Retrieved 17 July 2014.
- ^ "Australian Pancreatic Genome Initiative". Garvan Institute. Archived from the original on 26 July 2014. Retrieved 17 July 2014.
- ^ Biankin AV, Waddell N, Kassahn KS, Gingras MC, Muthuswamy LB, Johns AL, et al. (November 2012). "Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes". Nature. 491 (7424): 399–405. Bibcode:2012Natur.491..399.. doi:10.1038/nature11547. PMC 3530898. PMID 23103869.
- ^ Feng, Hui-Yi; Chen, Yang-Chao (2016-09-07). "Role of bile acids in carcinogenesis of pancreatic cancer: An old topic with new perspective". World Journal of Gastroenterology. 22 (33): 7463–7477. doi:10.3748/wjg.v22.i33.7463. ISSN 1007-9327. PMC 5011662. PMID 27672269.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Graham JS, Jamieson NB, Rulach R, Grimmond SM, Chang DK, Biankin AV (September 2015). "Pancreatic cancer genomics: where can the science take us?". Clinical Genetics. 88 (3): 213–9. doi:10.1111/cge.12536. PMID 25388820. S2CID 26414866.
- ^ Bruenderman EH, Martin RC (March 2015). "High-risk population in sporadic pancreatic adenocarcinoma: guidelines for screening". The Journal of Surgical Research. 194 (1): 212–9. doi:10.1016/j.jss.2014.06.046. PMC 4559279. PMID 25479908.
- ^ "About EUROPAC". European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC). University of Liverpool. Archived from the original on 26 July 2014. Retrieved 17 July 2014.
- ^ Subar D, Gobardhan PD, Gayet B (February 2014). "Laparoscopic pancreatic surgery: An overview of the literature and experiences of a single center". Best Practice & Research. Clinical Gastroenterology. 28 (1): 123–32. doi:10.1016/j.bpg.2013.11.011. PMID 24485260.
- ^ Weiss MJ, Wolfgang CL (2013). "Irreversible electroporation: a novel pancreatic cancer therapy". Current Problems in Cancer. 37 (5): 262–5. doi:10.1016/j.currproblcancer.2013.10.002. PMID 24331180. S2CID 3137300.
- ^ Moir J, White SA, French JJ, Littler P, Manas DM (December 2014). "Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer". European Journal of Surgical Oncology. 40 (12): 1598–604. doi:10.1016/j.ejso.2014.08.480. PMID 25307210.
- ^ Kleger A, Perkhofer L, Seufferlein T (July 2014). "Smarter drugs emerging in pancreatic cancer therapy". Annals of Oncology. 25 (7): 1260–1270. doi:10.1093/annonc/mdu013. PMID 24631947.
- ^ أ ب Tang SC, Chen YC (أغسطس 2014). "Novel therapeutic targets for pancreatic cancer". World Journal of Gastroenterology. 20 (31): 10825–44. doi:10.3748/wjg.v20.i31.10825. PMC 4138462. PMID 25152585.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Rossi ML, Rehman AA, Gondi CS (August 2014). "Therapeutic options for the management of pancreatic cancer". World Journal of Gastroenterology. 20 (32): 11142–59. doi:10.3748/wjg.v20.i32.11142. PMC 4145755. PMID 25170201.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Ady JW, Heffner J, Klein E, Fong Y (2014). "Oncolytic viral therapy for pancreatic cancer: current research and future directions". Oncolytic Virotherapy. 3: 35–46. doi:10.2147/OV.S53858. PMC 4918362. PMID 27512661.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Ren B, Cui M, Yang G, Wang H, Feng M, You L, Zhao Y (July 2018). "Tumor microenvironment participates in metastasis of pancreatic cancer". Molecular Cancer. 17 (1): 108. doi:10.1186/s12943-018-0858-1. PMC 6065152. PMID 30060755.
{{cite journal}}: CS1 maint: unflagged free DOI (link)
وصلات خارجية
| Classification | |
|---|---|
| External resources |
- CS1 maint: unflagged free DOI
- CS1 errors: unsupported parameter
- CS1 maint: DOI inactive as of يوليو 2022
- الصفحات بخصائص غير محلولة
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Articles with Curlie links
- سرطان الپنكرياس
- سرطان الجهاز الهضمي
- اضطرابات الپنكرياس
- أورام الجهاز الهضمي