سليلة قولونية غدية
| عدِّل |
يشير هذا المقال إلى السليلة القولونية الغدية الكابتة للورم، التي تؤدي طفراتها إلى سرطان القولون. للمقال الخاص بالتجمع التنظيمي لدورة الخلية- APC/C، أنظر Anaphase-promoting complex.
السليلة القولونية الغدية Adenomatous polyposis coli (APC) وتعرف أيضاً حذف السليلة 2.5 (DP2.5)، هي پروتيون بشري يرمز بالمورثة APC.[1] پروتيون السليلة القولونية الغدية هو المنظم السلبي الذي يتحكم في تركيزات بيتا-كاتنين يتفاعل مع E-cadherin والمسئول عن التصاق الخلايا. الطفرات في مورثة السليلة القولونية الغدية قد يؤدي إلى سرطان القولون.[2]
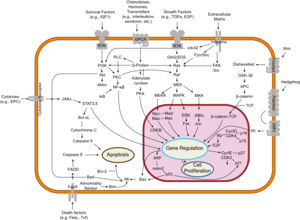
تصنف السليلة القولونية الغدية مورثة كابتة للورم. المورثات الكابتة للورم تمنع النمو الغير منضبط للخلايا الذي قد ينتج عنه أورام سرطانية. الپروتين المُنتج من مورثة السليلة القولونية الغدية يلعب دوراً محورياً في مختلف العمليات الخلوية التي تحدد ما إذا كانت الخلية قد تتطور إلى ورم. يساعد پروتين السليلة القولونية الغدية على التحكم في كيفية انقسام الخلية، وكيفية التصاقها بالخلايا الأخرى داخل النسيج، أو ما إذا كانت الخلية تتحرك داخل أو بعيد عن النسيج. يساعد هذا الپروتين أيضاً على ضمان أن الرقم الكروموسومي في الخلايا والذي يُنتج عن طريق انقسام الخلية صحيح. يحقق پروتين السليلة القولونية الغدية هذه المهام بالاشتراك مع پروتينات أخرى، خاصة تلك التي تعمل على التصاق وتأشير الخلية. نشاط أحد الپروتينات بصفة خاصة، بيتا-كاتنين، يسيطر عليه پروتين السليلة القولونية الغدية (انظر: Wnt signaling pathway). تنظيم البيتا-كاتنين يمنع المورثات التي تحفز الانقسام الخلوي من أن تتحول في كثير من الأحيان وتمنع النمو المفرط للخلية.
تقع مورثة السليلة القولونية الغدية البشرية على إمتداد الذراع (q) في الكروموسوم 5 على النطاق q22.2. تحتوي مورثة السليلة القولونية الغدية على internal ribosome entry site. APC orthologs[3] تم التعرف عليه أيضاً في جميع الثدييات والتي لديها بيانات جينوم مكتملة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التركيب
دورها في السرطان
تنظيم الانتشار
الطفرات

الدور العصبي
التفاعلات
تتفاعل مورثة السليلة القولونية الغدية مع:
انظر أيضاً
المصادر
- ^ Nishisho, I; Nakamura, Y; Miyoshi, Y; Miki, Y; Ando, H; Horii, A; et al. (August 1991). "Mutations of chromosome 5q21 genes in FAP and colorectal cancer patients". Science. 253 (5020): 665–9. doi:10.1126/science.1651563. PMID 1651563.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Markowitz, SD; Bertagnolli, MM (December 2009). "Molecular origins of cancer: Molecular basis of colorectal cancer". N. Engl. J. Med. 361 (25): 2449–60. doi:10.1056/NEJMra0804588. PMC 2843693. PMID 20018966.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "OrthoMaM phylogenetic marker: APC coding sequence".
- ^ Kawasaki, Y; Senda, T; Ishidate, T; Koyama, R; Morishita, T; Iwayama, Y; et al. (2000). "Asef, a link between the tumor suppressor APC and G-protein signaling". Science. 289 (5482): 1194–7. doi:10.1126/science.289.5482.1194. PMID 10947987.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Nakamura, T; Hamada, F; Ishidate, T; Anai, K; Kawahara, K; Toyoshima, K; et al. (1998). "Axin, an inhibitor of the Wnt signalling pathway, interacts with beta-catenin, GSK-3beta and APC and reduces the beta-catenin level". Genes Cells. 3 (6): 395–403. doi:10.1046/j.1365-2443.1998.00198.x. PMID 9734785.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Kaplan, KB; Burds, AA; Swedlow, JR; Bekir, SS; Sorger, PK; Näthke, IS (2001). "A role for the Adenomatous Polyposis Coli protein in chromosome segregation". Nat. Cell Biol. 3 (4): 429–32. doi:10.1038/35070123. PMID 11283619.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب Su, LK; Vogelstein, B; Kinzler, KW (1993). "Association of the APC tumor suppressor protein with catenins". Science. 262 (5140): 1734–7. doi:10.1126/science.8259519. PMID 8259519.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Kucerová, D; Sloncová, E; Tuhácková, Z; Vojtechová, M; Sovová, V (2001). "Expression and interaction of different catenins in colorectal carcinoma cells". Int. J. Mol. Med. 8 (6): 695–8. doi:10.3892/ijmm.8.6.695. PMID 11712088.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Tickenbrock, L; Kössmeier, K; Rehmann, H; Herrmann, C; Müller, O (2003). "Differences between the interaction of beta-catenin with non-phosphorylated and single-mimicked phosphorylated 20-amino acid residue repeats of the APC protein". J. Mol. Biol. 327 (2): 359–67. doi:10.1016/S0022-2836(03)00144-X. PMID 12628243.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Davies, G; Jiang, WG; Mason, MD (2001). "The interaction between beta-catenin, GSK3beta and APC after motogen induced cell-cell dissociation, and their involvement in signal transduction pathways in prostate cancer". Int. J. Oncol. 18 (4): 843–7. doi:10.3892/ijo.18.4.843. PMID 11251183.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Ryo, A; Nakamura, M; Wulf, G; Liou, YC; Lu, KP (2001). "Pin1 regulates turnover and subcellular localization of beta-catenin by inhibiting its interaction with APC". Nat. Cell Biol. 3 (9): 793–801. doi:10.1038/ncb0901-793. PMID 11533658.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب ت Homma, MK; Li, D; Krebs, EG; Yuasa, Y; Homma, Y (2002). "Association and regulation of casein kinase 2 activity by adenomatous polyposis coli protein". Proc. Natl. Acad. Sci. U.S.A. 99 (9): 5959–64. doi:10.1073/pnas.092143199. PMC 122884. PMID 11972058.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Satoh, K; Yanai, H; Senda, T; Kohu, K; Nakamura, T; Okumura, N; et al. (1997). "DAP-1, a novel protein that interacts with the guanylate kinase-like domains of hDLG and PSD-95". Genes Cells. 2 (6): 415–24. doi:10.1046/j.1365-2443.1997.1310329.x. PMID 9286858.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Eklof Spink, K; Fridman, SG; Weis, WI (2001). "Molecular mechanisms of beta-catenin recognition by adenomatous polyposis coli revealed by the structure of an APC-beta-catenin complex". EMBO J. 20 (22): 6203–12. doi:10.1093/emboj/20.22.6203. PMC 125720. PMID 11707392.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب Daniel, JM; Reynolds, AB (1995). "The tyrosine kinase substrate p120cas binds directly to E-cadherin but not to the adenomatous polyposis coli protein or alpha-catenin". Mol. Cell. Biol. 15 (9): 4819–24. PMC 230726. PMID 7651399.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Makino, K; Kuwahara, H; Masuko, N; Nishiyama, Y; Morisaki, T; Sasaki, J; et al. (1997). "Cloning and characterization of NE-dlg: a novel human homolog of the Drosophila discs large (dlg) tumor suppressor protein interacts with the APC protein". Oncogene. 14 (20): 2425–33. doi:10.1038/sj.onc.1201087. PMID 9188857.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Jimbo, T; Kawasaki, Y; Koyama, R; Sato, R; Takada, S; Haraguchi, K; et al. (2002). "Identification of a link between the tumour suppressor APC and the kinesin superfamily". Nat. Cell Biol. 4 (4): 323–7. doi:10.1038/ncb779. PMID 11912492.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Su, LK; Burrell, M; Hill, DE; Gyuris, J; Brent, R; Wiltshire, R; et al. (1995). "APC binds to the novel protein EB1". Cancer Res. 55 (14): 2972–7. PMID 7606712.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Nakamura, M; Zhou, XZ; Lu, KP (2001). "Critical role for the EB1 and APC interaction in the regulation of microtubule polymerization". Curr. Biol. 11 (13): 1062–7. doi:10.1016/S0960-9822(01)00297-4. PMID 11470413.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Shibata, T; Gotoh, M; Ochiai, A; Hirohashi, S (1994). "Association of plakoglobin with APC, a tumor suppressor gene product, and its regulation by tyrosine phosphorylation". Biochem. Biophys. Res. Commun. 203 (1): 519–22. doi:10.1006/bbrc.1994.2213. PMID 8074697.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Liu, J; Stevens, J; Rote, CA; Yost, HJ; Hu, Y; Neufeld, KL; et al. (2001). "Siah-1 mediates a novel beta-catenin degradation pathway linking p53 to the adenomatous polyposis coli protein". Mol. Cell. 7 (5): 927–36. doi:10.1016/S1097-2765(01)00241-6. PMID 11389840.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Li, Q; Dashwood, RH (2004). "Activator protein 2alpha associates with adenomatous polyposis coli/beta-catenin and Inhibits beta-catenin/T-cell factor transcriptional activity in colorectal cancer cells". J. Biol. Chem. 279 (44): 45669–75. doi:10.1074/jbc.M405025200. PMC 2276578. PMID 15331612.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Zumbrunn, J; Kinoshita, K; Hyman, AA; Näthke, IS (2001). "Binding of the adenomatous polyposis coli protein to microtubules increases microtubule stability and is regulated by GSK3 beta phosphorylation". Curr. Biol. 11 (1): 44–9. doi:10.1016/S0960-9822(01)00002-1. PMID 11166179.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Tickenbrock, L; Cramer, J; Vetter, IR; Muller, O (2002). "The coiled coil region (amino acids 129-250) of the tumor suppressor protein adenomatous polyposis coli (APC). Its structure and its interaction with chromosome maintenance region 1 (Crm-1)". J. Biol. Chem. 277 (35): 32332–8. doi:10.1074/jbc.M203990200. PMID 12070164.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)
29. Rosenberg MM1, Yang F, Mohn JL, Storer EK, Jacob MH.The postsynaptic adenomatous polyposis coli (APC) multiprotein complex is required for localizing neuroligin and neurexin to neuronal nicotinic synapses in vivo.J Neurosci. 2010 Aug 18;30(33):11073-85. doi: 10.1523/JNEUROSCI.0983-10.2010.
قراءات إضافية
- Cohen, MM (2003). "Molecular dimensions of gastrointestinal tumors: some thoughts for digestion". Am. J. Med. Genet. A. 122A (4): 303–14. doi:10.1002/ajmg.a.20473. PMID 14518068.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - Fearnhead, NS; Britton, MP; Bodmer, WF (2001). "The ABC of APC". Hum. Mol. Genet. 10 (7): 721–33. doi:10.1093/hmg/10.7.721. PMID 11257105.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - Fodde, R (2002). "The APC gene in colorectal cancer". Eur. J. Cancer. 38 (7): 867–71. doi:10.1016/S0959-8049(02)00040-0. PMID 11978510.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - Goss, KH; Groden, J (2000). "Biology of the adenomatous polyposis coli tumor suppressor". J. Clin. Oncol. 18 (9): 1967–79. PMID 10784639.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - Järvinen, HJ; Peltomäki, P (2004). "The complex genotype-phenotype relationship in familial adenomatous polyposis". Eur J Gastroenterol Hepatol. 16 (1): 5–8. doi:10.1097/00042737-200401000-00002. PMID 15095846.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - Lal, G; Gallinger, S (2000). "Familial adenomatous polyposis". Semin Surg Oncol. 18 (4): 314–23. doi:10.1002/(SICI)1098-2388(200006)18:4<314::AID-SSU6>3.0.CO;2-9. PMID 10805953.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - van Es, JH; Giles, RH; Clevers, HC (2001). "The many faces of the tumor suppressor gene APC". Exp. Cell Res. 264 (1): 126–34. doi:10.1006/excr.2000.5142. PMID 11237529.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - Rosenberg, MM; Yang, F; Giovanni, M; Mohn, JL; Temburni, MK; Jacob, MH (2008-03-04). "Adenomatous polyposis coli plays a key role, in vivo, in coordinating assembly of the neuronal nicotinic postsynaptic complex". Mol. Cell. Neurosci. 38 (2): 138–52. doi:10.1016/j.mcn.2008.02.006. PMC 2502068. PMID 18407517.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
وصلات خارجية
- GeneReviews/NCBI/NIH/UW entry on APC-Associated Polyposis Conditions
- OMIM entries on APC-Associated Polyposis Conditions
- MeSH Adenomatous+Polyposis+Coli+Protein
- GeneCard
- Database concerning peer-reviewed reports on cancer critical alteration in several genes including (APC (protein)), (TP53), (β-catenin)






