تسرطن
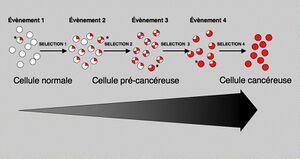
التسرطن (بالانگليزية Carcinogenesis)، الذي يُطلق عليه أيضًا عملية تكوين الأورام أو تكون الورم، هو تكوين السرطان، حيث تتحول الخلايا الطبيعية إلى خلايا سرطانية. وتتميز هذه العملية عن طريق التغييرات في المستويات الخلوية، الوراثية، و التخلقية وانقسام الخلايا الشاذ. انقسام الخلايا هو عملية فسيولوجية تحدث في جميع الأنسجة تقريبًا وفي ظل ظروف متنوعة. عادة، يتم الحفاظ على التوازن بين الانتشار وموت الخلايا المبرمج، في شكل الاستموات، لضمان سلامة الأنسجة والأعضاء. وفقًا للنظرية المقبولة السائدة عن التسرطن، ونظرية الطفرات الجسدية، فإن الطفرات في الحمض النووي والطفرات التخلقية التي تؤدي إلى السرطان تعطل هذه العمليات المنظمة من خلال التدخل في البرمجة التي تنظم العمليات، مما يخل بالتوازن الطبيعي بين الانتشار وموت الخلايا. ينتج عن هذا انقسام الخلايا الغير منضبط وتطور تلك الخلايا عن طريق الانتخاب الطبيعي في الجسم. تؤدي بعض الطفرات فقط إلى الإصابة بالسرطان في حين أن غالبية الطفرات لا تؤدي إلى ذلك.
قد تهيئ متغيرات الجينات الموروثة الأفراد للإصابة بالسرطان. بالإضافة إلى ذلك، فإن العوامل البيئية مثل المواد المسرطنة والإشعاع تسبب طفرات قد تساهم في تطور السرطان. أخيرًا، قد تؤدي الأخطاء العشوائية في النسخ المتماثل الطبيعي للحمض النووي إلى حدوث طفرات تسبب السرطان.[1]عادة ما تكون هناك حاجة إلى سلسلة من الطفرات المتعددة لفئات معينة من الجينات قبل أن تتحول الخلية الطبيعية إلى خلية سرطانية.[2][3][4][5][6]على سبيل المثال، تم العثور على 15 طفرة محركة و 60 طفرة عابرة في سرطانات القولون.[2] قد تؤدي الطفرات في الجينات التي تنظم انقسام الخلايا والاستموات (موت الخلايا) وترميم الحمض النووي إلى تكاثر الخلايا الغير منضبط والسرطان.
السرطان هو في الأساس مرض ينظم نمو الأنسجة. لكي تتحول الخلية الطبيعية إلى خلية سرطانية، يجب تغيير الجينات التي تنظم نمو الخلايا وتمايزها.[7] يمكن أن تحدث التغيرات الجينية والتخلقية على مستويات عديدة، من اكتساب أو فقدان كروموسومات كاملة، إلى طفرة تؤثر على نوكليوتيد دنا واحد، أو إلى قمع أو تنشيط الرنا الميكروي الذي يتحكم في التعبير عن 100 إلى 500 جين.[8][9] هناك فئتان عريضتان من الجينات التي تتأثر بهذه التغييرات. قد تكون الجينات الورمية جينات طبيعية يتم التعبير عنها بمستويات عالية بشكل غير لائق، أو جينات متغيرة لها خصائص جديدة. في كلتا الحالتين، فإن التعبير عن هذه الجينات يعزز النمط الظاهري الخبيث للخلايا السرطانية. الجينات الكابتة للورم هي جينات تمنع انقسام الخلايا أو البقاء على قيد الحياة أو غير ذلك من خصائص الخلايا السرطانية. غالبًا ما يتم تعطيل الجينات الكابتة للورم عن طريق التغيرات الجينية المعززة للسرطان. أخيرًا، يتم تصنيف الڤيروسات الورمية، وهي الڤيروسات التي تحتوي على أحد الجينات الورمية، على أنها مسببة للأورام لأنها تؤدي إلى نمو الأنسجة السرطانية في العائل. يشار إلى هذه العملية أيضًا باسم التحول الڤيروسي.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الاسباب
الجينية والتخلقية
هناك مخطط تصنيف متنوع للتغييرات الجينومية المختلفة التي قد تساهم في توليد الخلايا السرطانية. العديد من هذه التغييرات عبارة عن طفرات أو تغييرات في تسلسل النيوكليوتيدات للحمض النووي الجينومي. هناك أيضًا العديد من التغييرات التخلقية التي تغير ما إذا كان يتم التعبير عن الجينات أم لا. اختلال الصيغة الصبغية، وجود عدد غير طبيعي من الكروموسومات، هو أحد التغيرات الجينومية التي لا تعتبر طفرة، وقد تتضمن إما اكتساب أو فقدان واحد أو أكثر من الكروموسومات من خلال أخطاء في الانقسام الفتيلي. تتضمن الطفرات واسعة النطاق إما حذف أو تكرار جزء من الكروموسوم. يحدث التضخيم الجيني عندما تكتسب الخلية عدة نسخ (غالبًا 20 أو أكثر) من منطقة كروموسومية صغيرة، تحتوي عادةً على واحد أو أكثر من الجينات الورمية والمواد الوراثية المجاورة. يحدث الإزفاء عندما تلتحم منطقتان منفصلتان من الكروموسومات بشكل غير طبيعي، غالبًا في موقع مميز. أحد الأمثلة المعروفة على ذلك هو صبغي فيلادلفيا، أو إزفاء الكروموسومات 9 و 22، والذي يحدث في ابيضاض الدم النقوي المزمن، وينتج عنه إنتاج پروتين الاندماج BCR - abl، وهو تيروزين كيناز ورمي. تشمل الطفرات الصغيرة النطاق الطفرات النقطية والحذف والغرز، والتي قد تحدث في محفز الجين وتؤثر على تعبيره، أو قد تحدث في تسلسل تشفير الجين وتغير وظيفة أو استقرار منتج الپروتين. قد ينجم اضطراب جين واحد أيضًا عن تكامل مادة جينومية من ڤيروس دناوي أو ڤيروس قهقري، وقد يؤدي مثل هذا الحدث أيضًا إلى التعبير عن الجينات الورمية الڤيروسية في الخلية المصابة ونسلها.
تلف الدنا
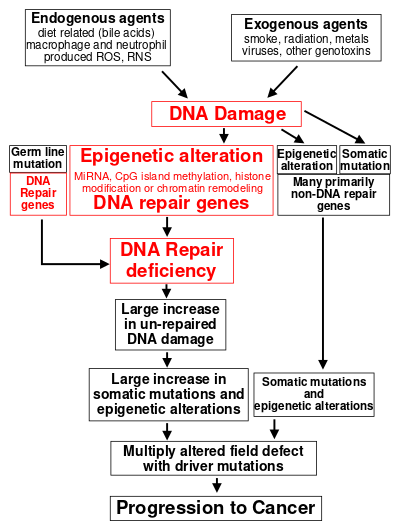
يعتبر تلف الحمض النووي السبب الرئيسي للسرطان.[10] تحدث أكثر من 60.000 حالة جديدة من تلف الحمض النووي، في المتوسط، لكل خلية بشرية يوميًا، بسبب العمليات الخلوية الداخلية (انظر مقالة تلف الحمض النووي (يحدث بشكل طبيعي) ).
يمكن أن ينشأ تلف إضافي للحمض النووي عن التعرض لعوامل خارجية. كأحد الأمثلة على العوامل الخارجية المسرطنة، يتسبب دخان التبغ في زيادة تلف الحمض النووي، ومن المحتمل أن يتسبب تلف الحمض النووي هذا في زيادة سرطان الرئة بسبب التدخين.[11] في أمثلة أخرى، يتسبب ضوء الأشعة فوق البنفسجية المنبعث من أشعة الشمس في تلف الحمض النووي وهو أمر مهم في الميلانوما،[12] وتنتج عدوى الملوية البوابية مستويات عالية من مركبات الأكسجين التفاعلية التي تتلف الحمض النووي وتسهم في الإصابة بسرطان المعدة،[13] ومستقلب الرشاشيات الصفراء السموم الفطرية هي عامل مدمر للحمض النووي تسبب سرطان الكبد.[14]
يمكن أن يحدث تلف الحمض النووي أيضًا بسبب المواد المنتجة في الجسم. تعد خلايا الدم البيضاء والعدلات في ظهارة القولون الملتهبة مصدرًا لمركبات الأكسجين التفاعلية التي تسبب تلف الحمض النووي الذي يؤدي إلى تكوين الأورام القولونية[15]كما أن الأحماض الصفراوية، عند مستويات عالية في القولون عند البشر الذين يتناولون نظامًا غذائيًا عالي الدهون، تسبب تلف الحمض النووي وتساهم في الإصابة بسرطان القولون.[16]
يشار إلى هذه المصادر الخارجية والداخلية لتلف الحمض النووي في المربعات الموجودة أعلى الشكل في هذا القسم. يشار إلى الدور المركزي لتلف الحمض النووي في تقدم السرطان في المستوى الثاني من الشكل. تظهر العناصر المركزية لتلف الحمض النووي والتغيرات التخلقية و قصور ترميم الحمض النووي في تطور السرطان باللون الأحمر.
سيؤدي نقص إصلاح الحمض النووي إلى تراكم المزيد من تلف الحمض النووي، وزيادة خطر الإصابة بالسرطان. على سبيل المثال، الأفراد الذين يعانون من ضعف وراثي في أي من الجينات ترميم الحمض النووي ال34 (انظر مقالةاضطراب نقص ترميم الحمض النووي ) معرضون لخطر متزايد للإصابة بالسرطان، مع بعض العيوب التي تتسبب في الإصابة بالسرطان بنسبة تصل إلى 100٪ (مثل طفرات p53.[17] تظهر هذه الطفرات الإنتاشية في مربع على يسار الشكل، مع إشارة إلى مساهمتها في نقص ترميم الحمض النووي. ومع ذلك، فإن مثل هذه الطفرات الإنتاشية (التي تسبب متلازمات سرطانية شديدة النفاذ ) هي سبب حوالي واحد بالمائة فقط من السرطانات.[18]
يُطلق على غالبية السرطانات اسم "سرطانات غير متوارثة" أو "سرطانات فرادي". حوالي 30٪ من السرطانات الفرادي لها مكونات وراثية غير محددة حاليًا، في حين أن الغالبية، أو 70٪ من السرطانات المتفرقة، ليس لها مكونات وراثية.[19]
في السرطانات الفرادي، يحدث نقص في ترميم الحمض النووي أحيانًا بسبب طفرة في جين ترميم الحمض النووي ؛ في كثير من الأحيان، يكون التعبير عن جينات ترميم الحمض النووي منخفض او غائب ناتجًا عن التغيرات التخلقية التي تقلل أو تسكت التعبير الجيني. يشار إلى هذا في الشكل في المستوى الثالث من الأعلى. على سبيل المثال، بالنسبة للـ 113 حالة من سرطانات القولون والمستقيم التي تم فحص التسلسل فيهم، كان لأربعة فقط طفرة مغلوطة في جين ترميم الحمض النووي MGMT، في حين أن الغالبية قللت من تعبير MGMT بسبب مثيلة منطقة المحفز MGMT (تغيير تخلقي).[20]
عندما يتم تقليل التعبير عن جينات ترميم الحمض النووي، فإن هذا يسبب نقصًا في ترميم الحمض النووي. يظهر هذا في الشكل في المستوى الرابع من الأعلى. مع نقص ترميمالحمض النووي، يستمر تلف الحمض النووي في الخلايا عند مستوى أعلى من المستوى المعتاد (المستوى الخامس من أعلى الشكل) ؛ يتسبب هذا الضرر الزائد في زيادة وتيرة الطفرة و / أو الطفرة التخلقية (المستوى السادس من أعلى الشكل). من الناحية التجريبية، تزداد معدلات الطفرات بشكل كبير في الخلايا المعيبة في ترميم عدم تطابق الحمض النووي[21][22] أو في الترميم التأشبي المتماثل (HRR).[23]يزداد أيضًا إعادة ترتيب الصبغيات واختلال الصيغة الصبغية في الخلايا المعيبة في HRRs[24] أثناء ترميم فواصل الحمض النووي ذو الطاقين أو ترميم تلف آخر للحمض النووي، يمكن أن تتسبب مواقع الترميم التي لم يتم ترميمها بشكل كامل في قمع الجينات التخلقية.[25][26]
تتراكم الطفرات الجسدية والتعديلات التخلقية الناتجة عن تلف الحمض النووي وأوجه القصور في ترميم الحمض النووي في عيوب المجال. عيوب المجال هي أنسجة تظهر بشكل طبيعي مع تغيرات متعددة (تمت مناقشتها في القسم أدناه)، وهي طلائع شائعة لتطور نسيلة الأنسجة المضطرب ومفرط التكاثر في السرطان. قد تحتوي عيوب المجال هذه (المستوى الثاني من أسفل الشكل) على العديد من الطفرات والتعديلات التخلقية.
من المستحيل تحديد السبب الأولي لمعظم أنواع السرطان المحددة. في حالات قليلة، يوجد سبب واحد فقط: على سبيل المثال، يتسبب الڤيروس HHV-8 في جميع ساركومات كابوزي. ومع ذلك، بمساعدة تقنيات ومعلومات علم الأوبئة السرطانية، من الممكن إنتاج تقدير للسبب المحتمل في العديد من المواقف الأخرى. على سبيل المثال، لسرطان الرئة عدة أسباب، بما في ذلك استخدام التبغ وغاز الرادون. الرجال الذين يدخنون التبغ حاليًا يصابون بسرطان الرئة بمعدل 14 ضعفًا للرجال الذين لم يدخنوا التبغ مطلقًا: تبلغ فرصة الإصابة بسرطان الرئة في المدخن الحالي بسبب التدخين حوالي 93٪ ؛ هناك احتمال بنسبة 7٪ أن يكون سرطان الرئة لدى المدخن ناتجًا عن غاز الرادون أو سبب آخر غير التبغ.[27] جعلت هذه الارتباطات الإحصائية من الممكن للباحثين أن يستنتجوا أن بعض المواد أو السلوكيات مسببة للسرطان. يتسبب دخان التبغ في زيادة تلف الحمض النووي الخارجي، وهذا التلف هو السبب المحتمل لسرطان الرئة بسبب التدخين. من بين أكثر من 5000 مركب في دخان التبغ، فإن العوامل السامة للجينات الضارة بالحمض النووي التي تحدث عند أعلى التركيزات، والتي لها أقوى تأثيرات مطفرة هي الأكرولين، والفورمالدهايد، والأكريلونتريل، و 1.3-بوتاديين، والأسيتالدهيد، وأكسيد الإيثيلين والإيزوپرين.[11]
استخدام تقنيات البيولوجية الجزيئية، أتاح توصيف الطفرات، الطفرات التخلقية أو التشوهات الصبغية داخل الورم، ويجري إحراز تقدم سريع في مجال التنبؤ بمآل معين لمرضى السرطان المبني علي طيف الطفرات. على سبيل المثال، ما يصل إلى نصف جميع الأورام بها جين p53 معيب. ترتبط هذه الطفرة بسوء المآل، حيث تقل احتمالية دخول الخلايا السرطانية إلى الاستموات أو موت الخلايا المبرمج عند تلفها عن طريق العلاج. تزيل طفرات التيلوميراز حواجز إضافية، مما يزيد من عدد المرات التي يمكن أن تنقسم فيها الخلية. تمكن الطفرات الأخرى الورم من نمو أوعية دموية جديدة لتوفير المزيد من العناصر الغذائية، أو للانتقال، والانتشار إلى أجزاء أخرى من الجسم. ومع ذلك، بمجرد أن يتشكل السرطان، فإنه يستمر في التطور وينتج مستنسخات فرعية. تم الإبلاغ في عام 2012 أن عينة واحدة من سرطان الكلى، تم أخذ عينات منها في تسع مناطق مختلفة، بها 40 طفرة "منتشرة في كل مكان"، وجدت في جميع المناطق التسعة، و 59 طفرة مشتركة بين بعض المناطق التسعة، ولكن ليس جميعها، و 29 طفرة "خاصة" فقط موجودة في منطقة واحدة.[28]
من الصعب تتبع أنساب الخلايا التي تتراكم فيها كل هذه التغيرات في الحمض النووي، لكن طريقين حديثين من الأدلة يقترحان أن الخلايا الجذعية الطبيعية قد تكون الخلايا الأصلية في السرطانات.[29][30] أولاً، يوجد ترابط إيجابي للغاية (معادلة سبيرمان = 0.81 ؛ P <3.5 × 10−8) بين خطر الإصابة بالسرطان في الأنسجة وعدد الانقسامات الطبيعية للخلايا الجذعية التي تحدث في نفس النسيج. تم تطبيق الترابط على 31 نوعًا من السرطان وامتد عبر خمسة قيم أسية.[31] يعني هذا الترابط أنه إذا انقسمت الخلايا الجذعية الطبيعية من الأنسجة مرة واحدة، فإن خطر الإصابة بالسرطان في هذا النسيج يقارب 1X. إذا تم انقسامهم 1000 مرة، فإن خطر الإصابة بالسرطان هو 1000مرة. وإذا انقسمت الخلايا الجذعية الطبيعية للنسيج 100000 مرة، فإن خطر الإصابة بالسرطان في هذا النسيج يبلغ 100000 مرة تقريبًا. يشير هذا بقوة إلى أن العامل الرئيسي في بدء الإصابة بالسرطان هو حقيقة أن الخلايا الجذعية "الطبيعية" تنقسم، مما يعني أن السرطان ينشأ في الخلايا الجذعية السليمة الطبيعية.[30]
ثانيًا، تُظهر الإحصائيات أن معظم السرطانات البشرية يتم تشخيصها عند كبار السن. التفسير المحتمل هو أن السرطانات تحدث لأن الخلايا تتراكم مع مرور الوقت. الدنا هو المكون الخلوي الوحيد الذي يمكن أن يراكم الضرر طوال فترة الحياة، والخلايا الجذعية هي الخلايا الوحيدة التي يمكنها نقل الحمض النووي من الزيجوت إلى الخلايا في وقت متأخر من الحياة. الخلايا الأخرى، المشتقة من الخلايا الجذعية، لا تحتفظ بالحمض النووي منذ بداية الحياة حتى يحدث سرطان محتمل. هذا يعني أن معظم السرطانات تنشأ من الخلايا الجذعية الطبيعية.[29][30]
اشتراك عيوب المجال
تم استخدام مصطلح " سرطنة المجال " لأول مرة في عام 1953 لوصف منطقة أو "مجال" من الظهارة التي تم تهيأتها مسبقًا (في ذلك الوقت) بواسطة عمليات غير معروفة إلى حد كبير وذلك لتهيئتها لتطور السرطان.[32] ومنذ ذلك الحين، تم استخدام المصطلحين "سرطنة المجال" و "عيب المجال" لوصف الأنسجة محتملة الخبيثة التي من المحتمل أن تظهر فيها سرطانات جديدة.
تم تحديد عيوب المجال بالاقتران مع السرطانات وهي مهمة في تقدم السرطان.[33][34] ومع ذلك، أشار روبن [35]أن "الغالبية العظمى من الدراسات في أبحاث السرطان قد أجريت على أورام محددة جيدًا في الجسم الحي، أو على بؤر أورام منفصلة في المختبر. ومع ذلك، هناك دليل على أن أكثر من 80٪ من الطفرات الجسدية الموجودة في النمط الظاهري الطفري لأورام القولون والمستقيم البشرية تحدث قبل بداية التوسع النسيلي النهائي…"[36] أكثر من نصف الطفرات الجسدية التي تم تحديدها في الأورام حدثت في مرحلة ما قبل الورم ( في عيب المجال)، أثناء نمو الخلايا الطبيعية الظاهرة.من المتوقع أيضًا أن العديد من التغيرات التخلقية الموجودة في الأورام قد تكون حدثت في عيوب مجالات ما قبل الأورام.[37]
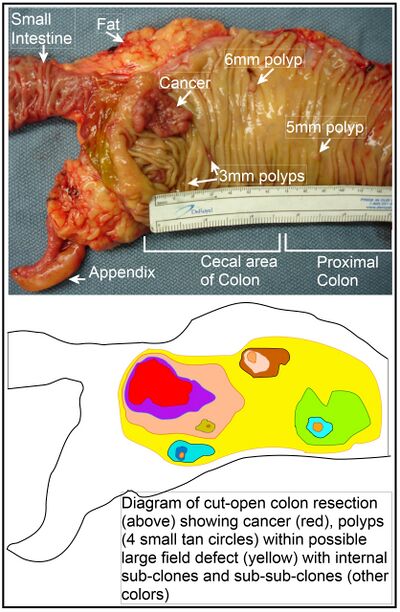
في القولون، من المحتمل أن ينشأ عيب في الحقل عن طريق الانتخاب الطبيعي لخلية متحولة أو متغيرة تخلقياً بين الخلايا الجذعية في قاعدة أحد الخبايا المعوية على السطح الداخلي للقولون. قد تحل الخلايا الجذعية الطافرة أو المعدلة وراثيًا محل الخلايا الجذعية القريبة الأخرى عن طريق الانتخاب الطبيعي. قد يتسبب هذا في ظهور لطخة من الأنسجة الغير طبيعية. يتضمن الشكل الموجود في هذا القسم صورة لجزء حديث تم استئصاله ومفتوح طوليًا من القولون يُظهر سرطان القولون وأربعة سلائل حميدة. يوجد أسفل الصورة رسم تخطيطي لكيفية تشكل لطخة كبيرة من الخلايا الطفرية أو المعدلة وراثيًا، كما هو موضح في المساحة الكبيرة باللون الأصفر في الرسم التخطيطي. ضمن هذه اللطخة الكبيرة الأولى في الرسم التخطيطي (نسيلة كبيرة للخلايا)، قد تحدث طفرة ثانية أو تغيير تخلقي، بحيث تكتسب خلية جذعية معينة ميزة مقارنة بالمجاورين لها، وقد تتوسع هذه الخلية الجذعية المتغيرة بشكل نسيليي، وتشكل لطخة ثانوية، أو نسيلة فرعي، داخل اللطخة الأصلية. يشار إلى هذا في الرسم التخطيطي بأربع لطخات أصغر بألوان مختلفة داخل المنطقة الأصلية الكبيرة الصفراء. ضمن هذه اللطخات الجديدة (النسخ الفرعية)، يمكن تكرار العملية عدة مرات، يشار إليها باللطخات الأصغر داخل اللطخات الثانوية الأربعة (مع ألوان مختلفة في الرسم التخطيطي) والتي تتوسع بشكل نسيليي، حتى تظهر الخلايا الجذعية التي تولد إما سلائل صغيرة أو ورم خبيث (السرطان). في الصورة، نتج عن عيب مجال واضح في هذا الجزء من القولون أربعة سلائل (مُصنَّفة بحجم السلائل، 6 مم، 5 مم، واثنان 3 مم، وسرطان حوالي 3 سم في البعد الأطول له). يشار إلى هذه الأورام أيضًا (في الرسم البياني أسفل الصورة) بواسطة 4 دوائر سمراء صغيرة (السلائل) ومنطقة حمراء أكبر (السرطان). حدث السرطان الذي في الصورة في منطقة الأعور من القولون، حيث يلتقي القولون بالأمعاء الدقيقة (المسماه في الصورة) وحيث تحدث الزائدة الدودية (المسماه في الصورة). الدهون في الصورة خارجية للجدار الخارجي للقولون. في جزء القولون الموضح هنا، تم فتح القولون بالطول لكشف سطحه الداخلي ولإظهار السرطان والسلائل التي تحدث داخل البطانة الظهارية الداخلية للقولون.
إذا كانت العملية العامة التي تنشأ من خلالها سرطانات القولون الفرادي هي تكوين نسيلة ما قبل الورم الذي ينتشر عن طريق الانتخاب الطبيعي، متبوعًا بتكوين نسائل فرعية داخلية داخل النسيلة الأولية، ونسائل متفرعة من الفرعية داخل تلك النسخ، فإن سرطانات القولون بشكل عام، يجب أن تكون مرتبطة بمجالات من التشوهات المتزايدة، مما يعكس تعاقب الأحداث السابقة للسرطان، وأن يسبقها. تعكس المنطقة الأكثر انتشارًا من التشوه (المنطقة الخارجية غير المنتظمة الصفراء في الرسم التخطيطي) الحدث المبكر في تكوين ورم خبيث.
في التقييم التجريبي لأوجه القصور المحددة لترميم الحمض النووي في السرطانات، ظهر أيضًا العديد من أوجه القصور المحددة لترميم الحمض النووي في عيوب المجال المحيطة بتلك السرطانات. يعطي الجدول أدناه أمثلة تبين أن نقص ترميم الحمض النووي في السرطان ناتج عن تغيير تخلقي، والترددات المنخفضة إلى حد ما التي تم العثور على نفس نقص ترميم الحمض النووي الناجم عن التخلق في عيب المجال المحيط.
| سرطان | جين | تواتر السرطان | تواتر عيوب المجال | المرجع |
|---|---|---|---|---|
| القولوني المستقيمي | MGMT | 46% | 34% | [38] |
| القولوني المستقيمي | MGMT | 47% | 11% | [39] |
| القولوني المستقيمي | MGMT | 70% | 60% | [40] |
| القولوني المستقيمي | MSH2 | 13% | 5% | [39] |
| القولوني المستقيمي | ERCC1 | 100% | 40% | [41] |
| القولوني المستقيمي | PMS2 | 88% | 50% | [41] |
| القولوني المستقيمي | XPF | 55% | 40% | [41] |
| الرأس والرقبة | MGMT | 54% | 38% | [42] |
| الرأس والرقبة | MLH1 | 33% | 25% | [43] |
| الرأس والرقبة | MLH1 | 31% | 20% | [44] |
| المعدة | MGMT | 88% | 78% | [45] |
| المعدة | MLH1 | 73% | 20% | [46] |
| المرئ | MLH1 | 77%–100% | 23%–79% | [47] |
قد تكون بعض السلائل الصغيرة في عيب المجال الموضحة في صورة مقطع القولون المفتوح عبارة عن أورام حميدة نسبيًا. في دراسة أجريت عام 1996 على السلائل التي يقل حجمها عن 10 ملم والتي تم العثور عليها أثناء تنظير القولون والتي أعقبها تنظير القولون المتكرر لمدة 3 سنوات، ظل 25 ٪ دون تغيير في الحجم، و 35 ٪ تراجع أو تقلص في الحجم و 40 ٪ نما في الحجم.[48]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
عدم استقرار الجينوم
من المعروف أن السرطانات تظهر عدم استقرار الجينوم أو "النمط الظاهري للطفرة".[49] يمثل الحمض النووي المرمز للپروتين داخل النواة حوالي 1.5 ٪ من إجمالي الحمض النووي الجينومي.[50] ضمن هذا الحمض النووي المشفر للپروتين (يسمى الإكسوم )، يمكن أن يحتوي سرطان الثدي أو القولون المتوسط على حوالي 60 إلى 70 طفرة تغير الپروتين، منها حوالي 3 أو 4 طفرات "محركة"، وقد تكون الطفرات المتبقية " عابرة.[37] ومع ذلك، فإن متوسط عدد طفرات تسلسل الحمض النووي في الجينوم بأكمله (بما في ذلك المناطق غير المشفرة للپروتين ) داخل عينة أنسجة سرطان الثدي هو حوالي 20000.[51] في المتوسط تكون عينة نسيج الميلانوما (الميلانوما لها تردد أعلى لطفرة الإكسوم )،[37]يبلغ العدد الإجمالي لطفرات تسلسل الحمض النووي حوالي 80000.[52] تشير هذه الترددات العالية للطفرات في تسلسل النيوكليوتيدات الكلي داخل السرطانات إلى أن التغيير المبكر في عيب المجال الذي يؤدي إلى ظهور السرطان (على سبيل المثال المنطقة الصفراء في الرسم البياني في القسم السابق) هو نقص في ترميم الحمض النووي. عيوب المجال الكبيرة المحيطة بسرطان القولون (تمتد إلى حوالي 10 سم على كل جانب من السرطان[41]غالبًا ما يكون به عيوب تخلقية في اثنين أو ثلاثة من پروتينات ترميم الحمض النووي ( ERCC1 و (ERCC4 (XPF) و / أو PMS2 ) في كامل منطقة عيب المجال. عندما يتم تقليل التعبير عن جينات ترميم الحمض النووي، يتراكم تلف الحمض النووي في الخلايا بمعدل أعلى من المعدل الطبيعي، ويؤدي هذا الضرر الزائد إلى زيادة تواتر الطفرة و / أو الطفرة التخلقية. تزداد معدلات الطفرات بشدة في الخلايا المعيبة في ترميم الدنا الغير المتطابق[21][22] أو في الترميم التأشبي المتماثل (HRR).[23] يمكن أن يؤدي النقص في ترميم الحمض النووي، في حد ذاته، إلى تراكم تلف الحمض النووي، وقد يؤدي التوليف عبر الآفة المعرض للخطأ لبعض المناطق المتضررة إلى حدوث طفرات. بالإضافة إلى ذلك، قد يؤدي الترميم الخاطئ لتلف الحمض النووي المتراكم هذا إلى ظهور التقرحات. قد توفر هذه الطفرات و / أو الطفرات التخلقية ميزة تكاثرية، مما يؤدي إلى حدوث عيب في المجال. على الرغم من أن الطفرات / الطفرات في جينات ترميم الحمض النووي لا تمنح، بحد ذاتها، ميزة انتقائية، إلا أنها قد تُحمل كعابرين في الخلايا عندما تكتسب الخلية طفرة / طفرة تخلقية توفر ميزة تكاثرية
النظريات الغير سائدة
هناك عدد من النظريات حول التسرطن وعلاج السرطان التي تقع خارج التيار الرئيسي للرأي العلمي، بسبب الافتقار إلى الرأي العلمي أو المنطق أو قاعدة الأدلة. يمكن استخدام هذه النظريات لتبرير العلاجات البديلة المختلفة للسرطان. يجب تمييزها عن نظريات التسرطن التي لها أساس منطقي في بيولوجيا السرطان السائدة، والتي يمكن من خلالها وضع فرضيات قابلة للاختبار تقليديًا.
ومع ذلك، فإن العديد من النظريات البديلة للتسرطن تستند إلى أدلة علمية ويتم الاعتراف بها بشكل متزايد. يعتقد بعض الباحثين أن السرطان قد يكون ناتجًا عن اختلال الصيغة الصبغية (تشوهات عددية وهيكلية في الصبغيات)[53] وليس بسبب الطفرات أو الطفرات التخلقية. يُعتبر السرطان أيضًا أحد الأمراض الاستقلابية، حيث يتم تحويل عملية الاستقلاب للأكسجين من المسار الذي يولد الطاقة ( الفسفرة التأكسدية ) إلى المسار الذي يولد مركبات الأكسجين التفاعلي.[54] يؤدي هذا إلى تحول الطاقة من الفسفرة التأكسدية إلى تحلل السكر الهوائي ( فرضية واربورغ )، وتراكم مركبات الأكسجين التفاعلية مما يؤدي إلى الإجهاد التأكسدي ("نظرية الإجهاد التأكسدي للسرطان").[54] يعتمد مفهوم آخر لتطور السرطان على التعرض لمجالات مغناطيسية وكهرومغناطيسية ضعيفة وتأثيرها على الإجهاد التأكسدي، المعروف باسم السرطنة المغناطيسية.[55]
شكك عدد من المؤلفين في الافتراض القائل بأن السرطانات تنتج عن طفرات عشوائية متتابعة باعتبارها مفرطة في التبسيط، واقترحوا بدلاً من ذلك أن السرطان ينتج عن فشل الجسم في تثبيط نزعة تكاثر فطرية ومبرمجة.[56] وتشير نظرية ذات صلة ان السرطان هو تأسل رجعي، ارتداد تطوري إلى شكل سابق من الحياة متعددة الخلايا.[57] تتشابه الجينات المسؤولة عن نمو الخلايا الغير منضبط والتعاون بين الخلايا السرطانية إلى حد كبير مع تلك التي مكّنت أشكال الحياة متعددة الخلايا الأولى من التجمع معًا والازدهار. لا تزال هذه الجينات موجودة داخل جينومات الحيوانات متعددة الخلايا الأكثر تعقيدًا، مثل البشر، على الرغم من أن الجينات المتطورة مؤخرًا تبقيها تحت السيطرة. عندما تفشل الجينات المتحكمة الأحدث لأي سبب من الأسباب، يمكن للخلية أن تعود إلى برمجتها الأكثر بدائية وتتكاثر خارج نطاق السيطرة. النظرية هي بديل لفكرة أن السرطانات تبدأ بالخلايا المارقة التي تخضع للتطور داخل الجسم. بدلاً من ذلك، يمتلكون عددًا ثابتًا من الجينات البدائية التي يتم تنشيطها تدريجياً، مما يمنحها تقلبات محدودة.[58] تعيد نظرية تطورية أخرى جذور السرطان إلى أصل خلية حقيقيات النوى (النواة) عن طريق نقل الجينات الأفقي الهائل، عندما تم شق جينومات الڤيروسات المصابة (وبالتالي تم إضعافها) من قبل المضيف، ولكن تم دمج اجزائها في جينوم المضيف كحماية مناعية. وهكذا ينشأ السرطان عندما تعيد طفرة جسدية نادرة تجميع هذه الاجزاء في محرك وظيفي لتكاثر الخلايا[59]
بيولوجيا الخلايا السرطانية
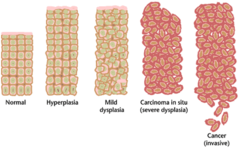
في كثير من الأحيان، قد تستغرق التغييرات الجينية المتعددة التي تؤدي إلى الإصابة بالسرطان سنوات عديدة لتتراكم. خلال هذا الوقت، يتغير السلوك البيولوجي للخلايا ما قبل الخبيثة ببطء من خصائص الخلايا الطبيعية إلى خصائص شبيهة بالسرطان. يمكن أن يكون للأنسجة ما قبل الخبيثة مظهر مميز تحت المجهر. من بين السمات المميزة للآفة ما قبل الخبيثة زيادة عدد الخلايا المنقسمة، والتباين في الحجم والشكل النووي، والتباين في حجم الخلية وشكلها، وفقدان السمات الخلوية المتخصصة، وفقدان التنظيم الطبيعي للأنسجة. الثدن هو نوع غير طبيعي من التكاثر المفرط للخلايا يتميز بفقدان ترتيب الأنسجة الطبيعي وهيكل الخلية في الخلايا ما قبل الخبيثة. يجب التمييز بين هذه التغيرات الورمية المبكرة وبين فرط التنسج، وهو زيادة عكسية في انقسام الخلايا ناتجة عن منبه خارجي، مثل اختلال التوازن الهرموني أو التهيج المزمن.
يشار إلى حالات خلل التنسج الأكثر شدة بالسرطانة اللابدة. في اللاتينية، يعني المصطلح اللابدة "in place" ؛ تشير السرطانة اللابدة إلى نمو غير متحكم فيه لخلايا خلل التنسج التي تظل في موقعها الأصلي ولم تظهر غزوًا للأنسجة الأخرى. قد تتطور السرطانة اللابدة إلى ورم خبيث غازي وعادة ما يتم إزالته جراحيًا عند اكتشافه.
تطور النسيلي
مثلما تخضع مجموعة من الحيوانات للتطور، يمكن أيضًا أن تخضع مجموعة من الخلايا الغير مراقبة "للتطور". تسمى هذه العملية غير المرغوب فيها التطور الجسدي، وهي الطريقة التي ينشأ بها السرطان ويصبح خبيثًا بمرور الوقت.[60]
تؤدي معظم التغييرات في الاستقلاب الخلوي التي تسمح للخلايا بالنمو بطريقة غير منظمة إلى موت الخلايا. ومع ذلك، بمجرد أن يبدأ السرطان، تخضع الخلايا السرطانية لعملية الانتخاب الطبيعي : الخلايا القليلة ذات التغييرات الجينية الجديدة التي تعزز بقائها أو تكاثرها تتكاثر بشكل أسرع، وسرعان ما تهيمن على الورم المتنامي حيث تتنافس الخلايا ذات التغيير الجيني الأقل ملاءمة.[61] هذه هي نفس الآلية التي يمكن من خلالها للأنواع المسببة للأمراض مثل المكورات العنقودية الذهبية المقاومة للمثيسيلين أن تصبح مقاومة للمضادات الحيوية ويمكن من خلالها أن يصبح ڤيروس نقص المناعة البشرية مقاومًا للأدوية )، والتي يمكن من خلالها أن تصبح أمراض النبات والحشرات مقاومة لمبيدات الآفات. يفسر هذا التطور سبب حدوث انتكاس السرطان غالبًا في الخلايا التي اكتسبت مقاومة لعقاقير السرطان أو مقاومة العلاج الإشعاعي
الخصائص البيولوجية لخلايا السرطان
في مقال نشر عام 2000 بواسطة هاناهان و واينبرغ، تم تلخيص الخصائص البيولوجية لخلايا السرطان الخبيثة على النحو التالي:[62]
- اكتساب الاكتفاء الذاتي في إشارات النمو مما يؤدي إلى نمو غير رادع
- فقدان الحساسية للإشارات المضادة للنمو، مما يؤدي أيضًا إلى نمو غير مراقب.
- فقدان القدرة على الاستموات، مما يسمح بالنمو على الرغم من الأخطاء الجينية والإشارات الخارجية المضادة للنمو.
- فقدان القدرة على الشيخوخة، مما يؤدي إلى إمكانية تكرار غير محدودة (الخلود)
- اكتساب تولد الأوعية المستمر، مما يسمح للورم بالنمو خارج حدود انتشار المغذيات السلبي.
- اكتساب القدرة على غزو الأنسجة المجاورة، الخاصية المميزة للسرطان الغازي.
- اكتساب القدرة على زرع النقائل في مواقع بعيدة، وهي خاصية تظهر في وقت متأخر لبعض الأورام الخبيثة (السرطانات أو غيرها).
سيكون إكمال هذه الخطوات المتعددة حدثًا نادرًا جدًا بدون:
- فقدان القدرة على ترميم الأخطاء الجينية، مما يؤدي إلى زيادة معدل الطفرات (عدم الاستقرار الجيني)، وبالتالي تسريع جميع التغييرات الأخرى.
هذه التغيرات البيولوجية نموذجية في السرطانات. الأورام الخبيثة الأخرى قد لا تحتاج إلى تحقيقها كلها. على سبيل المثال، نظرًا لأن غزو الأنسجة والإاحة إلى مواقع بعيدة هي خصائص طبيعية للكريات البيض، فإن هذه الخطوات ليست ضرورية في تطور ابيضاض الدم. ولا تمثل الخطوات المختلفة بالضرورة طفرات فردية. على سبيل المثال، سيؤدي تعطيل جين واحد، ترميز الپروتين p53، إلى عدم الاستقرار الجيني، وتجنب الاستموات وزيادة تولد الأوعية. علاوة على ذلك، ليست كل الخلايا السرطانية تنقسم. بدلاً من ذلك، تقوم مجموعة فرعية من الخلايا في الورم، تسمى الخلايا الجذعية السرطانية، بتكرار نفسها أثناء إنتاج خلايا متمايزة.[63]
Cancer as a defect in cell interactions
عادة، بمجرد إصابة الأنسجة أو إصابتها بالعدوى، تثير الخلايا التالفة الالتهاب عن طريق تحفيز أنماط معينة من نشاط الإنزيم والتعبير الجيني للسيتوكين في الخلايا المحيطة.[64][65] يتم إفراز مجموعات منفصلة ("مجموعات السيتوكين") من الجزيئات، والتي تعمل كوسيط، مما يحفز نشاط السلاسل اللاحقة من التغيرات الكيميائية الحيوية.[66] يرتبط كل سيتوكين بمستقبلات محددة على أنواع مختلفة من الخلايا، ويستجيب كل نوع خلية بدوره عن طريق تغيير نشاط مسارات نقل الإشارات داخل الخلايا، اعتمادًا على المستقبلات التي تعبر عنها الخلية وجزيئات الإشارة الموجودة داخل الخلية.[67][68]بشكل جماعي، تؤدي عملية إعادة البرمجة هذه إلى تغيير تدريجي في الأنماط الظاهرية للخلية، مما سيؤدي في النهاية إلى استعادة وظيفة الأنسجة ونحو استعادة السلامة الهيكلية الأساسية.[69][70] وبالتالي يمكن للنسيج أن يشفى، اعتمادًا على الاتصال المثمر بين الخلايا الموجودة في موقع التلف والجهاز المناعي.[71] أحد العوامل الرئيسية في الشفاء هو تنظيم التعبير الجيني للسيتوكين، والذي يمكّن مجموعات الخلايا التكميلية من الاستجابة للوسطاء الالتهابيين بطريقة تنتج تدريجياً تغييرات أساسية في فسيولوجيا الأنسجة.[72][73][74] تحتوي الخلايا السرطانية على تغيرات دائمة (وراثية) أو قابلة للعكس (تخلقية) في جينومها، والتي تثبط جزئيًا تواصلها مع الخلايا المحيطة ومع الجهاز المناعي.[75][76] لا تتواصل الخلايا السرطانية مع بيئتها المكروية للأنسجة بطريقة تحمي سلامة الأنسجة ؛ بدلاً من ذلك، تصبح حركة الخلايا السرطانية وبقائها ممكنة في الأماكن التي يمكن أن تضعف فيها وظيفة الأنسجة.[77][78] تعيش الخلايا السرطانية عن طريق "إعادة توصيل" مسارات الإشارات التي تحمي عادة الأنسجة من جهاز المناعة. هذا التغيير في الاستجابة المناعية واضح في المراحل المبكرة من الخباثة أيضًا.[79][80]
أحد الأمثلة على إعادة توصيل وظيفة الأنسجة في السرطان هو نشاط عامل النسخ NF-κB.[81] ينشط NF-κB التعبير عن العديد من الجينات المشاركة في الانتقال بين الالتهاب والتجديد، والذي يشفر السيتوكينات وعوامل الالتصاق والجزيئات الأخرى التي يمكنها تغيير مصير الخلية.[82] تسمح إعادة برمجة الأنماط الظاهرية الخلوية عادةً بتطوير نسيج سليم يعمل بكامل طاقته.[83] يتم التحكم بشدة في نشاط NF-B بواسطة پروتينات متعددة، والتي تضمن بشكل جماعي أن مجموعات الجينات المنفصلة فقط يتم تحفيزها بواسطة NF-B في خلية معينة وفي وقت معين.[84] هذا التنظيم الصارم لتبادل الإشارات بين الخلايا يحمي الأنسجة من الالتهاب المفرط، ويضمن أن أنواع الخلايا المختلفة تكتسب تدريجياً وظائف تكميلية ومواقف محددة. إن فشل هذا التنظيم المتبادل بين إعادة البرمجة الجينية والتفاعلات الخلوية يسمح للخلايا السرطانية بالتسبب في نقائل. تستجيب الخلايا السرطانية للسيتوكينات بشكل شاذ، وتنشط سلالات الإشارة التي يمكن أن تحميها من جهاز المناعة.[81][85]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
في الاسماك
إن دور اليود في الأسماك البحرية (الغنية باليود) وأسماك المياه العذبة (التي تعاني من نقص اليود) غير مفهوم تمامًا، ولكن تم الإبلاغ عن أن أسماك المياه العذبة أكثر عرضة للإصابة بالعدوى، وعلى وجه الخصوص، أمراض الأورام وتصلب الشرايين، من الاسماك البحرية.[86][87] تعتبر أسماك صفيحية الخياشيم البحرية مثل أسماك القرش وأسماك الراي اللساع وما إلى ذلك أقل تأثراً بالسرطان من أسماك المياه العذبة، وبالتالي فقد حفزت البحث الطبي لفهم التسرطن بشكل أفضل.[88]
الآليات
لكي تبدأ الخلايا في الانقسام بشكل لا يمكن السيطرة عليه، يجب أن تكون الجينات التي تنظم نمو الخلايا غير منظمة.[89] طليعة الجينات الورمية هي جينات تعزز نمو الخلايا والانقسام الفتيلي، بينما تثبط الجينات الكابتة للورم نمو الخلايا، أو توقف انقسام الخلايا مؤقتًا لإجراء ترميم الدنا. عادة، هناك حاجة لسلسلة من الطفرات العديدة لهذه الجينات قبل أن تتحول الخلية الطبيعية إلى خلية سرطانية.[5] يسمى هذا المفهوم أحيانًا "التطور الورمي". توفر الطفرات في هذه الجينات إشارات للخلايا السرطانية لبدء الانقسام بشكل لا يمكن السيطرة عليه. لكن الانقسام الخلوي الغير منضبط الذي يميز السرطان يتطلب أيضًا أن تضاعف الخلية المنقسمة جميع مكوناتها الخلوية لتكوين خليتين ابنتيتين. إن تنشيط تحلل الگلوگوز اللاهوائي ( تأثير واربورغ )، والذي ليس بالضرورة ناتجًا عن طفرات في طليعة الجينات الورمية والجينات الكابتة للورم،[90]يوفر معظم القوالب الأساسية اللازمة لتضاعف المكونات الخلوية للخلية المنقسمة، وبالتالي، هو أيضا ضروري للتسرطن.[54]
الجينات الورمية
تعزز الجينات الورمية نمو الخلايا من خلال مجموعة متنوعة من الطرق. يمكن للعديد منهم أن ينتج هرمونات، "مرسال كيميائي" بين الخلايا الذي يشجع الانقسام الفتيلي، والذي يعتمد تأثيره على تحويل الإشارة للأنسجة أو الخلايا المستقبلة. بمعنى آخر، عندما يتم تحفيز مستقبل هرمون في خلية مستقبلة، يتم توصيل الإشارة من سطح الخلية إلى نواة الخلية للتأثير على بعض التغيير في تنظيم النسخ الجيني على المستوى النووي. بعض الجينات الورمية هي جزء من نظام نقل الإشارة نفسه، أو مستقبلات الإشارة في الخلايا والأنسجة نفسها، وبالتالي تتحكم في الحساسية لمثل هذه الهرمونات. غالبًا ما تنتج الجينات الورمية محدثات التفتل، أو تشارك في نسخ الحمض النووي في تخليق الپروتين، مما ينتج عنه الپروتينات والإنزيمات المسؤولة عن إنتاج المنتجات التي تستخدمها الخلايا البيوكيميائية وتتفاعل معها.
يمكن للطفرات في طليعة الجينات الورمية، والتي تعتبر النظير الهادئ عادةً للجينات الورمية، تعديل تعبيرها ووظيفتها، مما يزيد من كمية أو نشاط پروتين المنتج. عندما يحدث هذا، تصبح طليعة الجينات الورمية جينات ورمية، وهذا الانتقال يخل بالتوازن الطبيعي لتنظيم دورة الخلية في الخلية، مما يجعل النمو غير المنضبط ممكنًا. لا يمكن تقليل فرصة الإصابة بالسرطان عن طريق إزالة طليعة الجينات الورمية من الجينوم، حتى لو كان ذلك ممكنًا، لأنها ضرورية لنمو وإصلاح واستتباب الكائن الحي. فقط عندما يتم تحورهم تصبح إشارات النمو مفرطة.
من أوائل الجينات الورمية التي تم تعريفها في أبحاث السرطان هي جين ورمي راس. الطفرات في عائلة راس من طليعة الجينات الورمية (التي تشمل H-راس و N-راس و K-راس) شائعة جدًا، حيث توجد في 20 ٪ إلى 30 ٪ من جميع الأورام البشرية.[91] تم التعرف على راس في الأصل في جينوم ڤيروس ساركوما هارفي، وتفاجأ الباحثون بأن هذا الجين ليس فقط موجودًا في الجينوم البشري، ولكن أيضًا، عند ربطه بعنصر تحكم محفز، يمكن أن يحفز السرطانات في مزارع خط الخلية.[92]
طليعة الجينات الورمية
تعزز طليعة الجينات الورمية نمو الخلايا بعدة طرق. يمكن أن ينتج الكثير منهم الهرمونات، "مرسال كيميائي" بين الخلايا التي تشجع الانقسام الفتيلي، ويعتمد تأثيرها على تحويل الإشارات للأنسجة أو الخلايا المستقبلة. بعضها مسؤول عن نظام نقل الإشارة ومستقبلات الإشارة في الخلايا والأنسجة نفسها، وبالتالي التحكم في الحساسية لمثل هذه الهرمونات. غالبًا ما ينتجون محدثين تفتل، أو يشاركون في نسخ الحمض النووي في تخليق الپروتين، والذي ينتج الپروتينات والإنزيمات المسؤولة عن إنتاج المنتجات التي تستخدمها الخلايا الكيميائية الحيوية وتتفاعل معها.
يمكن للطفرات في طليعة الجينات الورمية تعديل تعبيرها ووظيفتها، مما يزيد من كمية أو نشاط پروتين المنتج. عندما يحدث هذا، فإنها تصبح جينات ورمية، وبالتالي، فإن الخلايا لديها فرصة أكبر للانقسام بشكل مفرط وغير متحكم فيه. لا يمكن تقليل فرصة الإصابة بالسرطان عن طريق إزالة طليعة الجينات المسرطنة من الجينوم، لأنها ضرورية لنمو وإصلاح واستتباب الجسم. فقط عندما يتم تحورهم تصبح إشارات النمو مفرطة. من المهم ملاحظة أن الجين الذي يمتلك دورًا في تعزيز النمو قد يزيد من إمكانية الإصابة بالسرطان للخلية، بشرط تنشيط جميع الآليات الخلوية الضرورية التي تسمح بالنمو.[93] تتضمن هذه الحالة أيضًا تعطيل جينات معينة مثبطة للورم (انظر أدناه). إذا لم يتم استيفاء الشرط، فقد تتوقف الخلية عن النمو ويمكن أن تموت. وهذا يجعل تحديد مرحلة ونوع الخلية السرطانية التي تنمو تحت سيطرة أحد الجينات الورمية أمرًا ضروريًا لتطوير استراتيجيات العلاج.
الجينات المثبطة للورم
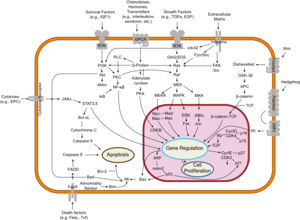
ترمز الجينات المثبطة للورم لإشارات منع الانتشار والپروتينات التي تثبط الانقسام الفتيلي ونمو الخلايا. بشكل عام، مثبطات الأورام هي عوامل نسخ يتم تنشيطها عن طريق الإجهاد الخلوي أو تلف الحمض النووي. غالبًا ما يتسبب تلف الحمض النووي في وجود مادة وراثية عائمة- حرة بالإضافة إلى علامات أخرى، وسيؤدي إلى تنشيط الإنزيمات والمسارات التي تؤدي إلى تنشيط الجينات المثبطة للورم. تتمثل وظائف هذه الجينات في إيقاف تقدم دورة الخلية من أجل إجراء ترميم الحمض النووي، ومنع الطفرات من الانتقال إلى الخلايا الوليدة. يعتبر الپروتين p53، أحد أهم الجينات المدروسة لتثبيط الورم، وهو عامل نسخ ينشط بواسطة العديد من الضغوطات الخلوية بما في ذلك نقص الأكسجين والتلف الناتج عن الأشعة فوق البنفسجية
على الرغم من أن ما يقرب من نصف السرطانات التي يُحتمل أن تنطوي على تغييرات في الپروتين p53، فإن وظيفة تثبيط الورم الخاص به غير مفهومة جيدًا. من الواضح أن p53 له وظيفتان: إحداهما دور نووي كعامل نسخ، والأخرى دور هيولي في تنظيم دورة الخلية وانقسام الخلايا والاستموات.
فرضية واربورغ هي الاستخدام التفضيلي لتحلل السكر للحصول على الطاقة للحفاظ على نمو السرطان. لقد ثبت أن p53 ينظم التحول من مسار الجهاز التنفسي إلى مسار تحلل السكر.[94]
ومع ذلك، يمكن أن تؤدي الطفرة إلى إتلاف الجين المثبط للورم نفسه، أو مسار الإشارة الذي ينشطه، مما يؤدي إلى "إيقاف تشغيله". والنتيجة الثابتة لهذا هي أن ترميم الحمض النووي يتم إعاقته أو تثبيطه: يتراكم تلف الحمض النووي دون إصلاح، مما يؤدي حتمًا إلى الإصابة بالسرطان.
تنتقل الطفرات في الجينات المثبطة للورم التي تحدث في خلايا الخط الجنسي إلى النسل، وتزيد من احتمالية تشخيص السرطان في الأجيال اللاحقة. أعضاء هذه العائلات زادوا من حدوث الأورام المتعددة وقللوا من زمن كمونها. أنواع الأورام نموذجية لكل نوع من الطفرات الجينية المثبطة للورم، مع بعض الطفرات التي تسبب سرطانات معينة، وطفرات أخرى تسبب أنواعًا أخرى. إن طريقة وراثة مثبطات الورم الطافرة هي أن الشخص المصاب يرث نسخة معيبة من أحد الوالدين، ونسخة عادية من الآخر. على سبيل المثال، يمكن للأفراد الذين يرثون أليل p53 متحور واحدًا (وبالتالي يكونون متغاير الزيجوت بالنسبة للطفرة p53 ) تطور الأورام الميلانينية وسرطان الپنكرياس، المعروفين باسم متلازمة لي-فراوميني. تشمل المتلازمات الجينية المثبطة للورم الموروثة الأخرى طفرات الورم الأورمي الشبكي، المرتبطة بالورم الأرومي الشبكي، وطفرات جين داء السلائل الورمي الغدي العائلي، المرتبطة بسرطان القولون الغدي. يرتبط سرطان القولون الغدي بآلاف السلائل في القولون في سن الشباب، مما يؤدي إلى الإصابة بسرطان القولون في سن مبكرة نسبيًا. أخيرًا، تؤدي الطفرات الموروثة في BRCA1 و BRCA2 إلى ظهور مبكر لسرطان الثدي.
تم اقتراح تطور السرطان في عام 1971 للاعتماد على حدثين طفريين على الأقل. في ما أصبح يُعرف باسم فرضية ندسون الضربتين، فإن طفرة الخط الجنسي الموروثة في الجين المثبط للورم لن تسبب السرطان إلا إذا حدث طفرة أخرى في وقت لاحق من حياة الكائن الحي، مما يؤدي إلى تعطيل الأليل الآخر لذلك الجين المثبط للورم.[95]
عادة، تكون الجينات الورمية هي السائدة، لأنها تحتوي على طفرات اكتساب الوظيفة، بينما تكون مثبطات الأورام الطافرة متنحية، لأنها تحتوي على طفرات فقدان الوظيفة. تحتوي كل خلية على نسختين من نفس الجين، واحدة من كل والد، وفي معظم الحالات، يكون اكتساب طفرات وظيفية في نسخة واحدة فقط من أحد طليعة الجينات الورمية كافية لجعل هذا الجين أحد الجينات الورمية الحقيقية. من ناحية أخرى، يجب أن يحدث فقدان للطفرات الوظيفية في كلتا نسختين من الجين المثبط للورم لجعل هذا الجين غير فعال تمامًا. ومع ذلك، توجد حالات يمكن فيها لنسخة واحدة من الجين المثبط للورم أن تجعل النسخة الأخرى من النوع البري غير وظيفية. تسمى هذه الظاهرة التأثير السلبي السائد ويتم ملاحظتها في العديد من طفرات p53.
تم تحدي نموذج ندسون الثنائي الذي تم تحديه مؤخرًا من قبل العديد من المحققين. إن تعطيل أليل واحد لبعض الجينات المثبطة للورم كافٍ للتسبب في الأورام. تسمى هذه الظاهرة بالقصور الفرداني وقد تم إثباتها من خلال عدد من الأساليب التجريبية.عادة ما يكون للأورام الناتجة عن القصور الفرداني عمر تأخر في الظهور عند مقارنتها بالأورام الناتجة عن عملية الضربتين.[96]
الطفرات المتعددة
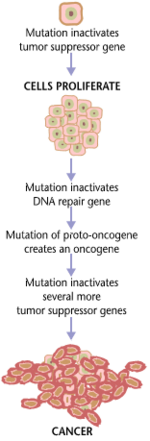
بشكل عام، الطفرات في كلا النوعين من الجينات مطلوبة لحدوث السرطان.على سبيل المثال، سيتم قمع طفرة تقتصر على أحد الجينات الورمية عن طريق التحكم في الانقسام الفتيلي والجينات المثبطة للورم، التي افترضتها فرضية كنودسون لأول مرة.[3] إن حدوث طفرة في جين واحد فقط من الجينات المثبطة للورم لن يسبب السرطان أيضًا، نظرًا لوجود العديد من الجينات "الاحتياطية" التي تكرر وظائفها. فقط عندما يتحول عدد كافٍ من طليعة الجينات الورمية إلى جينات ورمية، ويتم تعطيل أو تلف عدد كافٍ من الجينات المثبطة للورم، فإن إشارات نمو الخلايا تطغى على الإشارات لتنظيمها، فإن نمو الخلية بسرعة يخرج عن نطاق السيطرة.[5] في كثير من الأحيان، نظرًا لأن هذه الجينات تنظم العمليات التي تمنع معظم الأضرار التي تلحق بالجينات نفسها، فإن معدل الطفرات يزداد مع تقدم المرء في السن، لأن تلف الحمض النووي يشكل حلقة تغذية راجعة.
يمكن أن يؤدي تحور الجينات المثبطة للورم التي تنتقل إلى الجيل التالي ليس فقط من الخلايا، ولكن نسلها، إلى زيادة احتمالية توريث السرطانات.الأفراد داخل هذه العائلات زاد لديهم حدوث وتقليل كمون أورام متعددة. إن طريقة وراثة مثبطات الورم الطافرة هي أن الشخص المصاب يرث نسخة معيبة من أحد الوالدين، ونسخة عادية من آخر. نظرًا لأن الطفرات في مثبطات الورم تعمل بطريقة متنحية (لاحظ، مع ذلك، أن هناك استثناءات)، فإن فقدان النسخة الطبيعية يخلق النمط الظاهري للسرطان. على سبيل المثال، غالبًا ما يكون الأفراد متغايرين الزيجوت لطفرات p53 ضحايا لمتلازمة لي-فراوميني، والذين يكونون متغايرين الزيجوت لطفرات الورم الأرومي الشبكي يصابون بالورم الأرومي الشبكي. بطريقة مماثلة، والطفرات في جين داء السلائل الورمي الغدي العائلي مرتبطة بسرطان القولون الغدي، مع الآلاف من السلائل في القولون في سن الشباب، في حين أن الطفرات في BRCA1 و BRCA2 تؤدي إلى الظهور المبكر لسرطان الثدي.
تم الإعلان عن فكرة جديدة في عام 2011 وهي نسخة متطرفة من طفرات متعددة، يطلق عليها مؤيدوها اسم تفتيت الصبغيات. هذه الفكرة، التي تؤثر على 2-3 ٪ فقط من حالات السرطان، على الرغم من أن ما يصل إلى 25 ٪ من سرطانات العظام، تتضمن تحطيمًا كبيراً للكروموسوم إلى عشرات أو مئات القطع ثم إعادة ترقيعها معًا بشكل غير صحيح. من المحتمل أن يحدث هذا التمزق عندما يتم ضغط الكروموسومات أثناء الانقسام الطبيعي للخلية، لكن سبب هذا التمزق غير معروف. في ظل هذا النموذج، ينشأ السرطان نتيجة لحدث واحد منعزل، وليس نتيجة التراكم البطيء للطفرات المتعددة.[97]
مسرطنات غير طافرة
العديد من المطفرات هي أيضًا مسرطنات، لكن بعض المواد المسرطنة ليست مطفرة. تشمل أمثلة المسرطنات التي لا تعتبر مطفرة الكحول والإستروجن. يُعتقد أن هذه المواد تعزز الإصابة بالسرطان من خلال تأثيرها المحفز على معدل الانقسام الفتيلي. تترك معدلات الانقسام الفتيلي الأسرع على نحو متزايد فرصًا أقل لإصلاح الإنزيمات لترميم الحمض النووي التالف أثناء تنسخ الحمض النووي، مما يزيد من احتمال حدوث خطأ وراثي. يمكن أن يؤدي الخطأ الذي يحدث أثناء الانقسام الفتيلي إلى تلقي الخلايا الوليدة عددًا خاطئًا من الكروموسومات، مما يؤدي إلى اختلال الصيغة الصبغية وقد يؤدي إلى الإصابة بالسرطان.
دور العدوي
البكتيريا
يمكن أن تسبب الملوية البوابية سرطان المعدة. على الرغم من اختلاف البيانات بين البلدان المختلفة، فإن حوالي 1 ٪ إلى 3 ٪ من الأشخاص المصابين بعدوى الملوية البوابية يصابون بسرطان المعدة في حياتهم مقارنة بنسبة 0.13 ٪ من الأفراد الذين لا يعانون من عدوى الملوية البوابية.[98][99] تنتشر عدوى الملوية البوابية بشكل كبير. كما تم تقييمه في عام 2002، فهي موجودة في أنسجة المعدة بنسبة 74 ٪ من البالغين في منتصف العمر في البلدان النامية و 58 ٪ في البلدان المتقدمة.[100] نظرًا لأن 1 ٪ إلى 3 ٪ من الأفراد المصابين من المحتمل أن يصابوا بسرطان المعدة،[101] سرطان المعدة الناجم عن الملوية البوابية هو ثالث أكبر سبب لوفيات السرطان في جميع أنحاء العالم اعتبارًا من عام 2018.[102]
لا تسبب العدوى بالملوية البوابية أي أعراض لدى حوالي 80٪ من المصابين.[103] حوالي 75٪ من المصابين بالملوية البوابية يصابون بالتهاب المعدة.[104] وبالتالي، فإن النتيجة المعتادة لعدوى الملوية البوابية هي التهاب المعدة المزمن بدون أعراض.[105] بسبب النقص المعتاد في الأعراض، عندما يتم تشخيص سرطان المعدة أخيرًا، غالبًا ما يكون متقدمًا إلى حد ما. يعاني أكثر من نصف مرضى سرطان المعدة من نقائل في العقدة الليمفاوية عندما يتم تشخيصهم في البداية.[106]
التهاب المعدة الناجم عن بكتيريا الملوية البوابية مصحوب بالتهاب يتميز بارتشاح العدلات وخلايا الدم البيضاء إلى ظهارة المعدة، مما يساعد على تراكم السيتوكينات المحرضة للالتهابات ومركبات الأكسجين التفاعلية / مركبات النيتروجين التفاعلية (ROS / RNS.[107] يتسبب الوجود الكبير لـ ROS / RNS في تلف الحمض النووي بما في ذلك (8-أوكسو-2'-ديوكسي گوانوزين) (8-OHdG).[107] إذا كانت عدوي الملوية البوابية المصابة تحمل الجين cagA السام للخلايا (الموجود في حوالي 60٪ من العزلات الغربية ونسبة أعلى من العزلات الآسيوية)، فيمكنهم زيادة مستوى 8-OHdG في خلايا المعدة بمقدار 8 أضعاف، بينما إذا كانت الملوية البوابية لا تحمل الجين cagA، فإن الزيادة في 8-OHdG حوالي 4 أضعاف.[108] بالإضافة إلى تلف الحمض النووي المؤكسد 8-OHdG، تسبب العدوى بالملوية البوابية أضرارًا مميزة أخرى للحمض النووي بما في ذلك فواصل الحمض النووي ذو الطاقين.[109]
تسبب الملوية البوابية أيضًا العديد من التغيرات التخلقية المرتبطة بتطور السرطان.[110][111]هذه التغيرات التخلقية هي بسبب الملوية البوابية-المحفزة لمثيلة مواقع CpG لمحفزات الجينات[110]والملوية البوابية -المحفزة لتغير التعبير عن أحماض ريبوزية نووية ميكروية متعددة.[111]
كما راجعت من قبل سانتوس وريبيرو[112] ترتبط عدوى الملوية البوابية بكفاءة منخفضة تخلقياً لآلية ترميم الحمض النووي، والتي تفضل تراكم الطفرات وعدم الاستقرار الجيني بالإضافة إلى التسرطن المعدي. على وجه الخصوص، رازا وأخرون.[113] أظهروا أن التعبير عن اثنين من پروتينات ترميم الحمض النووي، ERCC1 و PMS2، قد انخفض بشدة بمجرد أن تتطور عدوى الملوية البوابية لتسبب عسر الهضم. يحدث عسر الهضم في حوالي 20٪ من المصابين.[114] بالإضافة إلى ذلك، كما راجع رازا وآخرون.،[113]تسبب العدوى المعوية البشرية بالبكتيريا الملوية البوابية انخفاضًا تخلقياً في التعبير الپروتيني لپروتينات ترميم الحمض النووي MLH1 و MGMT و MRE11. يؤدي انخفاض ترميم الحمض النووي في وجود تلف متزايد في الحمض النووي إلى زيادة الطفرات المسرطنة ومن المحتمل أن يكون سببًا مهمًا لتسرطن الملوية البوابية.
الڤيروس
علاوة على ذلك، فإن العديد من السرطانات تنشأ من عدوى ڤيروسية. هذا صحيح بشكل خاص في الحيوانات مثل الطيور، لكنه أقل صحة عند البشر. 12٪ من السرطانات البشرية يمكن أن تعزى إلى عدوى ڤيروسية.[115] يمكن تقسيم وضع الأورام المستحثة بالڤيروس إلى قسمين، يتحولان بشكل حاد أو يتحولان ببطء. في الڤيروسات المتحولة بشكل حاد، تحمل الجزيئات الڤيروسية جينًا يشفر جينًا ورميًا مفرط النشاط يسمى الجين الورمي الڤيروسي (v-onc)، وتتحول الخلية المصابة بمجرد التعبير عن الجين الورمي الڤيروسي. علي العكس، في الڤيروسات المتحولة ببطء، يتم إدخال جينوم الڤيروس، خاصة وأن إدخال الجينوم الڤيروسي هو جزء إلزامي من الڤيروسات القهقرية، بالقرب من طليعة الجين الورمي في جينوم العائل. يتسبب المحفز الڤيروسي أو عناصر تنظيم النسخ الأخرى، بدوره، في الإفراط في التعبير عن طليعة الجين الورمي ذلك، والذي بدوره يؤدي إلى تكاثر خلوي غير متحكم فيه. نظرًا لأن إدخال الجينوم الڤيروسي ليس خاصًا بطليعة بالجينات الورمية وفرصة الإدخال بالقرب من طليعة الجين الورمي ذلك منخفضة، فإن الڤيروسات المتحولة ببطء لها زمن انتقال طويل جدًا للورم مقارنة بالڤيروس المتحول بشكل حاد، والذي يحمل بالفعل الجين الورمي الڤيروسي.
الڤيروسات المعروفة بأنها تسبب السرطان مثل ڤيروس الورم الحليمي البشري ( سرطان عنق الرحم ) والتهاب الكبد الڤيروسي ب ( سرطان الكبد ) و ڤيروس إپستاين-بار (نوع من اللمفوما )، كلها ڤيروسات الدنا. يُعتقد أنه عندما يصيب الڤيروس خلية، فإنه يُدخل جزءًا من الحمض النووي الخاص به بالقرب من جينات نمو الخلية، مما يتسبب في انقسام الخلية. مجموعة الخلايا المتغيرة التي تشكلت من الخلية الأولى المنقسمة جميعها لها نفس الحمض النووي الڤيروسي بالقرب من جينات نمو الخلية. أصبحت مجموعة الخلايا المتغيرة خاصة الآن لأن أحد عناصر التحكم الطبيعية في النمو قد فقد.
اعتمادًا على موقعها، يمكن أن تتلف الخلايا من خلال الإشعاع والمواد الكيميائية من دخان السجائر والالتهابات من العدوى البكتيرية أو الڤيروسات الأخرى. كل خلية لديها فرصة للضرر. غالبًا ما تموت الخلايا في حالة تلفها، بسبب فشل عملية حيوية أو في جهاز المناعة، ومع ذلك، في بعض الأحيان، يؤدي التلف إلى القضاء على جين سرطاني واحد. يوجد لدى الشخص العجوز الآلاف أو عشرات الآلاف أو مئات الآلاف من الخلايا التي تم القضاء عليها. إن فرصة إصابة أي شخص بالسرطان منخفضة للغاية.[بحاجة لمصدر]
عندما يحدث الضرر في أي منطقة من الخلايا المتغيرة، يحدث شيء مختلف. كل خلية لديها القدرة على النمو. سوف تنقسم الخلايا المتغيرة بشكل أسرع عندما تتضرر المنطقة بسبب العوامل الفيزيائية أو الكيميائية أو الڤيروسية. تم تكون دائرة معيبة : سيؤدي إتلاف المنطقة إلى انقسام الخلايا المتغيرة، مما يزيد من احتمال تعرضها للضربات القاضية.
هذا النموذج من التسرطن شائع لأنه يفسر سبب نمو السرطانات. من المتوقع أن تموت الخلايا التي تضررت من خلال الإشعاع أو على الأقل تكون أسوأ حالًا لأن لديها عددًا أقل من الجينات العاملة ؛ تزيد الڤيروسات من عدد الجينات العاملة.
أحد الأفكار هو أننا قد ينتهي بنا الأمر بآلاف اللقاحات لمنع كل ڤيروس يمكن أن يغير خلايانا. يمكن أن يكون للڤيروسات تأثيرات مختلفة على أجزاء مختلفة من الجسم. قد يكون من الممكن منع عدد من أنواع السرطان المختلفة عن طريق التحصين ضد عامل ڤيروسي واحد. من المحتمل أن يكون لڤيروس الورم الحليمي البشري، على سبيل المثال، دور في سرطانات الأغشية المخاطية للفم.
الديدان الطفيلية
من المعروف أن بعض الديدان الطفيلية تسبب السرطان.[116] وهذا يشمل::
- متفرع الخصية الصيني (الكائن الحي الذي يسبب داء متفرعات الخصية ) و متأخر الخصية الزبادي (يسبب داء متأخرات الخصية) يرتبط مع سرطان الأوعية الصفراوية.[117]
- ترتبط فصائل البلهارسيا (الكائنات الحية المسببة لداء البلهارسيات ) بسرطان المثانة.
علم التخلق
علم التخلق هو دراسة تنظيم التعبير الجيني من خلال التغيرات الكيميائية غير الطفرية في بنية الحمض النووي. نظرية علم التخلق في التسبب في السرطان هي أن التغيرات غير الطفرية في الحمض النووي يمكن أن تؤدي إلى تغييرات في التعبير الجيني. عادة، تكون الجينات الورمية صامتة، على سبيل المثال، بسبب مثيلة الحمض النووي. يمكن أن يؤدي فقدان هذا المثيلة إلى التعبير الشاذ عن الجينات الورمية، مما يؤدي إلى التسبب في الإصابة بالسرطان. تشمل الآليات المعروفة للتغير التخلقي مثيلة الحمض النووي، والمثيلة أو الأستلة لپروتينات الهيستون المرتبطة بالحمض النووي الصبغي في مواقع محددة. يمكن لفئات الأدوية، المعروفة باسم مثبطات نازعة أستيل الهيستون ومثبطات ناقلة مثيلة الحمض النووي، إعادة تنظيم الإشارات التخلقية في الخلية السرطانية.
تشمل الطفرات التخلقية المثيلة أو إزالة ميثيل جزر CpG من مناطق محفز الجينات، مما يؤدي إلى قمع أو إلغاء قمع، على التوالي للتعبير الجيني.[118][119][120] يمكن أن تحدث الطفرات التخلقية أيضًا عن طريق الأستلة، أو المثيلة، أو الفسفرة أو أي تغييرات أخرى في الهيستونات، مما يؤدي إلى إنشاء كود هيستوني يقوم بقمع أو تنشيط التعبير الجيني، ويمكن أن تكون الطفرات التخلقية الهيستونية هذه عوامل تخلقية مهمة في السرطان.[121][122] بالإضافة إلى ذلك، يمكن أن تحدث الطفرات التخلقية السرطانية من خلال التغييرات في بنية الكروموسوم التي تسببها الپروتينات مثل HMGA2.[123] مصدر آخر من الطفرة التخلقية يرجع إلى زيادة أو نقص التعبير عن الدنا الميكروي (miRNAs). على سبيل المثال، يمكن أن يتسبب التعبير الإضافي عن miR-137 في تقليل تنظيم التعبير عن 491 جينًا، ويتم إسكات miR-137 بشكل متوالي في 32٪ من سرطانات القولون والمستقيم>[9]
الخلايا الجذعية للسرطان
تأتي طريقة جديدة للنظر في التسرطن من دمج أفكار علم الأحياء التطوري في علم الأورام. تقترح فرضية الخلايا الجذعية السرطانية أن الأنواع المختلفة من الخلايا في الورم الغير متجانس تنشأ من خلية واحدة تسمى الخلية الجذعية السرطانية. قد تنشأ الخلايا الجذعية السرطانية من تحويل الخلايا الجذعية البالغة أو الخلايا المتمايزة داخل الجسم. تستمر هذه الخلايا كمكوِّن فرعي للورم وتحتفظ بخصائص الخلايا الجذعية الرئيسية. أنها تؤدي إلى مجموعة متنوعة من الخلايا، قادرة على التجديد الذاتي والتحكم في الاستتباب.[124] علاوة على ذلك، فإن انتكاس السرطان وظهور نقائل يُعزى أيضًا إلى هذه الخلايا. لا تتعارض فرضية الخلايا الجذعية السرطانية مع المفاهيم السابقة للتسرطن. كانت فرضية الخلايا الجذعية السرطانية آلية مقترحة تساهم في عدم تجانس الورم.
تطور نسيلي
في حين ان التغيرات الوراثية و التخلقية في الجينات المثبطة للورم والجينات الورمية تغير سلوك الخلايا، تلك التعديلات، في نهاية المطاف، تؤدي إلى السرطان من خلال آثارها على مجموعة من الخلايا الورمية وبيئتما المكروية.[60] تتنافس الخلايا المطفرة في الأورام على المكان والموارد. وبالتالي، فإن النسيلة التي تحتوي على طفرة في الجين المثبط للورم أو الجين الورمي سوف تتوسع فقط في الورم إذا أعطت هذه الطفرة ميزة تنافسية على النسائل والخلايا الطبيعية في بيئتها المكروية.[125] وبالتالي، فإن عملية التسرطن هي رسميًا عملية تطور داروين، تُعرف بالتطور الجسدي أو النسيلي.[61] علاوة على ذلك، في ضوء الآليات الداروينية للتسرطن، فقد تم الافتراض بأن الأشكال المختلفة للسرطان يمكن تصنيفها إلى مرحلة البلوغ والشيخوخة. تُجرى الأبحاث الأنثروبولوجية حاليًا على السرطان كعملية تطورية طبيعية تدمر الانتخاب الطبيعي من خلالها الأنماط الظاهرية المتدنية بيئيًا بينما يدعم الآخرين. وفقًا لهذه النظرية، يأتي السرطان في نوعين منفصلين: من الولادة إلى نهاية سن البلوغ (حوالي 20 عامًا) يميل غائيًا نحو ديناميكيات المجموعة الداعمة، ومن منتصف العمر حتى الموت (حوالي 40 عامًا) يميل غائيًا بعيدًا عن ديناميات المجموعة المكتظة بالسكان.[بحاجة لمصدر]
انظر أيضاً
المصادر
- ^ Tomasetti C, Li L, Vogelstein B (23 March 2017). "Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention". Science. 355 (6331): 1330–1334. Bibcode:2017Sci...355.1330T. doi:10.1126/science.aaf9011. PMC 5852673. PMID 28336671.
- ^ أ ب Wood LD, Parsons DW, Jones S, Lin J, Sjöblom T, Leary RJ, et al. (November 2007). "The genomic landscapes of human breast and colorectal cancers". Science. 318 (5853): 1108–13. Bibcode:2007Sci...318.1108W. CiteSeerX 10.1.1.218.5477. doi:10.1126/science.1145720. PMID 17932254. S2CID 7586573.
- ^ أ ب Knudson AG (November 2001). "Two genetic hits (more or less) to cancer". Nature Reviews. Cancer. 1 (2): 157–62. doi:10.1038/35101031. PMID 11905807. S2CID 20201610.
- ^ Fearon ER, Vogelstein B (June 1990). "A genetic model for colorectal tumorigenesis". Cell. 61 (5): 759–67. doi:10.1016/0092-8674(90)90186-I. PMID 2188735. S2CID 22975880.
- ^ أ ب ت Belikov AV (September 2017). "The number of key carcinogenic events can be predicted from cancer incidence". Scientific Reports. 7 (1): 12170. Bibcode:2017NatSR...712170B. doi:10.1038/s41598-017-12448-7. PMC 5610194. PMID 28939880.
- ^ Belikov AV, Vyatkin A, Leonov SV (2021-08-06). "The Erlang distribution approximates the age distribution of incidence of childhood and young adulthood cancers". PeerJ. 9: e11976. doi:10.7717/peerj.11976. PMC 8351573. PMID 34434669.
- ^ Croce CM (January 2008). "Oncogenes and cancer". The New England Journal of Medicine. 358 (5): 502–11. doi:10.1056/NEJMra072367. PMID 18234754.
- ^ Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, Bartel DP, Linsley PS, Johnson JM (February 2005). "Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs". Nature. 433 (7027): 769–73. Bibcode:2005Natur.433..769L. doi:10.1038/nature03315. PMID 15685193. S2CID 4430576.
- ^ أ ب Balaguer F, Link A, Lozano JJ, Cuatrecasas M, Nagasaka T, Boland CR, Goel A (August 2010). "Epigenetic silencing of miR-137 is an early event in colorectal carcinogenesis". Cancer Research. 70 (16): 6609–18. doi:10.1158/0008-5472.CAN-10-0622. PMC 2922409. PMID 20682795.
- ^ Kastan MB (April 2008). "DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture". Molecular Cancer Research. 6 (4): 517–24. doi:10.1158/1541-7786.MCR-08-0020. PMID 18403632.
- ^ أ ب Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (November 2011). "A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants". Food and Chemical Toxicology. 49 (11): 2921–33. doi:10.1016/j.fct.2011.07.019. PMID 21802474.
- ^ Kanavy HE, Gerstenblith MR (December 2011). "Ultraviolet radiation and melanoma". Seminars in Cutaneous Medicine and Surgery. 30 (4): 222–8. doi:10.1016/j.sder.2011.08.003. PMID 22123420.
- ^ Handa O, Naito Y, Yoshikawa T (2011). "Redox biology and gastric carcinogenesis: the role of Helicobacter pylori". Redox Report. 16 (1): 1–7. doi:10.1179/174329211X12968219310756. PMC 6837368. PMID 21605492.
- ^ Smela ME, Hamm ML, Henderson PT, Harris CM, Harris TM, Essigmann JM (May 2002). "The aflatoxin B(1) formamidopyrimidine adduct plays a major role in causing the types of mutations observed in human hepatocellular carcinoma". Proceedings of the National Academy of Sciences of the United States of America. 99 (10): 6655–60. Bibcode:2002PNAS...99.6655S. doi:10.1073/pnas.102167699. PMC 124458. PMID 12011430.
- ^ Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (January 2012). "Early-stage formation of an epigenetic field defect in a mouse colitis model, and non-essential roles of T- and B-cells in DNA methylation induction". Oncogene. 31 (3): 342–51. doi:10.1038/onc.2011.241. PMID 21685942.
- ^ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (August 2011). "Carcinogenicity of deoxycholate, a secondary bile acid". Archives of Toxicology. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ^ Malkin D (April 2011). "Li-fraumeni syndrome". Genes & Cancer. 2 (4): 475–84. doi:10.1177/1947601911413466. PMC 3135649. PMID 21779515.
- ^ Fearon ER (November 1997). "Human cancer syndromes: clues to the origin and nature of cancer". Science. 278 (5340): 1043–50. Bibcode:1997Sci...278.1043F. doi:10.1126/science.278.5340.1043. PMID 9353177.
- ^ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (July 2000). "Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland". The New England Journal of Medicine. 343 (2): 78–85. doi:10.1056/NEJM200007133430201. PMID 10891514.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (June 2005). "O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions". Gut. 54 (6): 797–802. doi:10.1136/gut.2004.059535. PMC 1774551. PMID 15888787.
- ^ أ ب Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (April 1997). "Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2". Proceedings of the National Academy of Sciences of the United States of America. 94 (7): 3122–7. Bibcode:1997PNAS...94.3122N. doi:10.1073/pnas.94.7.3122. PMC 20332. PMID 9096356.
- ^ أ ب Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (December 2006). "Differing patterns of genetic instability in mice deficient in the mismatch repair genes Pms2, Mlh1, Msh2, Msh3 and Msh6". Carcinogenesis. 27 (12): 2402–8. doi:10.1093/carcin/bgl079. PMC 2612936. PMID 16728433.
- ^ أ ب Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (March 2002). "Disruption of Brca2 increases the spontaneous mutation rate in vivo: synergism with ionizing radiation". EMBO Reports. 3 (3): 255–60. doi:10.1093/embo-reports/kvf037. PMC 1084010. PMID 11850397.
- ^ German J (March 1969). "Bloom's syndrome. I. Genetical and clinical observations in the first twenty-seven patients". American Journal of Human Genetics. 21 (2): 196–227. PMC 1706430. PMID 5770175.
- ^ O'Hagan HM, Mohammad HP, Baylin SB (August 2008). Lee JT (ed.). "Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island". PLOS Genetics. 4 (8): e1000155. doi:10.1371/journal.pgen.1000155. PMC 2491723. PMID 18704159.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (July 2007). "DNA damage, homology-directed repair, and DNA methylation". PLOS Genetics. 3 (7): e110. doi:10.1371/journal.pgen.0030110. PMC 1913100. PMID 17616978.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Villeneuve PJ, Mao Y (November 1994). "Lifetime probability of developing lung cancer, by smoking status, Canada". Canadian Journal of Public Health. 85 (6): 385–8. PMID 7895211.
- ^ Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, et al. (March 2012). "Intratumor heterogeneity and branched evolution revealed by multiregion sequencing". The New England Journal of Medicine. 366 (10): 883–92. doi:10.1056/NEJMoa1113205. PMC 4878653. PMID 22397650.
- ^ أ ب López-Lázaro M (August 2015). "Stem cell division theory of cancer". Cell Cycle. 14 (16): 2547–8. doi:10.1080/15384101.2015.1062330. PMC 5242319. PMID 26090957.
- ^ أ ب ت López-Lázaro M (May 2015). "The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis". Oncoscience. 2 (5): 467–75. doi:10.18632/oncoscience.159. PMC 4468332. PMID 26097879.
- ^ Tomasetti C, Vogelstein B (January 2015). "Cancer etiology. Variation in cancer risk among tissues can be explained by the number of stem cell divisions". Science. 347 (6217): 78–81. doi:10.1126/science.1260825. PMC 4446723. PMID 25554788.
- ^ Slaughter DP, Southwick HW, Smejkal W (September 1953). "Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin". Cancer. 6 (5): 963–8. doi:10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q. PMID 13094644.
- ^ Bernstein C, Bernstein H, Payne CM, Dvorak K, Garewal H (February 2008). "Field defects in progression to gastrointestinal tract cancers". review. Cancer Letters. 260 (1–2): 1–10. doi:10.1016/j.canlet.2007.11.027. PMC 2744582. PMID 18164807.
- ^ Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (2010). "Deficient Pms2, ERCC1, Ku86, CcOI in field defects during progression to colon cancer". Journal of Visualized Experiments (41): 1931. doi:10.3791/1931. PMC 3149991. PMID 20689513.
- ^ Rubin H (March 2011). "Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture". BioEssays. 33 (3): 224–31. doi:10.1002/bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (February 2000). "Genetic reconstruction of individual colorectal tumor histories". Proceedings of the National Academy of Sciences of the United States of America. 97 (3): 1236–41. Bibcode:2000PNAS...97.1236T. doi:10.1073/pnas.97.3.1236. PMC 15581. PMID 10655514.
- ^ أ ب ت Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (March 2013). "Cancer genome landscapes". review. Science. 339 (6127): 1546–58. Bibcode:2013Sci...339.1546V. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
- ^ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (September 2005). "MGMT promoter methylation and field defect in sporadic colorectal cancer". Journal of the National Cancer Institute. 97 (18): 1330–8. doi:10.1093/jnci/dji275. PMID 16174854.
- ^ أ ب Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (October 2011). "Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence". Langenbeck's Archives of Surgery. 396 (7): 1017–26. doi:10.1007/s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, et al. (November 2010). "Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers". Gut. 59 (11): 1516–26. doi:10.1136/gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ أ ب ت ث Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, Nfonsam V, Krouse RS, Bernstein H, Payne CM, Stern S, Oatman N, Banerjee B, Bernstein C (April 2012). "Deficient expression of DNA repair enzymes in early progression to sporadic colon cancer". Genome Integrity. 3 (1): 3. doi:10.1186/2041-9414-3-3. PMC 3351028. PMID 22494821.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (February 2011). "Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa". Oral Oncology. 47 (2): 104–7. doi:10.1016/j.oraloncology.2010.11.006. PMID 21147548.
- ^ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (October 2009). "Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma". Otolaryngology–Head and Neck Surgery. 141 (4): 484–90. doi:10.1016/j.otohns.2009.07.007. PMID 19786217. S2CID 8357370.
- ^ Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). "Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene". American Journal of Otolaryngology. 32 (6): 528–36. doi:10.1016/j.amjoto.2010.11.005. PMID 21353335.
- ^ Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (November 2009). "Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions". Human Pathology. 40 (11): 1534–42. doi:10.1016/j.humpath.2009.01.029. PMID 19695681.
- ^ Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). "Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley" (PDF). Asian Pacific Journal of Cancer Prevention. 13 (8): 4177–81. doi:10.7314/APJCP.2012.13.8.4177. PMID 23098428.
- ^ Agarwal A, Polineni R, Hussein Z, Vigoda I, Bhagat TD, Bhattacharyya S, Maitra A, Verma A (2012). "Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma". International Journal of Clinical and Experimental Pathology. 5 (5): 382–96. PMC 3396065. PMID 22808291. Review.
- ^ Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T, Larsen S, Osnes M (September 1996). "Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years". Gut. 39 (3): 449–56. doi:10.1136/gut.39.3.449. PMC 1383355. PMID 8949653.
- ^ Schmitt MW, Prindle MJ, Loeb LA (September 2012). "Implications of genetic heterogeneity in cancer". Annals of the New York Academy of Sciences. 1267 (1): 110–6. Bibcode:2012NYASA1267..110S. doi:10.1111/j.1749-6632.2012.06590.x. PMC 3674777. PMID 22954224.
- ^ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. (February 2001). "Initial sequencing and analysis of the human genome". Nature. 409 (6822): 860–921. Bibcode:2001Natur.409..860L. doi:10.1038/35057062. PMID 11237011.
- ^ Yost SE, Smith EN, Schwab RB, Bao L, Jung H, Wang X, Voest E, Pierce JP, Messer K, Parker BA, Harismendy O, Frazer KA (August 2012). "Identification of high-confidence somatic mutations in whole genome sequence of formalin-fixed breast cancer specimens". Nucleic Acids Research. 40 (14): e107. doi:10.1093/nar/gks299. PMC 3413110. PMID 22492626.
- ^ Berger MF, Hodis E, Heffernan TP, Deribe YL, Lawrence MS, Protopopov A, et al. (May 2012). "Melanoma genome sequencing reveals frequent PREX2 mutations". Nature. 485 (7399): 502–6. Bibcode:2012Natur.485..502B. doi:10.1038/nature11071. PMC 3367798. PMID 22622578.
- ^ Rasnick D, Duesberg PH (June 1999). "How aneuploidy affects metabolic control and causes cancer". The Biochemical Journal. 340 (3): 621–30. doi:10.1042/0264-6021:3400621. PMC 1220292. PMID 10359645.
- ^ أ ب ت López-Lázaro M (March 2010). "A new view of carcinogenesis and an alternative approach to cancer therapy". Molecular Medicine. 16 (3–4): 144–53. doi:10.2119/molmed.2009.00162. PMC 2802554. PMID 20062820.
- ^ Juutilainen J, Herrala M, Luukkonen J, Naarala J, Hore PJ (May 2018). "Magnetocarcinogenesis: is there a mechanism for carcinogenic effects of weak magnetic fields?". Proceedings. Biological Sciences. 285 (1879): 20180590. doi:10.1098/rspb.2018.0590. PMC 5998098. PMID 29794049.
- ^ Soto AM, Sonnenschein C (October 2004). "The somatic mutation theory of cancer: growing problems with the paradigm?". BioEssays. 26 (10): 1097–107. doi:10.1002/bies.20087. PMID 15382143.
- ^ Davies PC, Lineweaver CH (February 2011). "Cancer tumors as Metazoa 1.0: tapping genes of ancient ancestors". Physical Biology. 8 (1): 015001. Bibcode:2011PhBio...8a5001D. doi:10.1088/1478-3975/8/1/015001. PMC 3148211. PMID 21301065.
- ^ Dean, Tim. "Cancer resembles life 1 billion years ago, say astrobiologists", Australian Life Scientist, 8 February 2011. Retrieved 15 February 2011.
- ^ Sterrer, W (August 2016). "Cancer - Mutational Resurrection of Prokaryote Endofossils" (PDF). Cancer Hypotheses. 1 (1): 1–15.
- ^ أ ب Nowell PC (October 1976). "The clonal evolution of tumor cell populations". Science. 194 (4260): 23–8. Bibcode:1976Sci...194...23N. doi:10.1126/science.959840. PMID 959840.
- ^ أ ب Merlo LM, Pepper JW, Reid BJ, Maley CC (December 2006). "Cancer as an evolutionary and ecological process". Nature Reviews. Cancer. 6 (12): 924–35. doi:10.1038/nrc2013. PMID 17109012. S2CID 8040576.
- ^ Hanahan D, Weinberg RA (January 2000). "The hallmarks of cancer". Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9. PMID 10647931.
- ^ Cho RW, Clarke MF (February 2008). "Recent advances in cancer stem cells". Current Opinion in Genetics & Development. 18 (1): 48–53. doi:10.1016/j.gde.2008.01.017. PMID 18356041.
- ^ Taniguchi K, Wu LW, Grivennikov SI, de Jong PR, Lian I, Yu FX, Wang K, Ho SB, Boland BS, Chang JT, Sandborn WJ, Hardiman G, Raz E, Maehara Y, Yoshimura A, Zucman-Rossi J, Guan KL, Karin M (March 2015). "A gp130-Src-YAP module links inflammation to epithelial regeneration". Nature. 519 (7541): 57–62. Bibcode:2015Natur.519...57T. doi:10.1038/nature14228. PMC 4447318. PMID 25731159.
- ^ You H, Lei P, Andreadis ST (December 2013). "JNK is a novel regulator of intercellular adhesion". Tissue Barriers. 1 (5): e26845. doi:10.4161/tisb.26845. PMC 3942331. PMID 24868495.
- ^ Busillo JM, Azzam KM, Cidlowski JA (November 2011). "Glucocorticoids sensitize the innate immune system through regulation of the NLRP3 inflammasome". The Journal of Biological Chemistry. 286 (44): 38703–13. doi:10.1074/jbc.M111.275370. PMC 3207479. PMID 21940629.
- ^ Wang Y, Bugatti M, Ulland TK, Vermi W, Gilfillan S, Colonna M (March 2016). "Nonredundant roles of keratinocyte-derived IL-34 and neutrophil-derived CSF1 in Langerhans cell renewal in the steady state and during inflammation". European Journal of Immunology. 46 (3): 552–9. doi:10.1002/eji.201545917. PMC 5658206. PMID 26634935.
- ^ Siqueira Mietto B, Kroner A, Girolami EI, Santos-Nogueira E, Zhang J, David S (December 2015). "Role of IL-10 in Resolution of Inflammation and Functional Recovery after Peripheral Nerve Injury". The Journal of Neuroscience. 35 (50): 16431–42. doi:10.1523/JNEUROSCI.2119-15.2015. PMC 6605511. PMID 26674868.
- ^ Seifert AW, Maden M (2014). "New insights into vertebrate skin regeneration". International Review of Cell and Molecular Biology. Vol. 310. pp. 129–69. doi:10.1016/B978-0-12-800180-6.00004-9. ISBN 978-0-12-800180-6. PMID 24725426.
- ^ Kwon MJ, Shin HY, Cui Y, Kim H, Thi AH, Choi JY, Kim EY, Hwang DH, Kim BG (December 2015). "CCL2 Mediates Neuron-Macrophage Interactions to Drive Proregenerative Macrophage Activation Following Preconditioning Injury". The Journal of Neuroscience. 35 (48): 15934–47. doi:10.1523/JNEUROSCI.1924-15.2015. PMC 6605453. PMID 26631474.
- ^ Hajishengallis G, Chavakis T (January 2013). "Endogenous modulators of inflammatory cell recruitment". Trends in Immunology. 34 (1): 1–6. doi:10.1016/j.it.2012.08.003. PMC 3703146. PMID 22951309.
- ^ Nelson AM, Katseff AS, Ratliff TS, Garza LA (February 2016). "Interleukin 6 and STAT3 regulate p63 isoform expression in keratinocytes during regeneration". Experimental Dermatology. 25 (2): 155–7. doi:10.1111/exd.12896. PMC 4724264. PMID 26566817.
- ^ Vidal PM, Lemmens E, Dooley D, Hendrix S (February 2013). "The role of "anti-inflammatory" cytokines in axon regeneration". Cytokine & Growth Factor Reviews. 24 (1): 1–12. doi:10.1016/j.cytogfr.2012.08.008. PMID 22985997.
- ^ Hsueh YY, Chang YJ, Huang CW, Handayani F, Chiang YL, Fan SC, Ho CJ, Kuo YM, Yang SH, Chen YL, Lin SC, Huang CC, Wu CC (October 2015). "Synergy of endothelial and neural progenitor cells from adipose-derived stem cells to preserve neurovascular structures in rat hypoxic-ischemic brain injury". Scientific Reports. 5: 14985. Bibcode:2015NatSR...514985H. doi:10.1038/srep14985. PMC 4597209. PMID 26447335.
- ^ Yaniv M (September 2014). "Chromatin remodeling: from transcription to cancer". Cancer Genetics. 207 (9): 352–7. doi:10.1016/j.cancergen.2014.03.006. PMID 24825771.
- ^ Zhang X, He N, Gu D, Wickliffe J, Salazar J, Boldogh I, Xie J (October 2015). "Genetic Evidence for XPC-KRAS Interactions During Lung Cancer Development". Journal of Genetics and Genomics = Yi Chuan Xue Bao. 42 (10): 589–96. doi:10.1016/j.jgg.2015.09.006. PMC 4643398. PMID 26554912.
- ^ Dubois-Pot-Schneider H, Fekir K, Coulouarn C, Glaise D, Aninat C, Jarnouen K, Le Guével R, Kubo T, Ishida S, Morel F, Corlu A (December 2014). "Inflammatory cytokines promote the retrodifferentiation of tumor-derived hepatocyte-like cells to progenitor cells". Hepatology. 60 (6): 2077–90. doi:10.1002/hep.27353. PMID 25098666. S2CID 11182192.
- ^ Finkin S, Yuan D, Stein I, Taniguchi K, Weber A, Unger K, et al. (December 2015). "Ectopic lymphoid structures function as microniches for tumor progenitor cells in hepatocellular carcinoma". Nature Immunology. 16 (12): 1235–44. doi:10.1038/ni.3290. PMC 4653079. PMID 26502405.
- ^ Beane JE, Mazzilli SA, Campbell JD, Duclos G, Krysan K, Moy C, et al. (April 2019). "Molecular subtyping reveals immune alterations associated with progression of bronchial premalignant lesions". Nature Communications. 10 (1): 1856. Bibcode:2019NatCo..10.1856B. doi:10.1038/s41467-019-09834-2. PMC 6478943. PMID 31015447.
- ^ Maoz A, Merenstein C, Koga Y, Potter A, Gower AC, Liu G, et al. (September 2021). "Elevated T cell repertoire diversity is associated with progression of lung squamous cell premalignant lesions". Journal for Immunotherapy of Cancer. 9 (9): e002647. doi:10.1136/jitc-2021-002647. PMC 8477334. PMID 34580161.
- ^ أ ب Vlahopoulos SA, Cen O, Hengen N, Agan J, Moschovi M, Critselis E, Adamaki M, Bacopoulou F, Copland JA, Boldogh I, Karin M, Chrousos GP (August 2015). "Dynamic aberrant NF-κB spurs tumorigenesis: a new model encompassing the microenvironment". Cytokine & Growth Factor Reviews. 26 (4): 389–403. doi:10.1016/j.cytogfr.2015.06.001. PMC 4526340. PMID 26119834.
- ^ Grivennikov SI, Karin M (February 2010). "Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer". Cytokine & Growth Factor Reviews. 21 (1): 11–9. doi:10.1016/j.cytogfr.2009.11.005. PMC 2834864. PMID 20018552.
- ^ Rieger S, Zhao H, Martin P, Abe K, Lisse TS (January 2015). "The role of nuclear hormone receptors in cutaneous wound repair". Cell Biochemistry and Function. 33 (1): 1–13. doi:10.1002/cbf.3086. PMC 4357276. PMID 25529612.
- ^ Lu X, Yarbrough WG (February 2015). "Negative regulation of RelA phosphorylation: emerging players and their roles in cancer". Cytokine & Growth Factor Reviews. 26 (1): 7–13. doi:10.1016/j.cytogfr.2014.09.003. PMID 25438737.
- ^ Sionov RV, Fridlender ZG, Granot Z (December 2015). "The Multifaceted Roles Neutrophils Play in the Tumor Microenvironment". Cancer Microenvironment. 8 (3): 125–58. doi:10.1007/s12307-014-0147-5. PMC 4714999. PMID 24895166.
- ^ Venturi, Sebastiano (2011). "Evolutionary Significance of Iodine". Current Chemical Biology. 5 (3): 155–162. doi:10.2174/187231311796765012. ISSN 1872-3136.
- ^ Venturi S (2014). "Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective". Human Evolution. 29 (1–3): 185–205. ISSN 0393-9375.
- ^ Walsh CJ, Luer CA, Bodine AB, Smith CA, Cox HL, Noyes DR, Maura G (December 2006). "Elasmobranch immune cells as a source of novel tumor cell inhibitors: Implications for public health". Integrative and Comparative Biology. 46 (6): 1072–1081. doi:10.1093/icb/icl041. PMC 2664222. PMID 19343108.
- ^ Vogelstein B, Kinzler KW (August 2004). "Cancer genes and the pathways they control". Nature Medicine. 10 (8): 789–99. doi:10.1038/nm1087. PMID 15286780. S2CID 205383514.
- ^ Brand KA, Hermfisse U (April 1997). "Aerobic glycolysis by proliferating cells: a protective strategy against reactive oxygen species". FASEB Journal. 11 (5): 388–95. doi:10.1096/fasebj.11.5.9141507. PMID 9141507. S2CID 16745745.
- ^ Bos JL (September 1989). "ras oncogenes in human cancer: a review". Cancer Research. 49 (17): 4682–9. PMID 2547513.
- ^ Chang EH, Furth ME, Scolnick EM, Lowy DR (June 1982). "Tumorigenic transformation of mammalian cells induced by a normal human gene homologous to the oncogene of Harvey murine sarcoma virus". Nature. 297 (5866): 479–83. Bibcode:1982Natur.297..479C. doi:10.1038/297479a0. PMID 6283358. S2CID 4234621.
- ^ Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V (April 2008). "The role of ATF-2 in oncogenesis". BioEssays. 30 (4): 314–27. doi:10.1002/bies.20734. PMID 18348191. S2CID 678541.
- ^ Matoba S, Kang JG, Patino WD, Wragg A, Boehm M, Gavrilova O, Hurley PJ, Bunz F, Hwang PM (June 2006). "p53 regulates mitochondrial respiration". Science. 312 (5780): 1650–3. Bibcode:2006Sci...312.1650M. doi:10.1126/science.1126863. PMID 16728594. S2CID 36668814.
- ^ Knudson AG (April 1971). "Mutation and cancer: statistical study of retinoblastoma". Proceedings of the National Academy of Sciences of the United States of America. 68 (4): 820–3. Bibcode:1971PNAS...68..820K. doi:10.1073/pnas.68.4.820. PMC 389051. PMID 5279523.
- ^ Fodde R, Smits R (October 2002). "Cancer biology. A matter of dosage". Science. 298 (5594): 761–3. doi:10.1126/science.1077707. PMID 12399571. S2CID 50724.
- ^ Stephens PJ, Greenman CD, Fu B, Yang F, Bignell GR, Mudie LJ, et al. (January 2011). "Massive genomic rearrangement acquired in a single catastrophic event during cancer development". Cell. 144 (1): 27–40. doi:10.1016/j.cell.2010.11.055. PMC 3065307. PMID 21215367.
{{cite journal}}: Unknown parameter|lay-date=ignored (help); Unknown parameter|lay-source=ignored (help); Unknown parameter|lay-url=ignored (help) - ^ Kuipers EJ (March 1999). "Review article: exploring the link between Helicobacter pylori and gastric cancer". Alimentary Pharmacology & Therapeutics. 13 (Suppl 1): 3–11. doi:10.1046/j.1365-2036.1999.00002.x. PMID 10209681.
- ^ Kusters JG, van Vliet AH, Kuipers EJ (July 2006). "Pathogenesis of Helicobacter pylori infection". Clin. Microbiol. Rev. 19 (3): 449–90. doi:10.1128/CMR.00054-05. PMC 1539101. PMID 16847081.
- ^ Parkin DM (June 2006). "The global health burden of infection-associated cancers in the year 2002". Int. J. Cancer. 118 (12): 3030–44. doi:10.1002/ijc.21731. PMID 16404738.
- ^ Wroblewski LE, Peek RM, Wilson KT (October 2010). "Helicobacter pylori and gastric cancer: factors that modulate disease risk". Clin. Microbiol. Rev. 23 (4): 713–39. doi:10.1128/CMR.00011-10. PMC 2952980. PMID 20930071.
- ^ Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin DM, Piñeros M, Znaor A, Bray F (April 2019). "Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods". Int. J. Cancer. 144 (8): 1941–1953. doi:10.1002/ijc.31937. PMID 30350310.
- ^ Meurer LN, Bower DJ (April 2002). "Management of Helicobacter pylori infection". Am Fam Physician. 65 (7): 1327–36. PMID 11996414.
- ^ Prabhu SR, Ranganathan S, Amarapurkar DN (November 1994). "Helicobacter pylori in normal gastric mucosa". J Assoc Physicians India. 42 (11): 863–4. PMID 7868485.
- ^ White JR, Winter JA, Robinson K (2015). "Differential inflammatory response to Helicobacter pylori infection: etiology and clinical outcomes". J Inflamm Res. 8: 137–47. doi:10.2147/JIR.S64888. PMC 4540215. PMID 26316793.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Deng JY, Liang H (April 2014). "Clinical significance of lymph node metastasis in gastric cancer". World J. Gastroenterol. 20 (14): 3967–75. doi:10.3748/wjg.v20.i14.3967. PMC 3983452. PMID 24744586.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Valenzuela MA, Canales J, Corvalán AH, Quest AF (December 2015). "Helicobacter pylori-induced inflammation and epigenetic changes during gastric carcinogenesis". World J. Gastroenterol. 21 (45): 12742–56. doi:10.3748/wjg.v21.i45.12742. PMC 4671030. PMID 26668499.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Raza Y, Khan A, Farooqui A, Mubarak M, Facista A, Akhtar SS, Khan S, Kazi JI, Bernstein C, Kazmi SU (2014). "Oxidative DNA damage as a potential early biomarker of Helicobacter pylori associated carcinogenesis". Pathol. Oncol. Res. 20 (4): 839–46. doi:10.1007/s12253-014-9762-1. PMID 24664859. S2CID 18727504.
- ^ Koeppel M, Garcia-Alcalde F, Glowinski F, Schlaermann P, Meyer TF (June 2015). "Helicobacter pylori Infection Causes Characteristic DNA Damage Patterns in Human Cells". Cell Rep. 11 (11): 1703–13. doi:10.1016/j.celrep.2015.05.030. PMID 26074077.
- ^ أ ب Muhammad JS, Eladl MA, Khoder G (February 2019). "Helicobacter pylori-induced DNA Methylation as an Epigenetic Modulator of Gastric Cancer: Recent Outcomes and Future Direction". Pathogens. 8 (1): 23. doi:10.3390/pathogens8010023. PMC 6471032. PMID 30781778.
- ^ أ ب Noto JM, Peek RM (2011). "The role of microRNAs in Helicobacter pylori pathogenesis and gastric carcinogenesis". Front Cell Infect Microbiol. 1: 21. doi:10.3389/fcimb.2011.00021. PMC 3417373. PMID 22919587.
- ^ Santos JC, Ribeiro ML (August 2015). "Epigenetic regulation of DNA repair machinery in Helicobacter pylori-induced gastric carcinogenesis". World J. Gastroenterol. 21 (30): 9021–37. doi:10.3748/wjg.v21.i30.9021. PMC 4533035. PMID 26290630.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Raza Y, Ahmed A, Khan A, Chishti AA, Akhter SS, Mubarak M, Bernstein C, Zaitlin B, Kazmi SU (February 2020). "Helicobacter pylori severely reduces expression of DNA repair proteins PMS2 and ERCC1 in gastritis and gastric cancer". DNA Repair (Amst.). 89: 102836. doi:10.1016/j.dnarep.2020.102836. PMID 32143126.
- ^ Dore MP, Pes GM, Bassotti G, Usai-Satta P (2016). "Dyspepsia: When and How to Test for Helicobacter pylori Infection". Gastroenterol Res Pract. 2016: 8463614. doi:10.1155/2016/8463614. PMC 4864555. PMID 27239194.
- ^ Carrillo-Infante C, Abbadessa G, Bagella L, Giordano A (June 2007). "Viral infections as a cause of cancer (review)". International Journal of Oncology. 30 (6): 1521–8. doi:10.3892/ijo.30.6.1521. PMID 17487374.
- ^ Safdar A (2011). Management of Infections in Cancer Patients. Springer. p. 478. ISBN 978-1-60761-643-6.
- ^ Samaras V, Rafailidis PI, Mourtzoukou EG, Peppas G, Falagas ME (June 2010). "Chronic bacterial and parasitic infections and cancer: a review". Journal of Infection in Developing Countries. 4 (5): 267–81. doi:10.3855/jidc.819. PMID 20539059.
- ^ Daniel FI, Cherubini K, Yurgel LS, de Figueiredo MA, Salum FG (February 2011). "The role of epigenetic transcription repression and DNA methyltransferases in cancer". Cancer. 117 (4): 677–87. doi:10.1002/cncr.25482. PMID 20945317. Review.
- ^ Kanwal R, Gupta S (April 2012). "Epigenetic modifications in cancer". Clinical Genetics. 81 (4): 303–11. doi:10.1111/j.1399-0004.2011.01809.x. PMC 3590802. PMID 22082348.
- ^ Pattani KM, Soudry E, Glazer CA, Ochs MF, Wang H, Schussel J, Sun W, Hennessey P, Mydlarz W, Loyo M, Demokan S, Smith IM, Califano JA (2012). Tao Q (ed.). "MAGEB2 is activated by promoter demethylation in head and neck squamous cell carcinoma". PLOS ONE. 7 (9): e45534. Bibcode:2012PLoSO...745534P. doi:10.1371/journal.pone.0045534. PMC 3454438. PMID 23029077.
- ^ Sampath D, Liu C, Vasan K, Sulda M, Puduvalli VK, Wierda WG, Keating MJ (February 2012). "Histone deacetylases mediate the silencing of miR-15a, miR-16, and miR-29b in chronic lymphocytic leukemia". Blood. 119 (5): 1162–72. doi:10.1182/blood-2011-05-351510. PMC 3277352. PMID 22096249.
- ^ Hitchler MJ, Oberley LW, Domann FE (December 2008). "Epigenetic silencing of SOD2 by histone modifications in human breast cancer cells". Free Radical Biology & Medicine. 45 (11): 1573–80. doi:10.1016/j.freeradbiomed.2008.09.005. PMC 2633123. PMID 18845242.
- ^ Baldassarre G, Battista S, Belletti B, Thakur S, Pentimalli F, Trapasso F, Fedele M, Pierantoni G, Croce CM, Fusco A (April 2003). "Negative regulation of BRCA1 gene expression by HMGA1 proteins accounts for the reduced BRCA1 protein levels in sporadic breast carcinoma". Molecular and Cellular Biology. 23 (7): 2225–38. doi:10.1128/MCB.23.7.2225-2238.2003. PMC 150734. PMID 12640109.
- ^ Dalerba P, Cho RW, Clarke MF (2007). "Cancer stem cells: models and concepts". Annual Review of Medicine. 58: 267–84. doi:10.1146/annurev.med.58.062105.204854. PMID 17002552.
- ^ Zhang W, Hanks AN, Boucher K, Florell SR, Allen SM, Alexander A, Brash DE, Grossman D (January 2005). "UVB-induced apoptosis drives clonal expansion during skin tumor development". Carcinogenesis. 26 (1): 249–57. doi:10.1093/carcin/bgh300. PMC 2292404. PMID 15498793.
قراءات إضافية
- Tokar EJ, Benbrahim-Tallaa L, Waalkes MP (2011). "Chepter 14. Metal Ions in Human Cancer Development". In Sigel A, Sigel H, Sigel RK (eds.). Metal ions in toxicology: effects, interactions, interdependencies. Metal Ions in Life Sciences. Vol. 8. RSC Publishing. pp. 375–401. doi:10.1039/9781849732116-00375. ISBN 978-1-84973-091-4.
- Dixon K, Kopras E (December 2004). "Genetic alterations and DNA repair in human carcinogenesis". Seminars in Cancer Biology. 14 (6): 441–8. doi:10.1016/j.semcancer.2004.06.007. PMID 15489137.
- Kleinsmith LJ (2006). Principles of cancer biology. San Francisco: Pearson Benjamin Cummings. ISBN 978-0-8053-4003-7.
- Sarasin A (November 2003). "An overview of the mechanisms of mutagenesis and carcinogenesis". Mutation Research. 544 (2–3): 99–106. doi:10.1016/j.mrrev.2003.06.024. PMID 14644312.
- Schottenfeld D, Beebe-Dimmer JL (2005). "Advances in cancer epidemiology: understanding causal mechanisms and the evidence for implementing interventions". Annual Review of Public Health. 26: 37–60. doi:10.1146/annurev.publhealth.26.021304.144402. PMID 15760280.
- Tannock I, Hill R, Bristow R, Harrington L (2005). The basic science of oncology (4th ed.). New York: McGraw-Hill. ISBN 978-0-07-138774-3.
- Wicha MS, Liu S, Dontu G (February 2006). "Cancer stem cells: an old idea--a paradigm shift". Cancer Research. 66 (4): 1883–90, discussion 1895–6. doi:10.1158/0008-5472.CAN-05-3153. PMID 16488983.
- CS1 maint: unflagged free DOI
- CS1 errors: unsupported parameter
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from December 2017
- Articles with unsourced statements from August 2012
- تسرطن
- الآثار الصحية للإشعاع
- مسرطنات