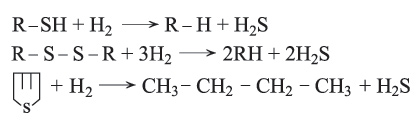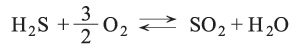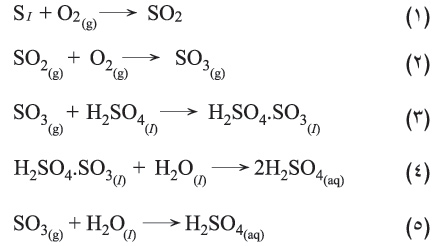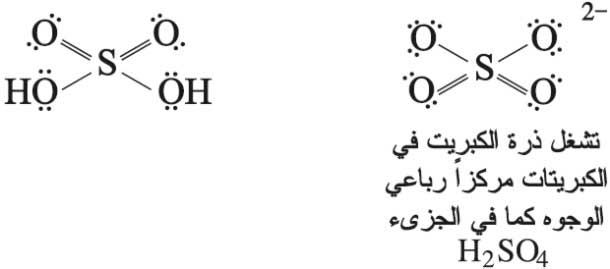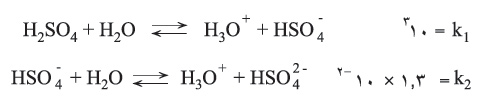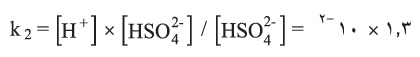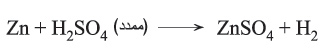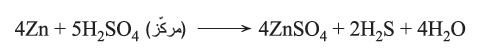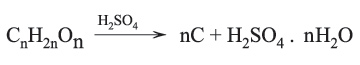كبريت
| |||||||||||||||||||||||||||||||||||||
| صفات عامة | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الإسم, الرقم, الرمز | كبريت, S, 16 | ||||||||||||||||||||||||||||||||||||
| سلاسل كيميائية | لا فلز | ||||||||||||||||||||||||||||||||||||
| المجموعة, الدورة, المستوى الفرعي | p , 3 , 16 | ||||||||||||||||||||||||||||||||||||
| المظهر | أصفر ليموني 
| ||||||||||||||||||||||||||||||||||||
| كتلة ذرية | 32.065(5) g/mol | ||||||||||||||||||||||||||||||||||||
| شكل إلكتروني | [Ne] 3s2 3p4 | ||||||||||||||||||||||||||||||||||||
| عدد الإلكترونات لكل مستوى | 2, 8, 6 | ||||||||||||||||||||||||||||||||||||
| خواص فيزيائية | |||||||||||||||||||||||||||||||||||||
| الحالة | solid | ||||||||||||||||||||||||||||||||||||
| كثافة عندح.غ. | (alpha) 2.07 ج/سم³ | ||||||||||||||||||||||||||||||||||||
| كثافة عندح.غ. | (beta) 1.96 ج/سم³ | ||||||||||||||||||||||||||||||||||||
| كثافة عندح.غ. | (gamma) 1.92 ج/سم³ | ||||||||||||||||||||||||||||||||||||
| كثافة السائل عند m.p. | 1.819 ج/سم³ | ||||||||||||||||||||||||||||||||||||
| نقطة الإنصهار | 388.36 ك 115.21 م ° 239.38 ف ° | ||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 717.8 ك 444.6 م ° 832.3 ف ° | ||||||||||||||||||||||||||||||||||||
| النقطة حرجة | 1314 K, 20.7 MPa | ||||||||||||||||||||||||||||||||||||
| حرارة الإنصهار | kJ/mol (mono) 1.727 | ||||||||||||||||||||||||||||||||||||
| حرارة التبخر | kJ/mol (mono) 45 | ||||||||||||||||||||||||||||||||||||
| السعة الحرارية | (25 22.75 C (م) ° ( J/(mol·K | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||||||||||
| البنية البللورية | orthorhombic | ||||||||||||||||||||||||||||||||||||
| حالة التأكسد | −1, ±2, 4, 6 (أكسيد شديد الحامضية) | ||||||||||||||||||||||||||||||||||||
| سالبية كهربية | 2.58 (مقياس باولنج) | ||||||||||||||||||||||||||||||||||||
| طاقة التأين (المزيد) |
1st: 999.6 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2nd: 2252 kJ/mol | |||||||||||||||||||||||||||||||||||||
| 3rd: 3357 kJ/mol | |||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 100 pm | ||||||||||||||||||||||||||||||||||||
| نصف قطر ذري (حسابيا) | 88 pm | ||||||||||||||||||||||||||||||||||||
| نصف القطر التساهمي | 102 pm | ||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فال | 180 pm | ||||||||||||||||||||||||||||||||||||
| متفرقة | |||||||||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | no data | ||||||||||||||||||||||||||||||||||||
| مقاومة كهربية | 20 °C (amorphous) 2×1015 Ω·m | ||||||||||||||||||||||||||||||||||||
| توصيل حراري | (300 K ك ) (amorphous) 0.205 (W/(m·K) | ||||||||||||||||||||||||||||||||||||
| معاير الحجم | 7.7 GPa | ||||||||||||||||||||||||||||||||||||
| صلابة موس | 2.0 | ||||||||||||||||||||||||||||||||||||
| رقم التسجيل | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| النظائر المهمة | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| المراجع | |||||||||||||||||||||||||||||||||||||
الكبريت هو عنصر لا فلزي ويوجد في الطبيعة بشكل خام ويدخل في صناعة البارود وعيدان الثقاب.
رمزه بالإنجليزية هو(S) وعدده الذري هو (16), ولون الكبريت أصفر, يوجد في النفط المستخرج وهو النفط الحامضي الحاوي على غاز H2S وللأستفادة من هذا النفط في التصدير أو المصافي يستوجب التخلص من هذا الغاز وبالتالي يمكن استخراج الكبريت من هذا الغاز ويكون على شكلين أما على شكل كتل وبودرة صفراء اللون أو على شكل شرائح صفراء اللون.
يستخدم الكبريت في كثير من الصناعات الكيميائية ومن أهم المنتجات حمض الكبريتيك H2SO4.
الكبريت معروف منذ العصرين الروماني واليوناني، وقد ذكره الشاعر الإغريقي القديم هوميروس في منتصف القرن التاسع قبل الميلاد. وقد استُخدم في الصين وفي مصر لتبييض الأنسجة، وللمحافظة على اللحوم عن طريق تدخينها. كان لاڤوازييه Lavoisier مابين (1743-1794) أول من تكهن خصائص الكبريت عنصراً، ولكن البرهان على ذلك تم من قبل گي لوساك Gay-Lussac ما بين (1778-1850) وتينار Thénard ما بين (1777-1857).
الكبريت عنصر كيميائي لا فلزي أصفر اللّون يوجد في كثير من أنحاء العالم، ورمزه الكيميائي (S). وقد استُخدِم لعدّة أغراض لمئات السنين. فقد استخدمه قدماء الإغريق والرومان منظفًا ومبيضًا ودواءً. واتضحت أهميته مؤخرًا كواحد من المكونات الرئيسية للبارود. ويستخدم الكبريت اليوم في منتجات متنوعة، وفي العمليات الصناعية.
درجة انصهار الكبريت 115 ْس، ودرجة غليانه (الشكل b) ت 444.67 ْس، أعداد أكسدته الأكثر شيوعاً - 2، 4، 6. كتلته الحجمية 2.07غ/سم3، نصف قطر الذرة 103.5 بيكومتر. الكهرسلبية (مقياس بولنغ) 2.56، نصف قطر الأيونS2- ت1.70بيكومتر، الترتيب الإلكتروني [Ne]3s23p4. و[Ne] هي البنية الإلكترونية للغاز الخامل النيون. طاقة التأين الأولى (كيلوجول/مول) تساوي 1003، الكمون القياسي ملف:8506-18.jpg يساوي 0.48 فلط، القساوة 2 موس mohs. والكبريت عازل كهربائياً. وأهم استعمالاته استحصال حمض الكبريت.
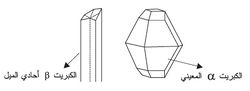
للكبريت - كما لكل من عناصر الفصيلة VI - أشكال متآصلة عدة. للكبريت الصلب شكلان بلوريان α وβ (الشكل-2أ). الشكل α ثابت عند درجة حرارة الغرفة وبلوراته معينية rhombic. أما فوق الدرجة 95.5 ْْس فالكبريت β هو الثابت وبلوراته أحادية الميل monoclinic.
إن تحول الكبريت المعيني إلى أحادي الميل بطيء؛ لذا يمكن الحفاظ على الشكل المعيني حتى درجة انصهاره (112.8 ْس). وهناك نوع بلوري ثالث للكبريت غير ثابت يحصل عليه بإضافة حمض كلور الماء المركز إلى ثيوكبريتات الصوديوم عند درجة الصفر المئوي (سلسيوس) ثم استخلاصه بوساطة التلوين وبلورته. وإذا صُبَّ الكبريت المصهور الساخن (فوق الدرجة160 ْس) في الماء يتكوَّن كبريت لدن لابلوري بلون أصفر بني. وإذا ترك الكبريت اللدن يبرد فإنه يتصلب ويصبح مؤلفاً من شكلين صلبين للكبريت Sα وSμ والشكل Sμ لا بلوري. وأشكال الكبريت جميعها لامعدنية في خواصها.
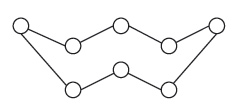
جزيء الكبريت بالدرجات العادية من الحرارة ثماني الذرة (S8)وله الشكل الحلقي (الشكل-2ب). وعندما ينصهر الكبريت يكون مؤلفاً من جزيئات S8، أما عندما تبلغ درجة الحرارة 159 ْس يطرأ عليه تحول مفاجئ إذ تزداد حرارته النوعية ازدياداً كبيراً وتزداد لزوجته (0.1 بواز عند الدرجة 159 ْس) فتصبح 200 بواز بدرجة 166 ْس. هذه التحولات تطرأ على الكبريت نتيجة لتحول بعض الجزيئات S8 إلى سلاسل مؤلفة من متماثرات (بولميرات) polymers عالية. وعندما يبدأ الكبريت بالغليان يكون بخاره مؤلفاً من جزيئات S8. وبارتفاع درجة الحرارة تتفكك الجزيئات إلى جزيئات أبسط S2,S4,S6 (الشكل-3).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الكبريت في الطبيعة
يشكل الكبريت نحو 0.048% من الغلاف الصخري لقشرة الكرة الأرضية وبهذا يأتي ترتيبه في المرتبة الخامسة عشرة بين عناصر الجدول الدوري. يوجد الكبريت حراً (الشكل-1) في الطبيعة وفي العديد من خامات الكبريتيدات والكبريتات مثل البيريت FeS2 وكبريتيد الرصاص PbS وكبريتيد الزنك (التوتياء) ZnS و الشالكوبيريت CuFeS2 وكبريتات الكالسيوم وكبريتات الباريوم والسترونسيوم. ويوجد أيضاً في الغاز الطبيعي بشكل كبريتيد الهدروجين، وفي النفط بشكل حر أو بشكل مركبات كبريتيدية.
ويوجد الكبريت بمفرده في الطبيعة، وفي الفحم الحجري، والزيت الخام والغاز الطبيعي وصخر الزيت، وفي كثير من المواد المعدنية.
وأكثر المواد المعدنية الكبريتية وجودًا هو مركب الكبريت والحديد الذي يسمى البيريت. ويحتوي الغلاف الجوي للزهرة (فينوس) على الكبريت. ويعتقد بعض العلماء أن جوف المريخ يتألف من كبريتيد الحديد النقي، وهو مركب آخر من الحديد والكبريت. وقد وجد الفلكيون مركبات الكبريت في السحب الواقعة بين النجوم وفي النيازك.
وتحتاج كل النباتات والحيوانات إلى كميات ضئيلة من الكبريت لتبقى على قيد الحياة، وتتحصل النباتات عليه من التربة. وكثير من الأطعمة النباتية ومن بينها الكرنب (الملفوف)، والبصل، وطحين الصويا، أطعمة غنية بالكبريت. كما يحتوي المثيونين ـ وهو حمض أميني يحتاجه الإنسان في غذائه ـ على الكبريت أيضًا. ويوجد الكبريت في بعض الأطعمة مثل البيض ومنتجات الألبان واللحوم.
الاستخدامات
كل الكبريت المُستخرج حاليًّا يستخدم في تحضير حمض الكبريتيك، وهو مركب كبريتي، ويُعد أهم مادة كيميائية تجارية في العالم. ويستخدم في إنتاج الأصباغ والدهانات (الطلاء)، والورق والمنسوجات وعدد من الكيميائيات الصناعية. كما يُستخدم أيضًا في إنتاج الفلزات وفي تكرير النفط.
أما المنتجات الأخرى المحتوية على الكبريت، فتشمل بعض أنواع الأسمدة، والمتفجرات ومبيدات الفطر والحشرات، والمطاط، والشامبو، والبطاريات (المراكم) وكذلك المواد الكيميائية المستخدمة في أفلام التصوير. كما يدخل الكبريت في صناعة الأدوية كواحد من المكونات. ويمكن استخدامه في إنشاء الطرق بدلاً من الأسفلت.
الخواص
الكبريت لاطعم له ولارائحة، ووزنه الذري 32,064، وعدده الذري 16. وينصهر عند درجة 120°م إذا سخن تدريجيًا، أمّا إذا سخن بسرعة فينصهر عند درجة 113°م. ويغلي عند درجة 444,6°م، وعند درجات حرارية أعلى من 150°م يصير غليظًا ولزجًا. ويصير أكثر سيولة مرة أخرى بعد أن تصل درجة الحرارة إلى أعلى من 250°م ويتغير لونه من الأصفر إلى الأحمر. أما لونه عند الغليان فهو بني قاتم.
والكبريت عنصر متفاعل جدًا، ويشتعل في الهواء عند درجة 250°م. وباحتراقه يتحد مع الأكسجين ليكون ثاني أكسيد الكبريت، وهو غاز عديم اللّون يوجد بكثرة في الأماكن المكتظّة بالسكان. وقد اقترن هذا الغاز بأمراض التنفُّس وإتلاف المباني والأمطار الحمضيّة انظر: المطر الحمضي.
وأغلب كميّات هذا الغاز الموجودة في الهواء تنتج من احتراق الفحم الحجري المحتوي على الكبريت. وتحُدّ قوانين حماية البيئة في دول كثيرة من كميات الكبريت التي تفرز بوساطة منشآت الطاقة الحارقة للفحم الحجري.
ـ بلورة الكبريت من محلول ثنائي كبريتيد الكربون:
بعد إذابة الكبريت في كبريتيد الكربون CS2 يترك المحلول في طبق قليل العمق مدة طويلة فتتشكل بلورات كبريت معينية صفراء ولكنها مشوهة.
ـ يذوب الكبريت في كبريتيت الصوديوم ويتكون ثيوكبريتات الصوديوم Na2S2O3، وفي السيانيد ويتكون ثيوسيانات SCN، كما يذوب في محاليل كبريتيدات المعادن القلوية[القلويات]، ويذوب في كبريتيد الأمونيوم (NH4)2S ويتكون مزيج من الأيونات العديدة الكبريت:
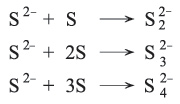 والشاردة (الأيون)
والشاردة (الأيون)![]() تشبه في تركيبها أيون فوق الأكسيد
تشبه في تركيبها أيون فوق الأكسيد ![]() وما البيريت إلا ثنائي كبريتيد الحديد FeS2.
وما البيريت إلا ثنائي كبريتيد الحديد FeS2.
ـ يتفاعل الكبريت بشدة مع عناصر كثيرة ويكوّن معها مركبات كيمياوية، ويشذ عن ذلك العناصر: الذهب والبلاتين والإريديوم والآزوت (النتروجين) والتلور واليود والغازات النادرة. ويحترق الكبريت في الهواء بسهولة بلهب أزرق معطياً ثنائي أكسيد الكبريت SO2 وهو غاز سام يتميز برائحة كريهة، وقد يرافق التفاعلَ تشكلُ القليل من ثلاثي أكسيد الكبريت SO3.
يدعى محلول SO2 في الماء «حمض الكبريت IV» ولكنه بمعزل عن الماء لا وجود لهذا الحمض لأنه لايمكن فصله. ولكن تعرف أملاحه الحمضية مثال ذلك NaHSO3 وأملاحه المعتدلة مثل Na2SO3.
ـ تفاعل الكبريت مع بعض المعادن والمركبات واللامعادن:
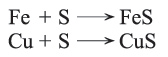
يحترق خليط من الكبريت مع المعادن في تفاعلات ناشرة للحرارة ويتكون كبريتيدات المعادن ويرافق ذلك انطلاق شرارة أو بصيص ضوئي، ومن هذه التفاعلات:
كما يتفاعل الكبريت مع غاز الميتان في الدرجة 700 ْس وبوجود أكسيد الألمنيوم الذي يعمل وسيطاً (حفازاً) معطياً كبريتيد الكربون (CS2)، وهو سائل سام لا لون له.
يتفاعل غاز الهدروجين عند الدرجة 450 ْس مع الكبريت وهو في حالة الغليان والتفاعل ناشر للحرارة (20 كيلو جول/مول).
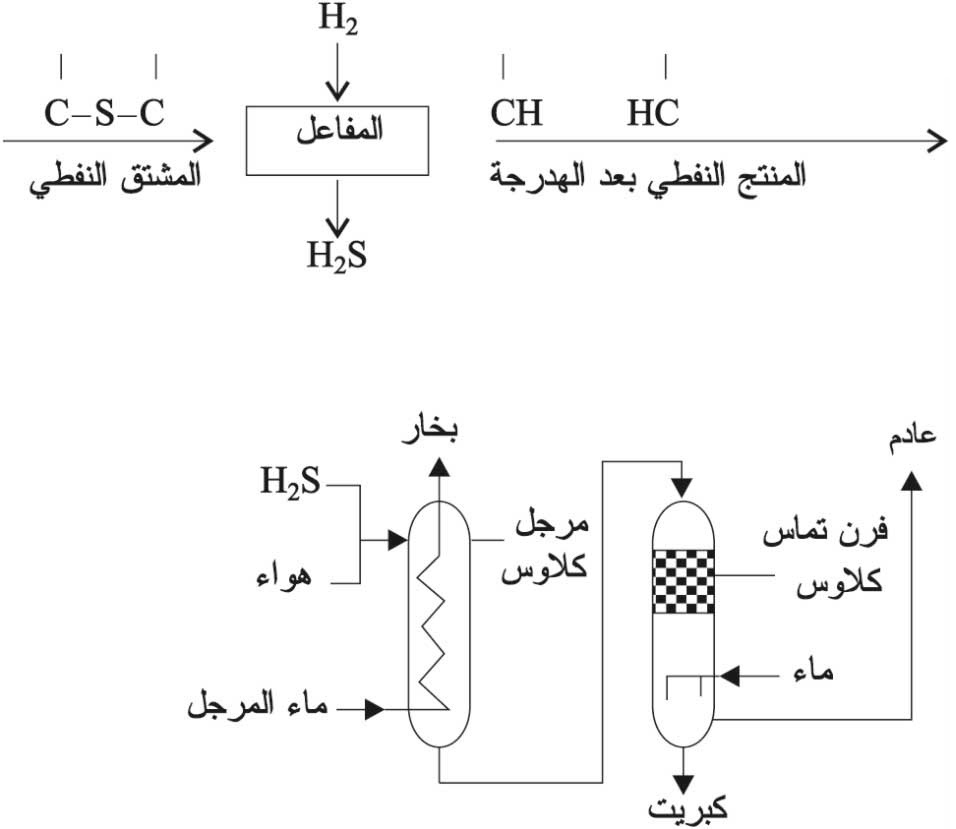
![]() لهذا التفاعل أهمية خاصة في عملية إزالة أو نزع الكبريت من المشتقات النفطية، أي من المركبتانات وثنائي الكبريتيد والتيوفين وغير ذلك من مركبات ضارة لو بقيت في المشتقات النفطية:
لهذا التفاعل أهمية خاصة في عملية إزالة أو نزع الكبريت من المشتقات النفطية، أي من المركبتانات وثنائي الكبريتيد والتيوفين وغير ذلك من مركبات ضارة لو بقيت في المشتقات النفطية:
تعطي تفاعلات هدرجة المركبات الكبريتية في المشتقات البترولية غاز H2S[ر. كبريت الهدروجين (مشتقات -)] ومواد أخرى. يحضر كبريتيد الهدروجين وهو غاز سام بفعل حمض على كبريتيد معدن خاصة كبريتيد الحديد (II)، ويحترق كبريتيد الهدروجين بوجود كمية زائدة من الهواء فيتكوَّن ثنائي أكسيد الكبريت وماء. وإذا جرى الاحتراق في كمية محدودة من الهواء يتكوّن الكبريت الحر إذ يتفاعل ثنائي أكسيد الكبريت مع كبريتيد الهدروجين حسب المعادلة:
وبهذا التفاعل يعلّل تشكل توضعات الكبريت الحر في المناطق البركانية. وH2S حمض ضعيف (K1 =ت1.1×10-7 و K2 =ت10-14).
الأشكال
يوجد الكبريت في أشكال عدّة تُسمى المتآصلات، وأكثر المتآصلات شيوعًا هو الكبريت معيِّني الشكل، وهو مادة متبلِّرة صفراء ليمونيّة اللّون وثابتة عند درجة حرارة الغرفة. أما الكبريت أحادي الميل أو الموشوري، فهو ثابت فقط ما بين درجة 94°م و120°م. وتوجد كبلورات إبريّة طويلة عديمة اللّون تقريبًا.
أما الكبريت غير المتبلر أو البلاستيكي فهو ناعم وليّن ولزج و يتمدد كالمطاط. وكلا النوعين ـ الكبريت أحادي الميل والكبريت غير المتبلر ـ يتحولان إلى الكبريت معيني الشكل عند درجة حرارة الغرفة.
ويمكن تحضير الكبريت معيني الشكل بعدة طُرُق للاستخدام التجاري. فمثلاً تتكون حبيبات الكبريت الناعمة عند تكثيف الكبريت. وتسمى هذه الحبيبات زهور الكبريت لأنها توجد في نسق كالأزهار. ويصنع الكبريت الأسطواني بتقوية الكبريت السائل في قوالب أسطوانية الشكل، أما كتل الكبريت فتحضر برش الكبريت المنصهر في أحواض الماء.
كيفيّة الحصول على الكبريت
حصلت كثير من الصناعات قبل القرن العشرين على الكبريت من الترسبات البركانية ومن مناجم الكبريت في صقلية ومن البيريت المحمّص. وظلّت الولايات المتحدة المنتج الرائد للكبريت منذ عام 1900م. وحتى الخمسينيات من القرن العشرين اعتمد إنتاج الكبريت على طريقة فراش. فقد اكتشف هرمان فراش، المهندس الكيميائي الأمريكي، عام 1891م، أن بالإمكان صهر الكبريت وهو في باطن الأرض وذلك بوساطة بخار مسخن لأكثر من درجة حرارة غليان الماء. وفي هذه الطريقة يُسخّن الماء تحت الضغط إلى درجة حرارية أعلى من درجة انصهار الكبريت. ويُضخ الماء بوساطة المضخات إلى داخل الأرض حيث يصهر الكبريت إلى سائل مزبد خفيف. ويرفع الكبريت السائل إلى السطح بوساطة الهواء المضغوط. وأغلب الكبريت المنتج بهذه الطريقة له درجة نقاء تتراوح ما بين 99,5% و99,9%.
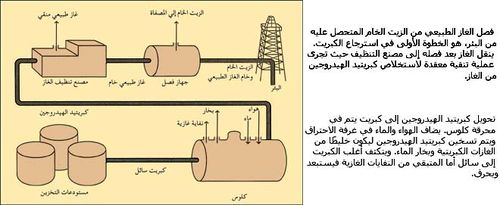
ومازالت طريقة فراش تستخدم بتوسُّع، إلا أن أغلب كميات الكبريت المنتجة حاليًا تأتي من مركبات الكبريت الموجودة بالزيت والغاز الطبيعي. وتحول هذه المركبات إلى كبريتيد الهيدروجين في موقع المصفاة أو البئر. يسخن الكبريتيد ويحول من بعد ذلك إلى الكبريت بدرجة نقاء 99,99%.
هذه العملية التي تُسمى تحويل كلوس اقترحها المهندس الكيميائي البريطاني س.ف. كلوس عام 1883م.
يُستحصَل الكبريت إما من مناجم الكبريت حيث يوجد حراً في ترسبات ملحية من كبريتات الكالسيوم وكبريتات الكالسيوم المميهة وكربونات الكالسيوم وملح صخري، وإما من غاز كبريتيد الهيدروجين الناتج من هدرجة المشتقات النفطي بهدف الحصول على كبريت الهدروجين أولاً ومنه على الكبريت.
ظلت صقلية أهم مصدر للكبريت في العالم حتى أوائل القرن العشرين. والطريقة التي كانت تستعمل لاستحصاله من خاماته الحاوية على 15-20% كبريت هي وضعه في فرن مبني من الآجر، ثم إشعاله، فيحترق 30% منه وينتشر من الحرارة ما يكفي لإذابة القسم الباقي من الكبريت الذي يسيل من جانب الفرن. والكبريت الناتج غير نقي ويجب تقطيره للحصول على كبريت نقي. وفي عام 1867 اكتشف وجود كبريت على عمق 150 متراً تحت طبقة رملية على شاطئ خليج المكسيك ويجري في الطبقة الرملية ماء غني بكبريتيد الهيدروجين. وفي أول محاولة لاستخراج هذا الكبريت قتل خمسة من العمال بالغاز الأخير. وفي عام 1890 فكر هرمان فراش Frasch وهو كيميائي كان يعمل في إحدى شركات البترول في حفر بئر تصل إلى الطبقة الغنية بالكبريت، ثم صهر الكبريت بوساطة بخار الماء وسحبه بوساطة مضخة.
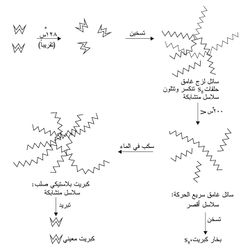
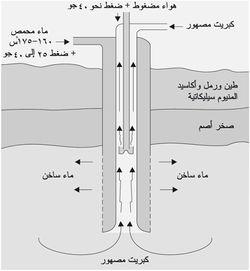
يستحصل الكبريت من مناجمه حسب طريقة فراش بوساطة ماء محمَّص (فوق مسخّن) ضغطه 25-40 ضغطاً جوياً ودرجة حرارته نحو 160-175 ٍْس كما يتضح من (الشكل-4).
يدخل الماء المحمَّص بأنبوب خارجي إلى باطن الأرض حيث الكبريت؛ ويؤدي ذلك إلى ذوبان الكبريت وتحوله إلى رغوة تصعد إلى سطح الأرض بوساطة هواء ساخن ضغطه نحو 40 ضغطاً جوياً، ويحتاج الحصول على طن واحد من الكبريت إلى نحو 10-15 طناً من الماء المحمص. يبلغ قطر الأنبوب الخارجي نحو 25سم، وقطر أنبوب الكبريت نحو 15سم، أما قطر أنبوب الهواء الساخن والمضغوط فيبلغ نحو 7.5سم.
وللحصول على الكبريت من غاز كبريتيد الهدروجين تبعاً لطريقة كلاوس Claus في مصافي البترول (الشكل-5) يجب أولاً فصل المواد الضارة العائدة إلى مركبات عضوية فيها مثل الكبريت والأكسجين والآزوت وكذلك المركبات المعدنية، وإن فصل هذه المواد ضروري للأسباب الآتية:
ـ تسمِّم مركبات العناصر المذكورة المواد المحفِّزة المستخدمة في عمليات تكرير البترول.
ـ تسبب تآكل الأجهزة وانسداد الأنابيب بسبب الأملاح، مثال ذلك أملاح الأمونيوم.
ـ تلوث المشتقات النفطية البيئة عند حرقها[بنزين (وقود السيارات) أو مازوت (زيت الوقود) أو كاز] لأنها تطلق أكاسيد الآزوت والكبريت وغيرها.
ـ لهذه المركبات روائح كريهة ولهذا لا يجوز أن توجد في المشتقات البترولية ولا في المواد المصنَّعة منها.
للحصول على الكبريت يجب أولاً الحصول على غاز H2S من المشتقات النفطية عن طريق هدرجتها تبعاً للشروط العامة الآتية: درجة الحرارة: 230-450 ْس، الضغط: 24-60 بار، السرعة الحجمية: 2-20 في الساعة وتعني نسبة الحجم المتدفق من المشتق النفطي مقدَّراً بالمتر المكعب إلى حجم وعاء التفاعل (حجم العمود أو المفاعل) مقدراً بالمتر المكعب في الساعة الواحدة، وتجري العملية بوجود وسيط مناسب.
تنطلق عملية كلاوس في الحصول على الكبريت من كبريتيد الهدروجين وأكسجين الهواء تبعاً للتفاعل الإجمالي الآتي وهو تفاعل ناشر للحرارة:
أ) يحترق جزء من غاز H2S في مرجل كلاوس بفعل حرارة التفاعل مما يؤدي إلى تحرر نحو 70% من مجمل الكبريت.
ب) بعد أن يبرد ما تبقى من غاز (H2S+SO2) إلى الدرجة 200-300 ْس يقاد إلى فرن تماس، فيه مادة محفزة (TiO2+Al2O3) فيتحرر الكبريت مجدداً تبعاً للتفاعل الآتي:
يستهلك معظم الكبريت المستحضر صناعياً في صناعة حمض الكبريت، وتستخدم كميات صغيرة منه في كبرتة المطاط، وفي صناعة الكبريتيت وثيو الكبريتات Na2S2O3، كما يستعمل في قصر الفواكه المجفَّفه وفي رش النباتات، وفي صنع المتفجرات والأصبغة واللدائن (البولميرات) والمنظفات وعدد لا يحصى من العمليات الكيمياوية.
تصنيع حمض الكبريت - طريقة التماس المزدوج
يصنّع حمض الكبريت حالياً تبعاً لطريقة التماس المزدوجة انطلاقاً من الكبريت والهواء باستخدام خماسي أكسيد الفاناديوم مادةً حافزة (وسيطاً).
g ترمز إلى غاز، l ترمز إلى السائل، aq ترمز إلى محلول.
ويمكن التعبير عن مجمل عملية تشكل حمض الكبريت بالمعادلة الآتية:
إن أكسدة ثنائي أكسيد الكبريت SO2 إلى ثلاثي أكسيد الكبريت SO3 هو قلب عملية تصنيع حمض الكبريت والذي يتم على خماسي أكسيد الفاناديوم أو البلاتين عند الدرجة 450 ْس تقريباً. ولذلك سميت هذه الطريقة طريقة التماس.
لايمكن الحصول على حمض الكبريت بالاتحاد المباشر بين SO3 والماء؛ إذ يؤدي ذلك إلى ضباب يصعب تكثيفه، فتعتمد الطريقة الصناعية على حل SO3 في H2SO4 لتشكيل بيرو حمض الكبريت H2S2O7 (التفاعل 3)، وبتمديد هذا الحمض ينتج حمض الكبريت.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
ثلاثي أكسيد الكبريت
لثلاثي أكسيد الكبريت SO3 ثلاث حالات: غازية ويكون على شكل جزيء SO3، وسائلة ويكون على شكل ثلاثية الجزيء (SO3)3، وصلبة ويكون على شكل متماثر [(SO3)3].
يتفاعل ثلاثي أكسيد الكبريت بشدة مع الماء مطلِقاً كمية كبيرة من الحرارة (-70.69 كيلو جول/مول) مشكلاً حمض الكبريت:
حمض الكبريت
لجزيء حمض الكبريت وأيون (شاردة) الكبريتات الصيغتان المنشورتان الآتيتان:
حمض الكبريت الصافي سائل لالون له ولا رائحة، لزج قليلاً، نقطة انصهاره 10.4 ْس، ونقطة غليانه. 279.6 ْس (98%) . ولحمض الكبريت غير المائي كتلة حجمية مقدارها 1.8269غ/سم3 عند الدرجة صفرمئوية ( سلسيوس)، ولزوجة ديناميكية تزداد مع انخفاض درجة الحرارة وزيادة التركيز لتصل إلى أعلى قيمها في مجال التركيزH2SO4 85-90%. تزداد ناقلية حمض الكبريت الكهربائية مع التركيز لتبلغ أعلى قيمة لها[0.80 سيمنز.سم-1] عند التركيز H2SO4 33.5% حيث تبلغ الكتلة الحجمية 1.25غ/سم3 عند الدرجة 20 ْس ومن ثم تنقص إلى أن تقترب من الصفر من أجل H2SO4 100%.
وحمض الكبريت قابل للمزج مع الماء بكل نسبة وذلك في تفاعل ناشر للحرارة. يشكل مع الماء العديد من الهدرات (مثل: H2SO4.x H2O، x تراوح بين 1 و6) ويذيب كميات غير محددة من SO3 مشكلاً حمض الكبريت المدخن (الأوليوم) oleum. يُعطى تركيز الأوليوم بالنسبة المئوية الكتلية للمركب SO3 المنحل والحر في 100% حمض كبريت ويحتوي على حموض كبريتية بلمرية polysulfuric acids مثل بيروحمض الكبريت أو ثاني حمض الكبريت H2S2O7 وأخرى أغنى بـ SO3 مثل H2S3O10 وH2S4O13.
لا يتشرد حمض الكبريت بتركيز 100% إلا قليلاً تبعاً لتفاعلات توازنية عديدة، على سبيل المثال:
لهذا يكون لحمض الكبريت الصافي (100%ن H2SO4) ناقلية كهربائية أصغرية تقترب من الصفر. ومع تمديد حمض الكبريت تزداد ناقليته بسبب تفاعلي التشرد:
يبلغ تشرد الخطوة الأولى لمحلول حمض متوسط التركيز (مثل: محلول يحوي مولاً واحداً في اللتر من حمض الكبريت) نحو 100%. ولكن تشرد الخطوة الثانية لايتجاوز 1.3% وإن كما يتضح ذلك من ثابت تشرد هذه الخطوة:
يتفاعل حمض الكبريت المركز مع الماء الأكسجيني[ر] H2O2 معطياً بيرأكسو ثاني حمض الكبريت H2S2O8. وشاردة بير أكسو ثاني الكبريتات من أقوى المؤكسدات.
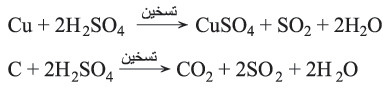
يؤكسد حمض الكبريت المركز والساخن المعادنَ الثمينة وكذلك الكربون والفسفور والكبريت في حين يرجع (يختَزَل) الحمض إلى SO2، ومن هذه التفاعلات:
يؤكسد حمض الكبريت الممدد المعادن غير الثمينة التي كمونها القياسي أقل من صفر، أي أقل من كمون الكترود (مسرى) الهدروجين (2H+/H2) القياسي الذي يساوي الصفر في هذه الحالة ترجَع بروتونات الحمض إلى هدروجين. أما إذا كان الحمض مركزاً فترجَع الكبريتات إلى كبريت الهدروجين:
لكن حمض الكبريت المركز يؤكسد التوتياء إلى Zn+2 ويرجَع إلى كبريت الهدروجين كالآتي:
لا يعد حمض الكبريت من العوامل agents المؤكسدة القوية ولكنه عامل قوي لنزع الماء dehydrating agent فهو ينزع الماء من الكربوهدرات (السكريات[ر]) ومن مواد عضوية أخرى محولاً إياها إلى كربون تبعاً للتفاعل العام:
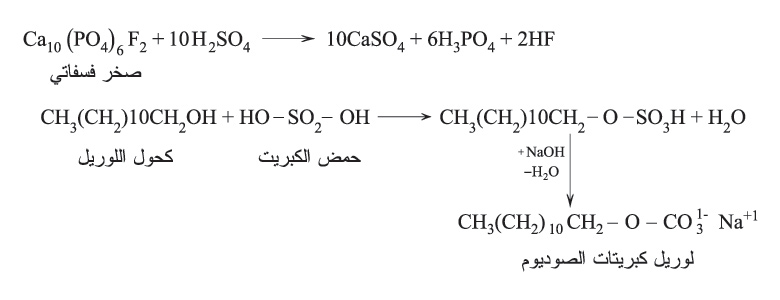
يستخدم حمض الكبريت في كثير من الصناعات الكيمياوية، مثل تصنيع حمض الفسفور (لصناعة الأسمدة)، وتصنيع لوريل كبريتات الصوديوم للمنظفات، تبعاً للتفاعلين الآتيين:
الدور الحيوي
انظر أيضًا
- دورة الكبريت
- Stratospheric sulfur aerosols
- Disulfide bond
- Sulfonium S+, S+R3
- Ultra-low sulfur diesel
- عملية كلاوس
- Shell-Paques sulfide removal/sulfur recovery process
- كبريتات
- كبريتيد
- سلفا
- ثاني أكسيد الكبريت
- حمض الكبريتيك
وصلات خارجية
- Sulfur phase diagram
- WebElements.com – Sulfur
- chemicalelements.com/sulfur
- Crystalline, liquid and polymerization of sulphur on Vulcano Island, Italy
- Sulfur and its use as a pesticide
- The Sulphur Institute
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||