كهرسلبية
السالبية الكهربية أو الكهرسلبية هى مقياس لمقدرة الذرة أو الجزيء على جذب الإلكترونات في الروابط الكيميائية . وتعتمد نوعية الرابطة المتكونة إعتمادا كبيرا على الفرق في السالبية الكهربية بين الذرات الداخلة فيها . وتقوم الذرات المتشابهة في السالبية الكهربية " بسرقة " الإلكترونات من بعضها البعض والذى يرجع لما يسمة " مشاركة " وتكون رابطة تساهمية . ولكن لو كان هذا الفرق كبير سينتقل الإلكترون إلى أحد الذرات وتتكون رابطة أيونية . إضافة إلى ذلك في حالة أن أحد الذرات تقوم بسحب الإلكترونات بقوة أكبر قليلا من الأخرى فإنه تتكون رابطة تساهمية قطبية .
ويتم إستخدام مقياسين مشهورين للسالبية الكهربية ، مقياس باولنج ( تم إقتراحه عام 1932 ) ومقياس مولكين ( تم إقتراحه عام 1934 ) . كما يوجد إقتراح أخر يسمى مقياس ألريد-روشو .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
كهرسلبية العناصر
قالب:Periodic table (electronegativity by Pauling scale)
طرق الحساب
مقياس پاولنگ
تم إقتراح مقياس باولنج عام 1932 . وفى هذا المقياس يكون عنصر الفلور هو أعلى العناصر في السالبية الكهربية حيث تبلغ 3.98 ، بينما أقل العناصر سالبية كهربية هو الفرانسيوم وله قيمة تبلغ 0.7 والعناصر الباقية تكون قيمها بين هاتين القيمتين . ويكون الهيدروجين له قيمة سالبية كهربية تساوى 2.1 أو 2.2 .
δEN تكون هى الفرق في السالبية الكهربية لأى ذرتين أو عنصرين . وكقاعدة عامة يكون نوع الرابطة بين ذرتين رابطة أيونية في حالة أن الفرق في السالبية الكهربية بينهما ( أكبر من أو يساوي 1.7 . وعندما يكون الفرق في السالبية الكهربية ( 0.4 - 1.7 ) فإن الرابطة تعتبر تساهمية قطبية ، وعندما يكون الفرق أقل من 0.4 تعتبر الرابطة تساهمية غير قطبية ، وعندما يكون الفرق مساويا للصفر فإن الرابطة تكون رابطة تساهمية غير قطبية تماما .
مقياس موليكن
يتم حساب الأرقام في مقياس موليكن بعمل متوسط لجهد التأين والألفة الإلكترونية . وعلى هذا يتم التعبير عن السالبية الكهربية مباشرة بوحدات الطاقة ، وعادة ما تكون بالإلكترون فولت . وتم إقتراحها في عام 1934 عن طريق روبرت إس مولكين .
كهرسلبية آلرد-روتشو
كهرسلبية آلن
In this scale neon has the highest electronegativity of all elements, followed by fluorine, helium, and oxygen.
قالب:Periodic table (electronegativity by Allen scale)
التعالق بين الكهرسلبية والخصائص الأخرى

مناحي في الكهرسلبية
مناحي دورية
اتجاه السالبية الكهربية
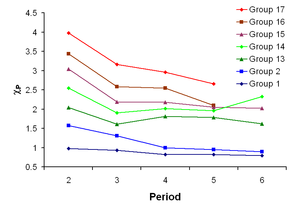
لكل عنصر كيميائي سالبية كهربية مميزة تتراوح بين صفر - 4 على مقياس باولنج. الفلور هو أعلى العناصر في السالبية الكهربية 3.98, بينما أقل العناصر سالبية كهربية هو الفرانسيوم وله قيمة تبلغ 0.7 وبصفة عامة تقل السالية الكهربية كلما اتجهنا لأسفل في الجدول الدوري وتزيد في الغتجاه العرضي كما موضح بالأسفل. وخلال الدورة فإن اللا فلزات تميل لإمتساب الإلكترونات بينما تميل الفلزات لفقدها وهذا راجع لميل الذرة للوصول إلى التركيب الثماني . وبالنزول خلال الدورة فإن تأثير شحنة النواة يقل على غلاف الطاقة الخارجي . وعلى هذا فإن أكثر العناصر سالبية كهربية هى العناصر الموجودة في أعلى الجدول, وأقلها سالبية كهربية يوجد في أسفل الجدول. وبالتالى فإنه بصفة عامة نصف القطر الذري يقل في الإتجاه العرضي للجدول الدوري, ولكن طاقة التأين تزيد في نفس الإتجاه .
| ← نصف القطر الذري يتناقص ← طاقة التأين تتزايد ← السالبية الكهربية تتزايد ← | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المجموعة | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Period | |||||||||||||||||||
| 1 | H 2.20 |
He | |||||||||||||||||
| 2 | Li 0.98 |
Be 1.57 |
B 2.04 |
C 2.55 |
N 3.04 |
O 3.44 |
F 3.98 |
Ne | |||||||||||
| 3 | Na 0.93 |
Mg 1.31 |
Al 1.61 |
Si 1.90 |
P 2.19 |
S 2.58 |
Cl 3.16 |
Ar | |||||||||||
| 4 | K 0.82 |
Ca 1.00 |
Sc 1.36 |
Ti 1.54 |
V 1.63 |
Cr 1.66 |
Mn 1.55 |
Fe 1.83 |
Co 1.88 |
Ni 1.91 |
Cu 1.90 |
Zn 1.65 |
Ga 1.81 |
Ge 2.01 |
As 2.18 |
Se 2.55 |
Br 2.96 |
Kr 3.00 | |
| 5 | Rb 0.82 |
Sr 0.95 |
Y 1.22 |
Zr 1.33 |
Nb 1.6 |
Mo 2.16 |
Tc 1.9 |
Ru 2.2 |
Rh 2.28 |
Pd 2.20 |
Ag 1.93 |
Cd 1.69 |
In 1.78 |
Sn 1.96 |
Sb 2.05 |
Te 2.1 |
I 2.66 |
Xe 2.6 | |
| 6 | Cs 0.79 |
Ba 0.89 |
Lu 1.27 |
Hf 1.3 |
Ta 1.5 |
W 2.36 |
Re 1.9 |
Os 2.2 |
Ir 2.20 |
Pt 2.28 |
Au 2.54 |
Hg 2.00 |
Tl 1.62 |
Pb 2.33 |
Bi 2.02 |
Po 2.0 |
At 2.2 |
Rn | |
| 7 | Fr 0.7 |
Ra 0.9 |
Lr |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Uub |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo | |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التفاوت في الكهرسلبية مع رقم الأكسدة
In inorganic chemistry it is common to consider a single value of the electronegativity to be valid for most "normal" situations. While this approach has the advantage of simplicity, it is clear that the electronegativity of an element is not an invariable atomic property and, in particular, increases with the oxidation state of the element.
Allred used the Pauling method to calculate separate electronegativities for different oxidation states of the handful of elements (including tin and lead) for which sufficient data was available.[1] However, for most elements, there are not enough different covalent compounds for which bond dissociation energies are known to make this approach feasible. This is particularly true of the transition elements, where quoted electronegativity values are usually, of necessity, averages over several different oxidation states and where trends in electronegativity are harder to see as a result.
| الحمض | الصيغة | حالة أكسدة الكلور |
pKa |
|---|---|---|---|
| Hypochlorous acid | HClO | +1 | +7.5 |
| Chlorous acid | HClO2 | +3 | +2.0 |
| Chloric acid | HClO3 | +5 | –1.0 |
| Perchloric acid | HClO4 | +7 | –10 |
الكهرإيجابية
الكهرإيجابية Electropositivity هي مقياس لقدرة عنصر على التبرع بإلكترونات، وبذلك يشكـِّل أيونات موجبة؛ ولذلك فهي معاكسة للكهرسلبية.
See also
References
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةAllred
Bibliography
- Jolly, William L. (1991). Modern Inorganic Chemistry (2nd ed.). New York: McGraw-Hill. pp. 71–76. ISBN 0-07-112651-1.
- Mullay, J. (1987). "Estimation of atomic and group electronegativities". Structure and Bonding. Structure and Bonding. 66: 1–25. doi:10.1007/BFb0029834. ISBN 3-540-17740-X.
وصلات خارجية
- WebElements, lists values of electronegativities by a number of different methods of calculation
- Video explaining electronegativity