زنك
ساهم بشكل رئيسي في تحرير هذا المقال
|
 | |||||||||||||||
| زنك | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | فضي-رمادي | ||||||||||||||
| الوزن الذري العياري Ar°(Zn) | |||||||||||||||
| زنك في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 30 | ||||||||||||||
| المجموعة | 12 | ||||||||||||||
| الدورة | period 4 | ||||||||||||||
| المستوى الفرعي | d-block | ||||||||||||||
| التوزيع الإلكتروني | [Ar] 3d10 4s2 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 18, 2 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | صلب | ||||||||||||||
| نقطة الانصهار | 692.68 K (419.53 °س، 787.15 °F) | ||||||||||||||
| نقطة الغليان | 1180 K (907 °س، 1665 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 7.14 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 6.57 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 7.32 kJ/mol | ||||||||||||||
| حرارة التبخر | 115 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 25.470 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| حالات الأكسدة | -2, 0, +1, +2 | ||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 1.65 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 134 pm | ||||||||||||||
| نصف قطر التكافؤ | 122±4 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 139 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| التواجد الطبيعي | primordial | ||||||||||||||
| البنية البلورية | سداسية الأضلاع مدموكة بتلاصق | ||||||||||||||
| سرعة الصوت قضيب رفيع | 116 W/(m·K) | ||||||||||||||
| التمدد الحراري | 30.2 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 59.0 nΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | معاكس المغناطيسية | ||||||||||||||
| معامل يونگ | 108 GPa | ||||||||||||||
| معامل القص | 43 GPa | ||||||||||||||
| معاير الحجم | 70 GPa | ||||||||||||||
| نسبة پواسون | 0.25 | ||||||||||||||
| صلادة موز | 2.5 | ||||||||||||||
| صلادة برينل | 327–412 MPa | ||||||||||||||
| رقم كاس | 7440-66-6 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف | علماء المعادن الهنود (قبل 1000 ق.م.) | ||||||||||||||
| أول عزل | أندرياس زيگيسموند مارگراف (1746) | ||||||||||||||
| أول من تعرف عليه كفلز متميز | راساراتنا ساموكايا (800) | ||||||||||||||
| نظائر الزنك | |||||||||||||||
| قالب:جدول نظائر زنك | |||||||||||||||
الخارصين أو الزنك Zn من عناصر السلسله الاولى في الفلزات الانتقالية وذلك لوجود مدارات فارغه بالمدار d وبالتالي يستطيع تكوين complex
الزنــك أو الخارصين عنصر رمزه الكيميائي Zn. وهو فلز لامع ذو لون أبيض ضارب إلى الزرقة، ويتمتع بأهمية في الصناعة. فالزنك يمكن تشكيله كيفما اتفق باستخدام الطرائق التقليدية لتشكيل الفلزات. ويتم جلفنة الفلزات مثل الحديد والفولاذ ـ أي صقلها بالزنك ـ لمنع الصدأ. ويستخدم الفلز المجلفن في بعض المنتجات مثل ميازيب أو بالوعات السطح وبطانات الصهاريج. ويُستخدم الزنك أيضاً في صناعة البطاريات الكهربائية. كما أنّ النباتات والحيوانات تحتاج إلى الزنك في النمو الطبيعي والعلاج. ويُعد الزنك أحد مكونات هورمون الأنسولين.
ويمكن للزنك أن يتحد مع فلزات أخرى لتشكيل سبائك. مثال ذلك الصفر الذي يُعد سبيكة من النحاس الأحمر والزنك، والبرونز وهو سبيكة من النحاس والقصدير والزنك، والفضة الألمانية وهي سبيكة من النحاس والنيكل والزنك. ويُستخدم الزنك أيضًا في صناعة سبائك اللحام (سبائك سهلة الانصهار تستخدم في لحام الفلزات) . ويُستخدم الزنك وسبائكه في عملية الصب في قوالب، أي تشكيل الأشياء من الفلزات المنصهرة باستخدام القوالب، وفي عملية الطلاء بالكهرباء، أي طلاء شيء ما باستخدام الكهرباء، وفي عملية تعدين المساحيق، أي تشكيل الأدوات من مساحيق الفلزات.
ويعمل الهواء الرطب على إطفاء بريق الزنك من خلال إكسابه طبقة طلاء رواقية من أكسيد الزنك. وحالما تتشكل طبقة الطلاء هذه، لايمكن للهواء أن يؤكسد الطبقة التالية من الزنك. يُستخدم مسحوق أكسيد الزنك الأبيض في صناعة مستحضرات التجميل واللدائن والمطاط ومراهم الجلد والصابون. ويُستخدم كذلك في صناعة الدهانات الصبغية والأحبار. ويتوهج كبريتيد الزنك، وهو مركب من الزنك والكبريت، عندما تُسلط عليه الأشعة فوق البنفسجية أو الأشعة السينية أو أشعة القطب السالب (الكاثود) وتيار من الإلكترونات. ويستخدم كبريتيد الزنك في طلاء المينا المضيئة في الساعات وشاشات أجهزة التلفاز والمصابيح الفلورية. كما أن كلوريد الزنك (مركب من الزنك والكلور) يقي الخشب من التآكل والحشرات.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تاريخ الزنك
كلمة الخارصين هى التسمية العربية للزنك . و يختلف العلماء اللغويون حول اصل كلمة زنك فبينما يرى بعضهم انها كلمة لاتينية تعنى الراسب الابيض يرى اخرون انها مشتقة من الكلمة الألمانية Zinke وتعنى أسنان المشط حيث ان شكل الفلز الخام. في فرن الصهر يكون شبيها بهذا . في حين يرى اخرون انها كلمة مشتقة من الكلم الفارسية "سنگ" وتعني الحجر.
الاكتشاف
وقد اكتُشفت سبائك تحتوي على كميات كبيرة من الزنك في مخلفات ما قبل التاريخ. وصنع الرومان في القرن الثاني قبل الميلاد عملات من النحاس الأصفر من خامات تحتوي على الزنك والنحاس. ولكن مقارنة بمعادن كالحديد والنحاس و الرصاص التى اكتشفت قبل قبل الميلاد بأكثر من ألف سنة، فان اكتشاف الزنك قد جاء متأخرا في القرن الرابع عشر ميلاديا في الهند والصين وقد عثر في الصين على عملات معدنية تحتوى في تكونيها على 99% من الزنك و 1% من النحاس وذلك في الفترة من 1368 إلى 1644 وقد عثرت في الهند على أدوات تشير إلى أن عمليات صهر الزنك تمت في القرن الرابع عشر. ويرجع تأخر اكتشاف الزنك إلى انخفاض درجة غليانه حيث يوجد في الطبيعة غالباً مع الرصاص والذى كان يصهر في أفران درجة حرارتها حوالي 1000° مئوية فكان سرعان ما يتبخر الزنك ولا يبقى إلا الرصاص. في عام 1617 عمل لوهنيس على دراسة عينات من الزنك أُحضرت من الهند والصين. وأطلق عليه اسم الزنك. في عام 1721 تمكن هنكل من تحضير الزنك من خام السميثسونيت (ZnCO3) إلا أنه احتفظ بالطريقة سراً.
وفي عام 1746 تمكن الألمانى أندرياس زيگيسموند مارگراف في برلين من انتاج الزنك بتقطير خام السميثسونيت في وعاء مغلق ووصف الطريقة التى اتبعها والخطوات بدقة. وبذلك يكون أول من توصل إلى تحضير الزنك معمليا.
التواجد
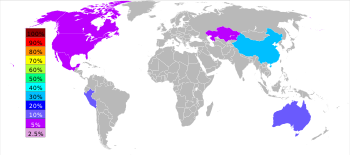
يوجد الزنك في الطبيعة بشكل مركبات في خامات ores مختلفة ولا يصادف في حالة حرة، ويوجد في القشرة الأرضية بنسبة 0.02% وزناً وفي مناطق عدة من العالم (الولايات المتحدة أغناها، تليها كندا، ثم روسيا، وأستراليا، والمكسيك، واليابان).
فيوجد الزنك على شكل خام يحتوي على كبريتيد الزنك أو كبريتيد الرصاص أو كبريتيد الفضة. وتُفصل هذه الكبريتيدات في المناجم بترسيبها على نحو دقيق ومزجها بالماء وكيميائيات التعويم. ثم تُزاح كبريتيدات الرصاص والفضة مع الزَّبَد الناتج في أوعية التعويم. وتُضاف مواد كيميائية أخرى إلى الثمالة المترسّبة في قاع أوعية التعويم حتى يتم الحصول على كبريتيد الزنك الذى يُحوَّل إلى أكسيد الزنك الذي يُغسل للحصول على محلول أكسيد الزنك. ثم يُحلَّل محلول أكسيد الزنك بالكهرباء للحصول على فلز الزنك. وفى هذه العملية يتولّد حمض الكبريتيك باعتباره ناتجاً ثانويًا. ويُعالج حمض الكبريتيك من خلال عملية الغسيل.
والعدد الذري للزنك 30 ووزنه الذريّ 65,39. وينصهر الزنك عند 419,59 °م، ويغلي عند 907°م, الأعداد الكتلية لنظائره الطبيعية: 64 66 67 68 70, والبنية الإلكترونية لذرة الزنك: k.L.M.4s2.
أهم خاماته
1ـ السفاليريت ZnS: ويأخذ شكل بلورات مكعبية صفراء أو بنية أو سوداء اللون، كثافتها 3.9ـ4.2غ/سم3.
2ـ البيورتسيت ZnS: ويأخذ شكل بلورات سداسية ذات لون بني مسودّ، كثافتها 3.98غ/سم3.
3ـ السميثسونيت (الحجر الزنكي) ZnCO3: ويأخذ شكل بلورات ثلاثية الميل ذات لون أبيض أو بني بحسب الشوائب كثافتها 4.3 ـ 4.5غ/سم3.
كما أن من خاماته الزنكيت ZnO والگانيت Zn(Al2O4)، إضافة إلى خامات أخرى كثيرة.
الانتاج
التعدين والمعالجة
إن الأفران المستخدمة على نطاق واسع في اختزال خامة الخارصين إلى خارصين فلزى هى فرن المُعْوَجَّة الأفقى، ويشار إليه عامة بفرن المعوجة البلجيكى، وفرن المُعْوَجَّة الرأسى المستمر، والفرن الحرارى الكهربائى ذو العمود الرأسى. ويتم تحرير الخارصين في الأفران الثلاثة بعملية اختزال وتقطير.
تحمص الخامة التى تحتوى أساساً على كبريتيدات و/أو تُلَبَّد قبل معالجتها بأى من عمليات الاستخلاص. وبخلاف معظم الفلزات، يختزل الخارصين من أكسيده في درجة حرارة أعلى من نقطة غليانه. ومن ثم يتحرر الخارصين في صورة بخار، ولذا يجب تكثيفه. والخصائص الهامة للحراريات المستخدمة في هذه العمليات هى الكثافة العالية والنفاذية المنخفضة، لكى تقلل الاختراق والتكثف المحتمل لبخار الخارصين داخل المادة الحرارية. ويجب أيضاً أن يكون محتوى الحراريات من أكسيد الحديد منخفض لتقليل التفاعل مع الخارصين.[3]
يتكون فرن المعوجة الأفقى من قسمين طوليين طويلين، ويحتوى على عدة مئات من المعوجات الأسطوانية. تشحن المعوجات برُكازات خامة خارصين محمصة، أو كريات ملبدة، أو عُقيدات، مخلوطة مع فحم مكسر أو أى مادة كربونية أخرى مناسبة. وعندما تسخن الشحنة بالتوصيل خلال جدران المعوجة يختزل أكسيد الخارصين إلى خارصين فلزى. تتصل المعوجات بمكثفات مخروطية، تُنشأ عادة من طين حرارى، ويتم فيها تبريد بخار الخارصين وجمعه في صورة سائلة.
ويتكون فرن المعوجة الرأسى من بطارية (مجموعة) من الأفران، يحتوى كل منها على معوجة واحدة، مضاف إليها امتداد مبنى من مادة حرارية، تُغذى فيه الشحنة وتمر من خلاله إلى المعوجة. وتصل إلى المعوجة الحرارة من خلال جدرانها الجانبية، التى تصنع عادة من كربيد السليكون. واختزال الخارصين في فرن المعوجة الرأسى هو عملية مستمرة، حيث يشحن ركاز خامة الخارصين المحمصة مع كربون (عامل مختزِل) بشكل دورى إلى قمة المعوجة في صورة قوالب مُكَوّّكَة (مقولبة مع الكوك). وعند وصول عمود القوالب الهابط ببطئ إلى درجة حرارة الاختزال، تُختزل الخامة، ويمر بخار الخارصين وأول أكسيد الكربون الناتجان خلال أنبوب تصريف إلى المكثف حيث يجمع الخارصين في صورة سائلة.
والفرن الحرارى الكهربائى هو فرن أسطوانى رأسى مبطن بالحراريات، طوله ~12م، ويحتوى على موزع تغذية دوار في قمته ومنضدة تفريغ دائرية في القاع، تسحب منها البقايا المستنفذة بعد الاختزال. تُحَمّى الشحنة الملبدة مع الكوك في فرن أفقى دوار قبل دخولها إلى فرن الاختزال. وتبرز أقطاب جرافيت من خلال جدران الفرن إلى داخل الشحنة في الأجزاء العلوية والسفلية من الفرن، وتقوم الشحنة بين الأقطاب بدور المقاوم أو عنصر التسخين. وفى القطاع الأوسط، يحاط الفرن بحلقة كبيرة لجمع البخار، تُسحب خلالها أبخرة الخارصين وغازات الفرن الأخرى، ويجمع الخارصين في مكثف. وغالباًً ما يستخدم طوب كربيد السليكون أو الكربون للتبطين في منطقة جمع البخار.
| الترتيب | البلد | طن |
|---|---|---|
| 1 | 2,600,000 | |
| 2 | 1,338,000 | |
| 3 | 1,201,794 | |
| 4 | 727,000 | |
| 5 | 710,000 | |
| 6 | 480,000 | |
| 7 | 425,700 | |
| 8 | 420,800 | |
| 9 | 400,000 | |
| 10 | 192,400 |
الخواص الفيزيائية
الزنك معدن أبيض فضي لمّاع، كثافته 7.13غ/سم3 عند الدرجة 20 ْس، درجة انصهاره 419.44 ْس، ودرجة غليانه 609 ْس، قساوته بحسب سلم مواس 2.5ـ2.9، له بنية بلورية سداسية متراصة .
يصبح الزنك قابلاً للطرق والسحب عند الدرجة 100ـ150 ْس، ويصبح هشاً عند درجة تزيد على 200 ْس (يتحول إلى مسحوق)، وهو ذو مغنطيسية مغايرة diamagnetic.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص الكيمياوية
الزنك أقل فعالية من المعادن القلوية والقلوية الترابية وأكثر فعالية من القصدير والرصاص والنحاس والزئبق والفضة والذهب. يحافظ الزنك على لمعانه زمناً طويلاً في الهواء الجاف بينما تتشكل عليه في الهواء الرطب طبقة رقيقة من الأكسيد والكربونات الأساسية تحميه من الصدأ.
يشتعل الزنك عند التسخين الشديد في الهواء ويحترق بشعلة خضراء مشكلاً ZnO.
يتفاعل الزنك مع الهالوجينات في الهواء الرطب في درجة حرارة الغرفة مشكلاً الهاليدات الموافقة، ويتم التفاعل عند درجة الحرارة العالية في الهواء الجاف أيضاً مشكلاً الهاليدات الموافقة.
ويتفاعل مسحوق الزنك مع مسحوق الكبريت مشكلاً ZnS، ويتفاعل الزنك المعدني مع H2S مشكلاً طبقة حامية من ZnS وينطلق الهدروجين، ومع النشادر الغازي مشكلاً نتريد الزنك Zn3N2.
أما مع الآزوت والكربون والهدروجين وعناصر أخرى فلا يتفاعل الزنك مباشرة بينما يتفاعل الزنك المعدني المسخن حتى 440ـ780 ْس مع بخار الفوسفور في جو من الهدروجين مشكلاً Zn3P2 وZnP2.
يزيح الزنك المعدني المعادن الأقل فعالية (مثل Cu,Ag,Hg,Au,Pt) من محاليل أملاحها. ويرجع حموض الكروم، والمنگنيز، والمولبدين، وأملاح الحديد (III) والقصدير (IV).
مركبات الزنك
يعرف للزنك مركبات بسيطة مستقرة كثيرة، ومركبات معقدة كثيرة يدخل فيها الزنك في بنية الشاردة (الأيون) الموجبة أو السالبة المعقدة. من مركباته:
1ـ المركبات اللاعضوية، ومنها:
ـ هدريد الزنك ZnH2 وهو مركب غير طيار صلب أبيض، يتفكك إلى عناصره لدى تسخينه حتى الدرجة 80 ْس سيئ الانحلال في الإتير، ويتفكك ببطء في الماء، وبسرعة في المحاليل المائية لـ HCl. يحضر بتأثير Zn(CH3)2 على LiAlH4 في الإتير في درجة الحرارة العادية.
ـ أكسيد الزنك ZnO: يصادف في الطبيعة بشكل خام الزنكيت، ويحضر مخبرياً بحرق الزنك المعدني في الهواء أو بتكليس كربونات أو نترات أو أكزالات الزنك.
ـ هدروكسيد الزنك Zn(OH)2: يوجد في الحالة البلورية في أشكال خمسة هي ,(ε,δ,γ,β,α)، قليل الانحلال في الماء. ينحل في الحموض والأسس، ويتشكل من معالجة أملاح الزنك بالقلويات.
ـ هاليدات الزنك ZnX2 مركبات بلورية لا لون لها تنحل جيداً في الماء، وتتميع بسرعة في الهواء (ما عدا ZnF2 فهو صعب الانحلال).
ـ كبريتيد الزنك ZnS: يصادف في الطبيعة بشكل خام السفاليريت أو البيورتسيت، ويحضر مخبرياً بتسخين مزيج من مسحوق الزنك أو ZnO أو ZnCO3 مع الكبريت، أو بإمرار مزيج الآزوت مع CS2 فوق الزنك المسخن حتى الإحمرار، أو بمعالجة محاليل أملاح الزنك بكبريتيد الأمونيوم بوسط تراوح درجة حموضته pH بين 2و3. كبريتيد الزنك مركّب أبيض غير مبلور، سيئ الانحلال في الماء والقلويات وحمض الأكزاليك، وينحل جيداً في الحموض المعدنية مع انطلاق H2S.
ـ كبريتات الزنك ZnSO4.7H2O: وهي بلورات لا لون لها، تنحل بسهولة في الماء، سيئة الانحلال في الكحول، تترسب بطريقة بلورة محاليل الزنك المعدني أو أكسيد أو هدروكسيد الزنك في ]]حمض الكبريت الممدد]].
2ـ المركبات العضوية المعدنية، ومنها:
ـ دي ميتل الزنك Zn(CH3)2: سائل لا لون له ذو رائحة كريهة، يحترق تلقائياً في الهواء ويتفكك في الماء، يتصلب في الدرجة29 ْس.
ـ دي إيتيل الزنك Zn(C2H5)2: سائل يتصلب في الدرجة 300 ْس، مستقر ولكنه فعال في درجة الحرارة التي تزيد على 200 ْس، يتحول إلى Zn(C2H5)2O2 بالأكسدة في الهواء، يتفاعل مع الماء والكحول.
استعمالات الزنك ومركباته
يستعمل الزنك المعدني لتغطية الصفائح والأسلاك الحديدية لحمايتها من الصدأ، ولاستخلاص الفضة من مركبات الرصاص الكبريتية. ويدخل في صنع السبائك (الأشابات)، مثال ذلك الشِبه Cu 70% ، Zn 30% ) brass ). ويستعمل في تحضير الهدروجين نتيجة تفاعله مع محلول HCl، وفي إزاحة المعادن (المعادن الأقل فعالية) من محاليل أملاحها، مثلاً إزاحة Ag أو الذهب من محاليل K[Au(CN)2], K[Ag(CN)2] أو الرصاص من محاليل Pb(CH3COO)2, Pb(NO3)2، ومُرجعاً في تفاعلات كيمياوية كثيرة، وفي تحضير مصهورات متعددة، وفي تصنيع الهياكل والتصاميم المختلفة عن طريق تحضير رقائق بسيطة للغاية من الزنك، وفي تصنيع العلب المستخدمة في حفظ المواد الغذائية. وفي الصناعات التعدينية لترسيب بعض العناصر النادرة.
أما مركبات الزنك فتستعمل في مجالات كثيرة إذ يستعمل أكسيد الزنك (يسمى أبيض الزنك) مادة مالئة، وفي الصناعات المطاطية والخزفية، وفي مواد التجميل، ومادة ملونة، كما يستعمل وسيطاً في اصطناع الكحول الميتيلي. وتستعمل كبريتات الزنك في تحضير غالبية مركبات الزنك، ويحضر منها إلكتروليتات لعملية الطلي الغلفاني، وتفيد في تصنيع خيوط الفسكوز، وفي حماية الأشجار من التعفن، وفي تصنيع المستحضرات الطبية. أما كلوريد الزنك ZnCl2 فيفيد في تجفيف المواد المختلفة. ويستعمل كبريتيد الزنك في صناعة الأصبغة، ولتصنيع الشاشات الحساسة التي تصطدم بها أشعة رونتجن، والإشعاعات الصادرة عن المواد المشعة.
الدور الاقتصادي
توجد خامات الزنك في كثير من البلدان. ويستفاد من 40% من الإنتاج العالمي للزنك في حماية الحديد والفولاذ من التآكل، وينبع دوره الاقتصادي من استعمالاته كمعدن ومن استعمالات مركباته المختلفة.
الدور الحيوي للزنك
يدخل الزنك في تركيب عدد من الخمائر، وهو ضروري لتصنيع الإنسولين، ويعد الجزء المكوّن لخميرة الأنهيدراز، التي تلعب دوراً مهماً في عملية التنفس. كما تبيّن أن نقص الزنك في الغذاء يظهر في بطء نمو الأطفال والأنيميا (فقر الدم)، وقد ظهر بطء نمو الأطفال في عام 1960 في إيران والهند، نتيجة نقص الزنك في الطعام. الزنك ضروري للجسم لأنه يكسب الجسم الحي مناعة ضد انتقال العدوى، كما أن نقصه يسبب في الجسم اضطرابات عصبية، وأمراضاً جلدية لذلك تستخدم مركبات الزنك في تحضير بعض الأدوية المستخدمة للأمراض النفسية، ويستخدم الزنك حديثاً لتحضير بعض العقاقير المخففة للاضطرابات السمعية مثل طنين الأذن، وتضاف مركباته مع أدوية معيّنة لزيا.[5]
انظر أيضاً
المصادر
- ^ Standard Atomic Weights 2013. مفوضية توافر النظائر والأوزان الذرية
- ^ Jasinski, Stephen M. "Mineral Commodity Summaries 2007: Zinc" (PDF). United States Geological Survey. Retrieved 2008-11-25.
- ^ وليد خليفة. "الحراريات المستخدمة في صناعة الفلزات (5)". نول. Retrieved 2012-03-28.
- ^ "Zinc: World Mine Production (zinc content of concentrate) by Country" (PDF). 2006 Minerals Yearbook: Zinc. Washington, D.C.: United States Geological Survey. February 2008. p. Table 15. Retrieved 2009-01-19.
- ^ رياض حجازي. "الزنك (التوتياء)". الموسوعة العربية.
وصلات خارجية
- Los Alamos National Laboratory - Zinc
- WebElements.com – Zinc
- History & Etymology of Zinc
- Statistics and Information from the U.S. Geological Survey
- Reducing Agents > Zinc
- American Zinc Association Information about the uses and properties of zinc.
- Outline safety data for zinc
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||

