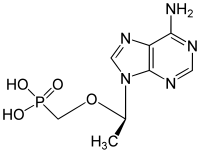
تينوفوڤير فوماريت الديسبروكسيل
 | |
 | |
| البيانات السريرية | |
|---|---|
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | Oral |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية | |
| بيانات الحركية الدوائية | |
| التوافر الحيوي | 25% |
| ارتباط الپروتين | < 1% |
| Elimination half-life | 17 hours |
| الإخراج | Renal |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.129.993 |
| Chemical and physical data | |
| التركيب | C9H14N5O4P |
| الكتلة المولية | 287.213 g/mol |
تينوفوفير/إمتريسيتابين بالإنجليزية: tenofovir/emtricitabine الاسم التجاري تروفادا بالإنجليزية: Truvada عقار توليفي (مشترك) بجرعة ثابتة يتألف من عقارين مضادين للفيروسات القهقرية (بالإنجليزية) يستخدمات في علاج متلازمة العوز المناعي المكتسب هما تينوفوفير (بالإنجليزية) بجرعة 300 مغ وإمتريسيتابين[إزالة القالب] بجرعة 200 مغ. يؤدي خلط العقارين في قرص[إزالة القالب] قرص واحد إلى التقليل من تعديد الأدوية (بالإنجليزية) وزيادة امتثال المريض للعلاج المضاد للفيروسات القهقرية. للدواء أثر وقائي (بالإنجليزية) أيضاً، حيث ثبتت فعاليته في اتقاء العدوى بفيروس العوز المناعي البشري عند غير المصابين به، وفي 10 مايو 2012 أوصت لجنة خبراء إدارة الأغذية والأدوية الأمريكية بترخيص تروفادا في الولايات المتحدة لدواعي اتقاء العدوى بفيروس الأيدز عند الأشخاص ذوي خطر إصابة مرتفع.[1] تأتي هذه التوصيات استناداً إلى ثلاث تجارب سريرية أثبتت أن للعقار مفعول واقٍ عند الذكور المثليين جنسياً والعائلات التي يكون أحد الشريكين مصاباً، وذلك بنسبة بين 44% إلى 75%.
للعقار عدد من الآثار الجانبية مثل الغثيان والإقياء والدوار وفقد الشهية والإسهال وسمية كلوية وكبدية ونقص كثافة العظام. كما أن الإمداد بالمتطلبات الشهرية لكل شخص يكلف 1200 دولار أمريكي، وهي تكلفة لا يتحملها أغلب المحتاجين إلى الدواء في البلدان النامية.
كما عبر عدد من الأطباء وناشطي مكافحة الأيدز عن قلقهم إزاء الاستعمال الوقائي للعقار مما يمكن أن يؤدي إلى تطور المقاومة الدوائية، وقد يعطي شعوراً كاذباً بالأمان لمستخدمي الدواء فيجعلهم يتركون الوسائل الوقائية الأخرى.[1]
أشكال الدواء
Tenofovir disoproxil fumarate هو دواء أولى شكل من Tenofovir. Tenofovir يكون أيضا متوافر في صورة مركب وحيد الجرعة مع emtricitabine في مركب ذو إسم تجارى Truvada بجرعة وحيدة يومية. (Emtricitabine يسوق كمركب وحيد-الجرعة يدعى Emtriva, تسوقه أيضاGilead.) Atripla, مركب ثلاثى التركيب من tenofovir, emtricitabine و efavirenz, أجيز بواسطة FDA في 12 يوليو 2006 وهو متوافر الآن مؤمنا جرعة واحدة يومية لعلاج HIV.
التاريخ
Tenofovir أكتشف خلال بحوث مشتركة بين Antonín Holý في معهد الكيمياء العضوية و الكيمياء الحيوية ,و أكاديمية العلوم بجمهورية التشيك (IOCB) في پراگ, و Erik DeClercq, مؤسسة ريجا للبحوث الطبية, Catholic جامعةLeuven, Belgium.
Tenofovir أجيز بالولايات Food and Drug Administration (FDA) في October 26, 2001 لعلاج HIV, وفى 11 أغسطس, [[2008]لعلاج chronic hepatitis B[2][3].
دواعى الإستعمال
Tenofovir يوصف بالإشتراك مع الأدوية الأخرى المضادة للفيروسات لعلاج عدوى HIV-1 في المرضى البالغين. وهذا الوصف مبنى على تحاليل البلازما HIV-1 RNA lمستويات و CD4 عدد خلاياin في دراسات تمت مراقبتها tenofovir في علاج-naïve و علاج-المرضى البالغين ذوى الخبرة. و لاتوجد نتائج لدراسات أثر التينوفوفير على التطور المرضى HIV.
الآثار الجانبية وتفاعلات الأدوية
The most common side effects associated with tenofovir include nausea, vomiting, diarrhea, and asthenia. Less frequent side effects include hepatotoxicity, abdominal pain, and flatulence.[4] Tenofovir has also been implicated in causing renal toxicity, particularly at elevated concentrations.[5]
Tenofovir can cause acute renal failure, Fanconi syndrome, proteinuria, tubular necrosis. These side effects are due to accumulation of drug in proximal tubule. Tenofovir can interact with didanosine by increasing didanosine's concentration. It also decreases the concentration of Atazanavir sulfate.
HIV risk reduction
A 2006 trial by Family Health International gave either Viread or a placebo to 936 high-risk women in Cameroon, Ghana and Nigeria. While the results show signs that the Viread group contracted HIV at a reduced rate, the researchers cautioned against drawing conclusions from the study because the sample size was so small.[6] [7]
الروابط الخارجية
المراجع
- ^ أ ب "خبراء أمريكيون يؤيدون استخدام دواء «تروفادا» للوقاية من الايدز". بي بي سي عربي. 2012-05-11. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://www.bbc.co.uk/arabic/scienceandtech/2012/05/120510_hiv_drug_.shtml. Retrieved on 2012-05-11. - ^ FDA letter of approval (regarding treatment of hepatitis B)
- ^ FDA Clears Viread for Hepatitis B
- ^ USPDI. Thompson. 2005. pp. 2741–2.
- ^
"Viread Prescribing Guidelines" (PDF). FDA. March 2006. Retrieved 2007-02-12.
{{cite web}}: Check date values in:|date=(help) - ^
"Tenofovir Use Safe for Uninfected, West African Women at Risk of HIV Infection". Family Health International. 2006-08-17. Retrieved 2007-06-01.
{{cite web}}: Check date values in:|date=(help) - ^ "Additional Studies Needed to Assess Effectiveness of Tenofovir for Prevention". Family Health International. Retrieved 2007-06-01.
- Drugs with non-standard legal status
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Articles without EBI source
- Chemical pages without ChemSpiderID
- Articles without KEGG source
- Articles without InChI source
- Articles without UNII source
- Articles containing unverified chemical infoboxes
- مقالات تحوي قالب غير مترجمة بلا ضرورة
- الأدوية الأساسية حسب منظمة الصحة العالمية
- گلعاد للعلوم
- مثبطات ترانسكريپتاز العكسي المضاهية للنيكليوسيد