فلوريد البريليوم
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Beryllium fluoride
| |
| أسماء أخرى
Beryllium difluoride
Difluoroberyllane | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.198 |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | BeF2 |
| كتلة مولية | 47.01 جم/مول hygroscopic |
| المظهر | كتل زجاجية عديمة اللون |
| الكثافة | 1.986 جم/سم3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | شديد الذوبان |
| قابلية الذوبان | قابل للذوبان بشكل ضئيل في الكحول |
| البنية | |
| البنية البلورية | Trigonal, α-quartz |
| الزمرة الفراغية | P3121 (No. 152)، رمز پيرسون hP9[1] |
| ثابت العقد | a = 473.29 pm, c = 517.88 pm |
| الشكل الجزيئي | خطي |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−1028.2 ك.ج/مول أو −1010 |
| Standard molar entropy S |
45 J/mol K |
| سعة الحرارة النوعية، C | 1.102 J/K or 59 J/mol K |
| المخاطر[4] | |
| صفحة بيانات السلامة | InChem MSDS |
| ن.م.ع. مخطط تصويري |    
|
| ن.م.ع. كلمة الاشارة | DANGER |
| H301, H305, H311, H314, H315, H319, H330, H335, H372, H411 | |
| P201, P202, P260, P264, P270, P271, P273, P280, P281, P284, P301+P310, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P308+P313, P310, P312, P314, P320, P321, P322, P330, P361, P363, P391, P403+P233, P405, P501 | |
| نقطة الوميض | Non-flammable |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
90 mg/kg (الفم، الفئران) 100 mg/kg (الفم، الفئران)[3] |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 0.002 mg/m3 C 0.005 mg/m3 (30 minutes), with a maximum peak of 0.025 mg/m3 (as Be)[2] |
REL (الموصى به)
|
Ca C 0.0005 mg/m3 (as Be)[2] |
IDLH (خطر عاجل)
|
Ca [4 mg/m3 (as Be)][2] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كلوريد البريليوم بروميد البريليوم يوديد البريليوم |
كاتيونات أخرى
|
فلوريد المغنسيوم فلوريد الكالسيوم فلوريد السترونشم فلوريد الباريوم فلوريد الراديوم |
مركـّبات ذات علاقة
|
|
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
فلوريد البريليوم (Beryllium fluoride)، هو مركب لاعضوي صيغته الكيميائية BeF2. هذه المادة الصلبة البيضاء هي المادة الأولية الرئيسية لتحضير فلز البريليوم. يشبه تركيبها تركيب الكوارتز، إلا أن فلوريد البريليوم قابل للذوبان في الماء بدرجة عالية.
الخصائص
Beryllium fluoride has distinctive optical properties. In the form of fluoroberyllate glass, it has the lowest refractive index for a solid at room temperature of 1.275. Its dispersive power is the lowest for a solid at 0.0093, and the nonlinear coefficient is also the lowest at 2 × 10−14.
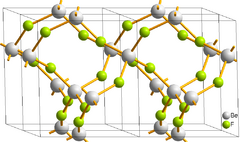
التركيب والارتباط
The structure of solid BeF2 resembles that of cristobalite. Be2+ centers are four coordinate and tetrahedral and the fluoride centers are two-coordinate.[5] The Be-F bond lengths are about 1.54 Å.[6] Analogous to SiO2, BeF2 can also adopt a number of related structures. An analogy also exists between BeF2 and AlF3: both adopt extended structures at mild temperature.
فلوريد البريليوم الغازي والسائل
Gaseous beryllium fluoride adopts a linear structure, with a Be-F distance of 143 pm.[7] BeF2 reaches a vapor pressure of 10 Pa at 686 °C, 100 Pa at 767 °C, 1 kPa at 869 °C, 10 kPa at 999 °C, and 100 kPa at 1172 °C.[8] Molecular BeF
2 in the gaseous state is isoelectronic to carbon dioxide.
As a liquid, beryllium fluoride has a tetrahedral structure. The density of liquid BeF2 decreases near its freezing point, as Be2+ and F− ions begin to coordinate more strongly with one another, leading to the expansion of voids between formula units.[9]
التحضير
The processing of beryllium ores generates impure Be(OH)2. This material reacts with ammonium bifluoride to give ammonium tetrafluoroberyllate:
- Be(OH)2 + 2 (NH4)HF2 → (NH4)2BeF4 + 2 H2O
Tetrafluoroberyllate is a robust ion, which allows its purification by precipitation of various impurities as their hydroxides. Heating purified (NH4)2BeF4 gives the desired product:
- (NH4)2BeF4 → 2 NH3 + 2 HF + BeF2
In general the reactivity of BeF2 ions with fluoride are quite analogous to the reactions of SiO2 with oxides.[10]
التطبيقات
Reduction of BeF2 at 1300 °C with magnesium in a graphite crucible provides the most practical route to metallic beryllium:[7]
- BeF2 + Mg → Be + MgF2
Beryllium chloride is not a useful precursor because of its volatility.[citation needed]
Niche uses
Beryllium fluoride is used in biochemistry, particularly protein crystallography as a mimic of phosphate. Thus, ADP and beryllium fluoride together tend to bind to ATP sites and inhibit protein action, making it possible to crystallise proteins in the bound state.[11][12]
Beryllium fluoride forms a basic constituent of the preferred fluoride salt mixture used in liquid-fluoride nuclear reactors. Typically beryllium fluoride is mixed with lithium fluoride to form a base solvent (FLiBe), into which fluorides of uranium and thorium are introduced. Beryllium fluoride is exceptionally chemically stable, and LiF/BeF2 mixtures (FLiBe) have low melting points (360–459 °C) and the best neutronic properties of fluoride salt combinations appropriate for reactor use. MSRE used two different mixtures in the two cooling circuits.
السلامة
Beryllium compounds are highly toxic. The increased toxicity of beryllium in the presence of fluoride has been noted as early as 1949.[13] The ج.م.50 in mice is about 100 mg/kg by ingestion and 1.8 mg/kg by intravenous injection.
المصادر
- ^ Wright, Albert F.; Fitch, Andrew N.; Wright, Adrian C. (1988). "The preparation and structure of the α- and β-quartz polymorphs of beryllium fluoride". Journal of Solid State Chemistry. 73 (2): 298. Bibcode:1988JSSCh..73..298W. doi:10.1016/0022-4596(88)90113-2.
- ^ أ ب ت NIOSH Pocket Guide to Chemical Hazards 0054
- ^ "Beryllium compounds (as Be)". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Beryllium Difluoride". PubChem. National Institute of Health. Retrieved October 13, 2017.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ Pallavi Ghalsasi, Prasanna S. Ghalsasi, "Single Crystal X-Ray Structure of BeF2: α-Quartz" Inorg. Chem., 2011, 50 (1), pp 86–89. DOI:10.1021/ic101248g
- ^ أ ب Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Vapor pressure, physics.nyu.edu, p. 6-63, from Ohe, S. (1976) Computer Aided Data Book of Vapor Pressure, Data Book Publishing Co., Tokyo.
- ^ Agarwal, M.; Chakravarty C (2007). "Waterlike Structural and Excess Entropy Anomalies in Liquid Beryllium Fluoride". J. Phys. Chem. B. 111 (46): 13294–300. doi:10.1021/jp0753272. PMID 17963376.
- ^ Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Reiko Kagawa; Martin G. Montgomery; Kerstin Braig; Andrew G. W. Leslie; John E. Walker (2004). "The structure of bovine F1-ATPase inhibited by ADP and beryllium fluoride". The EMBO Journal. 23 (5): 2734–2744. doi:10.1038/sj.emboj.7600293. PMC 514953. PMID 15229653.
- ^ Bigay J.; Deterre P.; Pfister C.; Chabre M. (1987). "Fluoride complexes of aluminium or beryllium act on G-proteins as reversibly bound analogues of the gamma phosphate of GTP". The EMBO Journal. 6 (10): 2907–2913. doi:10.1002/j.1460-2075.1987.tb02594.x. PMC 553725. PMID 2826123.
- ^ Fluoride in Drinking Water: A Scientific Review of EPA's Standards (in الإنجليزية). The National Academies Press. 2006. pp. 51–52. doi:10.17226/11571. ISBN 978-0-309-10128-8.
وصلات خارجية
- CS1 errors: unsupported parameter
- CS1 errors: extra text: edition
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Articles with unsourced statements from November 2018
- مركبات البريليوم
- فلوريدات
- Alkaline earth metal halides
- Highly-toxic chemical substances
