نموذج بور
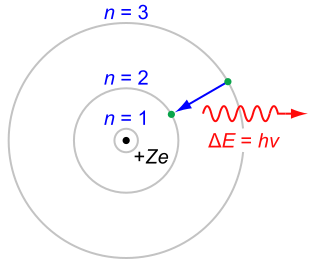
في الفيزياء الذرية نموذج بور يصور الذرة كنواة صغيرة موجبة الشحنة محاطة بالإلكترونات الموجودة في مدارات - وذلك مثل النظام الشمسي . ونظرا لسهولة هذا النموذج فإنه لا يزال يستخدم كمقدمة لدارسي ميكانيكا الكم .
التطور التاريخي
في أوائل القرن العشرين، أثبتت التجارب التى أجراها إرنست رذرفورد وأخرون أن الذرة تتكون من إلكترونات سالبة الشحنة تدور في مدارات حول نواة كثيفة وصغيرة وموجبة الشحنة .
وأبسط أواع الذرات هى ذرة الهيدروجين، والتى تتكون من بروتون وإلكترون مرتبطان معا القوى الكهرستاتيكية . وهذا مخالف لنظام الأرض-الشمس ، والذى يتم الإرتباط فيه عن طريق قوى الجاذبية .
في نموذج بور يمكن للإلكترونات أن تكون فقط على مسافة محددة من البروتون المرتبطة به . وعند تواجدها في أى مكان أخر فإنه يستلزم فقد طاقة ( بالإشعاع الضوئي ) وأخيرا يقل نصف قطر دوران الإلكترون حول البروتون حتى تسقط فيه مما يؤدى لتدمير الذرة . وقد كان هناك دعم لهذه النظرية بخطوط الطيف ، والتى وضحت أن الإلكترونات التى تدور في مدارات ينبعث منها ضوء في ترددات وطاقات معينة .
وعلى هذا فقد إقترح بور في عام 1913 الآتي:
- (1) الإلكترونات التى تدور في مدارات توجد في مدارات لها طاقات (كوانتمية) كم (فيزياء) منفصلة . أى أنه هناك مدارات معينة ممكنة فقط لدوران
الإلكترون .
- (2) قوانين الميكانيكا التقليدية لا يمكن تطبيقها عندما يقوم الإلكترون بعمل القفزات بين المدارات المسمحوح له التواجد فيها.
- (3) عندما يقوم إلكترون بعمل قفزة من مدار لأخر فإن فرق الطاقة إما يكتسب أو يفقد بوحدة واحدة كمية من الطاقة ( تسمى فوتون )، والذى له طاقة تساوى الفرق بين طاقتى المدارين .
- (4) المدارات المسموحة تعتمد على قيم الكمات المنفصلة للمدار العزم الزاوي L طبقا للمعادلة
حيث n=1,2,3,...etc وتسمى عدد العزم الزاوي الكمي
الإفتراض رقم (4) ينص على أن أقل مستوى n=1 . ينطبق على أقل نصف قطر 0.0529 نانو متر ، والذى يعرف بنصف قطر بور . وعندما يتواجد إلكترون في أقل مدار ، لا يمكن أن يقترب من البروتون لأقل من هذه القيمة .
ولوصف أكثر دقة للذرة راجع ميكانيكا الكم . المعالجة الكاملة من ناحية ميكانيكا الكم للذرة أكثر دقة - ولكنها حسابيا أكثر تعقيدا ، وإستخدام نموذج بور يمكن أن يعطى نتائج مفيدة بمجهودات أقل . والشيء الذى يجب تذكره ومثل النماذج الأخرى ، فإن هذا النموذج يساعد في فهم تركيب الذرة ، والتى ليست مجرد نظام شمسي مصغر .
وفي 29 فبراير 1936، نشرت مجلة نيتشر نموذج "وعاء الكريات" لنيلز بور لشرح تأثير قصف الجسيمات على نواة (Vol. 137, p. 344). فقد علـَّق على مقالة في ساينس (20 أغسطس 1937، p. 161) شارحاً أنه “لفهم السمات النمطية للتحورات النووية التي يبدأها ارتطام جسيمات المادة... فالنموذج الميكانيكي البسيط الذي يمثل تلك السمات للتصادمات النووية هو ... وعاء بسيط ضحل بعدد من كرات البلياردو فيه. إذا كان الوعاء خالياً، فإن الكرة المرسلة فيه ستغوص فيه حتى القاع وستعبر إلى الطرف المقابل بطاقتها الأصلية. إلا أنه حين يكون هناك كرات أخرى في الوعاء، ففي ذلك الوقت فإن الكرة الآتية أخيراً لن تتمكن من المرور بحـُرية بل ستـُقـَسـِّم طاقتها، أولاً مع أحد الكرات الأخرى، ثم ستتقاسم تلكما الكرتين طاقتيهما ... مقسمة بين كل الكرات.
إستنتاج مستويات الطاقة الإلكترونية للهيدروجين
نموذج بور دقيق فقط لنظام يحتوى على إلكترون واحد فقط مثل ذرة الهيدروجين أو الأيون الأحادى للهيليوم . وسيتم إستخدام نموذج بور لإستنتاج مستويات الطاقة للهيدروجين .
وسنقوم بالبدء بالثلاث فروض السهلة:
- 1- كل الجسيمات لها طبيعة موجية ، والطول الموجي للإلكترون ، يتناسب مع سرعته v كالتالي :
- حيث ، h هى ثابت بلانك ، هى كتلة الإلكترون . ولم يقم بور بعمل هذا الإفتراض ( والذى يعرف بفرض دى بروليه ) في شكله المشتق الأصلي ، لأنه لم يكن قد تم فرضه في هذا الوقت . عموما فإن هذا يسمح بلإفتراض الآتي :
- 2- محيط المدار الذى يدور فيه الإلكترون لابد أن يكون ناتج من ضرب رقم صحيح في قيمة الطول الموجي للإلكترون :
- حيث ، r نصف قطر المدار الذى يدور فيه الإلكترون ، n هى رقم صحيح .
- 3- يظل الإلكترون في المدار عن طريق قوى كولوم ، وهذه القوى تساوى قوة الجذب المركزية :
- حيث , و e هى شحنة الإلكترون.
وهذه ثلاث معادلات مع ثلاث معطيات غير معلومة : و r ، v . وبعد حل معادلات هذا النظام نجد معادلة واحدة خاصة بالمجهول v نضعها في المعادلة الخاصة بالطاقى الإجمالية للإلكترون :
- وبسبب مبرهنة ڤيريال يتم تبسيط الطاقة الكلية لتصبح :
وأخيراً نجد معادلة تعطينا الطاقة للمستويات المختلفة للهيدروجين :
وعلى هذا، يكون أقل مستويات الطاقة للهيدروجين n=1 يساوى -13.6 eV. ومستوى الطاقة التالى 'n=2 يساوى -3.4 eV ، والثالث 'n=3 يساوى -1.51 eV ، وهكذا.
لاحظ أن كل هذه الطاقات أقل من الصفر، وهذا يعنى أن الإلكترون في حالة إرتباط مع البروتون.
الإنتقال بين مستويات الطاقة (صيغة رايدبرگ)
عندما ينتقل الإلكترون من مستوى طاقة لمستوى اخر ، فإن هناك فوتون يفقد. وبإستخدام المعادلة الخاصة بمستويات الطاقة للهيدروجين يمكن تحديد الأطول الموجية للضوء الذى يمكن أن ينبعث من الهيدروجين.
أولا يتم حساب الطاقة التى تنبعث من الهيدروجين بحساب الفرق بين مستويين من مستويات طاقة الهيدروجين :
- حيث تعنى مستوى الطاقة الأخير، و تعنى مستوى الطاقة المبدئي ( بإفتراض ان مستوى الطاقة الأخير أقل من المستوى المبدئي ).
وحيث ان طاقة الفوتون تساوي :
يكون الطول الموجي للفوتون المنبعث يساوي :
- والذى يعرف بصيغة رايدبرگ.
وهذه المعادلة كانت معروفة للعلماء الذين قاموا بعمل دراسة للطيف في القرن التاسع عشر، ولكن لم يكن لديهم إثبات نظري للمعادلة حتى قام بور بفرض نظريته.
القصور في نموذج بور
فشل نموذج بور في تفسير الآتي:
- تفسير أطياف العناصر الأثقل من الهيدروجين، فهي بالكاد تفسر الذرات التي لها إلكترون وحيد.
- الفروق النسبية لخطوط الطيف.
- تواجد خطوط طيف فائقة الدقة.
- ظاهرة زيمان - والتي تنص على وجود تغير في خطوط الطيف عند وجود مجال مغناطيسي خارجي.
شاهد أيضا
المصادر
المصادر التاريخية
- بور ، نيلز (1913). تركيب الذرات والجزيئات ( الجزء 1 من 3 )
- بور ، نيلز (1913) . تركيب الذرات والجزيئات ( الجزء 2 ) الأنظمة التى تحتوى على نواة وحيدة الإلكترون. Philosophical Magazine 26: 476-502
- بور ، نيلز (1913). تركيب الذرات والجزيئات ( الجزء 3 ) Philosophical Magazine 26: 857-875.
- بور ، نيلز (1914). طيف الهيليوم والهيدروجين. Nature 92: 231-232
المصادر الحديثة
- Tipler, Paul; Llewellyn, Ralph 2002 ، الفيزياء الحديثة ( الطبعة الرابعة ) W. H. Freeman رقم ID=ISBN 0716743450
- ويكيبيديا الإنجليزية.
قراءات اضافية
- Linus Pauling (1970). General Chemistry, Chapter 5-1(3rd ed). San Francisco: W.H. Freeman & Co. A great explainer of Chemistry describes the Bohr model, appropriate for High School and College students.
- Reprint: Linus Pauling (1988). General Chemistry, Chapter 5-1 (3rd ed). New York: Dover Publications. ISBN 0-486-65622-5.
- George Gamow (1985). Thirty years that shook Physics, Chapter 2. Dover Publications. A popularizer of physics explains the Bohr model in the context of the development of quantum mechanics, appropriate for High School and College students
- Walter J. Lehmann (1972). Atomic and Molecular Structure: the development of our concepts, chapter 18. John Wiley and Sons. Great explanations, appropriate for High School and College students
- Paul Tipler and Ralph Llewellyn (2002). Modern Physics (4th ed.). W. H. Freeman. ISBN 0-7167-4345-0.

























