نظام يوتكتي
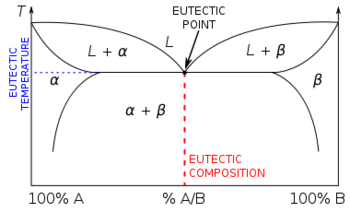
نظام يوتكتي أو نظام أصهري Eutectic system هو خليط من المركبات أو العناصر الكيميائية التي لها تركيب كيميائي يتصلب عند درجة حرارة أقل من أي تركيب آخر. هذا التركيب يـُعرف بإسم "تركيب يوتكتي" ودرجة الحرارة بإسم "درجة الحرارة اليوتكتية". وعلى مخطط الأطوار فإن تقاطع درجة الحرارة اليوتكتية والتركيب اليوتكتي يعطي "النقطة اليوتكتية".[1] وليس كل السبائك الثنائية لها نقطة يوتكتية؛ فعلى سبيل المثال، في نظام الفضة-ذهب، درجة حرارة الصهير (liquidus) ودرجة حرارة التجمد (solidus) كلاهما يزداد برتابة بتغير الخليط من فضة نقية إلى ذهب نقي.[2]
التفاعل اليوتكتي
التفاعل اليوتكتي يـُعرَّف كالتالي:[3]
هذا النوع من التفاعل هو invariant reaction، لأنها في اتزان حراري؛ وهناك طريقة أخرى للتعريف، وهي عندما تكون طاقة گيبس الحرة مساوية لصفر. وبطريقة ملموسة، فإن ذلك يعني أن السائل والمحلولين الصلبين يتعايشون معاً في نفس الوقت وأنهم في اتزان كيميائي. ويجد أيضاً الإمساك الحراري طيلة فترة التفاعل.[3]
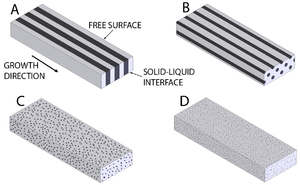
البنية الكبيرة macrostructure الصلبة الناتجة من التفاعل اليوتكتي تعتمد على عوامل قليلة. أهم تلك العوامل هو كيفية تنوّي ونمو المحلولين الصلبين. أكثر البنى شيوعاً هو بنية صفحية، ولكن البنى الأخرى المحتملة تتضمن أشكالاً عصوية وكروية وإبرية.[4]
التركيبات غير اليوتكتية
تركيبات النظام اليوتكتي التي لا تكون تركتيبات يوتكتية يشيع تسميتها إما تحت يوتكتية hypoeutectic أو فوق يوتكتية hypereutectic. التركيبات تحت اليوتكتية هي تلك الواقعة إلى يسار التركيب اليوتكتي، التركيبات فوق اليوتكتية إلى يمين اليوتكتي.[3]
الأنواع
السبائك
السبائك اليوتكتاوية تتكون من مادتين أو أكثر لها تركيب يوتكتية. وعندما تتصلب سبيكة غير يوتكتية، فإن مكوناتها تتصلب عند درجات حرارة مختلفة، مبدية نطاق انصهار لدن. وتصلب السبيكة اليوتكتية عند درجة حرارة حادة واحدة. تحولات الأطوار التي تحدث أثناء تصليب سبيكة معينة يمكن فهمها برسم خط رأسي من الطور السائل إلى الطور الصلب على مخطط الأطوار.
بعض الاستخدامات تتضمن:
- السبائك اليوتكتية المستخدمة في اللحام، تتكون من قصدير (Sn), رصاص (Pb) وأحياناً فضة (Ag) أو ذهب (Au)
- سبائك الصب، مثل الألومنيوم-سيليكون والحديد الزهر (عند تركيب اليوتكتي أوستنتيت-سمنتيت في نظام حديد-كربون)
- احدى الطرق المستخدمة في صناعة أشباه الموصلات هو ربط تشيپات السليكون إلى طبقات تحتية مطلية بالذهب وذلك لحث يوتكتي السليكون-ذهب من خلال تمرير طاقة فائقة الصوتية إلى التشيپة.
- التقسية، حيث الانتشار يمكن أن يزيل العناصر السابكة من الوصلة، حتى يصبح الانصهار اليوتكتي ممكناً فقط في مطلع عملية التقسية
- رد الفعل الحراري، أي فلز وود وفلز فيلد في رشاش اطفاء الحريق
- الاحلالات غير السامة للزئبق ، مثل گالينستان
- الفلزات الزجاجية التجريبية، ذات القوة العالية جداً ومقاومة التآكل
- السبائك اليوتكتية من الصوديوم والبوتاسيوم (NaK) التي تكون سائلة عند درجة حرارة الغرفة وتـُستخدم كمبرّد في المفاعل النووي النيوترونية السريعة التجريبية.
غيرها
نقاط حرجة أخرى
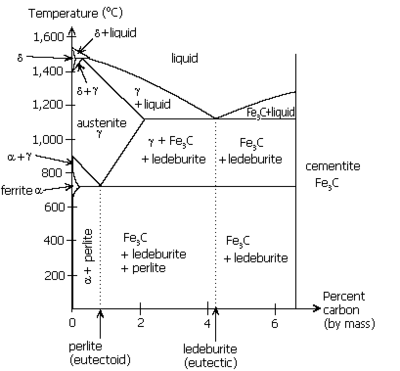
اليوتكتاوي Eutectoid
الحديد والكربون مرحلة الرسم، والتي تبين تحول eutectoid بين الأوستينيت (γ) والبرليت. عندما حل فوق نقطة تحول صلبة، بدلا من السائل، يمكن أن تحول eutectoid مماثل يحدث. على سبيل المثال، في نظامالحديد والكربون، ويمكن للمرحلة الأوستينيت يخضع لعملية تحول eutectoid لانتاج الفريت وcementite، في كثير من الأحيان في هياكل رقائقية مثل البرليت وbainite. هذه نقطة eutectoid يحدث في 723 درجة مئوية (1333 درجة فهرنهايت) والكربون حوالي 0.83٪.
پريتكتية
التحولات Peritectic هي أيضا مشابهة لردود الفعل سهل الانصهار. هنا، في مرحلة السائلة والصلبة ذات أبعاد ثابتة تتفاعل عند درجة حرارة ثابتة لتسفر عن مرحلة واحدة صلبة. منذ أشكال المنتج صلبة في مجال التفاعل بين المواد المتفاعلة2، ويمكن أن تشكل حاجزا نشر ويسبب عموما ردود الفعل هذه على المضي قدما ببطء أكثر بكثير من التحولات سهل الانصهار أو eutectoid. لهذا السبب، عندما تكوين peritectic يتصلب فإنه لا تظهر بنية رقائقية التي يتم العثور عليها مع التصلب سهل الانصهار. مثل هذا التحول موجود في نظام الحديد والكربون، وكما رأينا بالقرب من الزاوية اليسرى العليا من هذا الرقم. انه يشبه سهل الانصهار مقلوب، مع المرحلة δ مع الجمع بين السائل لإنتاج نقي الأوستينيت في 1495 درجة مئوية (2723 درجة فهرنهايت) والكربون 0.17٪. Peritectic التحلل. وقد تم تناول ما يصل إلى هذه النقطة في مناقشة التحولات من وجهة نظر من التبريد. أنها يمكن أيضا أن تناقش مشيرا إلى أن التغيرات التي تحدث لبعض المركبات الكيميائية الصلبة ويتم تسخينها هم. بدلا من الذوبان، فيدرجة حرارة التحلل peritectic، مجمع تتحلل إلى مركب آخر الصلبة والسائلة أ. يتم تحديد نسبة كل من حكم رافعة.المفردات يغير قليلا. تماما كما يطلق عليه في تبريد المياه، الأمر الذي يؤدي إلى جليد وتجميد وارتفاع حرارة الجليد يؤدي الىذوبان. في مرحلة الرسم شركة الاتحاد الأفريقي، على سبيل المثال، يمكن أن ينظر إلى أن اثنين فقط من المراحل تذوب بشكل متطابق، AuAl2 وAu2Al. بقية تتحلل peritectically
انظر أيضاً
الهامش
- ^ Smith & Hashemi 2006, pp. 326–327.
- ^ http://www.crct.polymtl.ca/fact/phase_diagram.php?file=Ag-Au.jpg&dir=SGTE
- ^ أ ب ت Smith & Hashemi 2006, p. 327.
- ^ Smith & Hashemi 2006, pp. 332–333.
ببليوگرافيا
- Smith, William F.; Hashemi, Javad (2006), Foundations of Materials Science and Engineering (4th ed.), McGraw-Hill, ISBN 0-07-295358-6.
للاستزادة
- Askeland, Donald R. (2005). The Science and Engineering of Materials. Thomson-Engineering. ISBN 0-534-55396-6.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Easterling, Edward (1992). Phase Transformations in Metals and Alloys. CRC. ISBN 0-7487-5741-4.
- Mortimer, Robert G. (2000). Physical Chemistry. Academic Press. ISBN 0-12-508345-9.
- Reed-Hill, R.E. (1992). Physical Metallurgy Principles. Thomson-Engineering. ISBN 0-534-92173-6.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Sadoway, Donald (2004). "Phase Equilibria and Phase Diagrams" (pdf). 3.091 Introduction to Solid State Chemistry, Fall 2004. MIT Open Courseware. Retrieved 2006-04-12.
![{\displaystyle {\text{Liquid}}{\xrightarrow[{\text{cooling}}]{\text{eutectic temperature}}}\alpha \,\,{\text{solid solution}}+\beta \,\,{\text{solid solution}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ddd335b6ed20e9308b5e9588ea94d3759fe9fbff)