منحنى الأطوار
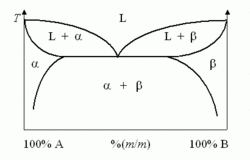
منحنيات الأطوار (Phase Diagrams) عبارة رسوم بيانية تشبه الخرائط تدلنا عند كل درجة الحرارة مثلا علي حالة السبيكة سواء أكانت سائلة أو صلبة أو شبه صلبة و كذلك علي عدد الأطوار المستقرة فيها ونسبة كل طور من وزن السبيكة و التركيب الكميائي لكل طور . أما الشائع والأكثر استخداما من بين أنواع منحنيات الأطوار فهو منحنيات الأطوار الثنائية و ذلك في علم الفلزات )تسمى أحيانا المعادن( و سبائكها. أما منحنيات الأطوار الثلاثية )وهى أكثر تعقيدا و صعوبة من السابقة( فيغلب استخدامها في علوم و تكنولوجيا الخزفيات. أما منحنيات الأطوار الرباعية و ما فوقها فنادرا ما تستخدم لصعوبة استقاء المعلومات منها وكذلك لصعوبة انشائها. ويستعاض عن ذلك بتقريبها من المنحنيات الثنائية أو الثلاثية.
تعريفات
قبل أن نبدأ في شرح منحنيات الأطوار ببعض التفصيل يجب أن نعرف بدقة المقصود من بعض المصطلحات المستخدمة في هذا الموضوع مثل: عنصر و مكون و سائل و جامد و طور و خليط و محلول جامد ، ويجب كذلك أن نتناول بالشرح قاعدة الأطوار لأهميتها هنا.
- عنصر (Element) هو أى من عناصر الجدول الدورى.
- طور (Phase) هو جزء من المنظومة متجانس تجانسا طبيعيا (فزيائيا) و كيميائيا.
- محلول ( Solution) هو الطور الناتج عن ذوبان مكون أو أكثر (يسمى المذاب) في مكون آخر (يسمى المذيب).
- محلول جامد (Solid Solution) هو الطور الناتج عن ذوبان مكون (يسمى المذاب) في مكون آخر (يسمى المذيب) دون أن يغير ذلك في التركيب البللورى للمذيب ( أى أنه مستقر في الحالة الجامدة).
- خليط أو خليط ميكانيكى (Mixture) هو مادة مكونة من أكثر من طور.
- اتزان (Equilibrium) هى الحالة التى لا يحدث فيها أى تفاعل بين الأطوار المتواجدة داخل المنظومة.
- طور شبه مستقر (Metastable Phase) هو الطور المستقر استقرارا مؤقتا في ظروف معينة مثل ضغط و درجة حرارة معينين ، وقد يتحول إلى حالة الاستقرار أو الاتزان عند تغير هذه الظروف.
- درجة الحرية (Degree of Freedom) هى عدد المتغيرات (مثل الضغط و درجة الحرارة و التركيب الكيميائى) الممكن تغييرها بشكل مستقل في ظروف المنظومة دون أن يؤدي ذلك أى تغير في عدد أو نوع الأطوار الموجودة في حالة اتزان داخل المنظومة.
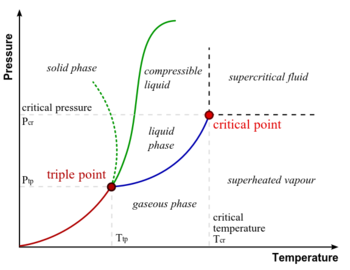
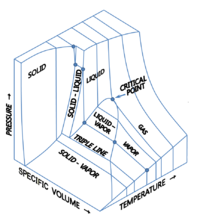
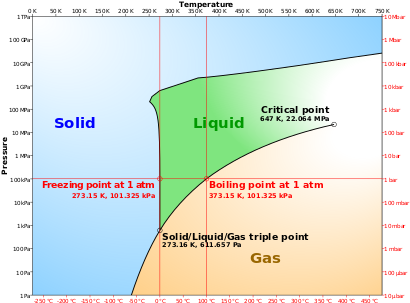
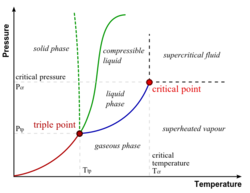
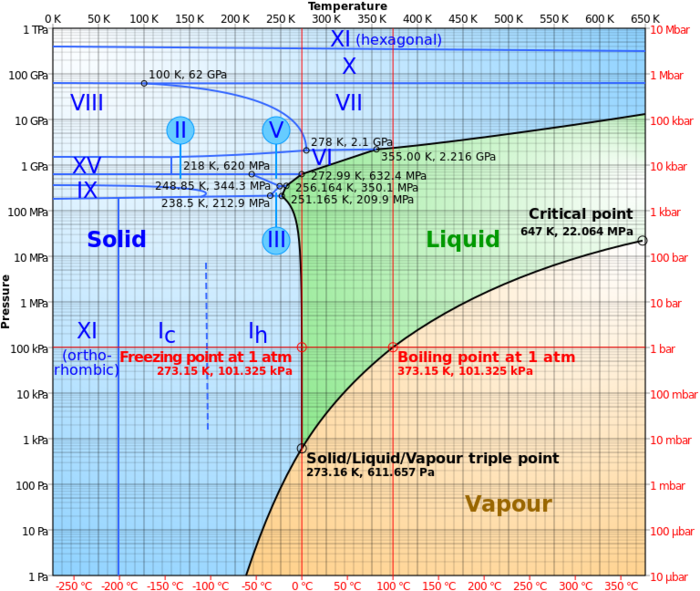
- نقطة ثلاثية (Triple Point) هى الضغط و درجة الحرارة اللازمان لحدوث اتزان بين أطوار المادة النقية (الجامد والسائل والغازى) ، أى تواجد هذه الأطوار معا في حالة مستقرة ، كما هو موضح في الشكل المقابل في حالة الماء.
- المواد النقية (Pure Substance) تتواجد غالبا في ثلاثة أطوار: الجامد والسائل والغازى وذلك تبعا لدرجة الحرارة والضغط المؤثرين عليها، ويتزن الطوران الجامد والسائل عند نقطة الانصهار، أما عند نقطة الغليان فيتزن عندها الطوران السائل والغازى.
مثال
لناخذ مثال الماء واطواره الثلاثة المعروفة: ماء (سائل)، وثلج (صلب)، وبخار (غاز) ومخططه ممثل في الشكل المجاور. نعرف أن الماء يغلي عند درجة حرارة 100 مئوية وتحت الضغط الجوي. ولنتتبع المنحنى إلى اليمين من عند تلك النقكة. فعندما نرفع الضغط عن 1 بار (1 ضغط جوي) نجد أن حالة التوازن بين الماء وبخاره تنتقل يمينا على المنحنى وترتفع نقطة الغليان. ومع استمرار رفعنا للضغط غلى الماء نجد أن درجة الغليان تظل تنزاح طبقا للمنحنى إلى اليمين وترتفع ولا يزال لدينا طورين في حالة توازن : الماء والبخار، حتى نصل إلى ما يسمى نقطة حرجة عندها يختفي سطح الماء ويتشكل ما يشبه الضباب في أنبوبة الأختبار. عند تلك النقطة نكون قد وصلنا أيضا إلى "الضغط الحرج ". وعندما نرفع درجة الحرارة إلى درجة أعلى من النقطة الحرجة ينقشع الضباب ويصبح الأنبوب شفافا وتسمى الماء في تلك الحالة "سائل فوق حرج ". ومعني أن الأنبوب شفافا أن الماء وبخاره قد كونا حالة جديدة لا هي ماء ولا هو بخار، ولا يوجد فاصل بينهما.
وعندما نبرد العينة ثانيا من تلك الدرجة العالية ونصل إلى النقطة الحركة تظهر الحالة الضبابية ثانيا لمدة قصيرة ويعود الصفاء ثانيا مع انخفاض درجة الحرارة عن الدرجة الحرجة ونستطيع رؤية ماء في أسفل الأنبوب وبخار شفاف لأنبوب.
والآن نريد معرفة باقي مخطط الطور، فلنستمر في خفض الضغط تحت 1 ضغط الجوي فنجد ان درجة الغليان تنخفض هي الأخرى تحت 100 درجة مئوية. ونستمر في خفض الضغط على طوري الماء وبخاره ونجد ان درجة الغليان تنخفض بانخفاض الضغط حتى نصل إلى نقطة تسمى نقطة ثلاثية (عند 0 درجة مئوية و 006و0 ضغط جوي)، ويتواجد عندها تلاثة أطوار للماء في نفس الوقت : ماء وثلج وبخار. لذلك تسمى تلك النقطة "نقطة ثلاثية ".
والآن، عندما نخفض الضغط تحت 006و0 ضغط جوي ونتتبع المنحنى السفلي نجد أن هذا الجزء من المنحنى يمثل حالة توازن بين البخار (أسفل) والثلج (أعلى)، ويختفي الماء. أما إذا بدأنا من النقطة الثلاثية وأزدنا الضغط على الثلاثة أطوار نجد أن درجة حرارة انصهار الماء تنخفض هي الأخرى وتصبح أقل من 0 درجة مئوية، ويختفي البخار ويصبح التوازن موجود بين طور الماء السائل وطور الثلج .
الأنواع
أطوار الماء
النقطة الحرجة حسب المفهوم العلمي في الكيمياء الفيزيائية والتحريك الحراري وفيزياء المواد المكثفة هي النقطة من الضغط ودرجة الحرارة التي لا يوجد فيها فواصل واضحة بين حالات المادة، (مثل فواصل بين الحالة السائلة، والحالة الصلبة، أو الحالة الغازية).
يوجد الماء في ثلاثة أطوار : السائل، والغازي في هيئة بخار، والصلب في هيئة الثلج. ومن المعهود لنا تواجد الماء في طورين في نفس الوقت :ماء وبخار، أو ماء وثلج. فمثلا عندما نسخن الماء فيتواجد الماء السائل والبخار. كذلك وجود الطورين ثلج وماء معهود لدينا عند انصهار الثلج.
في الشكل يمثل المحور الأفقي تغير درجة الحرارة والمحور الرأسي تغير الضغط . نجد طبقا لهذا الشكل نقطة تسمى نقطة ثلاثية تتواجد فيها الثلاثة أطوار في نفس الوقت. أما ماعدا ذلك فيوجد طوران في نفس الوقت إما ثلج وماء أو ثلج وبخار أو بخار وماء. وتبين المنحنيات تغير درجة الحرارة وما يتبعها من تغير في الضغط بين كل طورين متلامسين (كل منحنى من تلك الثلاثة منحنيات تشكل توازن بين طورين). عند النقطة الثلاثية تتواجد الثلاثة أطوار في نفس الوقت في حالة توازن.
ما هي حالة التوازن ؟ لدينا في مخطط الطور ثلاثة حالات للتوازن تنتمي إلى الثلاثة فروع من المنحنيات (مخطط طور الماء):
- المنحنى الأزرق : توازن بين الماء وبخاره، بمعنى ان معدل تبخر الماء يكون مساويا لمعدل تكثف البخار.
- المنحنى الأحمر : توازن بين الثلج والبخار، بمعنى أن معدل تحول الثلج إلى بخار يكون مساوية لمعدل تحول البخار إلى ثلح.
- المنحنى الأخضر المنقط : توازن بين الماء والثلج، بمعنى أن معدل تحول الماء إلى ثلج (تجمد) يساوي معدل تحول الثلج إلى ماء (انصهار). مسيرة المنحنى الأخضر المنقط تختص بالماء فقط (حالة شاذة تختص بالماء). أما بقية المواد فهي تتبع الخط الأخضر.
شذوذ الماء :
رأينا أن المنحنى الأخضر المنقط للماء يختلف قليلا عن مسيرة المنحنى الأخضر الخاص بجميع المواد الأخرى (المعروفة) ذلك لأن الماء يتمدد عند تحوله إلى ثلج، بعكس جميع المواد الأخرى فهي تنكمش عند تجمدها.
قيمة الميل dP/dT نحصل عليه من معادلة كلاپيرون للانصهار (الذوبان)[1]
حيث ΔHfus هي حرارة الانصهار التي هي دائماً موجبة، و ΔVfus هي التغير الحجمي للانصهار. لمعظم المواد ΔVfus تكون موجبة حتى أن الميل يكون موجباً. إلا أنه للماء والاستثناءات الأخرى، ΔVfus تكون سالبة حتى أن الميل يكون أيضاً سالباً.
خصائص ثرموديناميكية أخرى
بالاضافة لدرجة الحرارة والضغط، other thermodynamic properties may be graphed in phase diagrams. Examples of such thermodynamic properties include specific volume, specific enthalpy, or specific entropy. For example, single-component graphs of temperature vs. specific entropy (T vs. s) for water/steam or for a refrigerant are commonly used to illustrate thermodynamic cycles such as a Carnot cycle, Rankine cycle, or vapor-compression refrigeration cycle.
In a two-dimensional graph, two of the thermodynamic quantities may be shown on the horizontal and vertical axes. Additional thermodynamic quantities may each be illustrated in increments as a series of lines - curved, straight, or a combination of curved and straight. Each of these iso-lines represents the thermodynamic quantity at a certain constant value.
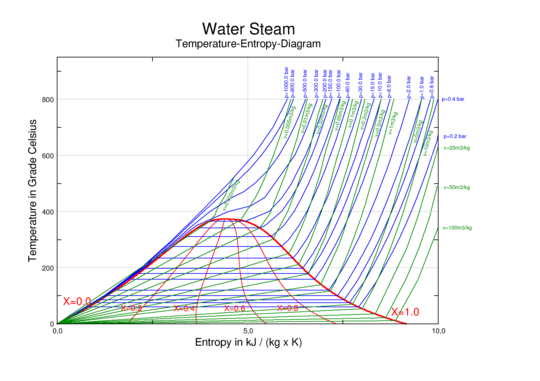
| enthalpy–entropy (h–s) diagram for steam | pressure–enthalpy (p–h) diagram for steam | temperature–entropy (T–s) diagram for steam |
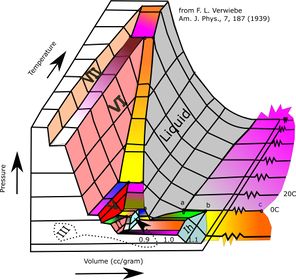
المخططات ثلاثية الأبعاد
It is possible to envision three-dimensional (3D) graphs showing three thermodynamic quantities.[2][3] For example, for a single component, a 3D Cartesian coordinate type graph can show temperature (T) on one axis, pressure (p) on a second axis, and specific volume (v) on a third. Such a 3D graph is sometimes called a p–v–T diagram. The equilibrium conditions are shown as curves on a curved surface in 3D with areas for solid, liquid, and vapor phases and areas where solid and liquid, solid and vapor, or liquid and vapor coexist in equilibrium. A line on the surface called a triple line is where solid, liquid and vapor can all coexist in equilibrium. The critical point remains a point on the surface even on a 3D phase diagram.
للماء، فإن مخطط p–v–T ثلاثي الأبعاد يكون كالتالي:[4]
An orthographic projection of the 3D p–v–T graph showing pressure and temperature as the vertical and horizontal axes collapses the 3D plot into the standard 2D pressure–temperature diagram. When this is done, the solid–vapor, solid–liquid, and liquid–vapor surfaces collapse into three corresponding curved lines meeting at the triple point, which is the collapsed orthographic projection of the triple line.
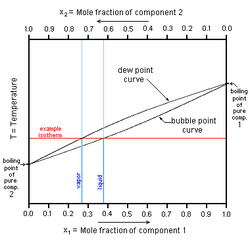
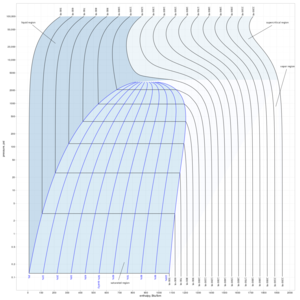
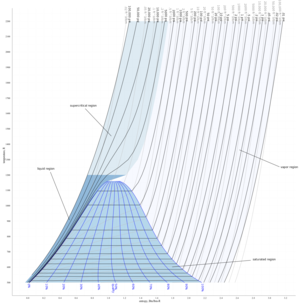
الخليط الثنائي
في هذا الشكل إلى اليسار سائل نقي 2 [ مثل الماء] له درجة غليان مبينة على المحور الرأسي إلى اليسار وإلى اليمين سائل نقي 1 [مثل كحول) وله درجة غليان نقرؤها على المحور الرأسي إلى اليمين. ويبين المحور الأفقي النسبة الموليه وهي تقول أنه عند المحور اليساري تكون نسبة الكحول في الماء 0، فقد افترضنا هنا وجود الماء النقي ودرجة غليانه مبين على المحور الرأسي. فإذا تابعنا زيادة نسبة الكحول في الماء بالانزياح إلى يمين المحور الأفقي، نجد أن نسبة الكحول تتزايد حتى تصبح 1 (أو 100%) عند المحور الرأسي حيث يوجد كحول نقي و 0 ماء. ونستطيع قراءة نقطة غليان الكحول النقي على محوره.
لدينا عند المحور اليميني كحول 100 % و 0% ماء، وبالانزياح نحو اليسار يمكننا معرفة نسبة كل مخلوط، مثل 70% كحول/ 30% ماء أو 50% كحول : 50 % ماء (أو 0.5 كحول/0.5 ماء).
نجد ان كل مخلوط بنسبة معينة له درجة غليان تقع على المنحنى السفلي، وتلك الدرجة تكون بين درجة غليان الماء ودرجة غليان الكحول. تحت هذا المنحنى نجد الحالة السائلة للمخلوط (أزرق). ونجد منحنى ثان أعلى من الأول ويشغله من أعلى مخلوط من يخار الماء وبخار الكحول (أحمر). أما في المساحة المحصورة بين المنحنيين فهي تمثل مخلوط غاز مشبع وسائل (ماء وكحول وبخاريهما في حالة تشبع).
يستخم هذا المنحنى في تتبع عملية التبخير وفصل الكحول عن الماء (انظر تقطير). وتستخم منحنيات مشابهة لفصل معدنين مثلا وتنقيتهما.
مخطط أطوار الحديد والكربون
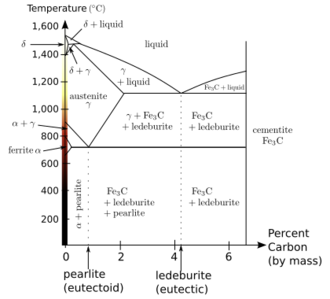
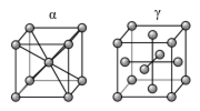
الحديد ألفا المكعب مركزي الجسم و
الحديد گاما نظام بلوري مكعب مركزي الوجه.
يبين منحنى أطوار الحديد والكربون تكوّن العديد من سبائك الحديد تختلف فيما بينها باختلاف نسبة الكربون في الحديد ودرجة الحرارة وطريقة المعاملة الحرارية حتى الوصول إلى درجة حرارة الغرفة أو التقسية. مخطط الحديد والكربون من المخططات الهامة في تقنية الحديد الصلب والفولاذ حيث يتم تصنيع أنواع من الفولاذ تكون فيها نسبة الكربون أقل من 7% (انظر الفولاذ).
ويتسم مخطط الحديد والكربون بنقطتين يوتكتيتين.
النقطة اليوتكتية الأولى في نظام أصهري للحديد والكربون هي أخفض درجة حرارة ينصهر عندها المزيج . فالنقطة تفصل بين الحالة السائلة (أعلى المنحنى) والحالة الصلبة (اسفل المنحنى). طبقا للرسم البياني لاطوار الحديد والكربون نجد نقطة يوتكتية أولى عند درجة حرارة 1140° درجة مئوية ونسبة كربون مقدارها 4.2% في الحديد.
البلورات
Polymorphic and polyamorphic substances have multiple crystal or amorphous phases, which can be graphed in a similar fashion to solid, liquid, and gas phases.
الأطوار الوسيطة
Some organic materials pass through intermediate states between solid and liquid; these states are called mesophases. Attention has been directed to mesophases because they enable display devices and have become commercially important through the so-called liquid-crystal technology. Phase diagrams are used to describe the occurrence of mesophases.[6]
انظر أيضا
- CALPHAD (method)
- Computational thermodynamics
- Congruent melting and incongruent melting
- Gibbs phase rule
- Glass databases
- Hamiltonian mechanics
- Phase separation
- Saturation dome
- Schreinemaker's analysis
- Simple phase envelope algorithm
- حد طور
- حالة سائلة
- ميوعة فائقة
- تقطير
- نسبة مولية
- رواية (تكنولوجيا)
- محلول
المراجع
- ^ Laidler, Keith J.; Meiser, John H. (1982). Physical Chemistry. Benjamin/Cummings. pp. 173–4.
- ^ Zemansky, Mark W.; Dittman, Richard H. (1981). Heat and Thermodynamics (6th ed.). McGraw-Hill. Figs. 2-3, 2-4, 2-5, 10-10, P10-1. ISBN 0-07-072808-9.
- ^ Web applet: 3D Phase Diagrams for Water, Carbon Dioxide and Ammonia. Described in Glasser, Leslie; Herráez, Angel; Hanson, Robert M. (2009). "Interactive 3D Phase Diagrams Using Jmol". Journal of Chemical Education. 86 (5): 566. doi:10.1021/ed086p566.
- ^ David, Carl. "Verwiebe's "3-D" Ice phase diagram reworked".
- ^ Water structure and science Site by Martin Chaplin, accessed 2 July 2015.
- ^ Chandrasekhar, Sivaramakrishna (1992). Liquid Crystals (2nd ed.). Cambridge University Press. pp. 27–29, 356. ISBN 0-521-41747-3.
وصلات خارجية
- A collection of about 150 alloy phase diagrams and some PT diagrams
- Iron-Iron Carbide Phase Diagram Example
- How to build a phase diagram
- Phase Changes: Phase Diagrams: Part 1
- Equilibrium Fe-C phase diagram
المصادر
(1) G. F. Carter and D. E. Paul, Materials Science & Engineering, ASM International, 1991.
(2) W.F. Smith, Principles of Materials Science and Engineering, McGraw-Hill, 1986.
(3) L.H. Van Vlack, Elements of Materials Science and Engineering, 6th edition, Addison-Wesley, 1989.