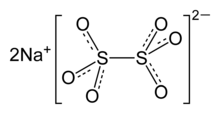
ثنائي ثيونيت الصوديوم
| |
| |

| |
| الأسماء | |
|---|---|
| أسماء أخرى
D-Ox
Hydrolin Reductone Sodium hydrosulfite Sodium sulfoxylate Sulfoxylate Vatrolite Virtex L | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.991 |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
| UN number | 1384 |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Na2S2O4 |
| كتلة مولية | 174.107 g/mol (anhydrous) 210.146 g/mol (dihydrate) |
| المظهر | white to grayish crystalline powder light-lemon colored flakes |
| الرائحة | faint sulfur odor |
| الكثافة | 2.38 g/cm3 (anhydrous) 1.58 g/cm3 (dihydrate) |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 18.2 g/100 mL (anhydrous, 20 °C) 21.9 g/100 mL (Dihydrate, 20 °C) |
| قابلية الذوبان | slightly soluble in alcohol |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Harmful (Xn) |
| توصيف المخاطر | R7, R22, R31 |
| تحذيرات وقائية | (S2), S7/8, S26, S28, S42 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | 100 °C (212 °F; 373 K) |
| 200 °C (392 °F; 473 K) | |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كبريتيت الصوديوم كبريتات الصوديوم |
مركـّبات ذات علاقة
|
ثيوكبريتات الصوديوم بيكبريتيت الصوديوم بيروكبريتيت الصوديوم بيكبريتات الصوديوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
هيدروكبريتيت الصوديوم هو مركب كيميائي له الصيغة Na2S2O4 ، كما يدعى بـثنائي ثيونيت الصوديوم، وهو مركب بلوري أبيض له رائحة كبريت خفيفة. يمتاز بخواصه المرجعة القوية لكنه لا يتمتع بثباتية عالية إذ يتفكك بالماء الساخن وبالمحاليل الحمضية.
التحضير
هناك عدة طرق للتحضير منهما طريقتان للتحضير تعتمدان على استخدام رماد الزنك (zinc dust) في كلتيهما إلا أنه بسبب ارتفاع أسعار معدن الزنك وبسسبب التشريعات البيئية فإن الاعتماد على هذا المعدن في تحضير هذا الملح يتضاءل بشكل مستمر.
الطريقة الأولى
يعالج رماد الزنك مع بيكبريتيت الصوديوم عند درجة حرارة الغرفة:
ناتج التفاعل يعالج بالكلس لتعديل الحموض الحرة ويقلل من انحلالية ZnSO3 والذي تتم تصفيته خارجاً. يضاف كلوريد الصوديوم إلى المحلول فنحصل على Na2S2O4.2H2O والذي ينزع الماء منه بالكحول ثم يجفف. تكون البلورات الناتجة ثابتة فقط في الحالة الجافة.
الطريقة الثانية
تتم بمعالجة محلول مائي مستعلق من رماد الزنك في الفورم ألدهيد(ألدهيد النمل) مع ثاني أكسيد الكبريت عند 80°س. ثم يضاف رماد الصودا (كربونات الصوديوم) فنحصل على ملح الصوديوم للملح الناتج والذي يستحصل عليه بشكل نقي بالتقطير تحت الفراغ.
الطريقة الثالثة
تعتمد على إرجاع كبريتيت الصوديوم بـملغمة الصوديوم.
الطريقة الرابعة
يتفاعل فيها فورمات الصوديوم (نملات الصوديوم) في محلول قلوي غولي مع ثاني أكسيد الكبريت.
الاستخدامات
- يستخدم بشكل واسع في صناعة الأصبغة نظراً لخاصيته المرجعة القوية، حيث يقوم بإرجاع بعض الأصبغة إلى أشكالها المنحلة.
- يستخدم في الصناعات الورقية لقصر عجينة الورق.
- يستخدم في إزالة لون الحديد الأحمر من الصلصال.
انظر أيضاً
المصادر
shreve´s chemical process industries, fifth edition, ISBN 0-07-057147-3
