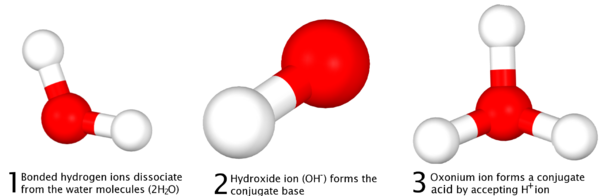
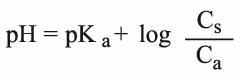تفاعل حمض-قلوي
تفاعل حمض-قلوي تفاعل كيميائي يحدث بين الحمض و القلوي . عدة مصطلحات تستخدم هنا لوصف آليات التفاعل و شرح هذه التفاعلات و تطبيقاتها . بالرغم من تشابه تعريفات الحمض و الأساس فإن كل تعرف له أهميته في التحليلات لطريقة عمل التفاعل و استخدامات تفاعلات حمض-قلوي من اجل المواد الغازية او السائلة .أول هذه التعريفات كان عن طريق الكيميائي الفرنسي أنطوان لاڤوازييه حوالي 1776 [1]
يعرف تفاعل حمض-قلوي انه النسبة الثابتة بين الحموض والأسس في العضوية، ويتحدد التوازن حمض ـ أساس للوسط الداخلي الضروري للحياة بتركيز أيونات الهيدروجين. ويعبر عن هذا التركيز بالقيمة اللغريتمية السالبة لتركيز هذه الأيونات أي الباهاء PH، لوجود علاقة ثابتة بين تركيزي أيونات الهيدروجين +H، وأيونات الهيدروكسيل OH-، وهي: [OH-] [H+] د=10-14، فإن الـPH يعبر أيضاً عن تركيز أيونات الهيدروكسيل، ويكون تركيزا أيونات الهيدروجين والهدروكسيل متساوييْن في الوسط المعتدل ويساويان 10 -7 (أي أن PH د=7) ويراوح PH الوسط الداخلي للعضوية عادة بين (7.35 و7.40)، فيحدث الحُماض (acidose) عندما يكون الـPH أقل من 7.35، والقلاء (alcalose) عندما يكون أعلى من7.40، ولا تكون الحياة ممكنة إلا إذا بقي الـPH بين القيمتين 7 و7.8. وتملك العضوية للمحافظة على قيمة الـPH ضمن المجال المذكور نظماً موقية Les systemes tampons وعضوين منظمين هما الرئة والكلية.
نظريات الحمض-قلوي الشائعة
تعريف لاڤوازييه
لما كانت معرفة لاڤوازييه بالأحماض القوية محصورة عموماً في oxyacids, التي نتحى إلى احتواء ذرات مركزية في حالات الأكسدة العالية محاطة بالأكسجين, مثل HNO3 و H2SO4, ولما كان لا يعلم بالتركيب الحقيقي للأحماض الهيدروهالية , HCl, HBr, and HI, فقد عرَّف الأحماض بناء على احتوائهم على الأكسجين, الذي كان هو أول من سماه بهذا الاسم من الكلميات اليونانية التي تعني "مشكـِّـل-الحمض" (من اليونانية οξυς (oxys) التي تعني "حمض" أو "حاد" و γεινομαι (geinomai) أي "مـُشكـِّـل engender"). وقد اُومن بتعريف لافوازييه كحقيقة مطلقة لأكثر من 30 عاماً, حتى مقالة ثم محاضرات عام 1810 من قيل همفري داڤي التي أثبت فيها انعدام الأكسجين في H2S, H2Te, و الأحماض الهيدروهالية.
تعريف ليبيگ
هذا التعريف اقترحه يوستوس فون ليبيگ حوالي 1838,[2] بناءً على أبحاثه المستفيضة في التركيب الكيميائي للأحماض العضوية.
تعريف أرهنيوس
تعريف برونستد-لاوري
 مقالة مفصلة: نظرية بونستد-لاوري للحمض-قلوي
مقالة مفصلة: نظرية بونستد-لاوري للحمض-قلوي
|
تنظيم التوازن حمض ـ أساس
يتألف النظام الموقِّي عادة من مزيج حمض ضعيف وملحه، ويكون مسؤولاً عن تخفيف خطر حدوث تبدل مفاجىء في PH الوسط إذا ما دخلته كمية زائدة من حمض قوي أو أساس قوي. ويتم ذلك عن طريق تحويل هذه الزيادة إلى حمض ضعيف أو أساس ضعيف وفق المعادلة:
ويتناسب تركيز شوارد الهدروجين في المحلول الموقي مع نسبة تركيز الحمض Ca إلى تركيز الملح Cs كما تُبين معادلة هندرسون ـ هاسلباخ الآتية:
حيث يمثل Ka ثابت تأين الحمض، ويعد النظام الموقي الذي تمتلكه المصوَّرة Plasma من أكثر النظم المعروفة الآلية. ويتألف هذا النظام من حمض الكربون وملحه بيكربونات الصوديوم. وتتم المحافظة على تركيز ثابت من هذين المركبين بطرح أي فائض من حمض الكربون عن طريق الرئة وأي فائض من بيكربونات الصوديوم عن طريق الكلية، ويدل على كمية البيكربونات المتوافرة لتعديل خطر حدوث الحماض بالميلّي مكافىء في اللترm Eq/L وتمثل هذه الكمية أكثر من نصف كمية أنيونات محاليل المصورة الموقية.
تشخيص اضطرابات التوازن حمض ـ أساس ومعالجتها
لا توجد أعراض واضحة لاضطرابات التوازن حمض ـ أساس، ولذلك يعتمد التشخيص على دراسة النظام بيكربونات ـ حمض الكربون. ويمكن أن تتم دراسة التوازن حمض ـ أساس باستخدام معادلة هندرسون ـ هاسلباخ التي يمكن بوساطتها حساب أحد المعاملات الثلاثة بعد قياس المعاملين الآخرين. وهكذا يمكن تعيين الـPH وتركيز CO2 الكلي وضغط CO2. وتكون البيكربونات مسؤولة عن الاضطراب الاستقلابي، أما القلاء والحماض الغازيين فيتعلقان بتركيز H2CO3. ويؤدي الخلل إلى تركيز أيٍ من هذين المركبين إلى اضطرابات سريرية وبيولوجية محددة تعتمد معالجتها على التحميض أو القلونة حسب الحال.[4]
انظر أيضا
- Electron configuration
- بنية لويس Lewis structure
- بنية الطنين Resonance structure
- برتنة Protonation و نزع بروتون Deprotonation
- استبدال محب للنواة Nucleophilic substitution و تفاعل أكجعة Redox reaction
ملاحظات
- ^ Miessler, L. M., Tar, D. A., (1991) p166 - Table of discoveries attributes Antoine Lavoisier as the first to posit a scientific theory in relation to حمض أكسجيني oxyacid.
- ^ Miessler, L. M., Tar, D. A., (1991) p166 - table of discoveries attributes Justus von Liebig's publication as 1838
- ^ Miessler, L. M., Tar, D. A., (1991) p165
- ^ غدير زيزفون. "توازن الحمض مع الأساس". الموسوعة العربية.
مراجع
- Miessler, L. M., Tar, D. A., (1991) "Inorganic Chemistry" 2nd ed. Pearson Prentice-Hall
- Clayden, J., Warren, S., et al. (2000) "Organic Chemistry" Oxford University Press
- Meyers, R. (2003) "The Basics of Chemistry" Greenwood Press
- Lux, Hermann (1939). ""Säuren" und "Basen" im Schmelzfluss: die Bestimmung. der Sauerstoffionen-Konzentration". Ztschr. Elektrochem. 45 (4): 303–309.
- Translated as: Lux, Hermann: “Acids” and “bases” in a fused salt bath: the determination of oxygen-ion. In: Journal of Electrochemistry, Vol 45 (1939), S. 303–309
- Drago, Russel S. (1966). "The Synthesis of Oxyhalides Utilizing Fused-Salt Media". Inorg. Chem. 5 (4): 677–682. doi:10.1021/ic50038a038.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - H. L. Finston and A. C. Rychtman, A New View of Current Acid-Base Theories, John Wiley & Sons, New York, 1982, pp. 140-146.
- Franz, H. (1966). "Solubility of Water Vapor in Alkali Borate Melts". J. Am. Ceram. Soc. 49 (9): 473–477.
- International Union of Pure and Applied Chemistry (2006) IUPAC Compendium of Chemical Terminology, Electronic version Retrieved from International Union of Pure and Applied Chemistry on 09 May, 2007 on URL http://goldbook.iupac.org/O04379.html
- Murray, K. K., Boyd, R. K., et al. (2006) "Standard definition of terms relating to mass spectrometry recommendations" International Union of Pure and Applied Chemistry.