هلجنة
في الكيمياء، الهلجنة (إنگليزية: halogenation)، هي تفاعل كيميائي يستلزم إدخال واحد أو أكثر من الهالوجينات إلى مركب كيميائي. المركبات التي تحتوي على الهاليد منتشرة، مما يجعل هذا النوع من التحول هاماً، على سبيل المثال. في إنتاج الپوليمرات، الأدوية.[1]
في الواقع، هذا النوع من التحويل شائع جدًا لدرجة أن النظرة العامة الشاملة تشكل تحديًا. تتناول هذه المقالة بشكل أساسي الهلجنة باستخدام الهالوجينات العنصرية (F
2، Cl
2، Br
2، I
2). يتم أيضًا تقديم الهاليدات بشكل شائع باستخدام أملاح الهاليدات وأحماض الهالوجين.قالب:Cln يوجد العديد من الكواشف المتخصصة لإدخال الهالوجينات في الركائز، على سبيل المثال كلوريد الثيونيل.
الكيمياء العضوية
توجد عدة مسارات لهلجنة المركبات العضوية، بما في ذلك هلجنة الجذور الحرة، الهلجنة الكيتونية، الهلجنة الكهربية، وتفاعل إضافة الهالوجين. تحدد طبيعة الركيزة المسار. تتأثر طريقىة الهلجنة بالهالوجين. الفلور والكلور أكثر ألفة للإلكترونات وأكثر عوامل الهلجنة عدوانية. البروم هو عامل هلجنة أضعف من كل من الفلور والكلور، في حين أن اليود هو الأقل تفاعلاً بينهم جميعًا. تتبع طريقة نزع هاليد الهيدروجين الاتجاه المعاكس: يزال اليود بسهولة من المركبات العضوية، وتكون مركبات الفلور العضوي مستقرة للغاية.
هلجنة الجذور الحرة
هلجنة الهيدروكربونات المشبعة هو تفاعل استبدال. يتطلب التفاعل عادة مسارات جذور حرة. تُحدد الكيمياء الحيوية لهلجنة الألكانات إلى حد كبير من خلال الضعف النسبي روابط C–H. ينعكس هذا الاتجاه من خلال التفاعل الأسرع في المواضع الثالثية والثانوية.
تعتبر الفلورة بعنصر الفلور (F
2) طاردة للحرارة بشكل خاص، لدرجة أنها تتطلب ظروفًا وأجهزة متخصصة للغاية. تولد طريقة الفلورة الكهروكيميائية كميات صغيرة من عنصر الفلور في الموقع من فلوريد الهيدروجين. تتجنب هذه الطريقة مخاطر التعامل مع غاز الفلور. يتم فلورة العديد من المركبات العضوية العضوية تجاريًا باستخدام هذه التقنية. بصرف النظر عن F
2 والمكافئ المولد كهروكيميائيًا، يُستخدم فلوريد الكوبالت الثلاثي كمصادر لجذور الفلور.
تستخدم كلورة الجذور الحرة للإنتاج الصناعي لبعض المذيبات:[2]
- CH
4 + Cl
2 → CH
3Cl + HCl
عادةً ما تنتج مركبات البروم العضوي الموجود بشكل طبيعي عن طريق مسار جذري حر محفز بواسطة إنزيم بروموبيروكسيديز. يتطلب التفاعل بروميد مع الأكسجين كـ عامل مؤكسد. تشير التقديرات إلى أن المحيطات تطلق ما يتراوح بين 1-2 مليون طن من البروموفورم و56.000 طن من البروموميثان سنويًا.[3]قالب:Cln
تفاعل اليودوفورم، والذي يتضمن تحلل كيتون الميثيل، يتم عن طريق يودنة الجذور الحرة.
إضافة الهالوجينات إلى الألكينات والألكاينات
المركبات غير المشبعة، وخاصة الألكينات والألكاينات، تضيف الهالوجينات:
- R−CH=CH−R' + X
2 → R−CHX−CHX−R'
في كلورة الأكسجين، يعمل مزيج كلوريد الهيدروجين والأكسجين كمعادل للكلور، كما هو موضح في هذا المسار إلى 2،1-ثنائي كلورو الإيثان:
- 4 HCl + 2 CH
2=CH
2 + O
2 → 2 Cl−CH
2−CH
2−Cl + 2 H
2O
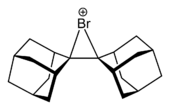
تضاف الهالوجينات إلى الألكينات عبر وسائط أيونات الهالونيوم. وفي حالات خاصة، عُزلت هذه الوسائط.[4]
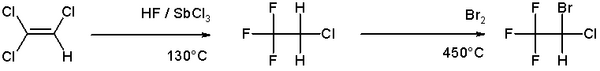
تعتبر البرومة أكثر انتقائية من الكلورة لأن التفاعل أقل طرداً للحرارة. من الأمثلة التوضيحية لبرومة الألكين هو المسار إلى مخدر الهالوثان من ثلاثي كلور الإيثيلين:[5]
يمكن أن تتم عمليتي اليودنة والبرومة بإضافة اليود والبروم إلى الألكينات. التفاعل، الذي يتم بشكل ملائم مع تفريغ لون I
2 and Br
2، هو أساس الطريقة التحليلية. رقم اليود والبروم هما مقياسان لدرجة عدم تشبع الدهون والمركبات العضوية الأخرى.
هلجنة المركبات الأروماتية
تخضع المركبات الأروماتية إلى للهلجنة المحبة للإلكترونات:
- R−C
6H
5 + X
2 → HX + R−C
6H
4−X
عادةً ما يعمل هذا النوع من التفاعلات بشكل جيد مع الكلور والبروم. في كثير من الأحيان يستخدم محفز حمض لويس، مثل كلوريد الحديديك.[6] تتوفر العديد من الإجراءات التفصيلية.[7][8] نظرًا لأن الفلور تفاعلي، تستخدم طرق أخرى، مثل تفاعل بالز-شيمان، لتحضير المركبات الأروماتية المفلورة.
طرق هلجنة أخرى
في تفاعل هونسديكر، يتم تحويل الأحماض الكربوكسيلية إلى هاليد عضوي، حيث تُقصر سلسلة الكربون بمقدار ذرة كربون واحدة بالنسبة إلى سلسلة الكربون في حمض كربوكسيلي خاص. يتم أولاً تحويل الحمض الكربوكسيلي إلى ملح الفضة، والذي يتم أكسدته بعد ذلك مع الهالوجين:
- R−COO−
Ag+
+ Br
2 → R−Br + CO
2 + Ag+
Br− - CH
3−COO−
Ag+
+ Br
2 → CH
3−Br + CO
2 + Ag+
Br−
تتفاعل العديد من المركبات الفلزية العضوية مع الهالوجينات لتعطي الهاليد العضوي:
- RM + X
2 → RX + MX - [[n−
Butyllithium|CH
3CH
2CH
2CH
2Li]] + Cl
2 → [[−
1chlorobutane|CH
3CH
2CH
2CH
2Cl]] + LiCl
الكيمياء الغير عضوية
جميع العناصر ما عدا الأرگون، النيون، والهيليوم تشكل فلوريدات عن طريق التفاعل المباشر مع الفلور. الكلور أكثر انتقائية قليلاً، لكنه لا يزال يتفاعل مع معظم المعادن واللافلزات الأثقل. باتباع الاتجاه المعتاد، يكون البروم أقل تفاعلية واليود أقل تفاعلية من أي عنصر آخر. من بين التفاعلات العديدة الممكنة، هو تكوين كلوريد الذهب الثلاثي بواسطة كلورة الذهب. لا تعد كلورة المعادن ذات أهمية صناعية كبيرة نظرًا لأن الكلوريدات تُحضر بسهولة أكبر من الأكاسيد وكلوريد الهيدروجين. حيث يتم كلورة المركبات غير العضوية على نطاق واسع نسبيًا لإنتاج ثلاثي كلوريد الفوسفور وثنائي كلوريد ثنائي الكبريت.[9]
انظر أيضاً
- نزع الهالوجين
- هالوألكان (هاليد الألكيل)
- هالوجينوأرين (هاليد الأريل)
- هلجنة الجذور الحرة
- هالوكيتون
- استبدال محب للإلكترون
المصادر
- ^ Hudlicky, Milos; Hudlicky, Tomas (1983). "Formation of Carbon-Halogen Bonds". In S. Patai; Z. Rappoport (eds.). Halides, Pseudo-Halides and Azides: Part 2 (1983). PATAI's Chemistry of Functional Groups. pp. 1021–1172. doi:10.1002/9780470771723.ch3. ISBN 9780470771723.
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_233.pub2.
{{cite encyclopedia}}: Cite has empty unknown parameter:|authors=(help) - ^ Gribble, Gordon W. (1999). "The diversity of naturally occurring organobromine compounds". Chemical Society Reviews. 28 (5): 335–346. doi:10.1039/a900201d.
- ^ T. Mori; R. Rathore (1998). "X-Ray structure of bridged 2,2′-bi(adamant-2-ylidene) chloronium cation and comparison of its reactivity with a singly bonded chloroarenium cation". Chem. Commun. (8): 927–928. doi:10.1039/a709063c.
- ^ Synthesis of Essential Drugs, Ruben Vardanyan, Victor Hruby; Elsevier 2005 ISBN 0-444-52166-6
- ^ Beck, Uwe; Löser, Eckhard (2011). "Chlorinated Benzenes and Other Nucleus-Chlorinated Aromatic Hydrocarbons". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.o06_o03. ISBN 978-3527306732.
- ^ Organic chemistry by Jonathan Clayden, Nick Grieves, Stuart Warren, Oxford University Press
- ^ Edward R. Atkinson, Donald M. Murphy, and James E. Lufkin (1951). "dl-4,4′,6,6′-Tetrachlorodiphenic Acid". Organic Syntheses. 31: 96. doi:10.15227/orgsyn.031.0096
{{cite journal}}: CS1 maint: multiple names: authors list (link). - ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.