الفلزات في الطب
تستخدم الفلزات في الطب في الأنظمة العضوية لأغراض التشخيص والعلاج.[1] العناصر غير العضوية ضرورية أيضًا للحياة العضوية كعوامل مساعدة في إنزيمات تسمى البروتينات الفلزية . عندما تكون الفلزات نادرة أو بكميات عالية ، فإن الموازنة تخرج عن التوازن ويجب إعادتها إلى حالته الطبيعية عبر الأساليب التدخلية والطبيعية.
الفلزات السامة
يمكن أن تكون الفلزات سامة عندما تكون بكميات كبيرة. يمكن أن يؤدي الابتلاع أو مسارات الايض الخاطئة إلى تسمم الفلزات. تشمل مصادر المعادن السامة الكادميوم من التبغ والزرنيخ من الزراعة والزئبق من البراكين وحرائق الغابات. الطبيعة ، في شكل أشجار ونباتات ، قادرة على حبس العديد من السموم ويمكن أن تعيد مستويات عالية بشكل غير طبيعي إلى التوازن. عادة ما يتم علاج التسمم بالفلزات السامة بنوع من العوامل الخلابية.[2][3] التسمم بالفلزات الثقيلة ، مثل الزئبق ، الكادميون ، الزرنيخ ، ضار بشكل خاص..
تتضمن أمثلة أنواع معينة من الفلزات السامة ما يلي:
- النحاس : عادة ما تظهر سمية النحاس نفسها كأثر جانبي لمستويات منخفضة من بروتين السيرولوبلازمين ، والذي يشارك عادة في تخزين النحاس. يشار إلى هذا باسم مرض ويلسون . مرض ويلسون هو اضطراب جيني وراثي متنحي يتسبب تحوره في إنزيم الأدينوسين ثلاثي الفوسفات الذي ينقل النحاس إلى المرارة ويدمجه في النهاية في السيرولوبلازمين إلى خلل وظيفي.
- الپلوتونيوم : منذ العصر النووي ، أصبح التسمم بالبلوتونيوم خطرًا محتملاً ، خاصة بين العاملين في المفاعلات النووية ؛ يعتبر استنشاق غبار البلوتونيوم خطيرًا بشكل خاص بسبب انبعاث جسيمات ألفا الشديدة. كانت هناك حالات قليلة جدًا من التسمم بالبلوتونيوم.
- الزئبق : يُبتلع الزئبق عادة من مصادر زراعية أو مصادر بيئية أخرى. يمكن أن يؤدي التسمم بالزئبق إلى أمراض عصبية وفشل كلوي إذا ترك دون علاج.
- الحديد : سمية الحديد ، تسمم الحديد ، أو الحديد الزائد معروفة جيدا. يختبر الحديد إيجابيًا بشكل ضعيف جدًا لاختبار أميس للسرطان ، ومع ذلك ، نظرًا لأنه محفز قوي وضروري لإنتاج أدينوسين ثلاثي الفوسفات وبالتالي إنتاج الحمض النووي ، فإن أي حديد قابل للذوبان يكون سامًا خاصة بمرور الوقت. تم ربط الكثير من الحديد المترسب في الأنسجة أو المستويات العالية في مجرى الدم بنجاح بالغالبية العظمى من الأمراض البشرية من مرض الزهايمر إلى الملاريا. في علم النبات ، يعتبر الحديد مشكلة خطيرة لري النباتات مثل الأرز والذرة والقمح في أفريقيا جنوب الصحراء حيث تحتوي مياهها الجوفية على كميات زائدة من الحديد مما يؤدي إلى تسمم هذه المحاصيل.
- الرصاص والكادميوم : التسمم بالرصاص والكادميوم يمكن أن يؤدي إلى خلل في الجهاز الهضمي والكلى والعصبي. أدى استخدام الدهانات الخالية من الرصاص والغاز إلى تقليل عدد حالات التسمم بالرصاص بالمعادن الثقيلة.
- النيكل والكروم والكادميوم : من خلال تفاعلات الدنا المعدنية ، يمكن أن تكون هذه المعادن مسببة للسرطان.[3]
- النيكل : تنتشر الحساسية تجاه النيكل ، خاصةً من الجلد إلى المعدن عبر المجوهرات.
- الزنك والكادميوم والمغنيسيوم والكروم : يمكن أن تحدث حمى الأبخرة الفلزية عن طريق ابتلاع أبخرة هذه الفلزية وتؤدي إلى أعراض تشبه الدخان.
فقر الدم الفلزي
يحتاج البشر إلى كمية معينة من فلزات معينة ليعملوا بشكل طبيعي. تُستخدم معظم الفلزات كعوامل مساعدة أو أطراف صناعية في الإنزيمات ، وتحفز تفاعلات محددة وتؤدي أدوارًا أساسية. الفلزات الأساسية للإنسان هي: الصوديوم والبوتاسيوم والمغنيسيوم والنحاس والفاناديوم والكروم والمنغنيز والحديد والكوبالت والنيكل والزنك والموليبدينوم والكادميوم . تنجم أعراض فقر الدم عن نقص فلز أساسي معين. يمكن أن يترافق فقر الدم مع سوء التغذية أو خلل في عمليات الايض ، وعادة ما يكون سببها خلل جيني.[3]
تتضمن أمثلة أنواع معينة من فقر الدم الفلزي ما يلي:
- الحديد : فقر الدم البسيط الشائع (نقص الحديد) ، يؤدي إلى فقدان بروتينات الهيم الوظيفية ( الهيموگلوبين ، الميوگلوبين ، إلخ) ، المسؤولة عن نقل الأكسجين أو الاستفادة منه. يأتي فقر الدم الخبيث من نقص فيتامين ب 12 (الذي يحتوي على مركب كوبالت يسمى كوبالامين) ، والذي بدوره يتداخل مع وظيفة خلايا الدم الحمراء.
- الزنك : فقر الدم بالزنك يرجع في الغالب إلى النظام الغذائي يمكن أن يؤدي إلى تأخر النمو.
- النحاس : ينتج فقر الدم النحاسي عند الرضع عن سوء التغذية ويمكن أن يسبب أمراض القلب.[3]
الفلزات في التشخيص
غالبًا ما تستخدم أيونات الفلزات في التصوير الطبي التشخيصي. يمكن استخدام المجمعات الفلزية إما للتصوير بالنظائر المشعة (من إشعاعها المنبعث) أو كعوامل تباين ، على سبيل المثال ، في التصوير بالرنين المغناطيسي (MRI). يمكن تحسين مثل هذا التصوير عن طريق التلاعب بالروابط في معقد لخلق خصوصية بحيث يتم تناول المعقد بواسطة نوع خلية أو عضو معين.[3][4]
تشمل أمثلة الفلزات المستخدمة في التشخيص ما يلي:
- تكنيشيوم . 99m Tc هو عامل النظائر المشعة الأكثر استخدامًا لأغراض التصوير. لها عمر نصف قصير ، ولا تصدر إلا فوتونات أشعة جاما ، ولا تصدر جسيمات بيتا أو ألفا (وهي أكثر ضررًا للخلايا المحيطة) ، وبالتالي فهي مناسبة بشكل خاص كنظير إشعاعي للتصوير.
- الگادولينيوم (III) ، والحديد (III) ، والمنغنيز (II): للتصوير بالرنين المغناطيسي ، هناك حاجة إلى الفلزات شبه المغناطيسية للتصوير المتباين. الجادولينيوم (III) والحديد (III) والمنجنيز (II) كلها فلزات مغناطيسية قادرة على تغيير أوقات استرخاء الأنسجة وإنتاج صورة تباين.
- الغاليوم -68 مفيد كمصدر بوزيترون للتصوير مقطعي بابتعاث البوزيترونات .
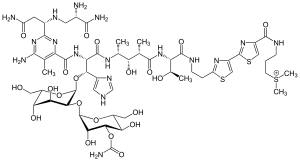
- الكوبالت (III): 57 يستخدم الكوبالت (III) مع مركب البليومايسين (BLM) (الشكل 1) ، وهو مضاد حيوي ، ليتم التقاطه بشكل انتقائي بواسطة الخلايا السرطانية. ينتج عن استخدام الكوبالت أفضل نسبة توزيع للدم إلى الورم ، لكن نصف عمره أطول من أن يفضي إلى أغراض التصوير. تم اقتراح حل لربط جزء ثنائي أمين الإيثيلين رباعي حمض الأسيتيك بحلقة الثيازول الطرفية للبليومايسين ، والتي تم تمييزها إشعاعيًا بحيث يمكن تتبع المجمع بأكمله. يمكن أن يوفر هذا النظام مواقع الورم بدقة ، مما يؤدي إلى الكشف المبكر والمزيد من الإجراءات غير الغازية في المستقبل.[3]
الفلزات في العلاج
تم استخدام الفلزات في العلاجات منذ العصور القديمة. بردية إبيرس من عام 1500 قبل الميلاد هي أول حساب مكتوب لاستخدام الفلزات في العلاج ويصف استخدام النحاس لتقليل الالتهاب واستخدام الحديد لعلاج فقر الدم. تم استخدام فاندات الصوديوم منذ أوائل القرن العشرين لعلاج التهاب المفاصل الروماتويدي. تم استخدام الفلزات مؤخرًا لعلاج السرطان ، من خلال مهاجمة الخلايا السرطانية على وجه التحديد والتفاعل المباشر مع الحمض النووي. يمكن أن تتفاعل الشحنة الموجبة في معظم الفلزات مع الشحنة السالبة للعمود الفقري للفوسفات في الحمض النووي. تم تطوير بعض الأدوية التي تتضمن فلزات تتفاعل بشكل مباشر مع فلزات أخرى موجودة بالفعل في المواقع النشطة للبروتين ، في حين أن الأدوية الأخرى يمكن أن تستخدم الفلزات للتفاعل مع الأحماض الأمينية ذات إمكانية الاختزال الأعلى.[4]
تشمل أمثلة الفلزات المستخدمة في العلاج ما يلي:
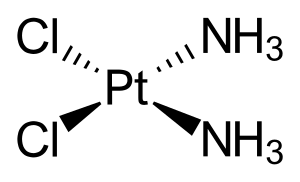
- البلاتين : ثبت أن المركبات القائمة على البلاتين تؤثر بشكل خاص على أورام الرأس والعنق. يُعتقد أن مجمعات التنسيق هذه تعمل على ربط الحمض النووي في الخلايا السرطانية (الشكل 2).
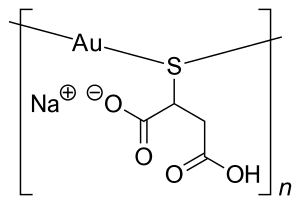
- الذهب : تم استخدام مجمعات ملح الذهب لعلاج التهاب المفاصل الروماتويدي (الشكل 3). يُعتقد أن أملاح الذهب تتفاعل مع الألبومين وفي النهاية تمتصها الخلايا المناعية ، مما يؤدي إلى تأثيرات مضادة للمقتدرة وفي النهاية موت الخلايا المبرمج. هذا علاج غير مباشر لالتهاب المفاصل ، يخفف من الاستجابة المناعية.
- الليثيوم : يمكن استخدام Li 2 CO 3 لعلاج الوقاية من اضطراب الهوس الاكتئابي.
- الزنك : يمكن استخدام الزنك موضعيًا لعلاج الجروح. يمكن استخدام Zn 2+ لعلاج فيروس الهربس.
- الفضة: تم استخدام الفضة لمنع العدوى في موقع الحرق لمرضى جرح الحروق.
- البلاتين ، التيتانيوم ، الفاناديوم ، الحديد: cis DDP (cis-diaminedichoroplatinum) ، التيتانيوم ، الفاناديوم ، والحديد ثبت أنها تتفاعل مع الحمض النووي على وجه التحديد في الخلايا السرطانية لعلاج مرضى السرطان.
- الذهب والفضة والنحاس : مركبات الفوسفين التي تحتوي على الذهب والفضة والنحاس لها خصائص مضادة للسرطان.[3]
- اللانثانم : غالبًا ما تستخدم كربونات اللانثانم تحت الاسم التجاري. فوسرينول يستخدم كمواد رابطة للفوسفات في المرضى الذين يعانون من مرض الكلى المزمن.
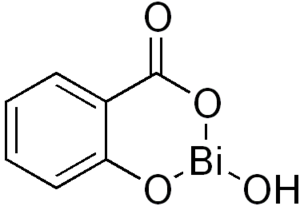
- البزموت : يستخدم ساليسيلات البزموت كمضاد للحموضة .
انظر أيضاً
المصادر
- ^ Carver, Peggy L. (2019). "Chapter 1. Essential Metals in Medicine: The therapeutic Use of Metal Ions in the Clinic". In Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (Guest editor) (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Vol. 19. Berlin: de Gruyter GmbH. pp. 1–16. doi:10.1515/9783110527872-007. ISBN 978-3-11-052691-2.
{{cite book}}:|editor4-first=has generic name (help);|journal=ignored (help) - ^ Nash, Robert A. “Metals in Medicine.” Alternative Therapies II.4 (2005):18-25.
- ^ أ ب ت ث ج ح خ Lippard, Stephen J. “Metals in Medicine.” Bioinorganic Chemistry. Mill City: University Science Books, 1994. 505-583.
- ^ أ ب Dabrowiak, James C. “Metals in Medicine.” Inorganic Chemica Acta. (2012). Preface.