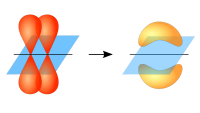الروابط الأيونية
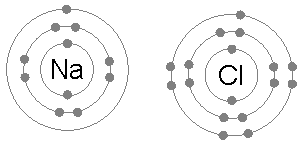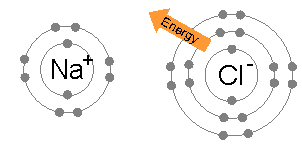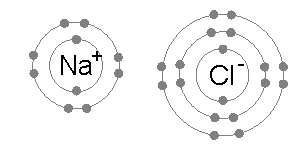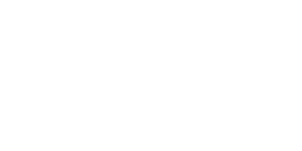
Sodium and chlorine bonding ionically to form sodium chloride. Sodium loses its outer electron to give it توزيع إلكترونات الغازات النبيلة، ويدخـِل هذا الإلكترون ذرة الكلور exothermically. The oppositely charged ions are then attracted to each other, and their bonding releases energy. الانتقال الخالص للطاقة هو أن الطاقة تترك الذرات، ولذلك فالتفاعل قادر أن يحدث.
الروابط الأيونية Ionic bond هي أبسط أنواع الروابط الكيمائية. وتنشأ هذه الرابطة نتيجة للتجاذب بين الأيونات المتضادة الشحنة مثل أيون الصوديوم الموجب (+Na) وأيون الكلور السالب (-Cl) في كلوريد الصوديوم. وتقل الرابطة الأيونية كثيراً كلما زادت المسافة بين الأيونات, بينما تزداد قوة الرابطة بزيادة الشحنات الكهربية للأيونات. والروابط الأيونية هي أكثر أنواع الراوابط الكيمائية شيوعاً في المعادن, حيث إن نحو 90% من المعادن هي في الأصل مركبات أيونية.
التركيب الأيوني
التوصيل الكهربائي
قوة الرابطة الأيونية
تأثير الاستقطاب
الروابط الأيونية مقابل التكافئية
الأنيونات والكاتيونات الشائعة
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
انظر أيضا
- أساسيات الجيولوجسا الفيزيائية
- Coulomb's law
- Linear combination of atomic orbitals
- Hybridization
- Chemical polarity
External link
المراجع
الكلمات الدالة:
All content in this article is created by Marefa contributors and is © Marefa. All rights reserved.