بروتين
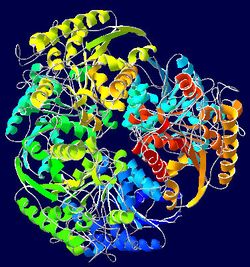
البروتين غذاء معقّد التركيب عضوي ذو وزن جزيئي عالي يتكون من أحماض أمينية مرتبطة مع بعضها بواسطة رابطة ببتيدية. البروتين ضروري في تركيب ووظيفة كلّ الخلايا الحية وحتى الفيروسات.
العديد من البروتينات تشكل الانزيمات أَو وحدات بروتينية تدخل في تركيب الإنزيماتِ. كما يقوم البروتين بأدوار أخرى الهيكليةِ أَو الميكانيكيةِ، مثل تلك تشكيل الدعاماتَ و المفاصلَ ضمن الهيكل الخلوي . تلعب البروتينات مهام حيوية اخرى فهي عضو مهم في الإستجابة المناعية و في تخزين و نقل الجزيئات الحيوية كما تشكل مصدرا للحموض الأمينية بالنسبة للكائنات التي لا تستطيع تشكيل هذه الحموض الأمينية بنفسها .
البروتينات أيضا واحدة من الجزيئات الضخمة الحيوية إلى جانب عديدات السكريدات و الدسم و الأحماض النووية، وهذه الجريئات الضخمة الحيوية تشكل بمجموعها مكونات المادة الحية الأساسية .
مكونات البروتين
وهي تتكون من وحدات أولية هي الحموض الأمينية والببتيدات.[1]
الحموض الأمينية
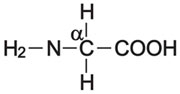
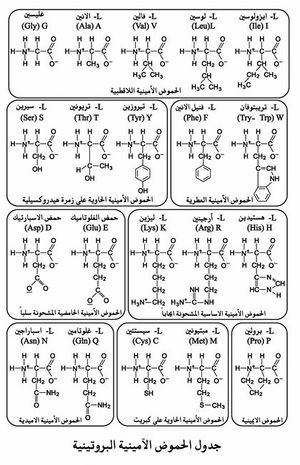
يعرف من الحموض الأمينية المعروفة حتى اليوم في جسم الكائنات الحية عشرون حمضاً أمينياً فقط، وهي حموض من نوع α، تبنى جميعها على أساس واحد، فلكل حمض زمرة أمينية NH2 في أحد طرفيه، وزمرة كربوكسيلية COOH في الطرف الآخر، وترتبط الزمرتان بذرة كربون مركزية تدعى «الكربون ألفا» α، ترتبط به ذرة هيدروجين وزمرة رابعة (R) تدعى السلسلة الجانبية (عدا الغليسين حيث H=R)، فلا تختلف الحموض الأمينية بعضها عن بعض إلا بطبيعة هذه السلسلة الجانبية.
يقتضي وجود ذرة كربون لا متناظرة ظهور عدة متماثلات في التركيب مع الحمض الأميني نفسه (عدا الغليسين)، وتعتمد تسمية هذه المتماثلات في التركيب على وضع الزمرة NH2 حول ذرة الكربون اللامتناظرة، فإذا كانت الزمرة NH2 إلى يسار هذا الكربون كان الحمض الأميني من زمرة اليسار «L» وإذا كانت إلى يمينه كان الحمض من زمرة اليمين «D». علماً أن كافة الحموض الأمينية الطبيعية التي في البروتينات من زمرة اليسار L. وقد جرت العادة أن يرمز للحمض الأميني عند كتابة صيغ البروتينات إما بثلاثة أحرف وإما يكتفى بحرف واحد في حالة البروتينات الضخمة (انظر جدول الحموض الأمينية البروتينية).
خواص الحموض الأمينية
تبدي الحموض الأمينية خواصَّ كلٍ من الحموض والأمينات إضافة إلى خواص مشتركة تتعلق بالزمرتين الأمينية والكربوكسيلية.
تصنيف الحموض الأمينية
اقتُرِحت طرائق مختلفة لتصنيف الحموض الأمينية معتمدة على اختلاف طبيعة السلسلة الجانبية R. ومن أهم هذه الطرائق التصنيف الآتي:
أ ـ الحموض الأمينية ذات السلسلة الجانبية اللاقطبية (رُهابية الماء).
ب ـ الحموض الأمينية ذات السلسلة الجانبية الحاوية زمرة هيدروكسيلية.
ج ـ الحموض الأمينية ذات السلسلة الجانبية الحاوية كبريتاً.
د ـ الحموض الأمينية ذات السلسلة الجانبية الحامضية المشحونة سلباً.
هـ ـ الحموض الأمينية ذات السلسلة الجانبية الأساسية المشحونة إيجاباً.
الببتيدات (الهضميدات)
إن من أهم تفاعلات الحموض الأمينية تشكيل الرابطة الببتيدية. ينتج الببتيد من التحام حمضين أمينيين على الأقل بإزاحة جزيء ماء، فترتبط الزمرة الحمضية للمركب الأول بالزمرة الأمينية للمركب الثاني وتؤلف «الرابطة الببتيدية» CO -NH-R-R.
اعتمد تحليل الببتيدات الذي يؤدي إلى الحموض الأمينية طرائق كيمياوية تُحطم الرابطة الببتيدية كالتحليل المائي الحمضي (غلي الببتيد مع 6ـ نظامي حمض كلور الماء بالدرجة 105 ْس مدة 24 ساعة) وبالتحليل المائي القلوي (غلي الببتيد مع 5 ـ نظامي هيدروكسيد الصوديوم مدة 24 ساعة). ويلجأ في التحليل المائي الإنظيمي (حضن الببتيد بالدرجة 37 ْس لعدة ساعات في وسط pH معين لكل إنظيم) إلى عدد من الإنظيمات التي عرفت اليوم جيداً كالببسين Pepsin، والهضمين الثنائية الإنفحة أو المنْفحة Rennet، والتربسين Trypsin، والهضمين الثلاثية الكيموتربسين Chymotrypsin، والبابين Papain، وغيرها تحطم الرابطة الببتيدية في أماكن معينة تتعلق بالحموض الأمينية المؤلفة لهذه الرابطة.
يطلق أحياناً اسم قليلات الببتيد Oligopeptides على الببتيدات القليلة المكونات، ويطلق اسم كثيرات الببتيد Polypeptides على الببتيدات المكوَّنة من أكثر من عشر وحدات من الحموض الأمينية، والببتيدات الطبيعية تشتمل على هذين الصنفين.
بعض الببتيدات ذات البنية المشهورة
أ ـ الغلوتاتيون Glutathione ثلاثي الببتيد مكون من γ ـ زمرة الكربوكسيل لحمض الغلوتاميك وα ـ زمرة الأمين للسيستئين وتشغل بقية الغليسين الطرف ـ C.
ينتشر الغلوتاتيون في كثير من الأعضاء الحيوانية (الكظر، والكبد، والطحال، والمعثكلة، والقلب، والرئة).
ب ـ الأكسيتوسين Oxytocin والفازوبريسين Vasopressin هرمونان فصلا من القسم الخلفي للنخامة، وهما ذَوَا طبيعة ببتيدية حلقية مكونة من 9 بقايا حموض أمينية، ويمكن استنساخهما بالاصطناع. الأكسيتوسين هرمون يسبب تقلص الرحم وينشط هرمون البرولكتين Prolactin الذي يزيد إفراز الحليب. الفازوبريسين هرمون رافع لضغط الدم Hypertensive ومضاد للبوال Antiduretic.
جـ ـ الغسترين Gastrin هرمون ببتيدي يحتوي على 17 بقية حمض أميني فُصل من غشاء المعدة المخاطي. ينشط الغسترين اصطناع حمض كلور الماء وإفراز عصارة المعدة.
د ـ الغلوكاغون Glocagon هرمون ببتيدي رافع لسكر الدم Hyperglucemic فصل من المعثكلة، يحتوي على 29 بقية حمض أميني.
بنية البروتين
 مقالة مفصلة: بنية البروتين
مقالة مفصلة: بنية البروتين
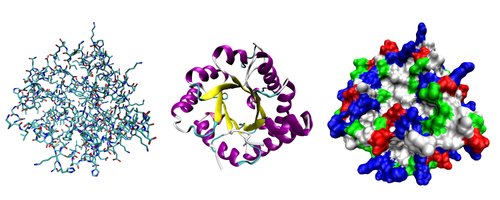
يتألف البروتين من سلاسل ببتيدية مؤلفة من ترابط حموض نووية تلتف فيما بعد لتشكل بنية ثلاثية الأبعاد فريدة ( يتميز كل بروتين ببنية مختلفة عن البروتينات الأخرى ، تدعى هذه البنية بالحالة الأصلية للبروتين و تتحدد حسب ترتيب الحموض الأمينية في عملية الترابط التي تشكل السلاسل البروتينية .
- بنية أولية: تحددها تسلسل الحموض الأمينية وتعيين عدد الجسور الثنائية الكبريت، وأمكنتها في البروتين (إن وجدت) اسم البنية الأولية. تتألف البروتينات المرتفعة الوزن الجزيئي عادة من عدة سلاسل كثيرات الببتيد (الهضميد).
- بنية ثانوية: تتألف من بنى ثانوية تتشكل من التفاف السلاسل الببتيدية على بعضها بشكل حلزونات ألفا و صفائح بيتا .وقد توصل كل من الكيميائي الفيزيائي الأميركي باولنغ L.Pauling والكيميائي الأمريكي كوري R.B.Corey إلى وضع نماذج للبنيات الثانوية أكانت من نوع الحلزون ألفا والبنية الصفيحية المنطوية بيتا، والحلزون الثلاثي.
- بنية ثالثية: وهي ما يحدد شكل البروتين النهائي ، تتألف من اجتماع البنى الثانوية للبروتين ( لوالب ألفا و صفائح بيتا ) بوساطة قوى فيزيائية غير تكافؤية لتعطي الشكل النهائي للبروتين
- بنية رابعية: يستخدم عادة هذا المصطلح للدلالة على البنية التي تكونها اتحاد بروتينين أو أكثر في ما يسمى الوحدة البروتينية .(ولكل سلسلة بنيتها الخاصة الأولية والثانوية والثالثية).
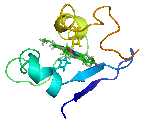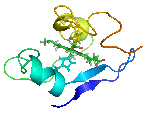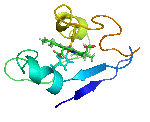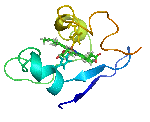
البنية البروتينية غير ثابتة اطلاقا بل تتغير لتأدية وظائفها المختلفة و لتحقيق هذا التغيير البنيوي يحدث تغير في ارتباطات البنية الثالثية و الرابعية ، لذلك ندعو هذه البنى الثالثية و الرابعية تشكيلات كيميائية و ما يحدث لها من تغيرات بالتغيرات التشكيلية conformational changes .
تحديد البنية
تصنيف البروتينات
إن عدد البروتينات المختلفة المعزولة من أعضاء الكائنات الحية والنباتات والأحياء المجهرية كبير للغاية. وتختلف البروتينات بعضها عن بعض بالتركيب الكيمياوي (بعدد الحموض الأمينية وتتابعها) وبالبنية الفراغية وبالوظيفة والفعالية الحيوية. ولا يوجد حتى الآن نظام عام مناسب مُرْضٍ لتصنيف البروتينات، إلا أن هناك أنظمة تصنيفية متعددة للبروتينات ومختلفة فيما بينها مازالت مستخدمة حتى وقتنا الحاضر.
تعتمد النظم التصنيفية للبروتينات على: الذوبان، والتركيب الكيمياوي، والشكل، والوظيفة، والبنية الفراغية الثلاثية الأبعاد.
وينتسب إلى البروتينات البسيطة تلك المؤلفة من حموض أمينية فقط، وإن عدد البروتينات البسيطة كبير للغاية.
البروتينات السكرية Glycoproteins وهي تنتج من ارتباط جزيء بروتيني بسكر؛ والبروتينات الشحمية Liporoteins وهي البروتينات المرتبطة بالشحوم، والبروتينات الملونة Chromoproteins وهي البروتينات المرتبطة بزمر لونية، والبروتينات النووية Nucleoproteins وهي البروتينات المرتبطة بالحموض النووية، والبروتينات المُفَلَّزه Metalloproteins وهي البروتينات المرتبطة بالمعادن، والبروتينات الفسفورية Phosphoproteins وهي البروتينات المرتبطة بحمض الفسفور.
ويمكن في بعض الحالات تمييز صفين رئيسيين من البروتينات يسمى الأول البروتينات الكروية Globular proteins والثاني البروتينات الليفية Fibrous proteins وذلك بالاعتماد على الشكل العام.
تصنف البروتينات أيضاً طِبقاً لوظائفها الحيوية التي تتحقق في الجسم البروتينات الإنظيمية، البروتينات الهرمونية، البروتينات الناقلة....
بعض البروتينات ذات البنية المشهورة
يهتم العلماء بدراسة الببتيدات العالية وفي مقدمتها الهرمونات والإنظيمات.
الأنسولين Insulin
هرمون مُنقِص لسكر الدم Hypoglucemic تفرزه المعثكلة. يتألف الأنسولين من 51 بقية حمض أميني موزعة على سلسلتين ببتيديتين، تحتوي السلسلة A على 21 بقية حمض أميني والسلسلة B على 30 بقية حمض أميني. يربط هاتين السلسلتين جسران كبريتيان.
الفبرين Fibrin
تفرز الفبرين يرقات دود القز على هيئة خيوط حريرية دقيقة، وهو بروتين خطي يتألف من سلاسل عديدات الببتيد ترتبط بعدد كبير من الروابط الهيدروجينية (البنية ـ بيتا)، وزنه الجزيئي مرتفع نحو 100 ألف. تتوضع بقايا الحموض الأمينية في السلسلة الببتيدية وفق الترتيب الآتي:
X-Gly-Ala-Gly-Ala-Gly
(X = بقية السيرين أو أي حمض أميني آخر).
الألبومين Albumin
ألبومين البيض وزنه الجزيئي 45 ألف ويؤلف 64% من الكتلة الرئيسية لبروتينات بيض الدجاج. أما ألبومين الدم فوزنه الجزيئي 65 ألف ويؤلف 60% من بروتينات مصل الدم.
الهيموغلوبين Hemoglobin
وهو المكون الأساسي لكريات الدم الحمراء. يدخل في تركيب جزيء الهيموغلوبين أربع ذرات حديد كل ذرة تتوضع في مركز زمرة الهيم. يتألف الجزء البروتيني الغلوبيني من 574 بقية حمض أميني.
α -الكيموتربسين Chymotrypsin-α
يتألف جزيء α- كيموتربسين من 246 بقية حمض أميني وخمسة جسور ثنائية الكبريت، يحلل الكيموتربسين تحليلاً مائياً الروابط الببتيدية والاسترية.
هرمون النمو Growth Hormone
ينتجه الفص الأمامي لنخامة الإنسان، ويتألف من سلسلة ببتيدية واحدة تحتوي 245 بقية حمض أميني وزنه الجزيئي 27 ألف. ينشط هرمون النمو اصطناع الإنظيمات والبروتينات في كل خلية.
الخواص
الخاصيات الفيزيائية للبروتينات
تعطي البروتينات مع الماء محاليل غروانية لزجة تقريباً، وترسب من هذه المحاليل بالغول والمحاليل الملحية، وتخربها الحرارة فتخثرها. ويمكن فصل مركباتها أو مجموعات من هذه المركبات في محاليلها هذه بالرحلان الكهربائي Electrophoresis وبالتنبيذ الفوقي Ultracentrifugation والاستشراب Chromatography ويمكن أن تتخرب بسهولة القوى الضعيفة نسبياً المسؤولة عن تثبيت البنية الفراغية، بتأثير كثير من الكواشف والحالات المختلفة، مما يؤدي إلى فقدان الفعالية الحيوية، وتعرف هذه الخاصة بإفساد Denaturation البروتينات أي مسخها.
الخاصيات الكيمياوية
تلون كبريتات النحاس القلوية البروتينات بلون أحمر بنفسجي يدعى «تفاعل بيوريت» المميز للببتيدات. وتتلون البروتينات باللون الأحمر بتفاعلها مع كاشف «ميلون Millon» (نترات الزئبق الحمضية)، وهو تفاعل يعزى إلى التيروزين، لذلك لا يحصل التلون مع الجزيئات التي لا تحوي هذا الحمض الأميني. وتتفكك الروابط الببتيدية في البروتينات بتقنيات التحلل المائي الكيمياوي أو الإنظيمي لتعطي ببتيدات تتحول بالتدريج إلى حموض أمينية.
الوظائف
يشارك البروتين تقريبا في جميع العمليات الخلوية بما فيها تنظيم الوظائف الخلوية مثل نقل الإشارات الخلوية و الاستقلاب فعملية تحطيم البروتينات نفسها تجري في الخلية بالإستعانة بأنزيمات ( و هي مركبات بروتينية ) تدعى بروتيازات .
آلية التنظيم البروتيني
يمكن للبروتينات ان تربط بها جزيئات كيماوية متنوعة و شوارد معدنية ضمن تجويفات خاصة في بنيتها تدعى : مواقع الإرتباط Bindingsites ومع ذلك تتميز البروتينات باصطفائية كيميائية عالية تجاه المركبات التي ترتبط بها . تدعى المركبات التي ترتبط بالبروتينات لجينات ligand ، أما شدة الارتباط لجين-بروتين فهي إحدى خصائص موقع الارتباط و تدعى الألفة affinity .
بما أن البروتينات تتدخل في كل عملية تتم ضمن الخلايا الحية ، لذلك فإن التحكم في العمليات الحيوية يمكن ان يتم عن طريق التحكم بفعالية هذه البروتينات . هذا التنظيم لمل البروتينات يمكن أن يتم عن طريق شكل البروتينات أو تركيزها :
- تحوير تفارغي Allosteric modulation
- تحوير تساهمي Covalent modulation .
ما المركبات الرئيسية التي تسهم في تركيب البروتين
تساهم في عملية تركيب البروتينات في الخلية الحية المركبات الآتية: حمض(DNA)-حمض (RNA)المرسال-حمض(RNA)الناقل-الريباسات
نسخ المادة الوراثية لا تتحول المعلومات الوراثية في المورثات إلى بروتينات مباشرة حيث تقوم المورثة بنسخ ال(RNA)المرسال الخاص بها حاملا إلى الهيولى رسالة المورثة التي يعبر عنها بلغة النوكليوتيدات بالاتجاه(5َ إلى 3َ)على ال(RNA) المرسال لذلك تدعى سلسة(DNA) المورثة السلسلة الناسخة أو المشفرة.
استقلاب البروتينات
إن لكل نوع نباتي أو حيواني بنيته البروتينية الخاصة المكونة من حموض أمينية جوهرية لا غنى عنها. ومع أن بإمكان الكائن الحي اصطناع بعض هذه الحموض فإن هناك حموضاً أمينية أخرى لا يستطيع الكائن الحي اصطناعها، لذلك ينبغي أن تأتي من التغذية (بروتينات ضرورية). وتتفكك هذه البروتينات تدريجياً بالعصارات الهاضمة محررة حموضاً أمينية. ويقوم الكائن الحي بإعادة تكوين الأبنية البروتينية الضرورية للحياة بدءاً من هذه الأخيرة. وتحذف الكلية بقايا هذه التفاعلات على هيئة بولة وحمض البول في المقام الأول.
الكيمياء السريرية للبروتينات
تتيح الكيمياء الحيوية السريرية إدراك اضطراب الكثير من الوظائف، وذلك بتحليل البروتينات والمواد التي تشتق من استقلابها. وكثيراً ما يتطلب الأمر معايرة البروتينات الدموية وتجزئتها بالرحلان الكهربائي ومعايرة البولة وحمض البول وغيرهما. كما يدل وجود بعض الحموض الأمينية في البول على بعض الأمراض.
التغذية
 مقالة مفصلة: البروتين في التغذية
مقالة مفصلة: البروتين في التغذية
تحوي جميع البنى في النباتات بروتينات بمقادير متفاوتة وقليلة نسبياً بالمقارنة مع النسج الحيوانية، ويوجد الكثير من البروتينات في بذور النباتات بحالة حرة غير مرتبطة بالشحوم أو السكريات.
يدخل في تركيب البروتينات النباتية: الألبومينات، والغلوبولينات، والغلوتيلينات، والبرولامينات. وتراوح نسبة البروتينات في الصانعات الخضر Chloroplasts بين 35- 45% ترتبط بالشحوم وبصباغ الكلوروفيل بوساطة المغنزيوم. تؤلف البروتينات النووية الجزء الرئيس من بروتينات الهيولى Cytoplasma.
تصنع النباتات المركبات الآزوتية على حساب النترات التي في التربة، بإرجاعها إلى نشادر يتفاعل مع الحموض العضوية (حمض الفومار، حمض حماض الخل، حمض α - كيتو الغلوتار) ليعطي حمض الاسبارتيك. وبنتيجة تفاعلات نقل الأمين من حمض الاسبارتيك تتكون الحموض الأمينية الأخرى ومنها الجزيئات البروتينية. وقد تبين في الوقت الحاضر أن استقلاب الآزوت يتم بأربع مراحل: أ ـ تمثـل الآزوت، ب ـ تكوين الحموض الأمينية وتحولاتها، ج ـ اصطناع الأميدات والببتيدات وغيرها من المركبات الآزوتية البسيطة، د ـ تكوين البروتينات والحموض النووية.
ليست القيمة الغذائية للبروتينات النباتية كالقيمة الغذائية للبروتينات الحيوانية نتيجة لعوز البروتينات النباتية في الغالب إلى بعض الحموض الأمينية، وخاصة عوزها إلى الليزين والمتيونين إذا ما قورنت بألبومين البيض.
ويعد بروتين الصويا من أجود أنواع البروتينات النباتية إذ يزيد محتواه بالليزين على 20 %.
ويتبقى عند استخلاص الزيت الذي في الحبوب الزيتية منتجٌ ثانوي هو الكُسْب الذي يحتوي على جميع بروتينات الحبوب، والذي غالباً ما يستعمل في تغذية الحيوانات، وإن كان يستعمل أحياناً في تغذية البشر.
معظم عضية دقيقة microorganisms والنباتات باستطاعتها تخليق كل العشرين حامض أميني القياسيين, بينما الحيوانات, (بما فيهم البشر) يتوجب عليهم الحصول على بعض الأحماض الأمينية من غذائهم.[2] الإنزيمات الأساسية في سبيل التخليق الحيوي biosynthetic pathways التي تحلّق أحماض أمينية معينة - مثل أسپارتوكيناز aspartokinase, التي تساعد في الخطوة الأولى لتخليق ليسين lysine, مثيونين methionine, وثريونين threonine من الأسپارتات aspartate - لا يتواجدول في الحيوانات. والأحماض الأمينية التي لا تستطيع التخليق بنفسها يشار إليها باسم الأحماض الأمينية الأساسية. وإذا تواجدت أحماض أمينية في البيئة, فالعضيات الدقيقة بإمكانها توفير الطاقة بأخذ الأحماض الأمينية من محيط تلك العضيات و downregulating سبلهم للتخليق الحيوي.
وفي الحيوان، فإن الأحماض الأمينية يتم الحصول عليها من خلال استهلاك الأطعمة المحتوية على البروتين. البروتينات المأكولة يتم تكسيرها من خلال الهضم، الذي عادة ما يتضمن denaturation البروتين عبر تعريضه للحمض و hydrolysis بواسطة إنزيمات تسمى پروتيازات proteases.
أطلق منذ زمن طويل على وجود بروتينات في البول اسم بيلة ألبومينية Albuminuria (يعتمد اختبار كشفها على ترسيب البروتين الذي يعطي هلامة مبيضة غَبْشاء مماثلة لألبومين البيض المتخثر). ويزداد اليوم شيئاً فشيئاً استعمال المصطلح الأصح ألا وهو البيلة البروتينية Proteinuria. وبالفعل تُمثَّل البروتينات التي في البول بألبومين المصل، كما تُمثَّل بالغلوبولينات α وβ وγ.
تلاحظ البيلة البروتينية في أغلب أمراض الكلية، وهي تراوح بين 1 و4غ في الليتر في التهابات الكلية Nephritis (الكُبَيْبية Glomerular أو الخلالية Interstitial)، وتزيد على 5غ في اللتر في الكُلاء Nephrosis.
تتأتى البيلة البروتينية القائمة Orthostatic من وجود بروتينات في البول حين يكون الشخص المصاب واقفاً، في حين أنها تختفي عند النوم أثناء الليل، وهي تنجم عن آفة في الكلية وإن كانت تحتاج إلى مراقبة.
العواقب الفيزيولوجية الناجمة عن تغيرات في بنية البروتينات
إن استبدال حمض أميني بآخر في جزء معين من سلسلة ببتيدية، يمكن أن يؤدي إلى نقصان الفعالية الحيوية أو إلغائها مع حدوث عواقب خطرة. فمثلاً يكون سبب فقر الدم المنجلي Sicklecell Disease المنتشر في وسط إفريقية وغربها، تغير حمض أميني واحد في جزيء الهيموغلوبين، إذ يوجد عوضاً عن بقية حمض الغلوتاميك بقية الفالين الحمض الأميني السادس في السلسلة الببتية ـ β من الطرف ـ N. وإن كثيراً من الاضطرابات الاستقلابية الوراثية يمكن أن تحدث نتيجة لمثل هذا التغيير.
البروتينات النفطية
أطلق اسم بروتينات نفطية ـ خلافاً للأصول ـ على خمائر حُصل عليها بتخمير أرومة على ركيزة من زراعة مكوّنة من فحوم هيدروجينية.
وقد دفع نقص البروتينات ذات الأصل الحيواني (اللحم والحليب والسمك)، الصناعة النفطية منذ عام 1960، إلى إكثار كائنات حية قادرة على استخراج مادتها الصرفة من بعض الفحوم الهدروجينية الألكانية (البرفينية) ذات السلاسل المستقيمة والصيغة العامة CnH2n+2، إضافة إلى أن جهاز الهضم يتحمل تحملاً كاملاً شتى الزيوت الطبيعية والبرفينات النفطية.
وسرعان ما اتضح أن أهم الكائنات الحية، الأحادية الخلية المدروسة كمصدر جديد للبروتينات، هي الخمائر المستعملة منذ زمن طويل في التخمرات الغذائية وفي تغذية الماشية. وقد اختيرت أرومات من زمرة المُبْيَضَّة Candida، وهي كائنات دقيقة من عالم النبات مصنفة بين الفطور Mushrooms قادرة على تحويل المصادر القليلة التكلفة من الآزوت والكربون إلى بروتينات عالية الجودة. ومع أن حجم كل خلية لا يزيد على بضعة أجزاء من الألف من الميليمتر فإن معدل تكاثرها نظرياً، لا يكاد يصدق؛ غير أن هذا التنامي يتوقف في الحقيقة عندما يتوقف تقديم العناصر الحية المغذية لها كالماء وأكسجين الهواء والألكان (البرافين) وشتى الأملاح المعدنية.
كشف تحليل مسحوق الخميرة الحاصلة عن محتوى بالبروتينات قدره 70 % من المادة الجافة مما يضفي عليه قيمة مغذية مساوية على الأقل إلى قيمة طحين السمك وكُسْب الصويا الأكثر استعمالاً اليوم في إغناء غذاء الحيوانات، وعن أن الخميرة النفطية غنية بفيتامينات الزمرة B وبالفسفور القابل للتمثل إضافة إلى الحموض الأمينية الجوهرية كالليزين والمتيونين.
وقد أجريت اختبارات علمية لا جدال فيها أكدت سلامة طحين هذه الخميرة وعدم تسبُّبِها بالأمراض وخاصة المسرطنة منها، واستعداد الأجهزة الهضمية لتمثلها، وأن درجة تمثل حموضها الأمينية تزيد على 95%، في حين لا تتجاوز درجة تمثل أجود أنواع طحين السمك 85%.
وضع أغلب علماء التغذية نصب أعينهم استعمال الخمائر مباشرة في التغذية البشرية وخاصة في البلاد التي استوطن فيها سوء التغذية بالبروتينات.
انظر أيضا
المصادر
- ^ صلاح يحياوي. "البروتينات". الموسوعة العربية. Retrieved 2012-04-13.
- ^ Voet D, Voet JG. (2004). Biochemistry Vol 1 3rd ed. Wiley: Hoboken, NJ.
قواعد بيانات ومشاريع
- The Protein Databank (see also PDB Molecule of the Month, presenting short accounts on selected proteins from the PDB)
- Proteopeida - Life in 3D
- UniProt the Universal Protein Resource
- Human Protein Atlas
- iHOP - Information Hyperlinked over Proteins
- MIT's Laboratory for Protein Molecular Self-Assembly
- NCBI Entrez Protein database
- NCBI Protein Structure database
- Human Protein Reference Database
- Human Proteinpedia
- Folding@Home (Stanford University)
دروس ومواقع تعليمية
- Proteins: Biogenesis to Degradation - The Virtual Library of Biochemistry and Cell Biology
- Amino acid metabolism
- Data Book of Molecules - Home Page for Learning Environmental Chemistry
مراجع للإستزادة
- صلاح يحياوي، الكيمياء العضوية المفتوحة (منشورات جامعة دمشق 1968).
- أحمد مالو، مروان البحرة، هيفاء العظمة، الكيمياء الحيوية البنيوية (منشورات جامعة دمشق 1983ـ1984).
- دافيد مارتين، بيتر مايس، فيكتور رودول، نظرة عامة في مباحث الكيمياء الحيوية (هاربر)، ترجمة أحمد محمد خير كرزة (منشورات وزارة التعليم العالي 1987).
روابط خارجية
- بنك بيانات البروتينات
- UniProt مصدر معلومات البروتينات العالمي
- أطلس البروتينات البشرية
- iHOP - روابط معلومات حول البروتينات
- البروتينات: من التشكيل الحيوي إلى التفكك - المكتبة الافتراضية للكيمياء الحيوية و البيولوجيا الجزيئية
- MIT's Laboratory for Protein Molecular Self-Assembly
- Numerous publications on synthetic biomimetic protein-based biomaterials
- أيض الحمض الأميني
- صور پروتينات
- Online Protein viewer with a local PDB database
دروس ومواقع تعليمية
- Proteins: Biogenesis to Degradation - The Virtual Library of Biochemistry and Cell Biology
- Amino acid metabolism
- Data Book of Molecules - Home Page for Learning Environmental Chemistry