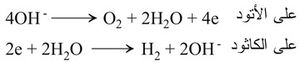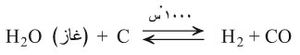هيدروجين
| |||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
غاز عديم اللون ذو بريق قرمزي في حالة البلازما الخطوط الطيفية للهيدروجين | |||||||||||||||||||||||||
| الخصائص العامة | |||||||||||||||||||||||||
| الاسم، الرمز، الرقم | هيدروجين, H, 1 | ||||||||||||||||||||||||
| النطق | /ˈhaɪdrɵdʒ | ||||||||||||||||||||||||
| تصنيف العنصر | لا فلزات | ||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 1, 1, s | ||||||||||||||||||||||||
| الوزن الذري القياسي | 1.00794(7) | ||||||||||||||||||||||||
| التوزيع الإلكتروني | 1s1 1 | ||||||||||||||||||||||||
| الخصائص الطبيعية | |||||||||||||||||||||||||
| اللون | colorless | ||||||||||||||||||||||||
| الطور | gas | ||||||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كپا) 0.08988 g/L | ||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 0.07 (0.0763 solid)[2] گ·سم−3 | ||||||||||||||||||||||||
| الكثافة السائلة عند ن.غ. | 0.07099 گ·سم−3 | ||||||||||||||||||||||||
| نقطة الانصهار | 14.01 ك, -259.14 °C, -434.45 °F | ||||||||||||||||||||||||
| نقطة الغليان | 20.28 ك, -252.87 °س, -423.17 °ف | ||||||||||||||||||||||||
| النقطة الثلاثية | 13.8033 ك (-259°س)، 7.042 كپا | ||||||||||||||||||||||||
| النقطة الحرجة | 32.97 ك، 1.293 مپا | ||||||||||||||||||||||||
| حرارة الانصهار | (H2) 0.117 كج·مول−1 | ||||||||||||||||||||||||
| حرارة التبخر | (H2) 0.904 كج·مول−1 | ||||||||||||||||||||||||
| السعة الحرارية المولية | (H2) 28.836 ج·مول−1·ك−1 | ||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخصائص الذرية | |||||||||||||||||||||||||
| حالات الأكسدة | 1, -1 (amphoteric oxide) | ||||||||||||||||||||||||
| سالبية كهربية | 2.20 (مقياس پولنگ) | ||||||||||||||||||||||||
| طاقات التأين | 1st: 1312.0 كج·مول−1 | ||||||||||||||||||||||||
| نصف قطر تساهمي | 31±5 pm | ||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 120 pm | ||||||||||||||||||||||||
| متفرقات | |||||||||||||||||||||||||
| البنية البلورية | hexagonal | ||||||||||||||||||||||||
| الترتيب المغناطيسي | diamagnetic[3] | ||||||||||||||||||||||||
| ناقلية حرارية | 0.1805 W·m−1·K−1 | ||||||||||||||||||||||||
| سرعة الصوت | (gas, 27 °C) 1310 م·ث−1 | ||||||||||||||||||||||||
| رقم تسجيل كاس | 1333-74-0 | ||||||||||||||||||||||||
| أكثر النظائر استقراراً | |||||||||||||||||||||||||
| المقالة الرئيسية: نظائر هيدروجين | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
الهيدروجين [ملحوظة 1] (![]() /ˈhaɪdrɵdʒ
/ˈhaɪdrɵdʒɪn/)،(HY-drə-jin)
[4] إنگليزية: Hydrogen هو عنصر كيميائي في الجدول الدوري، له الرمز الكيميائي H وله الرقم الذري 1. وفي ظروف الضغط والحرارة القياسية فإنه غاز عديم اللون والرائحة، لا فلزي، وحيد التكافؤ، سريع الاشتعال، ثنائي الذرة. الهيدروجين أخف الغازات وأكثرها تواجدا في الكون حيث يشكل 75% من حجم الكون [5] يوجد في الماء وكل المركبات العضوية والكائنات الحية.
والكيميائيون لم يتوصلوا حتى الآن إلى قرار حول المكان الذي يجب أن يشغله الهيدروجين في جدول مندلييف الدوري، فهم يضعونه في آن واحد في فصيلتين: في الفصيلة السابعة حيث ينسب إلى الهالوجينات كالفلور والكلور والبروم، وفي الفصيلة الأولى لتشابهه مع الفلزات القلوية كالليثيوم والصوديوم والبوتاسيوم.
وقد تم توليف الهيدروجين إصطناعياً في القرن ال16، وذلك عن طريق خلط المعادن بالأحماض القوية وكان هنري كاڤندش أول من يعرفه كمادة منفصلة [6]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
كيفية تكوينه
تكوّن الهيدروجين بعد فترة وجيزة جدّاً بعد الانفجار العظيم ولم تعلو درجة الحرارة بشكل كاف في أي مكان منذ ذلك الحين، أي أن كلّ الهيدروجين تشكّل فور تشكُّل الفضاء الكوني قبل ١٣ مليار سنة.[7]
الاكتشاف
عرف الهيدروجين لأول مرة كمادة متميزة عن غيرها من الغازات القابلة للاشتعال في 1766 هنري كافيندش، الذي يرجع إليه الفضل في اكتشافه.[8] وكان غاز الهيدروجين أول ما يتم توليفه اصطناعياً عن طريق فيليب فون بوسلاگر وذلك بخلط المعادن بالأحماض القوية.[9] إذ استحضره بفعل حمض كلور الماء أو حمض الكبريت على المعادن، كما بيَّن أن الماء هو الناتج الوحيد من حرق الهيدروجين في الهواء، علماً أن جيمس واط James Watt أعلن أنه هو الذي حصل على ماء من احتراق الهيدروجين في الوقت نفسه الذي حصل عليه كافنديش.[10]
أما الاسم «هيدروجين» فقد أطلقه على هذا الغاز لافوازييه مبيناً أنه يولِّد الماء عند احتراقه.
يرافق الهيدروجينَ في مركّباته جميعها النظير isotope المدعو ديوتريوم deuterium؛ واسمه يعني (الثاني) باليونانية، ويرمز له بـ D بنسبة مول ديوتريوم لكل 7000 مول هيدروجين عادي. اكتشَف هذا النظير الأميركي هارولد يوري Urey عام 1932. تنبع أهمية هذا النظير من استعماله مهدئاً للنترونات في المفاعلات النووية، يختلف هذا النظير عن الهيدروجين العادي باحتواء نواته على نترون إضافة إلى البروتون في الهيدروجين العادي. وهناك نظير آخر للهيدروجين يدعى التريتيوم tritium، واسمه يعني (الثالث) باليونانية ويرمز له بالحرف T. تحوي نواته نترونين إضافة إلى البروتون، وقد اصطنعه العالم ألفاريز Alvarez في جامعة كاليفورنيا بقذف الديوتريوم بوساطة النترونات:
التحضير
تحضيره في المعمل
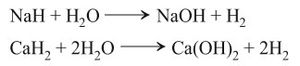
أ - فعل الحموض الممددة على كثير من المعادن metals، مثل التوتياء والحديد والمغنسيوم والقصدير[11]
ولا تصلح المعادن القلوية والقلوية الترابية في مثل هذه التفاعلات؛ لأنها تطلق الهيدروجين بشدة تجعل من الصعب السيطرة على التفاعل. أما المعادن الأخرى مثل الفضة والذهب والزئبق والنحاس فهي لا تطلق الهيدروجين بتفاعلها مع الحموض. ولا يستعمل حمض الآزوت في هذا المجال بسبب قوته المؤكسِدة.
يتم تحضير الهيدروجين في المعمل عن طريق تفاعل الأحماض مع الفلزات مثل الزنك. أما لتحضير الهيدروجين بكميات كبيرة للاستخدامات الصناعية فيتم ذلك عن طريق تعديل البخار بالغاز الطبيعي.
ب - فعل هدريدات المعادن القلوية والقلوية الترابية (ماعدا المغنسيوم) على الماء:
وقد يكون التفاعل السابق عنيفاً خصوصاً في حال استعمال البوتاسيوم والروبيديوم والسيزيوم.
جـ- فعل بخار الماء على بعض المعادن الأخرى:
يعود ذلك إلى أن هنالك بعض المعادن التي لا تتفاعل مع الماء بصورة محسوسة على الرغم من كونها أعلى من الهدروجين في جدول الترتيب الكهرحركي للعناصر، وذلك بسبب تكون طبقة من هدروكسيد المعدن تمنع استمرار التفاعل ولكن الحرارة الآتية من البخار تجعل هذه الطبقة مسامية ليأخذ التفاعل مجراه كما هو الأمر في المغنسيوم والحديد.
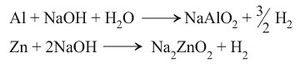
د - فعل بعض المعادن الأمفوتيرية amphoteric على الأسس:
هـ - التحليل الكهربائي لبعض المحاليل المائية الممددة: ففي التحليل الكهربائي لمحلول ممدد من حمض الكبريت أو ماءات الصوديوم حيث التفاعل الإجمالي هو الآتي:
ينطلق الهدروجين حول المهبط والأكسجين حول المصعد، وتحتاج العملية إلى طاقة كهربائية عالية نسبياً، وذلك بسبب قوة الرابطة بين الهدروجين والأكسجين في جزيء الماء.
كما أن التحليل الكهربائي للماء يعتبر من الطرق البسيطة, ولكن تكاليفه عالية لدرجة عدم استخدامه تجاريا. ويحاول العلماء هذه الأيام الوصول لطرق جديدة لإنتاج الهيدروجين, وأحد هذه الطرق يتضمن استخدام الطحالب. كما أنه توجد طريقة أخرى تتضمن استخدام الجلوكوز والسوربيتول, والذي يتم في درجة حرارة منخفضة, واستخدام عامل حفاز جديد.
تحضيره صناعيا
أ - بطريقة التحليل الكهربائي في المناطق التي تكون فيها الطاقة الكهربائية رخيصة. ففي معظم معامل اصطناع النشادر[ر] الموجودة بالقرب من مساقط المياه يستحصل على الهدروجين من تحليل محاليل مائية ممددة من حمض الكبريت أو هدروكسيد الصوديوم وذلك في خلايا تحليل مصممة على أساس فصل نواتج الكاتود (المهبط) عن نواتج الأنود (المصعد). أما التفاعلان الحاصلان على المسريين فهما:
وتتشكل كميات وافرة من الهدروجين محصولاً ثانوياً عند استحصال Cl2 وNaOH بالتحليل الكهربائي لمحلول ملح الطعام.
ب - إمرار بخار الماء المسخن فوق فحم الكوك المتوهج
يدعى المزيج الغازي الناتج غاز الماءwater gas، وهو ذو قيمة صناعية كبرى وقوداً. والتفاعل السابق ماص للحرارة ولهذا يجب أن يكون فحم الكوك متوهجاً حتى يندفع التفاعل نحو اليمين .
وإذا كان المراد استعمال الهدروجين المستحصل من هذه العملية في أغراض كيمياوية فإنه يجب التخلص من CO، ويتم ذلك بإضافة بخار ماء جديد إلى المزيج الغازي الناتج:
وهو تفاعل ناشر للحرارة، ولذلك يفضَّل فيه استعمال درجات حرارة متوسطة والاستعانة بوسيط مثل الحديد أو النحاس لتسريعه. للتخلص من CO2 يمرَّر المزيج الناتج في وسط قلوي، أو يضغط ويبرَّد فينحل هذا الغاز عندئذ في الماء.
جـ - من مصافي النفط (البترول) أو من الغاز الطبيعي
يرافق عمليات التكسير المختلفة للحصول على الغازولين تشكل كميات كبيرة من الهدروجين. وتعدّ هذه الطريقة المصدر الرئيسي للحصول على الهدروجين في الوقت الحاضر. أما في المناطق التي يوجد فيها الغاز الطبيعي بكميات كبيرة فيمكن الحصول على كميات ضخمة من الهدروجين بالحرق الجزئي للميتان:
الخواص
الخواص الفيزيائية
الكتلة الذرية النسبية 1.008، طاقة التأين 13.6 إلكترون فولط، الألفة الإلكترونية 72 كيلو جول مول-1، صيغته الجزيئية H2، نقطة الانصهار -259 ْس، الكتلة الحجمية في الشروط النظامية 0.09كيلوغرام/المتر المكعب، طاقة الرابطة H–H تساوي 436 كيلوجول، طول الرابطة H–H يساوي 74 بيكومتر. ينحل من الهدروجين في الشروط العادية 19.2سم3 في لتر من الماء ،الهيدروجين أخف العناصر الكيميائية على الإطلاق, ويتكون هو ونظائره من إلكترون مفرد وبروتون. وفي درجة الحرارة والضغط القياسيين يقوم الهيدروجين يتكوين غاز ثنائي الذرة, H2, ودرجة غليانه 20.27 K ودرجة ذوبانه 14.02 K. وتحت ظروف الضغط العالية, كالتي توجد في مركز كوكب المارد الغازي يفقد الهيدروجين خواصه ويصبح فلزا سائلا (راجع الهيدروجين الفلزي). وتحت ظروف الضغط المنخفض كالتي توجد في الفضاء, يميل الهيدروجين لأن يتواجد في شكل ذرات مفردة, نظرا لعدم وجود ظروف مناسبة لها لأن تتحد, تتكون سحب من الهيدروجين H2 عند تكون النجوم.
ويلعب الهيدروجين دورا حيويا في الكون عن طريق تفاعل بروتون-بروتون ودورة كربون-نيتروجين. (وهذه عمليات انصهار نووي تطلق كميات هائلة من الطاقة خلال اتحاد ذرات الهيدروجين لتكوين الهيليوم.)
اكتشف فريق بحث سوفييتي في السابق أن الهيدروجين يكتسب فجأة لدى تعريضه إلى ضغط يبلغ ثلاثة ملايين ضغط جوي خاصة غريبة وهي أنه يصبح ناقلا للكهرباء كأي فلز من الفلزات المعروفة. فالهيدروجين على ما يبدو هو فلز [12]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص الكيماوية
كهرسلبية الهدروجين 2.1، فهي وسط بين العناصر الكهرسلبية التي تميل إلى ضم إلكترونات إضافية وبين العناصر الكهرجابية التي تميل إلى التخلي عن بعض إلكتروناتها. ولهذا السبب فإن الهدروجين يرتبط في معظم مركّباته برابطة مشتركة مع العناصر الأخرى.
اتحاده مع الأكسجين
مزيج الأكسجين والهدروجين مستقر عند درجة الحرارة العادية، ولكن زيادة الحرارة - مثل حصول شرارة مثلاً أو إشعال عود ثقاب - يؤدي إلى اتحادهما الذي ينشر نحو 58 كيلو حريرة/مول. فإذا وجد المزيج في مكان محصور أدى ذلك إلى حصول انفجار بسبب ارتفاع ضغط البخار الناتج في ذلك المكان. ويحصل الانفجار مهما كانت نسبة الهدروجين إلى الأكسجين في المزيج؛ وذلك بسبب كمية الحرارة الضخمة الناتجة، ولكن الانفجار يكون أشد كلما كانت النسبة بين حجم الهدروجين إلى الأكسجين أقرب إلى 2.
مع الكبريت
تنقص حدة التفاعل بين الهدروجين وعناصر الفصيلة VIA بالانتقال من أعلى الفصيلة إلى أسفلها، ولذلك فإن الاتحاد مع الكبريت بطيء:
ولا يمكن دفع التفاعل نحو اليمين بالتسخين لأن التفاعل ناشر للحرارة، ولذلك فإن استحضار كبريتيد الهدروجين بهذه الطريقة غير عملي بتاتاً، ويستعاض عن ذلك بفعل الحموض المعدنية على كبريتيدات المعادن.
مع الهالوجينات
حدة تفاعل الهدروجين مع الفلور شديدة جداً تصل حد الانفجار حتى لو جرى التفاعل عند درجة حرارة الهدروجين السائل:
وتنتشر كمية من الحرارة قدرها 128 كيلو حريرة. وتفاعل الهدروجين مع الكلور أقل حدة؛ إذ يبقى مزيج من الهدروجين والكلور من دون تفاعل إذا لم يعرَّض للضوء أما إذا تعرض للضوء، فإنه ينفجر، ولكن ليس بشدة الاتحاد مع الفلور نفسها:
وتنتشر كمية كبيرة من الحرارة قدرها 44 كيلوحريرة.
ووجد أن وظيفة الضوء في التفاعل السابق هي تفكيك جزيئات الكلور إلى ذرات فعّالة:
التي تتفاعل مع الهدروجين مكوِّنة حمض كلور الماء. وبمعنى آخر فإن التفاعل (1) هو التفاعل الإجمالي، ويوضح التفكك السابق ميكانيكية التفاعل.
أما مع البروم فالتفاعل أقل شدة:
وتنتشر كمية حرارة قدرها 17كيلو حريرة. أما مع اليود، فالتفاعل غير كامل:
وتنتشر كمية من الحرارة قدرها 13 كيلو حريرة. وتعطي تفاعلات الهدروجين مع الهالوجينات خير مثال على تغير الفاعلية في فصيلة ما بتغير حجم ذرة العنصر.
مع الآزوت (النتروجين)
يتحد الآزوت مع الهدروجين بصعوبة وفي شروط خاصة مكوِّناً غاز النشادر (الأمونيا):
ويعد هذا التفاعل أهم تفاعل للهدروجين.
مع الكربون
يتحد الهدروجين مع الكربون عند درجات الحرارة العالية معطياً الميتان:
الذي يؤلف القسم الرئيسي من الغاز الطبيعي المنطلق من الآبار البترولية. وتعود أهمية هذا الغاز إلى كمية الحرارة الكبيرة التي ينشرها باحتراقه مع الهواء أو الأكسجين:
وتنطلق كمية كبيرة من الحرارة قدرها 212 كيلو حريرة.
مع المعادن
يتحد الهدروجين مع معادن الفصيلة الأولى ومعادن الفصيلة الثانية (عدا المغنسيوم والبريليوم) مكوناً مركّبات بلورية ذات بنية أيونية يوجد فيها الهدروجين على شكل أيون سالب H-.
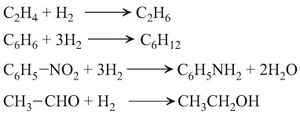
ز - مع المركّبات العضوية: يقوم الهدروجين بتفاعلات مع كثير من المركّبات العضوية، ويذكر منها:
الاحتراق
ذرة الهيدروجين
المقالة الرئيسية: ذرة هيدروجين. ذرة الهيدروجين هي ذرة عنصر الهيدروجين. وتتكون من إلكترون وحيد سالب الشحنة, يدور حول بروتون موجب الشحنة, والذي يعتبر نواة ذرة الهيدروجين. وحركة الإلكترون ثابتة في دورانها حول النواة عن طريق قوى كولوم.
ذرات الغازات التي تتألف من جزيئات ثنائية الذرة عموماً أكثر فاعلية بكثير من الجزيئات نفسها. فذرة الهدروجين H أشد فعالية من جزيء الهدروجين H2، وذرة الآزوت N أشد فاعلية من جزيء الآزوت N2.
يحضّر الهدروجين الذري من الهدروجين العادي، ولكن ذلك يتم بصعوبة بالغة، ذلك أن التفكك:
ماص للحرارة (103 كيلوحريرة/مول)، ولذلك فإنه من الضروري تسخين الهدروجين العادي إلى درجات حرارة عالية جداً كي يبدأ بالتفكك. ويُحصل على هذه الحرارة العالية بوساطة القوس الكهربائية، كما يمكن تأمين الطاقة الضرورية لهذا التفكك بالأشعة فوق البنفسجية.
يستخدم الهدروجين الذري للحصول على درجات حرارة عالية جداً وذلك باحتراقه مع الأكسجين في ما يدعى بمصباح torch الهدروجين الذري:
وتنتشر كمية كبيرة من الحرارة قدرها 303 كيلوحريرة. يمر الهدروجين الجزيئي بادئ الأمر خلال قوس كهربائية ما يؤدي إلى تفكك قسم منه يتحد مع الأكسجين في رأس المصباح.
إن الطاقة الكبيرة الضرورية لتفكك جزيء الهدروجين وكسر الرابطة المشتركة التي تربط بين ذرتيه تجعل من الهدروجين غازاً بطيء التفاعل نسبياً مع جزيئات العناصر الأخرى. وبمعنى آخر، فإن الطاقة التنشيطية للهدروجين مرتفعة جداً. وهذا هو السبب وراء استعمال المواد الوسيطة في التفاعلات التي يكون فيها الهدروجين أحد أركان التفاعل. وأفضل هذه المعادن الوسيطة معدنا النيكل والبلاتين، إذ يعتقد أن جزيء الهدروجين يتفكك إلى ذرتيه على سطح هذه المعادن، ثم يرتبط بذرات المعدن برابطة ضعيفة. وتكون النتيجة أنه يصبح أكثر فعالية وقدرة على التفاعل مع المواد الأخرى.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
استخداماته
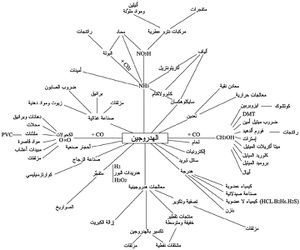
يتم استخدام كميات كبيرة من الهيدروجين في الصناعة, وخاصة في إنتاج الأمونيا بطريقة هابر وكذلك في هدرجة الزيوت والدهون وإنتاج الميثانول للحصول على المرغرين والمنتجات البترولية وفي بعض عمليات الإرجاع، كما هي الحال في الحصول على التنغستن من WO3، ويستعمل الهدروجين في اللحام. كما يستخدم الهيدروجين في الألكلة الهيدروجينية, السلفرة الهيدروجينية, التكسير الهيدروجيني. وتوجد استخدامات أخرى:
- تصنيع حمض الهيدروكلوريك واللحام وتقليل ركاز الفلزات.
- يستخدم في وقود الصواريخ. فقد جاء في نشرات أبحاث الفضاء الحديثة أن الهدروجين السائل يعطي، عندما يمزج مع الفلور السائل، دفعاً هائلاً للصاروخ لم يحققه أيّ وقود آخر. وجاء هذا الاستعمال نتيجة للتقدم العظيم الذي حققته الهندسة الكيمياوية منذ نهاية القرن العشرين إذ لا يخفى مدى الخطر الذي ينطوي عليه استعمال كميات ضخمة من الهدروجين السائل إذ تكفي شرارة صغيرة لإحداث انفجار هائل.
- له قدرة على التوصيل الحراري أعلى من أي غاز آخر, ولذا فإنه يستخدم إبريد المواتير في المولدات الكهربية في محطات الطاقة.
- يساعد الهيدروجين السائل في أبحاث الحراريات المنخفضة, متضمنة دراسات الموصلات الكهربية الفائقة.
- نظرا لأنه أخف من الهواء بأربعة عشر مرة, فقد تم استخدامه بتوسع كعامل رفع في البالونات والمنطاد. وقد كان ذلك حتى وقوع كارثة هايدنبيرج والتي أقنعت العامة بخطورة استخدام الهيدروجين لهذا الغرض.
- يستخدم نظير الهيدروجين الديوتريوم (هيدروجين-2) في تطبيقات الانشطار النووي كمهدئ للنيوترونات لتقليل سرعتها, وأيضا يستخدم في الاندماجات النووية. وتستخدم مركبات الديوتريوم في الكيمياء والأحياء في دراسات تفاعلات تأثير النظائر.
- يستخدم التريتيوم (هيدروجين-3) والذي يتم الحصول عليه في المفاعلات النووية في عمل القنابل الهيدروجينية. كما يستخدم أيضا لتعيين النظائر في علوم الأحياء ومصدر إشعاع في الدهانات الضوئية.
- يستحصل أكثر من 20 مليون طن هدروجين سنوياً. يستخدم 50٪ منها في عمليات اصطناع النشادر، كما أن قسماً كبيراً منه يستخدم في اصطناع كيمياويات أخرى، مثال ذلك، الكحول الميتيلي CH3OH وفق التفاعل:
كما يمكن للهيدروجين أن يحترق في محركات الاحتراق الداخلية, وقد تم تطوير سيارة تعمل باحتراق الهيدروجين تحت إشراف BMW-Chrysler (شاهد سيارة هيدروجينية).
تُعدّ الخلايا الوقودية fuel cells هدروجين - أكسجين وسائل مفيدة لتحويل طاقة التفاعل:
يخرج الهدروجين والأكسجين معاً فوق إلكترودين (مسريين) يحفّزان التفاعل بينهما. والإلكتروليت (الكهرليت) يكون حمضاً أو أساساً حسب نمط الخلية. وميزة خلية الوقود أنها تنتج كهرباء والناتج الثانوي فيها الماء فقط. وتشتغل خلايا الوقود باستطاعة أعلى من الطرق التقليدية لتوليد الكهرباء ومردودها أكبر، مثال ذلك محطات توليد الطاقة التي تعمل على النفط. وقد استعملت خلايا وقود في المركبات الفضائية لأنها موثوقة، ومردودها عالٍ، وحجمها صغير نسبياً بالمقارنة مع الخلايا الكهربائية التقليدية. ويلخص المخطط (1) أهم استعمالات الهدروجين الصناعية.
كما أن خلايا الوقود الهيدروجينية تستخدم لإنتاج قوة ذات انبعاثات أقل من محركات الاحتراق الداخلي الهيدروجينية. وتعتبر الانبعاثات الصادرة من محركات الاحتراق الداخلي الهيدروجينية والخلايا الهيدروجينية متعادلة مع الانبعاثات التي تصدر أثناء إنتاج الهيدروجين. وقد يؤدى هذا لحدوث تغير في كهرباء المستقبل حيث سيتم الاعتماد على التحليل الكهربائي للماء باستخدام قوى الشمس أو الرياح أو القوة النووية للحصول على دورة وقود خالية من التلوث.
- ولا تزال الأبحاث جارية ليكون الهيدروجين وقود المستقبل. ويمكن أن يكون هذا حلقة الربط بين اختلاف أنواع الطاقة وكيفية نقلها وتخزينها, فمثلا يمكن أن يتم تحويلها إلى كهرباء (لحل مشكلة تخزين الكهرباء ونقلها), كما يمكن أن تكون بديلا للوقود الحيوي, أو بديل للغاز الطبيعي ولوقود الديزل. وكل هذا ممكن نظريا بدون أي انبعاثات CO2 أو أى ملوثات غازية سامة.
الاستخدامات الكيميائية
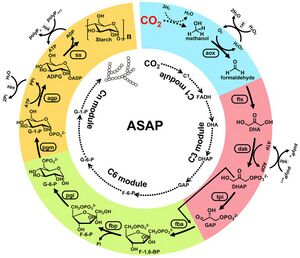
أثناء عملية التمثيل الضوئي، تقوم العديد من النباتات بتحويل الگلوكوز إلى پوليمرات تشكل حبيبات نشا غير قابلة للذوبات، ومثالية لتخزين الطاقة على المدى الطويل في الجذور والبذور. في 22 سبتمبر 2021، طور تشاي وزملائه نظامًا هجينًا يتم فيه اختزال ثاني أكسيد الكربون إلى ميثانول بواسطة محفز غير عضوي ثم تحويله بواسطة الإنزيمات أولاً إلى ثلاث وست وحدات سكر-كربون ثم إلى نشا پوليمري. يعتمد المسار الابتنائي للنشا الاصطناعي هذا على إنزيمات المأشوب المهندسة من العديد من مصادر ختلفة من العديد من الكائنات الحية، ويمكن ضبطه لإنتاج الأميلوز أو الأميلوپكتين بمعدلات وكفاءة ممتازة مقارنة بأنظمة تثبيت الكربون الاصطناعية الأخرى - واعتمادًا على المقياس المستخدم، حتى المحاصيل الحقلية.[13]
تاريخ الهيدروجين
الهيدروجين (في اللغة الفرنسية تعني مكون الماء وفى اللغة الإغريقية تعنى هيدرو "ماء" وجين أي "تكون") تم التعرف عليه لأول مرة كمادة منفصلة عام 1766 م بواسطة هنري كافيندش, فقد عثر عليه أثناء تفاعلات الزئبق مع الأحماض. وبالرغم من أنه افترض خطأ أن الهيدروجين أحد مكونات الزئبق (وليس أحد مكونات الحمض) فقد استطاع وصف كثير من خصائص الهيدروجين بدقة. وقد أعطى أنطوان لافوازييه الاسم للهيدروجين كما أثبت أن الماء يتكون منه مع الأكسجين وكان من أول استخدامات الهيدروجين المنطاد. كما أن الديوتريوم وهو أحد نظائر الهيدروجين تم اكتشافه بإشراف هارولد سي يوري بتقطير عينة من الماء عدة مرات. وقد حصل يوري على جائزة نوبل لاكتشافه عام 1934 م. وقد تم اكتشاف النظير الثالث (التريتيوم) في نفس العام.
تحضيره
يحضر غاز الهيدروجين بعده طرق منها:
- من الغاز الطبيعى أو الغازات البتروليه بالاكسده الجزيئيه أو التعديل ببخر الماء.
- التحليل الكهربى للماء.
- اختزال بخار الماء بالكربون (طريقة بوش).
- إمرار بخار الماء على الحديد السائل.
- أستخلاص الايدروجين من الغازات الصناعية.
- تفاعل السليكون مع إيدروكسيد الصوديوم.
- كمنتج ثانوى في صناعه الصودا الكاويه بالتحليل الكهربى لكلوريد الصوديوم.
- قذف جزيأت الماء بواسطة الكترونات.
- تفاعل عناصر المجموعة الأولى مع الماء.
مستويات الطاقة الإلكترونية
الطاقة الأرضية للإلكترون الموجود في ذرة الهيدروجين تساوى 13.6 إلكترون فولت والتي تعادل تقريبا فوتون من المنطقة فوق البنفسجية تقريبا 92 نانو متر.
ويمكن عن طريق نموذج بور أن يتم حساب مستويات طاقة الهيدروجين بطريقة شبه دقيقة. ويتم هذا بجعل الإلكترون يدور حول البروتون مثلما تدور الأرض حول الشمس. ولكن الأرض لها مدار ثابت حول الشمس محكوم بقوى الجاذبية بين الأرض والشمس, أما الإلكترون فإنه يحتفظ بمداره تحت تأثير القوة الكهرومغناطيسية. كما يوجد فرق آخر بين نظامي الشمس الأرض والبروتون الإلكترون هو أنه طبقا لميكانيكا الكم يمكن للإلكترون أن يكون على مسافة ثابتة فقط من البروتون. وعند عمل تصور لذرة الهيدروجين طبقا لهذا النظام فإنه يعطى مستويات الطاقة الصحيحة وإشعاعاتها.
وجوده في الطبيعة
الهيدروجين هو أكثر العناصر وفرة في الكون, ويمثل نحو 75 % من المواد بالكتلة ونحو 90 % بعدد الذرات. يحتل الهدروجين المرتبةَ التاسعة بين العناصر الموجودة على سطح الأرض من حيث الوفرة إذا رُتِبت العناصر تبعاً للنسبة الوزنية، أما إذا كان الترتيب تبعاً لعدد الذرات فإنه يحتل المرتبة الثالثة بعد الأكسجين والسيليكون . ومعظم هذا الهدروجين موجود على شكل ماء، ولكن قسماً كبيراً منه يوجد في النفط والمادة الحية بمختلف أنواعها. أما في الصخور فالهدروجين نادر نسبياً إلا ما وجد منه على شكل ماء تبلور مع الأملاح أو ممتصاً من قبل الغضار. ويتواجد هذا العنصر بوفرة كبيرة في النجوم والكواكب الغازية العملاقة ولكنه شحيح للغاية في غلاف الأرض (1 جزء في المليون بالحجم). أكثر المصادر شيوعا لهذا العنصر هي الماء والذي يتكون من ذرتي هيدروجين وذرة أكسجين (H2O). كما توجد مصادر أخرى تتضمن معظم أشكال المواد العضوية (كل أشكال الحياة المعروفة) متضمنة الفحم والغاز الطبيعي وأنواع الوقود الحفري الأخرى. الميثان (CH4) يعتبر مصدرا مهما للهيدروجين.
يمكن تحضير الهيدروجين بعدة طرق كتمرير البخار على الكربون الساخن وتحلل الهيدروكربونات بالحرارة وتفاعلات القواعد القوية في محاليلها المائية مع الألومنيوم والتحليل الكهربائي للماء وتفاعلات تبادل الأحماض مع الفلزات.
ويتم إنتاج الهيدروجين بصورة كبيرة عن طريق إعادة تكوين البخار للغاز الطبيعي في درجات حرارة عالية (700-110 °C), حيث يتفاعل البخار مع الميثان لينتج أول أكسيد الكربون والهيدروجين.
كما يمكن الحصول على هيدروجين إضافي من أول أكسيد الكربون خلال عملية تبادل ماء غاز.
يرافق الهدروجينَ في مركّباته جميعها النظير isotope المدعو ديوتريوم deuterium؛ واسمه يعني (الثاني) باليونانية، ويرمز له بـ D بنسبة مول ديوتريوم لكل 7000 مول هدروجين عادي. اكتشَف هذا النظير الأميركي أوري Urey عام 1932. تنبع أهمية هذا النظير من استعماله مهدئاً للنترونات في المفاعلات النووية، يختلف هذا النظير عن الهدروجين العادي باحتواء نواته على نترون إضافة إلى البروتون في الهدروجين العادي. وهناك نظير آخر للهدروجين يدعى التريتيوم tritium، واسمه يعني (الثالث) باليونانية ويرمز له بالحرف T. تحوي نواته نترونين إضافة إلى البروتون، وقد اصطنعه العالم ألفاريز Alvarez في جامعة كاليفورنيا بقذف الديوتريوم بوساطة النترونات:
ونسبة الهدروجين الحر في جو الأرض لا تتجاوز 0.01٪ لخفّته، أما في بعض الكواكب الأخرى فإنه يعتقد بأنه المكوِّن الرئيسي لجوها، وذلك لأن جاذبيتها أقوى من جاذبية الأرض. ويعتقد أن الهدروجين - في كثير من النجوم بما فيها الشمس - هو المنبع الرئيسي للطاقة الإشعاعية التي تنتج عن اندماج ذرات الهدروجين وتكوين الهليوم[ر: الاندماج النووي].
مركبات الهيدروجين
الهيدروجين أخف الغازات, يتحد مع معظم العناصر الأخرى ليكون مركبات. الهيدروجين له سالبية كهربية قدرها 2.2 ولذا فإنه يكون مركبات حيث أنه أكثر العناصر لا فلزية وأكثرها فلزية أيضا. الحالة اللافلزية يطلق عليها الهيدرايدات وفيها يكون الهيدروجين في صورة أيونات H- أو مادة مذابة في العنصر الآخر (كما في هيدرايد البالاديوم. أما الحالة الفلزية فإنها تحدث عندما يميل الهيدرجين لأن يكون رابطة تساهمية حيث أن أيون H+ سيكون عبارة عن نواة بدون إلكترونات وبالتالي سيكون لها قدرة كبيرة على جذب الإلكترونات لها. وفي الحالتين تتكون الأحماض. وعلى هذا فإنه حتى في حالة المحاليل الحمضية يمكن أن ترى أيونات مثل الهيدرونيوم (H3O+) حيث يتعلق البورتون بعنصر أخر.
يتحد الهيدروجين مع الأكسجين لتكوين الماء H2O, وتنبعث كمية كبيرة من الطاقة, كما أنه يحترق في الهواء ويحدث انفجارا. أكسيد الديوتريوم D2O, يسمى الماء الثقيل. ينتج الهيدروجين مركبات كقيرة مع الكربون. ونظرا لارتباط هذه المركبات بالكائنات الحية فإن هذه المركبات يطلق عليها مركبات عضوية, ودراسة خواص هذه المركبات يطلق عليها الكيمياء العضوية..
أشكال الهيدروجين
في الظروف العادية فإن غاز الهيدروجين خليط من نوعين من الجزيئات واللذان يختلفان عن بعضهما بطريقة الدوران حول النواة. وهذان النوعان يعرفان أورثو-هيدروجين، بارا-هيدروجين (وهذا يختلف عن موضوع النظائر - شاهد التالي) الأورثو-هيدروجين يكون دوران النواة متوازي (ويكون ثلاثيات)، بينما في البارا-هيدروجين يكون الدوران عكس توازي (ويكون أحاديات). وفى الظروف القياسية يتكون الهيدروجين من 25 % من البارا و 75 % من الأورثو (والذي يطلق عليه الشكل العادى للهيدروجين). وتعتمد نسبة الإتزان بين هذين الشكلين على الحرارة، ولكن حيث ان الأورثو له طاقة أكبر (في الحالة المثارة لا يكون ثابت في حالته النقية. وفى درجات (درجة حرارة الغليان) فإن حالة الإتزات تتكون كلها غالبا من البارا.
وحالة التحول بين النوعين بطيئة ولو تم تبريد الهيدروجين وتكثيفه سريعا، فإنه يحتوى على كميات كبيرة من الأورثو. ومن المهم أثناء تحضير وتخزين الهيدروجين السائل حيث أن التحول بين أورثو-بارا ينتج حرارة أكبر من طاقة تبخره ويتم فقد كميات كبيرة من الهيدروجين بالتبخر بهذه الطريقة بعد عدة أيام من تسييله. ولذا فإنه يتم استخدام عوامل حفازة لتحولات أورثو-بارا خلال تبريد الهيدروجين. كما أن النوعين لهما اختلاف طفيف في الخواص الفيزيائية. فمثلا درجة الذوبان والغليان في البارا-هيدروجين أقل 0.1 كلفن من الشكل العادى.
النظائر
الهيدروجين هو العنصر الوحيد الذي له أسماء مختلفة لنظائره. (خلال الدراسات الأولى للمواد المشعة، كان يطلق على النظائر المشعة أسماء مختلفة عن العناصر، ولكن لا يتم استخدام هذه الأسماء حاليا، وبالرغم من ذلك فإن الرادون تم تسميته على اسم أحد نظائره). يتم استخدام الرمز D بدلا من 2H، الرمز T بدلا من 3H وذلك للتعبير عن الديوتريوم، التريتيوم وهذا على الرغم من أن هذا ليس معتمد. (كما أنه الرمز P محجوز للعنصر فوسفور وبالتالى لا يمكن استخدامه للبروتيوم)
- 1H
أكثر نظائر الهيدروجين ثباتا، وهو أخفها[12]، وله نواة ذرة تتكون من بروتون واحد، ويستخدم الاسم بروتيوم للتعبير عن هذا النظير. والهيدروجين الموجود في الماء العادي يتألف بأكمله تقريبًا من البروتيوم.
- 2H
النظير الثابت الأخر يسمى ديوتريوم أو ديوتريوم ويرمز له بالرمز D وله نيترون إضافي في النواة، ويكون الديوتريوم 0.0184 - 0.0082 % من كل الهيدروجين (IUPAC)، نسبة الديوتريوم إلى البروتيوم تم عملها بواسطة VSMOW والمرجع القياسي هو الماء. والديوتريوم قليل جدًا في الماء، إذ توجد منه ذرة واحدة فقط مقابل 6700 ذرة من البروتيوم[12].
- 3H
النظير الثالث الطبيعي للهيدروجين هو تريتيوم ويرمز له بالحرف T. وتتكون نواة التريتيوم من 2 نيوترون بلإضافة إلى البروتون. وتتحلل عن طريق تحلل بيتا وله فترة نصف عمره (نصف تفككه) تساوى 13.2 سنة. وهو يتكون باستمرار في الطبقة العليا من الغلاف الجوي (ستراتوسفير) بفعل الأشعة الكونية[12]. وكميته على الأرض ضئيلة جدًا جدًا. فهي أقل من كيلوغرام واحد في الكرة الأرضية كلها[12].
- 4H
هيدروجين-4 تم تصنيعه بقذف التريتيوم بنواة ديوتريوم سريعة الحركة. ويتحلل عن طريق انبعاث النيترون، وله فترة عمر نصف تساوى 9.93696x10−23 ثانية.
- 5H
تم التعرف على هيدروجين-5 في عام 2001 بقذف الهيدروجين بالأيونات الثقيلة. ويتحلل عن طريق انبعاث النيترون، وله فترة عمر نصف تساوى 8.01930x10−23 ثانية.
- 6H
هيدروجين-6 يتحلل عن طريق انبعاث النيترون، وله فترة عمر نصف تساوى 3.26500x10−22 ثانية.
- 7H
تم الحصول على هيدروجين-7 في عام 2003 (المقالة) في معامل ريكين اليابانية بتبريد شعاع من عالى-الطاقة من الهيليوم-8 بواسطة الهيدروجين وتم التعرف على تريتون - نواة التريتيوم - والنيوترونات الناتجة من تكسر هيدروجين-7، وبنفس الطريقة يمكن إنتاج والتعرف على هيدروجين-5.
اندماج الهيدروجين في الشمس والنجوم
عن طريق الاندماج النووي تستمد الشمس حرارتها وكذلك النجوم. تندمج ذرات الهيدروجين في درجة حرارة نحو 12 مليون درجة مئوية وضغط عالى جدا فيتكون الهيليوم. ويقوم النجم والشمس بذلك التفاعل أثناء 90 % من عمره. بعد ذلك يكون الجزء الأكبر من الهيدروجين قد استهلك وتحول إلى هيليوم.
يمكن سريان التفاعل الاندماجي بطريقتين، وبواسطتهما يلتحم 4 بروتونات وهي أنوية الهيدروجين فتكون نواة الهيليوم 4He :
- الالتحام المباشر سلسلة تفاعل بروتون-بروتون
- العناصر الثقيلة القليلة (الكربون, النتروجين, الأكسجين) عن طريق ما يسمى دورة CNO أو (دورة بيته-فايتزيكر) (CNO-Zyklus).
وعند حساب الطاقة الناتجة فيجب الأخذ في الحسبان تولد أثنين من البوزيترونات في كل تفاعل يؤدي إلى هيليوم-4 سواء في تفاعل البروتون-بروتون أو في دورة بيته-فايتزيكر. يتفاعل كل بوزيترون مع أحد الإلكترونات في الحال عن طريق إفناء إلكترون-بوزيترون وينتجا طاقة إضافية قدرها 1,022 مليون إلكترون فولت. أي أنه يلزم لحساب الطاقة الناتجة حساب نقص الكتلة للأربعة بروتونات التي التحمت مكونة نواة الهيليوم بالإضافة إلى ضعف كتلة الإلكترون. ونقص الكتلة هو الفرق في كتلة المواد الداخلة في التفاعل وهي كتلة أربعة ذرات الهيدروجين (وهي تتكون من 4 بروتونات وأربعة إلكترونات) وطرح كتلة ذرة الهليوم 4He. كما ينتج عن ذلك أيضا نيوترينو يأخذ جزءا من الطاقة ويغادر بها الشمس أو النجم.
وعن طريق الاندماج النووي يفقد الهيدروجين الداخل في التفاعل نحو 0,73 % من كتلته تتحول إلى طاقة وتلك هي مايسمى نقص الكتلة. ويمكن حساب الطاقة الناتجة عن ذلك النقص في الكتلة عن طريق المعادلة الشهيرة لأينشتاين وهي معادلة تكافؤ المادة والطاقة:
- E = mc²
حيث:
- m الكتلة
- c سرعة الضوء في الفراغ.
وينشأ هذا الفقد في الطاقة من طاقة الارتباط النووي بين البروتونات والنيوترونات (التسمية الجامعة لهما نوكليونات).
ويعتبر الاندماج النووي بين الهيدروجين لإنتاج الهيليوم أكثر التفاعلات النووية منتجة للطاقة من بين التفاعلات النووية الأخرى (أنظر طاقة ارتباط). كما يسير توليد الطاقة في النجوم أيضا على نفس المنوال، أي أندماج الهيدروجين. وعندما يقترب استهلاك الهيدروجين في النجم يتبعه اندماج الهيليوم الذي ينتح الكربون ذو كتلة ذرية 12 ثم يتولد الأكسجين وكتلته الذرية 16، وهكذا تتولد العناصر الأكثر كتلة في الشمس وفي النجوم حتى ينشأ الحديد وكتلته الذرية 57. وتبلغ الطاقة الناتجة عن إنتاج ذرة كربون واحدة نحو 1/10 الطاقة الناتجة عند إنتاج ذرة هيليوم واحدة.
طاقة الهيدروجين البديلة
من مشروعات المحافظة على البيئة والاستغناء عن الوقود الأحفوري مشروع الستخدام غاز الهيدروجين لإنتاج الطاقة وذلك عن طريق خلايا وقود. وخلية الطاقة تُنتج الكهرباء من خلال تفاعل كيميائي باستخدام الهيدروجين والأوكسجين.
فهذه الخلية الكهروكيميائية تستخدم لإنتاج الطاقة الكهربائية عن طريق تزويد الخلية بغازي الأكسجين والهيدروجين باستمرار. عند المصعد يتأكسد الهيدروجين إلى بروتونات (التي تنتجه داخل وسط كهرل) وإلكترونات (التي تتجه في خارج الخلية إلى الأنود) حيث يلتقي الإثنان مع الأكسجين الذي يختزل ويتكوين تيار كهربائي والماء. والهدف من ذلك أن يقوم محرك كهربائي يعمل بالتيار المتولد من التفاعل الكيميائي ويحرك السيارة. أي أن عددا كبيرا من سيارات المستقبل سوف يسير بغاز الهيدروجين بدلا عن البنزين.
و توجد أنواع متعددة من الخلايا الوقود والتي يمكن تصنيفها حسب نوع الكهارل ودرجة الحرارة التي تعمل عليها. فعلى سبيل المثال تعتبر تلك التي تستخدم مكوثرا ككهرل موصلا للبروتونات أكثر مناسبة للإسخدام في تسيير السيارة الكهربائية بينما تلك التي تستخدم الخزف كموصل لأيونات الأكسجين أفضل للاستخدام المنزلي مثلا للتزويد بالكهرباء والحرارة.
تعتبر تقنية استغلال الهيدروجين لإنتاج الطاقة الكهربائية من أحسن وسائل توليد الطاقة حفاظا على البيئة حيث لا ينتج عنها إلى التيار الكهربائي وماء. لهذا تحظي تلك التقنية الجديدة باهتمام كبير نحو تطويرها وتسخيرها في تسيير السيارات وإمداد المنازل بالتيار الكهربائي. وقد بدأت شركات كبيرة لصناعة السيارات في إنتاج سيارات صغيرة وتعرضها في الأسواق. وبدلا من شحنها بالبنزين أو الديزل يمكن شحنها ب 4 كيلوجرام من الهيدروجين تكفيها للسير مسافة نحو 400 كيلومتر. ولكن سرعة تلك السيارات لا زالت منخفضة ولكنها كافية للاستخدام في السرعات العادية للقيادة في المدينة.
أما الوحدات التي سوف تقوم بتوليد الكهرباء في المنازل والبيوت فستكون وحدات كبير مناسبة وتزن عدة أطنان.
السلامة والاحتياطات
| المخاطر | |
|---|---|
| ن.م.ع. مخطط تصويري | 
|
| ن.م.ع. كلمة الاشارة | Danger |
| H220 | |
| P202, P210, P271, P377, P381, P403[14] | |
| NFPA 704 (معيـَّن النار) | |
الهيدروجين غاز له قابلية كبيرة للاشتعال حتى في التركيزات القليلة حتى 4 %. كما أنه يتفاعل بشدة مع الكلور والفلور لينتج أحماض الهيدروهاليك والتي تكون مضرة للرئة والأنسجة. وعند خلطه مع الأكسجين فإن الهيدروجين ينفجر عند الاشتعال. والهيدروجين أيضا له خاصية فريدة هي أن شعلته في الهواء نظيفة تماما. وعلى هذا فإنه من الصعب معرفة حدوث أى احتراق يحدث من تسرب الهيدروجين، كما أنه هناك خطر كبير من أن يكون هناك حريق هيدروجين بدون أى ملاحظة.
شاهد أيضا
هوامش
ملاحظات
المراجع
- ^ Simpson, J.A.; Weiner, E.S.C. (1989). "Hydrogen". Oxford English Dictionary. Vol. 7 (2nd ed.). Clarendon Press. ISBN 0-19-861219-2.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. p. 240. ISBN 0123526515.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^
"Magnetic susceptibility of the elements and inorganic compounds". [[CRC Handbook of Chemistry and Physics]] (PDF) (81st ed.). CRC Press.
{{cite book}}: URL–wikilink conflict (help) - ^ Simpson, J.A.; Weiner, E.S.C. (1989). "Hydrogen". Oxford English Dictionary. Vol. 7 (2nd ed.). Clarendon Press. ISBN 0-19-861219-2.
- ^ خطأ في استخدام قالب template:cite web: Parameters url and title must be specified
- ^ خطأ في استخدام قالب template:cite web: Parameters url and title must be specified
- ^ http://www.bbc.co.uk/iplayer/episode/b007vbql/b007vbnj/Atom_The_Key_to_the_Cosmos/
- ^ خطأ في استخدام قالب template:cite web: Parameters url and title must be specified
- ^ خطأ في استخدام قالب template:cite web: Parameters url and title must be specified
- ^ هيام بيرقدار. "الهدروجين". الموسوعة العربية. Retrieved 2012-03-01.
- ^ هيام بيرقدار. "الهدروجين". الموسوعة العربية. Retrieved 2012-10-01.
- ^ أ ب ت ث ج بتريانوف, إيغور فاسيلفيتش (1987), "الماء: تلك المادة العجيبة", دار مير للطباعة والنشر،ترجمة الدكتور عيسى مسوح
- ^ "Cell-free chemoenzymatic starch synthesis from carbon dioxide". www.science.org. 2021-09-22. Retrieved 2021-12-18.
- ^ "MyChem: Chemical" (PDF). Archived from the original (PDF) on 1 October 2018. Retrieved 1 October 2018.
وصلات خارجية
- WebElements.com - الهيدروجين
- EnvironmentalChemistry.com - الهيدروجين
- It's Elemental &- الهيدروجين
- صور الهيدروجين
- اكتشاف الهيدروجين
- الهيدروجين خواصه واستخاماته وتتطبيقاته
- اكتشاف الهيدروجين الرحلة الأولى حول العالم بقارب هيدروجيني
- معمل لوس ألاموس القومي - هيدروجين
- معمل ريكين العلمي للإشعاع، اليابان - أبحاث الهيدروجين الثقيل
- النيوكليدات والنظائر، الطبعة الرابعة عشر: شكل النوكليدات، شركة جنرال إليكتريك، 1989
- Basic Hydrogen Calculations of Quantum Mechanics
- Hydrogen (University of Nottingham)
- High temperature hydrogen phase diagram
- Wavefunction of hydrogen
| Diatomic Elements | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
هيدروجين |
| |
نيتروجين |
| |
أكسجين |
| |
فلور |
|||||||||||||||||||||||||
|
كلور |
| |
بروم |
| |
يود |
| |
أستاتين |
|||||||||||||||||||||||||
- CS1 errors: URL–wikilink conflict
- Infobox element missing image
- Articles containing إنگليزية-language text
- Articles with hatnote templates targeting a nonexistent page
- Chembox container only
- Short description is different from Wikidata
- هيدروجين
- لا فلزات تفاعلية
- عناصر كيميائية
- Diatomic nonmetals
- Biology and pharmacology of chemical elements
- Nuclear fusion fuels
- Airship technology
- Reducing agents
- Refrigerants
- Gaseous signaling molecules
- مضافات غذائية بأرقام أوروپية