منجنيز
 Pure manganese cube and oxidized manganese chips | |||||||||||||||
| منجنيز | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | silvery metallic | ||||||||||||||
| الوزن الذري العياري Ar°(Mn) | |||||||||||||||
| منجنيز في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 25 | ||||||||||||||
| المجموعة | 7 | ||||||||||||||
| الدورة | period 4 | ||||||||||||||
| المستوى الفرعي | d-block | ||||||||||||||
| التوزيع الإلكتروني | [Ar] 3d5 4s2 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 13, 2 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | solid | ||||||||||||||
| نقطة الانصهار | 1519 K (1246 °س، 2275 °F) | ||||||||||||||
| نقطة الغليان | 2334 K (2061 °س، 3742 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 7.21 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 5.95 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 12.91 kJ/mol | ||||||||||||||
| حرارة التبخر | 221 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 26.32 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 1.55 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 127 pm | ||||||||||||||
| نصف قطر التكافؤ | Low spin: 139±5 pm High spin: 161±8 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| التواجد الطبيعي | primordial | ||||||||||||||
| البنية البلورية | body-centered cubic (bcc) | ||||||||||||||
| سرعة الصوت قضيب رفيع | 5150 م/ث (عند 20 °س) | ||||||||||||||
| قضيب رفيع | 7.81 W/(m·K) | ||||||||||||||
| التمدد الحراري | 21.7 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 1.44 µΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | paramagnetic | ||||||||||||||
| القابلية المغناطيسية | (α) +529.0×10−6 cm3/mol (293 K)[1] | ||||||||||||||
| معامل يونگ | 198 GPa | ||||||||||||||
| معاير الحجم | 120 GPa | ||||||||||||||
| صلادة موز | 6.0 | ||||||||||||||
| صلادة برينل | 196 MPa | ||||||||||||||
| رقم كاس | 7439-96-5 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف | Carl Wilhelm Scheele (1774) | ||||||||||||||
| أول عزل | Johann Gottlieb Gahn (1774) | ||||||||||||||
| نظائر المنجنيز | |||||||||||||||
| قالب:جدول نظائر منجنيز غير موجود | |||||||||||||||
المنجنيز إنگليزية: Manganese، هو عنصر كيميائي في الجدول الدوري، رمزه Mn، ورقمه الذري 25. وهو من العناصر الإنتقالية ويوجد في الدورة الطويلة الأولى من الجدول الدورى، حيث يقع بين الكروميوم والحديد. للمجنيز خواص مميزة مع كلا من هذه العناصر. على الرغم من محدودية ما عرف عنه وعن استخداماته وهو في الحالة النقية فإن للمنجنيز أهمية عظمى من الناحية العملية وذلك في صناعة الصلب. [2] لمنجنيز عنصر كيميائي يحمل الرمز Mn. وهو فلز مُتَقصِّفُ رمادي فضي اللون، وله استخدامات مهمّة وعديدة في الصناعة وخاصة في صناعة الفُولاذ. والوزن الذري للمنجنيز 54,938، وعدده الذري 25. والمنجنيز عنصر موجود بوفرة في أماكن كثيرة من القشرة الأرضية. وعلى الرغم من ذلك فإنه يوجد فقط متحداً مع عناصر كيميائية أخرى. وتشمل المعادن التي تحتوي على كميات كبيرة من المنجنيز على البرونيت والهوسمنيت والمانغنيت والبسلمولين والبيروليسيت.
وتحتاج كل النباتات والحيوانات إلى كميات بسيطة من المنجنيز. كما أن نقص المنجنيز في النباتات يؤثر على إنتاج الكلوروفيل (اليخضور) مما يؤدي إلى اصفرار أوراقها. وفي الإنسان والحيوانات الأخرى يؤدي النقص في المنجنيز إلى اختلال في النمو، وينتج من ذلك عديد من تشوهات العظام والجهاز العصبي المركزي. وتوفر الحمية الغذائية التي تحتوي على البنجر والتوت البري الأزرق ودقيق القمح الكامل ونُخَالة القمح كمية كافية من المنجنيز.
يعتبر المنجنيز أيضًا عنصراً غذائياً أساسياً للإنسان، ومهماً في استقلاب المغذيات الكبيرة، وتكوين العظام، وأنظمة حماية الجذور الحرة. إنه عنصر حاسم في عشرات البروتينات والإنزيمات.[3] يوجد في الغالب في العظام، ولكن أيضاً في الكبد والكلى والدماغ.[4] في الدماغ البشري، المنجنيز مرتبط ببروتين المنجنيز المعدني، وعلى الأخص مخلقة الغلوتامين في الخلايا النجمية.
عُزل المنجنيز لأول مرة عام 1774. وهو مألوف في المختبر على شكل پرمنگنات الپوتاسيوم بملح بنفسجي عميق. يحدث في المواقع النشطة في بعض الإنزيمات.[5] من الأمور ذات الأهمية الخاصة استخدام الكتلة Mn-O، مركب استخراج الأكسجين، في إنتاج الأكسجين بواسطة النباتات.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص المميزة
الخواص الطبيعية
المنجنيز معدن رمادي فضي يشبه الحديد. إنه قاس وجاف للغاية، ويصعب صهره، لكن من السهل تأكسدته.[6]معدن المنجنيز وأيوناته الشائعة هي مغناطيسية مسايرة.[7] يتلاشى المنغنيز ببطء في الهواء ويتأكسد ("الصدأ") مثل الحديد الموجود في الماء الذي يحتوي على أكسجين مذاب.
النظائر
يتكون المنجنيز الموجود بشكل طبيعي من نظير، 55Mn. كما عُزل العديد من النظائر المشعة ووصفها، وتتراوح في الوزن الذري من 44 u (44Mn) إلى 69 u (69Mn). الأكثر استقراراً هي (53Mn) مع عمر النصف 3.7 مليون سنة، و54Mn بعمر نصف يبلغ 312.2 يوماً، و52Mn بعمر نصف 5.591 يوماً. جميع النظائر المشعة المتبقية لها نصف عمر أقل من ثلاث ساعات، وأغلبها أقل من دقيقة واحدة. وضع الاضمحلال الأساسي في النظائر الأخف من النظائر المستقرة الأكثر وفرة، 55Mn، هو اصطياد إلكترون والوضع الأساسي في النظائر الثقيلة هو اضمحلال بيتا.[8]يحتوي المنجنيز أيضاً على ثلاث مصاوغات نووية.[8]
المنجنيز هو جزء من مجموعة العناصر الحديدية، والتي يعتقد أنها تتكون في نجوم كبيرة قبل وقت قصير من انفجار سوپرنوڤا.[9]> يتحلل 53Mn إلى 53Cr مع عمر النصف يبلغ 3.7 مليون سنة. نظراً لعمرها النصفي القصير نسبياً، يعد 53Mn نادراً نسبياً، وينتج عن تأثير الأشعة الكونية على الحديد.[10]عادةً ما يتم دمج محتويات نظائر المنجنيز مع محتويات نظائر الكروم وقد وجدت تطبيقاً في الجيولوجيا النظيرية والتأريخ الإشعاعي. تعزز النسب النظيرية Mn–Cr الأدلة من 26Al و107Pd للتاريخ المبكر للنظام الشمسي. تشير الاختلافات في 53Cr/52Cr وMn/Cr من عدة نيازك تقترح قيمة أولية 53Mn/55Mn، والتي تشير إلى أن التركيب النظيري Mn–Cr يجب أن ينتج عن اضمحلال "في الموقع" لـ 53Mn في الأجسام الكوكبية المتباينة. ومن ثم، يوفر 53Mn دليلًا إضافياً على عمليات التخليق النووي مباشرةً قبل اندماج النظام الشمسي.
حالات الأكسدة

حالات الأكسدة الأكثر شيوعاً للمنجنيز هي +2, +3, +4, +6, و+7، على الرغم من ملاحظة جميع حالات الأكسدة من −3 إلى +7. غالباً ما يتنافس Mn2+ مع Mg2+ في الأنظمة البيولوجية، مع تشابه الأيون أيضاً في خصائصه مع Ca2+ وZn2+. مركبات المنجنيز حيث يكون المنغنيز في حالة أكسدة +7، والتي تقتصر في الغالب على أكسيد غير مستقر Mn2O7، مركبات أنيون برمنجنات أرجوانية مكثفة MnO4− وقليل من أوكسييدات (MnO3F وMnO3Cl) عوامل مؤكسدة قوية.[6] المركبات ذات حالات الأكسدة +5 (أزرق) و+6 (أخضر) عوامل مؤكسدة قوية وهي عرضة لعدم التناسب.
حالة الأكسدة الأكثر استقراراً للمنجنيز هي +2، والتي لها لون وردي باهت، والعديد من مركبات المنجنيز (II) معروفة، مثل كبريتات المنجنيز (II) (MnSO4) وكلوريد المنجنيز (II) (MnCl2). تظهر حالة الأكسدة هذه أيضاً في معدن رودوكروزيت (كربونات المنجنيز (II)). يوجد المنجنيز (II) بشكل شائع مع دوران عالي، S = 5/2 حالة أرضية بسبب طاقة الاقتران العالية للمنجنيز (II). ومع ذلك، هناك بعض الأمثلة على الدوران المنخفض، S = 1/2 المنجنيز (II).[12] لا توجد انتقالات d-d مسموح بها للسبين في المنجنيز (II)، مما يفسر سبب كون مركبات المنجنيز (II) باهتة إلى عديمة اللون.[13]
| Oxidation states of manganese[14] | |
|---|---|
| 0 | Mn 2(CO) 10 |
| +1 | MnC 5H 4CH 3(CO) 3 |
| +2 | MnCl 2, MnCO 3, MnO |
| +3 | MnF 3, Mn(OAc) 3, Mn 2O 3 |
| +4 | MnO 2 |
| +5 | K 3MnO 4 |
| +6 | K 2MnO 4 |
| +7 | KMnO 4, Mn 2O 7 |
| Common oxidation states are in bold. | |
تُعرف حالة الأكسدة +3 في مركبات مثل أسيتات المنجنيز (III)، لكنها عوامل مؤكسدة قوية جداً وعرضة أيضاً لعدم التناسب في المحلول، وتشكيل المنجنيز (II) والمنجنيز (IV). تتميز المركبات الصلبة من المنجنيز (III) بلونها الأحمر الأرجواني القوي وتفضيل التنسيق ثماني السطوح المشوه الناتج عن تأثير يان-تلر.
يمكن إنتاج حالة الأكسدة +5 عن طريق إذابة ثاني أكسيد المنجنيز في مادة نتريت الصوديوم المنصهرة.[15] يمكن إنتاج أملاح المنجنيز (VI) عن طريق إذابة مركبات المنجنيز، مثل ثاني أكسيد المنجنيز، في القلويات المنصهرة أثناء تعرضها للهواء.
تكون مركبات الپرمنگنات (+7 حالة أكسدة) أرجوانية ويمكن أن تعطي الزجاج لوناً بنفسجياً. پرمنگنات الپوتاسيوم، پرمنگنات الصوديوم، وپرمنگنات الباريوم كلها عوامل مؤكسدة قوية. پرمنگنات الپوتاسيوم، المعروف أيضاً باسم بلورات كوندي، هو مختبر كاشف كيميائي شائع الاستخدام بسبب خصائصه المؤكسدة; يتم استخدامه كدواء موضعي (على سبيل المثال، في علاج أمراض الأسماك). كانت محاليل پرمنگنات الپوتاسيوم من أولى البقع والمثبتات التي استخدمت في تحضير الخلايا والأنسجة البيولوجية للفحص المجهري الإلكتروني.[16]
توجد حالة الأكسدة النادرة +1 في بعض مركبات المنجنيز العضوي مثل مركب MnC5H4CH3(CO)3 المذكور في الجدول أعلاه.
معادن المنجنيز
منجنيت
هو معدن تركيبه Mn O (OH) , يتبلور في نظام orthorhombic system الصلابة 4 الكثاقة النوعية 4.3 , لونه اسود وله لمعان فلزى . يكون مع المانجانيت اكاسيد منجنيز اخرى . وجدت بلوراته واضحه في Cornwall, England , المانجانيت خام قليل المحتوى من المنجنيز .
بيرولوسيت
البيرولوسيت هو عبارة عن ثاني أكسيد المنجنيز حر، يحتوى عادة على قليل من الماء , ويتبلور في نظام orthorhombic system , غالبا ما يوجد في حالة pseudomorph ، يستفاد منه كخام للمنجنيز، يستجدم كعامل مؤكسد ومزيل للالوان.
بوليانيت
البوليانيت هو عبارة عن ثاني أكسيد المنجنيز، يتبلور في نظام رباعي الأضلاع، يمكن تمييزه عن البيرولوسيت بصلابته وكونه لامائي.
پسيلوملان Psilomelane
پسيلوملان هو أحد أكاسيد المنجنيز التى تحتوى على كميات متغيرة من أكاسيد الباريوم، بوتاسيوم، الصوديوم والماء ويعرف بثاني أكسيد المنجنيز الغرواني colloidal manganese dioxide ، يستفاد منه كخام للمنجنيز .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
بيروكرويت
هيدروكسيد المنجنيز، يتبلور في نظام ثلاثي الأضلاع شبيه جدا لمعدن البروسيت brucite والذي هو هيدروكسيد المغنسيوم.
هيوسمانيت
كل من أكسيد المنجنيز لونه بني-أسود، يوجد (نادراً) مع خامات المنجنيز الأخرى كما في منطقة بحيرة سوپريور.
رودونيت
سيليكات المنجنيز المتحولة Mn Si O2 ميتاسليكات المغنسيوم يتبلور في نظام ثلاثي الميول، لونه وردى يستخدم في بعض الأحيان كحجر للزينة .
رودوكروزيت
يطلق على كربونات المنجنيز التي تتبلور في نظام ثلاثي الأضلاع، لونه وردى-قرمزي، وهو خام ذو محتوى قليل من المنجنيز ويسمى أيضا manganese spar .
تنجستات المنجنيز
تنجستات المنجنيز يوجد في معدن الولفراميت wolframite، تنجستات حديد ومنجنيز (Fe Mn)WO4 ، لونه بني-أسود بلوراته أحادية الميل، في شكل قطع عمدانية columnar aggregates أو كتل حبيبية، ويصاحب خامات القصدير وهو مصدر هام للتنجستن.
منجنوفيليت
بيوتيت يحتوى منجنيز، يوجد على شكل تبر يتراوح لونه من النحاسي إلى نحاسي أحمر.
منجنوزيت
هو المنجنيز الذى يتبلور في نظام المكعب .
الإستعمال
يرتبط الإستهلاك الهائل لخام المنجنيز بإنتاج الصلب وذلك يشمل صناعة الحديد الضخمة وصناعات السبائك الحديدية والسبائك السيليكية , ولمركبات المنجنيز إستخدامات عديدة في الصناعة حيث يستخدم ثاني أكسيد المنجنيز كعامل مجفف , أو كعامل محفز في ألأصباغ والورنيش , وكمزيل للألوان في صناعة الزجاج , وفى البطاريات الجافة . ويستخدم برمنجانات البوتاسيوم للتبيض , ومزيل للألوان في الزيوت, وكعامل محفز للاكسدة في الكيمياء التحليلية ,كما يدخل المنجنيز ضمن مكونات السماد للزراعة ,وضمن مكونات ألأغذية الحيوانية .
التاريخ
أصل اسم المنجنيز معقد. في العصور القديمة، تم التعرف على اثنين من المعادن السوداء من مناطق ماگنتس (إما ماگنيسيا، الواقعة داخل اليونان الحديثة، أو Magnesia ad Sipylum، الواقعة داخل تركيا الحديثة).[17] سُمي كلاهما بالمغنطيسات من موطنهما الأصلي، ولكن تم اعتبارهما مختلفين في الجنس. جذبت "المغنطيسات" الحديد الداخلي، وكان خام الحديد المعروف الآن باسم حجر المغناطيس أو المغنتيت، والذي ربما أعطانا مصطلح المغناطيس. لم يكن خام المغنطيسات الأنثوي يجذب الحديد، ولكنه كان يستخدم لإزالة لون الزجاج. هذه الأنثى المغنيسات أُطلق عليها فيما بعد اسم المغنيسيا، والمعروفة الآن في العصر الحديث باسم پيرولوسيت أو أكسيد المنجنيز الرباعي.[بحاجة لمصدر] لا هذا المعدن ولا عنصر المنجنيز مغناطيسي. في القرن السادس عشر، أطلق صانعو الزجاج على ثاني أكسيد المنجنيز اسم manganesum (لاحظ Ns بدلاً من واحد)، ربما على أنه فساد وترابط من كلمتين، حيث كان على الكيميائيين وصانعي الزجاج في النهاية التمييز بين المغنيسيا السوداء (الخام الأسود) من Magnesia alba (خام أبيض، أيضاً من Magnesia ، مفيد أيضاً في صناعة الزجاج). ميشيل ميركاتي أطلق عليها اسم Magnesia nigra "manganesa" ، وأخيراً أصبح المعدن المعزول منه يعرف باسم manganese (بالألمانية: Mangan). في نهاية المطاف، تم استخدام اسم المغنيسيا للإشارة فقط إلى Magnesia alba (أكسيد المغنيسيوم) الأبيض، والذي أعطى الاسم المغنسيوم للعنصر الحر عندما تم عزله في وقت لاحق.[18]
العديد من أكاسيد المنجنيز الملونة، على سبيل المثال ثاني أكسيد المنجنيز، وفيرة في الطبيعة وتستخدم كأصباغ منذ العصر الحجري. تحتوي رسومات الكهف في گارگاس التي يتراوح عمرها بين 30.000 و24.000 سنة على أصباغ المنجنيز.[20]
استُخدمت مركبات المنجنيز من قبل صانعي الزجاج المصريين والرومان، إما لإضافة أو إزالة اللون من الزجاج.[21]استمر استخدام "صابون لصناعة الزجاج" خلال العصور الوسطى حتى العصر الحديث وهو واضح في زجاج القرن الرابع عشر من البندقية.[22]

نظراً لاستخدامه في صناعة الزجاج، كان ثاني أكسيد المنجنيز متاحاً للتجارب بواسطة الكيميائيين، وهم الكيميائيون الأوائل. اكتشف إگناتيوس گوتفريد كايم (1770) ويوهان گلوبر (القرن السابع عشر) أن ثاني أكسيد المنجنيز يمكن تحويله إلى پرمنگنات، وهو كاشف مخبري مفيد.[23] بحلول منتصف القرن الثامن عشر، استخدم الكيميائي السويدي كارل ڤيلهلم شيله ثاني أكسيد المنجنيز لإنتاج الكلور. أولاً، تم تصنيع حمض الهيدروكلوريك، أو خليط من حمض الكبريتيك وكلوريد الصوديوم للتفاعل مع ثاني أكسيد المنجنيز، وبعد ذلك تم استخدام حمض الهيدروكلوريك من عملية لوبلانك وتم إعادة تدوير ثاني أكسيد المنجنيز بواسطة عملية ويلدون. كان إنتاج مسحوق تبييض بالكلور وعوامل هيپوكلوريت مستهلكاً كبيراً لخامات المنجنيز.
بحلول منتصف القرن الثامن عشر، استخدم كارل ڤيلهلم شيله الپيرولوسيت لإنتاج الكلور. كان شيل وآخرون يدركون أن الپيرولوسيت (المعروف الآن باسم ثاني أكسيد المنجنيز) يحتوي على عنصر جديد. كان يوهان گوتلب گان أول من عزل عينة غير نقية من معدن المنجنيز عام 1774، وهو ما فعله عن طريق اختزال ثاني أكسيد مع الكربون.
أدى محتوى المنجنيز في بعض خامات الحديد المستخدمة في اليونان إلى تكهنات بأن الفولاذ المنتج من هذا الخام يحتوي على منجنيز إضافي، مما يجعل فولاذ اسپرطة صلباً بشكل استثنائي.[24] في بداية القرن التاسع عشر، تم استخدام المنجنيز في صناعة الصلب وتم منح العديد من براءات الاختراع. في عام 1816، تم توثيق أن سبائك الحديد مع المنجنيز كانت أكثر صلابة ولكنها ليست أكثر هشاشة. في عام 1837، لاحظ الأكاديمي البريطاني جيمس كوپر وجود ارتباط بين تعرض عمال المناجم الشديد للمنجنيز وشكل من أشكال مرض پاركنسن.[25] في عام 1912، مُنحت براءات الاختراع الأمريكية لحماية الأسلحة النارية من الصدأ والتآكل باستخدام طلاءات تحويل الكهروكيميائية لفوسفات المنجنيز، وشهدت العملية استخداماً واسع النطاق منذ ذلك الحين.[26]
أدى اختراع خلية لكلانشيه في عام 1866 والتحسين اللاحق للبطاريات التي تحتوي على ثاني أكسيد المنجنيز كمادة مزيل الاستقطاب إلى زيادة الطلب على ثاني أكسيد المنجنيز. حتى تطوير البطاريات باستخدام نيكل-كادميوم والليثيوم، كانت معظم البطاريات تحتوي على المنجنيز. عادةً ما تستخدم بطارية زنك-كربون والبطاريات القلوية ثاني أكسيد المنجنيز المنتج صناعياً لأن ثاني أكسيد المنجنيز الموجود بشكل طبيعي يحتوي على شوائب. في القرن العشرين، تم استخدام ثاني أكسيد المنجنيز على نطاق واسع باعتباره المحرك الكاثودي للبطاريات التجارية الجافة التي يمكن التخلص منها من النوعين القياسيين (الزنك والكربون) والقلوية.[27]
الخامات والتواجد والانتاج
يتكون المنغنيز من حوالي 1000 ppm (0.1%) من قشرة الأرض، وهو ثاني عشر أكثر عناصر القشرة وفرة.[4] تحتوي التربة على 7–9000 ppm من المنجنيز بمتوسط 440 ppm.[4]تحتوي مياه البحر على 10 ppm فقط من المنجنيز والغلاف الجوي يحتوي على 0.01 μg/m3.[4]يتواجد المنجنيز بشكل أساسي في صورة پيرولوسيت (MnO2)، برونيت، (Mn2+Mn3+6)(SiO12),[28] سيلوملن (Ba,H
2O)
2Mn
5O
10، وبدرجة أقل مثل رودوكروسيت (MnCO3).
| خام المنجنيز | سيلوملن (خام المنجنيز) | سپيگلايزن عبارة عن سبيكة حديد بها نسبة منجنيز تبلغ حوالي 15٪ | تشعبات أكسيد المنجنيز على الحجر الجيري من زونهوفن، ألمانيا - نوع من pseudofossil. المقياس بالملم | رودوكروزيت المعدني (كربونات المنغنيز (II)) |
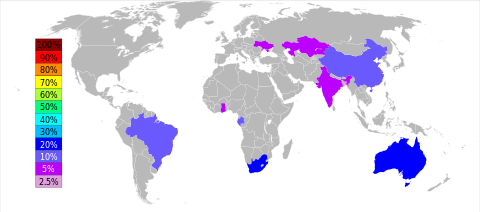
أهم خام المنجنيز هو پيرولوسيت (MnO2). عادةً ما تُظهر خامات المنجنيز الأخرى المهمة اقتصادياً علاقة مكانية وثيقة بخامات الحديد، مثل سفاليريت.[6][30]الموارد البرية كبيرة ولكنها موزعة بشكل غير منتظم. حوالي 80 ٪ من موارد المنغنيز المعروفة في العالم موجودة في جنوب إفريقيا; توجد رواسب المنجنيز المهمة الأخرى في أوكرانيا وأستراليا والهند والصين والگابون والبرازيل.[29] وفقاً لتقديرات عام 1978، يحتوي قاع المحيط على 500 مليار طن من عقيدات المنجنيز.[31] تم التخلي عن محاولات إيجاد طرق مجدية اقتصادياً لحصاد عقيدات المنجنيز في السبعينيات.[32]
في جنوب إفريقيا، تقع معظم الرواسب التي تم تحديدها بالقرب من هوتازل في مقاطعة كيپ الشمالية، مع تقدير عام 2011 بنحو 15 مليار طن. في عام 2011، أنتجت جنوب إفريقيا 3.4 مليون طن، متصدرة جميع الدول الأخرى.[33]
يُستخرج المنجنيز بشكل رئيسي في جنوب إفريقيا وأستراليا والصين والگابون والبرازيل والهند وقزخستان وغانا وأوكرانيا وماليزيا.[34]
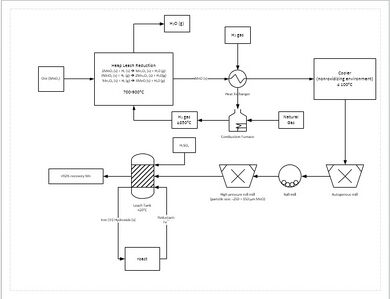
لإنتاج المنجنيز الحديدي، يتم خلط خام المنجنيز مع خام الحديد والكربون، ثم يتم تقليله إما في فرن الصهر أو في فرن القوس الكهربائي.[35] المنجنيز الحديدي الناتج يحتوي على نسبة منجنيز تتراوح من 30 إلى 80٪.[6] يتم إنتاج المنجنيز النقي المستخدم في إنتاج السبائك الخالية من الحديد عن طريق ترشيح خام المنجنيز باستخدام حمض الكبريتيك وعملية الاستخلاص الكهربائي اللاحقة.[36]
تتضمن عملية الاستخراج الأكثر تقدماً التقليل المباشر لخام المنجنيز في كومة ترشيح. يتم ذلك عن طريق ترشيح الغاز الطبيعي من خلال قاع الكومة; يوفر الغاز الطبيعي الحرارة (يجب أن تكون 850 درجة مئوية على الأقل) وعامل الاختزال (أول أكسيد الكربون). هذا يقلل من كل خام المنجنيز إلى أكسيد المنجنيز (MnO)، وهو شكل قابل للرشح. ينتقل الخام بعد ذلك عبر دائرة طحن لتقليل حجم جزيئات الخام إلى ما بين 150 و250 ميكرومتر، مما يزيد من مساحة السطح للمساعدة في الترشيح. ثم يضاف الخام إلى خزان ترشيح مكون من حمض الكبريتيك والحديد الصلب (Fe2+) بنسبة 1.6: 1. يتفاعل الحديد مع ثاني أكسيد المنجنيز لتكوين هيدروكسيد الحديد والمنجنيز الأولي. ينتج عن هذه العملية استرداد ما يقرب من 92٪ من المنجنيز. لمزيد من التنقية، يمكن إرسال المنجنيز بعد ذلك إلى منشأة الاستخلاص الكهربائي.[37]
في عام 1972، قام Project Azorian التابع لـCIA، من خلال الملياردير هوارد هيوز، بتكليف السفينة هيوز گلومار إكسپلورر مع قصة الغلاف عن الحصاد عقيدات المنجنيز من قاع البحر.[38] أدى ذلك إلى اندفاع النشاط لجمع عقيدات المنجنيز، وهو ما لم يكن عملياً في الواقع. كانت المهمة الحقيقية لـ هيوز گلومار إكسپلورر هي رفع غواصة سوڤيتية غارقة، K-129، بهدف لاسترجاع كتب الرموز السوڤيتية.[39]
وقد وُجد مورد وفير من المنجنيز على شكل عقيدات المنجنيز في قاع المحيط.[40][41]هذه العقيدات التي تتكون من 29٪ منجنيز،[42] وتقع على طول قاع المحيط ويتم بحث التأثير المحتمل لتعدين هذه العقيدات. يمكن أن تحدث تأثيرات بيئية فيزيائية وكيميائية وبيولوجية بسبب تعدين العقيدات هذا الذي يزعج قاع البحر ويتسبب في تكوين أعمدة الرواسب. يشتمل هذا المعلق على معادن ومغذيات غير عضوية، والتي يمكن أن تؤدي إلى تلوث المياه القريبة من القاع من المركبات السامة الذائبة. عقيدات المنجنيز هي أيضاً مناطق كشط، وأماكن المعيشة، وحماية الأنظمة الداخلية والجماعية. عند إزالة هذه العقيدات، تتأثر هذه الأنظمة بشكل مباشر. بشكل عام، يمكن أن يتسبب هذا في مغادرة الأنواع للمنطقة أو موتها تماماً.[43] قبل بدء التعدين نفسه، يجري البحث من قبل الأمم المتحدة الهيئات التابعة والشركات التي ترعاها الدولة في محاولة لفهم الآثار البيئية تماماً على أمل التخفيف من هذه الآثار.[44]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
بيئة المحيطات
تأتي العديد من العناصر النزرة في المحيط من الجسيمات الحرارية المائية الغنية بالمعادن من الفتحات الحرارية المائية.[45] تم العثور على المنجنيز الذائب (dMn) في جميع أنحاء محيطات العالم، 90٪ منها يأتي من الفتحات الحرارية المائية.[46] تتطور الجسيمات Mn في أعمدة طافية فوق مصدر تنفيس نشط، بينما يتصرف dMn بشكل متحفظ.[45]تختلف تركيزات المنجنيز بين الأعمدة المائية للمحيطات. على السطح، يرتفع dMn بسبب المدخلات من مصادر خارجية مثل الأنهار والغبار ورواسب الجرف. عادة ما تحتوي الرواسب الساحلية على تركيزات منخفضة من المنجنيز، ولكن يمكن أن تزيد بسبب التصريفات البشرية المنشأ من صناعات مثل التعدين وتصنيع الصلب، والتي تدخل المحيط من مدخلات الأنهار. يمكن أيضاً زيادة تركيزات dMn السطحية بيولوجياً من خلال التمثيل الضوئي والفيزيائي من الموجات الصاعدة الساحلية والتيارات السطحية التي تحركها الرياح. كما يمكن للدورة الداخلية مثل تقليل الأشعة فوق البنفسجية أن ترفع المستويات عن طريق تسريع تفكك أكاسيد المنجنيز والكسح التأكسدي، مما يمنع المنجنيز من الغرق في المياه العميقة.[47]يمكن أن تحدث المستويات المرتفعة في الأعماق الوسطى بالقرب من التلال وسط المحيط والفتحات الحرارية المائية. تطلق الفتحات الحرارية المائية السائل المخصب dMn في الماء. يمكن لـ dMn بعد ذلك السفر لمسافة تصل إلى 4000 كيلومتر بسبب وجود الكبسولات الميكروبية، مما يمنع التبادل مع الجسيمات، ويقلل من معدلات الغرق. تكون تركيزات المنجنيز الذائب أعلى عندما تكون مستويات الأكسجين منخفضة. بشكل عام، تكون تركيزات dMn أعلى عادةً في المناطق الساحلية وتنخفض عند الانتقال بعيداً عن الشاطئ.[47]
التربة
يوجد المنجنيز في التربة في ثلاث حالات أكسدة: الكاتيون ثنائي التكافؤ، Mn2+ وكأكاسيد وهيدروكسيدات سوداء بنية اللون تحتوي على Mn (III IV)، مثل MnOOH وMnO2. تؤثر ظروف درجة الحموضة في التربة وظروف تقليل الأكسدة على أي من هذه الأشكال الثلاثة من المنجنيز هو السائد في تربة معينة. عند قيم الأس الهيدروجيني أقل من 6 أو في ظل الظروف اللاهوائية، يهيمن Mn (II)، بينما في ظل ظروف أكثر قلوية وهوائية، تسود أكاسيد وهيدروكسيدات Mn (III ،IV). يمكن تعديل تأثيرات حموضة التربة وحالة التهوية على شكل المنغنيز أو التحكم فيها عن طريق النشاط الميكروبي. يمكن أن يتسبب التنفس الميكروبي في أكسدة Mn2+ للأكاسيد، ويمكن أن يسبب اختزال أكاسيد الكاتيون ثنائي التكافؤ.[48]
توجد أكاسيد Mn (III ،IV) كبقع بنية سوداء وعقيدات صغيرة على جزيئات الرمل والطمي والطين. هذه الطلاءات السطحية على جزيئات التربة الأخرى لها مساحة سطح عالية وتحمل شحنة سالبة. يمكن للمواقع المشحونة امتصاص الكاتيونات المختلفة والاحتفاظ بها، خاصة المعادن الثقيلة (على سبيل المثال، Cr Cr3+, Cu2+, Zn2+, and Pb2+). بالإضافة إلى ذلك، يمكن للأكاسيد أن تمتص الأحماض العضوية والمركبات الأخرى. يمكن بعد ذلك أن يتسبب امتزاز المعادن والمركبات العضوية في تأكسدها بينما يتم تقليل أكاسيد Mn (III ،IV) إلى Mn2+ (على سبيل المثال، Cr3+ إلى Cr(VI) وهيدروكينون عديم اللون إلى پوليمرات كينون بلون الشاي).[49]
الاستخدامات
تنحصر معظم استخدامات المنجنيز في صناعة السبائك والمركبات الكيميائية. وتستخدم سبيكة المنجنيز الحديدي، وهي سبيكة تحتوي على 80% من المنجنيز و20% من الحديد، في صناعة الفولاذ. والمنجنيز يزيل الأكسجين والكبريت من الفولاذ، ويؤدي بالتالي إلى تقوية الفلز. فوجود فقاعات الأكسجين في الفولاذ تؤدي إلى إضعافه، ويؤدي وجود الكبريت إلى إضعاف الفولاذ خلال عملية الطرق، وهي العملية التي يتم فيها تسخين الحديد وتشكيله. وتشمل سبائك الحديد الأخرى، التي تحتوي على نسبة كبيرة من المنجنيز، وتعد مهمة في صناعة الفولاذ، المنجنيز السليكوني وحديد شبيغل.
وتحتوي سبيكة فولاذ تعرف بفولاذ المنجنيز على 14% من المنجنيز. وهي عديدة الاستخدامات، إذ تستخدم في صناعة الآلات قوية الاحتمال والخزائن. وتشمل استخدامات المنجنيز، ماعدا المذكورة سابقا، صناعة الإلكترونيات التي تستخدم سبائك فولاذ المنجنيز في صناعة نوع معين من المغانط الكهربائية، يستخدم في أجهزة إرسال الرادار وفي الراديو، ووحدات تخزين الحاسوب التي تسمى قلب الذّاكرة المغنطيسيّة.
ويستخدم المنجنيز في صناعة الفولاذ الغير قابل للصدأ، وفي سبائك عديدة من الألومنيوم والنحاس والمغنسيوم، إذ تؤدي إضافة المنجنيز إلى هذه الفلزات إلى جعلها سبائك قوية وشديدة المقاومة للصدأ.
ومن أكثر مركبات المنجنيز المُستَخدَمة شيوعاً ثاني أُكسيد المنجنيز MnO2. وتأتي أهميته لاستخدامه في صناعة البطاريات الجافة وكثير من الأصباغ. ويستَخدِم منتجو الدهانات ومجفّفات طلاء الأحذية كميات كبيرةً من كبريتات المنجنيز Mn SO4 في العمليات الإنتاجية. كما تكون كبريتات المنجنيز أحد المحتويات الأساسية لبعض الأسمدة المُخصِّبة ذات الاستخدامات المُعّينة.
ويستخدم مركب آخر من مركبات المنجنيز هو برمنجنات البوتاسيوم KMnO4، مطهرًا ومزيلاً للروائح، وفي تنقية المياه. كما تستخدم مركبات أخرى، كنترات المنجنيز Mn (NO3)2، وأكسيد المنجنيز MnO، عوامل حفازة في إنتاج عدد من المركبات البتروكيميائية والبلاستيكية والألياف الاصطناعية. والعوامل الحفازة مواد تساعد على زيادة سرعة التفاعلات الكيميائية.
يوجد معظم المنجنيز مع خام الحديد. ويؤدي تواجد كميات كبيرة من المنجنيز إلى جعل الخام ذا قيمة اقتصادية كبيرة. والخام الذي يحتوي على 5% إلى 10% من المنجنيز يسمى الخام الحاوي للمنجنيز، والخام الذي يحتوي على 10% إلى 35% من المنجنيز يسمى خام المنجنيز الحديدي. كما يسمى الخام الذي يحتوي على 35% فأكثر من المنجنيز خام المنجنيز. وتعد الصين وأوكرانيا في مقدمة أكبر الدول المنتجة لأعلى درجات خام المنجنيز جودة، وتأتي بعدهما جنوب إفريقيا والبرازيل وأستراليا.
التركيب الكيميائى للخام عالي الدرجة ومصدره روسيا كما يلي:-
Mn I 18.8 , Mn O2 62.4 , Fe2 O3 1.3 , Si O2 6.9 , P2 O5 0.33 , Al2 O31.1, Ca O 1.4 , H2 O 5.5 .
وهذا يعادل 53.97% Mn , 0.89% Fe , 0.15% P .
كما توجد كميات كبيرة من رواسب المنجنيز في قاع المحيطات في شكل كتل مستديرة تسمى العقيدات. وعلى الرّغم من ذلك فإنّ التّكلفة المرتفعة لتعدين تلك الرواسب حدت من الاستفادة منها تجارياً.
تتم تنقية خام المنجنيز بعدة طرق مختلفة. ففي إحدى هذه الطرق يُوضع خام المنجنيز في فرن كهربائي مع الألومنيوم والرمل حيث يتم اختزاله. وتتم طريقة أخرى لتنقية المنجنيز بوساطة التحليل الكهربائي لمحلول كبريتات المنجنيز. وتعد طريقة التحليل الكهربائي أكثر الطرق اقتصاداً للنفقات وتنتِج أنقى أنواع المنجنيز. كما يمكن تحويل خام المنجنيز بالتسخين إلى أكاسيد المنجنيز، والتي بدورها تخلط مع حمض الكبريتيك لينتج كبريتات المنجنيز. وبعد تنقية محلول كبريتات المنجنيز يتعرض للتحليل الكهربائي.
استخدامه في صناعة الصلب
المنجنيز مكون أساسي في الصناعة الضخمة للصلب المطاوع ولايوجد بديل يعادله . فهو يساعد في عدم أكسدة الصلب , وأيضا باتحاده مع الكبريت يدعم الخواص اللازمة للإستخدام الساخن للصلب. لهذا الغرض يستخدم المنجنيز في شكل فيرو- منجنيز والذى يحتوى تقريبا على (80 % ) منجنيز . وهو يستخدم بدرجات الكربون العالية بنسبة 6-7 % والمنخفضة بنسبة 0.1 % كربون أو أقل . الفيرو-منجنيز العالى الكربون يجرى صنعه بواسطة الإختزال المباشر لخام المنجنيز بفحم الكوك في افران الإحتراق. الخامات منخفضة السيليكون وتحتوى على الأقل40 % منجنيز بنسبة منجنيز الى حديد 9 :10 هي المطلوبة لهذا الغرض.
الفيرو منجنيز منخفض الكربون ينتج عادة بإختزال خام المنجنيز بواسطة السيليكو- منجنيز في فرن القوس الكهربائى .
من الطبيعى أن يكون إنتاج الفرومنجنيز منخفض الكربون أكثر تكلفة من إنتاج السبائك عالية الكربون لكن إستخدامه الأساسى هو لإنتاج الصلب الذى يجب أن يكون الكربون فيه منخفض المستوى مثل بعض الصلب الفولاذى والمقاوم للحرارة .
إنتاج المنجنيز النقي
المنجنيز بنقاوة 97 – 98 % يوجد على المستوى التجارى بواسطة إختزال خام الالومينيوم ذو درجة عالية من المنجنيز ومنخفض المحتوى من الحديد . وينتج المنجنيز العالى النقاء بالتبادل الاليكتروليتى بين محلول من كبريتات المنجنيز (II) وكبريتات الامونيوم في خلية يستخدم فيها سبيكة رصاص أقطاب موجبة (أنود) , وسبيكة صلب أقطاب سالبة (كاثود) , وهذه الطريقة التى تستخدم حالياً على المستوى التجارى تنتج منجنيز به أقل من 0.1 % شوائب فلزية بتكلفة مقبولة عن طريقة إنتاج الفيرو- منجنيز منخفض الكربون . وقبل هذه الطريقة كان المنجنيز عالى النقاء نادراً ما كان يجرى انتاجه ميتالورجياً من المنجنيز الالومينى الحرارى تجارى النقاء بواسطة التقطير والتكثيف في حيز مفرغ من الهواء.
السبائك
يمكن تقسيم السبائك إلى حديدية ferrous , أو غير حديدية nonferrous .
السبائك الحديدية
يستخدم المنجنيز كإضافة مانعة للأكسدة أو التحول إلى مركبات كبريتية deoxidant and desulfurizing في صناعة الصلب وبالتالى فإن جميع أنواع الصلب التجارى تحتوى منجنيز بدرجة صغيرة ولكن يكون أساسى وفى شكل سبيكة ويؤثر وجوده على جودة الصلب وقابليته للتشكيل بالحرارة . قليل من المنجنيز يعطى للصلب مقاومة عالية في الإستخدام وخاصة تحت درجات الحرارة المنخفضة. يحتوى الصلب الحقيقى على 0.9 – 1.2 % منجنيز , وتحتوى أنواع أخرى من الصلب على 1.3 – 1.6 % منجنيز .لهذا الصلب قوة شد أعلى مقارنة بالصلب الذى يحتوى على كربون ومنجنيز في الحدود المعتادة ويجرى إنتاجه بكميات ضخمة.
كما أن إضافة المنجنيز إلى الحديد يخفض درجة حرارة التحول γ ↔ α للحديد وبإضافة أكثر من 12 % منجنيز تنجفض درجة حرارة التحول إلىأقل من درجة حرارة الغرفة. هذا الصلب الفولاذى ، المنجنيزى غير المغناطيسى له خواص عظيمة الأهمية .
يدخل المنجنيز أيضا في بعض انواع الصلب الفولاذى المحتوى على نيكل – كروم والذى له إستخدامات واسعة في التطبيقات المقاومة للتآكل والحرارة . أنواع الصلب المعروفة جيدا تحتوى 18 % كروم , 8 % نيكل & 25 % كروم , 20 % نيكل . يمكن أن يحل المنجنيز محل بعض النيكل مع عدم فقدان الصلب لأى من خواص تركيبه الفولاذى وخواص المقاومة للحرارة والتآكل.
السبائك غير الحديدية
للمنجنيز إستخدام محدود في السبائك الغير حديدية فهو مؤثر في منع ألأكسدة للسبائك التى تعتمد على النحاس وثبتت كفاءة خواصه الميكانيكية . عندما يضاف المنجنيز الى النحاس الاصفر المحتوى 40-45 % زنك فإنه يزيد قوة الشد بمعدل 0.7 طن/بوصة2 . وبإضافه 1 % منجنيز يزيد التمدد 5 % , مزيد من الإضافة يقلل من قابلية السحب لكنه يستمر في زيادة القوة .
النحاس الأصفر المحتوى 39 % زنك , 1 % منجنيز مع كميات قليلة من الحديد حوالي 0.25 % والومينيوم يعرف ببرونز المنجنيز , وله قوة شد حوالى 26.5 طن/ بوصة2 , وتمدد 47 % , ولمقامته للتآكل يستخدم عادة في صناعة ريش المحركات البحرية وريش التربينات البخارية .
كلا من سبائك النحاس والمنجنيز , وسبائك النحاس والمنجنيز والنيكل لها خواص مهمة حيث ان سبيكة من النوع الثانى تحتوى حوالى 84 % نحاس , 4 % نيكل , 12 % منجنيز معروفة جدا للأغراض الكهربائيه ( ماجانين ) حيث ان لها مقاومة 75 × 10-6 اوم . سم ومعامل حرارى 1× 10-5 عند 20°م ( 68°ف ).
هناك سبائك اخرى في هذا النظام لها خواص اكثر تميزا مثل سبيكة من 60 % منجنيز , 20 % من كل من النحاس والنيكل , لها مقاومة كهربية 190× 10-6 اوم . سم ولها معامل حرارى للمقامة تكون منخفضة مثل تلك المميزه للمانجانين manganin على الأقل .
هذا النظام من السبائك يتضمن ايضا سبائك ذات معامل تمدد حرارى عالى جدا , حيث ان سبيكة تحتوى 72 % منجنيز , 10 % نيكل , 18 % نحاس يكون لها اقصى معامل تمدد ا 27× 10-6 / °م ويجرى طرحها تجاريا كعنصر مزدوج فلزيا عالى التمدد كثرموستات ( مجس حرارى لفصل وتوصيل التيار الكهربائ ) .
عقد المنجنيز
توجد عقد تحتوى تركيزات من اكاسيد المنجنيز والحديد على قيعان عديد من المحيطات تأخذ شكل البطاطس (1-5سم) .
تم وصف عقد المنجنيز اول مرة وجرى تقسيمها بواسطة J. Murry اثناء الرحلة التاريخية للباحث H. M. S. Challenger( 1873- 1876 ). إلا أنه بعد 80 سنة لاحقا ظهرت القيمة الإقتصادية لعقيدات المنجنيز البحرية .
تكون عقد المنجنيز من بعض المواقع غنية بدرجة ملحوظة بالنيكل , النحاس , الكوبلت , الزنك , الموليبدينيت , وعناصر اخرى ليتكون منها إحتياطيات هامة من هذه الفلزات الإستراتيجية وتشير كمياتها الى انها تمثل المصدر لهذه الفلزات في المستقبل , ومن الناحية العملية الاقتصادية فإنه يمكن إستغلالها والحصول عليها من الأعماق تحت الماء والتى غالبا ما تزيد على 4كم Archer(1976). حددت أعمال المسح لقاع المحيطات الحديثة مناطق منها حيث توجد وفرة من العقد وإرتفاع في تركيز الفلزات , بينما وفرت الأبحاث الجيوكيميائة معلومات عن ميكانيكية التواجد الوفير من Ni , Cu , Co. وكذلك عقد المنجنيز .
المناطق المحتوية عقد غنية فلزيا
على الرغم من أخذ عينات من عقد المنجنيز –الحديدية manganiferrous nodules وطبقات القشرة من القيعان او انه قد لوحظ وجودها على اغلب قيعان البحار , فإن ألإنتباه قد تركز على العقيدات الغنية بالنيكل + النحاس ( 2-3 % فلزات ) الموجودة في الباسفيك الإستوائى في حزام يمتد من جنوب شرق هاواى ألى كاليفورنيا وكما في العقيدات العالية المحتوى من الكوبلت والموجودة في مرتفعات قاع الحيط الباسفيكى . وتحتوى عقيدات المنجنيز في المحيط الأطلنطى وكذلك في المناطق أعلى خطوط العرض في الباسفيكى على تركيزات أقل من الفلزات الإستراتيجية الشحيحة . وقد أوضحت أعمال المساحة في المحيط الهندى وجود تركيز فلزى عالى مقارنة مقارنة بالعقيدات الموجودة في المحيط الباسفيكى . يوجد في المناطق الإستوائية من المحيطات عقيدات ذات محتوى عالى من النيكل والنحاس .يجرى تعين معدل نمو عقيدات المنجنيز الموجودة في المحيطات وذلك بقياس تناقص النظائر المشعة مثل 230Th , 231Pa , 10Be , 40K الموجودة في العقيدات nodules والذى ىحدث ببطء شديد بمعدل يقدر بملليمترات قليلة / مليون سنة .
السمية
 مقالة مفصلة: تسمم المنجنيز
مقالة مفصلة: تسمم المنجنيز
التسمم المزمن بالمنجنيز هو مرض بيئى يصيب عمال مناجم المنجنيز والعاملين في طحن خام المنجنيز، ويحدث ذلك في قرى مناجم المنجنيز في روسيا، الهند، شمال أفريقيا، يوغوسلافيا، كوبا، وشيلي، ويصيب حوالى 25 % من الأفراد المعرضين لإستنشاق أتربة الخام، في بعض المناطق تقل النسبة إلى 2-4 % كما في شيلي. ويؤثر التسمم بالمنجنيز على المخ.
والمنجنيز هو معدن شائع في استخداماته ومعروف لكثير من الناس، ويوجد في كل مكان على سطح الأرض، ومن المعروف عنه أن بتعرض الإنسان لتركيزات عالية منه يتسبب في إصابته بالتسمم. يتواجد المنجنيز في الأطعمة مثل السبانخ، أما الأطعمة التى تحتوى على أعلى التركيزات من هذا المعدن نجدها في الحبوب، الأرز، الفاصوليا، فول الصويا، المكسرات، زيت الزيتون، الفاصوليا الخضراء، والمحار.[50]
بعدها يمتص جسم الإنسان المنجنيز الذى ينتقل من خلال الدم إلى الكبد والكلى والبنكرياس والغدد الصماء. يؤثر المنجنيز بشكل أساسى على الجهاز التنفسى والمخ. من أعراض التسمم بالمنجنيز: الهلوسة، النسيان، ضمور الأعصاب. كما يسبب المنجنيز الشلل الرعاش، الصمامة الرئوية، التهاب الشعب الهوائية.
عندما يتعرض الإنسان للمنجنيز لفترة طويلة من الزمن قد يؤثر على خصوبته ويسبب له العقم وبعض الاضطرابات الأخرى مثل:
- الشيزوفرنيا
- وهن العضلات
- الصداع
- الأرق
نقص معدلات المنجنيز في جسم الإنسان يعرضه للأضرار الصحية مثل:
- السمنة
- التجلطات الدموية
- اضطرابات الجلد
- معدلات منخفضة من الكوليسترول
- اضطرابات الهيكل العظمى
- تشوهات الجنين الخلقية
- تغير في لون الشعر
- أعراض متصلة بالأعصاب
- حساسية مفرطة من الجلوكوز
التسمم المزمن من المنجنيز يكون نتيجة للاستنشاق طويل المدى لغباره ودخانه. الجهاز العصبى المركزى هو أكثر الأعضاء تأثراً مما ينجم عنه إعاقة دائمة وتتضمن الأعراض على: النوم، الضعف، اضطرابات المشاعر، تكرار الشد العضلى بالرجل، شلل.
وجدت أكبر نسب للإصابة بالالتهاب الرئوى وعدوى الجهاز التنفسى العلوى بين العاملين الذين يتعرضون لأدخنة وغبار مركبات المنجنيز. وثبت أن مركبات المنجنيز (معملياً لكن بشكل غير قاطع) من العوامل التى تساعد على إصابة الإنسان.
المنجنيز في مصر
فى أم بجمة , جنوب غرب سيناء , على بعد 20كم شرق خليج السويس ، ويتواجد المنجنيز في جبل صول حامد جنوب الصحراء الشرقية وهناك دراسات عن تواجد المنجنيز في الصحراء الغربية.
النظائر المشعة للمنجنيز
مصادر المنجنيز
المصادر. يوجد معظم المنجنيز مع خام الحديد. ويؤدي تواجد كميات كبيرة من المنجنيز إلى جعل الخام ذا قيمة اقتصادية كبيرة. والخام الذي يحتوي على 5% إلى 10% من المنجنيز يسمى الخام الحاوي للمنجنيز، والخام الذي يحتوي على 10% إلى 35% من المنجنيز يسمى خام المنجنيز الحديدي. كما يسمى الخام الذي يحتوي على 35% فأكثر من المنجنيز خام المنجنيز.
وتعد الصين وأوكرانيا في مقدمة أكبر الدول المنتجة لأعلى درجات خام المنجنيز جودة، وتأتي بعدهما جنوب إفريقيا والبرازيل وأستراليا.
كما توجد كميات كبيرة من رواسب المنجنيز في قاع المحيطات في شكل كتل مستديرة تسمى العقيدات. وعلى الرّغم من ذلك فإنّ التّكلفة المرتفعة لتعدين تلك الرواسب حدت من الاستفادة منها تجارياً.تتم تنقية خام المنجنيز بعدة طرق مختلفة. ففي إحدى هذه الطرق يُوضع خام المنجنيز في فرن كهربائي مع الألومنيوم والرمل حيث يتم اختزاله وتتم طريقة أخرى لتنقية المنجنيز بوساطة التحليل الكهربائي لمحلول كبريتات المنجنيز. وتعد طريقة التحليل الكهربائي أكثر الطرق اقتصاداً للنفقات وتنتِج أنقى أنواع المنجنيز. كما يمكن تحويل خام المنجنيز بالتسخين إلى أكاسيد المنجنيز، والتي بدورها تخلط مع حمض الكبريتيك لينتج كبريتات المنجنيز. وبعد تنقية محلول كبريتات المنجنيز يتعرض للتحليل الكهربائي.
الدور الحيوي
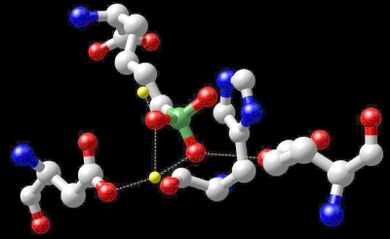
الحاجة
يؤدي نقص المنجنيز في الإنسان إلى عدد من المشاكل الطبية. تفشل العديد من منتجات مكملات الفيتامينات والمعادن الشائعة في تضمين المنجنيز في تركيباتها. قد يؤدي تناول كميات كبيرة نسبياً من المعادن الأخرى مثل الحديد والمغنسيوم والكالسيوم إلى منع تناول المنجنيز بشكل صحيح. يتسبب نقص المنجنيز في حدوث تشوه في الهيكل العظمي في الحيوانات ويمنع إنتاج الكولاجين في التئام الجروح. انظر نقص المنجنيز
الكيمياء الحيوية
تشتمل فئات الإنزيم التي تحتوي على العوامل المرافقة من المنجنيز على أوكسيدريدوكتاز، ناقلات الإنزيم، هيدروليزات، ليازات، إيزوميرازات وليگازات. الإنزيمات الأخرى التي تحتوي على المنجنيز هي أرگينازات وسوبر أكسيد ديسميوتاز المحتوي على المنجنيز (Mn-SOD). كما تحتوي فئة الإنزيم المنتسخة العكسية للعديد من الفيروسات القهقرية (وإن لم تكن الفيروسات تتميز بتأخير ظهور الأعراض بعد الإصابة مثل HIV) على المنجنيز. كما تحتوي پولي پپتيدات المحتوية على المنجنيز على ذيفان الخناق ولكتين والإنتگرين.[51]
الدور البيولوجي في الإنسان
المنجنيز عنصر غذائي أساسي للإنسان. وهو موجود باعتباره إنزيم في العديد من العمليات البيولوجية، والتي تشمل استقلاب المغذيات الكبيرة، وتكوين العظام، وأنظمة حماية الجذور الحرة. فهو عنصر حاسم في عشرات البروتينات والإنزيمات.[3] يحتوي جسم الإنسان على حوالي 12 ملليغرام من المنجنيز، معظمها في العظام. تتركز الأنسجة الرخوة المتبقية في الكبد والكلى.[4]في الدماغ البشري، المنجنيز مرتبط ببروتينات المنجنيز المعدنية، وعلى الأخص مخلقة الگلوتامين في الخلايا النجمية.[52]
السمّية
قد يؤدي التعرض المفرط أو التناول المفرط إلى حالة تعرف باسم التسمم بالمنجنيز، وهو اضطراب تنكس عصبي يسبب موت الخلايا العصبية الدوبامينية وأعراض مشابهة لمرض پاركنسن.[4][53]
السمّية في الحياة البحرية
تحتاج العديد من الأنظمة الأنزيمية إلى المنجنيز لتعمل، ولكن في المستويات العالية، يمكن أن يصبح المنجنيز ساماً. أحد الأسباب البيئية التي يمكن أن تزيد مستويات المنجنيز في مياه البحر هو حدوث فترات نقص الأكسجة.[54]منذ عام 1990 كانت هناك تقارير عن تراكم المنجنيز في الكائنات البحرية بما في ذلك الأسماك والقشريات والرخويات وشوكيات الجلد. أنسجة معينة هي أهداف في أنواع مختلفة، بما في ذلك الخياشيم والدماغ والدم والكلى والكبد والبنكرياس. تم الإبلاغ عن تأثيرات فسيولوجية في هذه الأنواع. يمكن أن يؤثر المنجنيز على تجديد الخلايا المناعية ووظائفها، مثل البلعمة وتنشيط pro-phenoloxidase، مما يثبط أجهزة المناعة في الكائنات الحية. هذا يجعل الكائنات الحية أكثر عرضة للإصابة بالعدوى. مع حدوث تغير المناخ، تزداد توزيعات العوامل الممرضة، ولكي تعيش الكائنات الحية وتدافع عن نفسها ضد هذه العوامل الممرضة، فإنها تحتاج إلى نظام مناعي قوي وصحي. إذا تم اختراق أنظمتهم من مستويات عالية من المنجنيز، فلن يكونوا قادرين على محاربة هذه العوامل الممرضة والموت.[46]
الغذاء
التوصيات الغذائية
| الذكور | الإناث | ||
|---|---|---|---|
| العمر | AI (mg/day) | العمر | AI (mg/day) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| الحامل: 2 | |||
| المرضعة: 2.6 | |||
قام المعهد الأمريكي للطب (IOM) بتحديث متوسط المتطلبات المقدرة (EARs) والبدلات الغذائية الموصى بها (RDAs) للمعادن في عام 2001. بالنسبة للمنجنيز، لم تكن هناك معلومات كافية لتحديد EARs وRDAs، لذلك يتم وصف الاحتياجات على أنها تقديرات الجرعة الغذائية المرجعية (AIs). بالنسبة للسلامة، يحدد المعهد الأمريكي للطب المستوى الأقصى المقبول (ULs) للفيتامينات والمعادن عندما تكون الأدلة كافية. في حالة المنجنيز، يتم ضبط UL البالغ عند 11 ملجم/يوم. بشكل جماعي، يشار إلى EARs وRDAs وAIs وULs باسم الكمية الغذائية المرجعية (DRIs).[55]من النادر حدوث نقص في المنجنيز.[56]
تشير الهيئة الأوروپية لسلامة الأغذية (EFSA) إلى مجموعة المعلومات الجماعية مثل القيم المرجعية الغذائية، مع الكمية المرجعية للسكان (PRI) بدلاً من RDA، ومتوسط المتطلبات بدلاً من EAR. تم تعريف AI وUL كما هو الحال في الولايات المتحدة. بالنسبة للأشخاص الذين تبلغ أعمارهم 15 عاماً فأكثر، يتم تعيين AIs عند 3.0 ملجم/يوم. AIs للحمل والرضاعة هو 3.0 ملجم/يوم. بالنسبة للأطفال الذين تتراوح أعمارهم من 1 إلى 14 عاماً، تزداد AIs مع تقدم العمر من 0.5 إلى 2.0 ملجم/يوم. AIs للبالغين أعلى من RDAs في الولايات المتحدة.[57] استعرضت الهيئة العامة للرقابة المالية نفس سؤال السلامة وقررت عدم وجود معلومات كافية لتعيين UL.[58]
لأغراض وضع العلامات على المواد الغذائية والمكملات الغذائية في الولايات المتحدة، يتم التعبير عن الكمية في الوجبة كنسبة مئوية من القيمة اليومية (٪ DV). لأغراض وضع العلامات على المنجنيز، كان 100٪ من القيمة اليومية 2.0 ملجم، ولكن اعتباراً من 27 مايو 2016، تم تنقيحه إلى 2.3 ملجم لجعله متوافقاً مع RDA.[59][60] يتوفر جدول بالقيم اليومية القديمة والجديدة للبالغين في الكمية الغذائية اليومية المرجعية.
الدور الحيوي في البكتريا
Mn-SOD هو نوع SOD الموجود في المتقدرات حقيقية النوى، وكذلك في معظم البكتريا (هذه الحقيقة تتماشى مع نظرية الأصل البكتيري للمتقدرات). من المحتمل أن يكون إنزيم Mn-SOD هو أحد أقدم الإنزيمات، حيث تستخدمه تقريباً جميع الكائنات الحية التي تعيش في وجود الأكسجين للتعامل مع التأثيرات السامة للأكسيد الفائق (O−2)، يتكون من اختزال إلكترون واحد للديوكسجين. تشمل الاستثناءات، وهي جميع البكتريا، Lactobacillus plantarum وما يرتبط بها من العصيات اللبنية، والتي تستخدم آلية غير إنزيمية مختلفة مع أيونات المنجنيز (Mn2+) معقد مع متعدد الفوسفات، مما يشير إلى مسار التطور لهذه الوظيفة في الحياة الهوائية.
الدور الحيوي في النباتات
المنجنيز مهم أيضاً في تطور الأكسجين في التمثيل الضوئي في البلاستيدات الخضراء في النباتات. معقد تطور الأكسجين (OEC) هو جزء من النظام الضوئي الثاني الموجود في أغشية الثايلاكويد للبلاستيدات الخضراء; وهي مسؤولة عن الأكسدة الضوئية للماء أثناء التفاعلات الضوئية من التركيب الضوئي، ولها قلب معدني يحتوي على أربع ذرات من المنجنيز.[61][62]لتلبية هذا المطلب، تحتوي معظم الأسمدة النباتية واسعة النطاق على المنجنيز.
التحذيرات
| المخاطر | |
|---|---|
| H401 | |
| P273, P501[63] | |
| NFPA 704 (معيـَّن النار) | |
تعتبر مركبات المنجنيز أقل سمية من تلك الموجودة في المعادن الأخرى واسعة الانتشار، مثل النيكل والنحاس.[64]ومع ذلك، يجب ألا يتجاوز التعرض لغبار وأبخرة المنجنيز قيمة السقف البالغة 5 mg/m3 حتى لفترات قصيرة بسبب مستوى سميته.[65] تم ربط التسمم بالمنجنيز بضعف المهارات الحركية والاضطرابات الإدراكية.[66]
تُظهر الپرمنگنات سمية أعلى من مركبات المنجنيز (II). الجرعة المميتة حوالي 10 g وحدثت عدة حالات تسمم قاتلة. يؤدي التأثير المؤكسد القوي إلى نخر في الغشاء المخاطي. على سبيل المثال، يتأثر المريء إذا ابتلع الپرمنگنات. تمتص الأمعاء كمية محدودة فقط، لكن هذه الكمية الصغيرة تظهر آثاراً شديدة على الكلى والكبد.[67][68]
يُنظم التعرض للمنجنيز في الولايات المتحدة من قبل إدارة السلامة والصحة المهنية (OSHA).[69] يمكن أن يتعرض الناس للمنجنيز في مكان العمل عن طريق استنشاقه أو ابتلاعه. لقد حددت إدارة السلامة والصحة المهنية (OSHA) الحد القانوني (حد التعرض المسموح) للتعرض للمنجنيز في مكان العمل على أنه 5 mg/m3 خلال 8 ساعات يوم عمل. حدد المعهد الوطني للسلامة والصحة المهنية (NIOSH) حد التعرض الموصى به (REL) بمقدار 1 mg/m3 خلال يوم عمل مدته 8 ساعات و حد قصير المدى 3 mg/m3. عند مستويات 500 mg/m3، يعتبر المنجنيز خطيراً على الحياة والصحة.[70]
بشكل عام، يمكن أن يؤدي التعرض لتركيزات Mn في الهواء المحيط التي تزيد عن 5 μg Mn/m3 إلى أعراض يسببها Mn. يرتبط التعبير البروتيني المتزايد الفيروپروتين في خلايا الكلى الجنينية البشرية (HEK293) بانخفاض تركيز المنجنيز داخل الخلايا وتخفيف السمية الخلوية، والذي يتميز بانعكاس امتصاص المنجنيز المخفض الگلوتامات وتناقص تسرب اللاكتات نازعة الهيدروجين.[71]
مخاوف الصحة البيئية
في مياه الشرب
يحتوي المنجنيز المنقول بالماء على توافر حيوي أكبر من المنجنيز الغذائي. وفقاً لنتائج دراسة عام 2010،[72]ترتبط المستويات المرتفعة من التعرض للمنجنيز في مياه الشرب بزيادة الضعف الذهنب وانخفاض نسبة الذكاء لدى الأطفال في سن المدرسة. من المفترض أن التعرض طويل المدى بسبب استنشاق المنجنيز الطبيعي في مياه الاستحمام يعرض ما يصل إلى 8.7 مليون أمريكي للخطر.[73] ومع ذلك، تشير البيانات إلى أن جسم الإنسان يمكن أن يتعافى من بعض الآثار الضارة للتعرض المفرط للمنجنيز إذا توقف التعرض ويمكن للجسم التخلص من الفائض.[74]
في البنزين
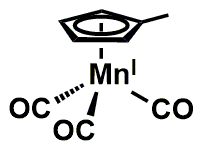
لثلاثي كربونيل ميثيل سيكلوپنتاديينيل المنجنيز (MMT) عبارة عن مادة مضافة للبنزين تستخدم لتحل محل مركبات الرصاص للبنزين الخالي من الرصاص لتحسين رقم الأوكتان من نواتج تقطير البترول منخفضة الأوكتان. يقلل من عامل طرقة المحرك من خلال عمل الكربونيل. تميل أنواع الوقود المحتوية على المنجنيز إلى تكوين كربيدات المنجنيز التي تتلف صمام العادم. مقارنة بعام 1953، انخفضت مستويات المنجنيز في الهواء.[75]
في دخان التبغ
يمتص نبات التبغ ويتراكم في الفلزات الثقيلة مثل المنجنيز من التربة المحيطة إلى أوراقه. يتم استنشاقها لاحقاً أثناء تدخين التبغ.[76] بينما المنجنيز أحد مكونات دخان التبغ،[77]وقد خلُصت الدراسات إلى حد كبير إلى أن التركيزات ليست خطرة على صحة الإنسان.[78]
دوره في الاضطرابات العصبية
تسمم المنجنيز
يرتبط التعرض المفرط للمنجنيز في أغلب الأحيان بالمنجنيز، وهو اضطراب عصبي نادر مرتبط بإفراط في تناول المنجنيز أو استنشاقه. تاريخياً، الأشخاص العاملون في إنتاج أو معالجة سبائك المنجنيز[79][80] هم معرضون لخطر تسمم بالمنجنيز متطور; ومع ذلك، فإن لوائح الصحة والسلامة الحالية تقوم بحماية العمال في الدول المتقدمة.[69] فقد وُصف الاضطراب لأول مرة في عام 1837 من قبل الأكاديمي البريطاني جون كوپر، الذي درس مريضين كانا متسممين بالمنجنيز.[25]
تسمم المنجنيز هو اضطراب ثنائي الطور. في مراحله المبكرة، قد يعاني الشخص المخمور من الاكتئاب وتقلب المزاج والسلوكيات القهرية والذهان. الأعراض العصبية المبكرة تفسح المجال لمرحلة متأخرة من التسمم بالمنجنيز، والتي تشبه مرض پاركنسن. تشمل الأعراض الضعف، والكلام الرتيب وبطء الكلام، والوجه الخالي من التعبيرات، والرعشة، والمشي المائل للأمام، وعدم القدرة على المشي للخلف دون السقوط، والتيبس، والمشاكل العامة المتعلقة بالخفة والمشي والتوازن.[25][81] على عكس مرض پاركنسن، لا يرتبط المنجنيز بفقدان حاسة الشم وعادة لا يستجيب المرضى للعلاج بـ L-DOPA.[82] تصبح أعراض المرحلة المتأخرة من المنجنيز أكثر حدة بمرور الوقت حتى إذا تمت إزالة مصدر التعرض وعودة مستويات المنجنيز في المخ إلى طبيعتها.[81]
تبين أن التعرض المزمن للمنجنيز ينتج عنه مرض شبيه بمرض پاركنسن يتميز بخلل في الحركة.[83] ولا تستجيب هذه الحالة للعلاجات النموذجية المستخدمة في علاج پاركنسن، مما يشير إلى مسار بديل عن الخسارة الدوبامين النموذجية داخل المادة السوداء.[83]قد يتراكم المنجنيز في العقد القاعدية مما يؤدي إلى حركات غير طبيعية.[84] كما تم ربط طفرة في جين SLC30A10، ناقل تدفق المنجنيز الضروري لتقليل المنجنيز داخل الخلايا، مع تطور هذا المرض الشبيه بالپاركنسن.[85] لا تظهر أجسام ليوي النموذجية لمرض پاركنسن في مرض پاركنسن الذي يسببه المنجنيز.[84]
أعطت التجارب على الحيوانات الفرصة لدراسة عواقب التعرض المفرط للمنجنيز في ظل ظروف خاضعة للرقابة. في الجرذان (غير العدوانية)، يتسبب المنجنيز في سلوك قتل الفئران.[86]
اضطرابات نمو الطفولة
تحاول العديد من الدراسات الحديثة فحص آثار التعرض المفرط للجرعات المنخفضة من المنجنيز على نمو الطفل. وقد أجريت الدراسة الأولى في مقاطعة شانشي الصينية. وقد تلوثت مياه الشرب هناك من خلال الري غير السليم بمياه الصرف الصحي واحتوت على 240–350 μg Mn/L. على الرغم من أن تركيزات المنجنيز عند أو أقل من 300 μg Mn/L كانت تعتبر آمنة في وقت الدراسة من قبل وكالة حماية البيئة الأمريكية و 400 μg Mn/L بواسطة منظمة الصحة العالمية، تم أخذ عينات من 92 طفلاً (بين 11 و13 سنة) من هذه المقاطعة أظهروا أداءً أقل في اختبارات البراعة اليدوية والسرعة، والذاكرة قصيرة المدى، والتعرف البصري، مقارنةً بالأطفال من منطقة غير ملوثة. في الآونة الأخيرة، أظهرت دراسة أجريت على أطفال يبلغون من العمر 10 سنوات في بنغلاديش وجود علاقة بين تركيز المنجنيز في مياه الآبار وانخفاض درجات معدل الذكاء. فحصت دراسة ثالثة أجريت في كيبيك أطفال المدارس الذين تتراوح أعمارهم بين 6 و15 عاماً الذين يعيشون في منازل تتلقى المياه من بئر يحتوي على 610 μg Mn/L; تتواجد المتحكمات بالمستوى في المنازل التي تلقت المياه من بئر 160 μg Mn/L. وقد أظهر الأطفال في المجموعة التجريبية زيادة في النشاط المفرط والسلوك المعارض.[72]
يبلغ الحد الأقصى الحالي للتركيز الآمن بموجب قواعد وكالة حماية البيئة 50 μg Mn/L.[87]
الأمراض العصبية
الناقل الرئيسي لامتصاص المنغنيز من الأمعاء هو بروتين يسمى DMT1، وقد يكون الناقل الرئيسي للمنجنيز عبر حاجز دموي دماغي. ينقل DMT1 أيضاً المنجنيز المستنشق عبر ظهارة الأنف. وتتمثل الآلية المقترحة لسمية المنجنيز في أن عدم التنظيم يؤدي إلى الإجهاد التأكسدي، والخلل الوظيفي في المتقدرات، والگلوتامات بوساطة الإثارة، وتجمع البروتينات.[88]
انظر أيضاً
- Manganese exporter، پروتين النقل الغشائي
- List of countries by manganese production
- Parkerizing
- پرمنگنات الپوتاسيوم
- مغناطيس
- تسمم المنجنيز
المصادر
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ كنانة أونلاين
- ^ أ ب Erikson, Keith M.; Ascher, Michael (2019). "Chapter 10. Manganese: Its Role in Disease and Health". In Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (Guest editor) (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Vol. 19. Berlin: de Gruyter GmbH. pp. 253–266. doi:10.1515/9783110527872-016. ISBN 978-3-11-052691-2. PMID 30855111. S2CID 73725546.
{{cite book}}:|editor4-first=has generic name (help);|journal=ignored (help) - ^ أ ب ت ث ج ح Emsley, John (2001). "Manganese". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, UK: Oxford University Press. pp. 249–253. ISBN 978-0-19-850340-8.
- ^ Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). "Chapter 6 Manganese Homeostasis and Transport". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 169–201. doi:10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4. PMC 6542352. PMID 23595673. Electronic-book ISBN 978-94-007-5561-1.
- ^ أ ب ت ث Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Mangan". Lehrbuch der Anorganischen Chemie (in الألمانية) (91–100 ed.). Walter de Gruyter. pp. 1110–1117. ISBN 978-3-11-007511-3.
- ^ Lide, David R. (2004). Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press. ISBN 978-0-8493-0485-9. Archived from the original on 17 December 2019. Retrieved 7 September 2019.
- ^ أ ب قالب:NUBASE2016
- ^ Clery, Daniel (4 June 2020). "The galaxy's brightest explosions go nuclear with an unexpected trigger: pairs of dead stars". Science. Retrieved 26 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregory F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg; Schlüchter, Christian; Serifiddin, Feride; Winckler, Gisela (2006). "Terrestrial manganese-53 – A new monitor of Earth surface processes". Earth and Planetary Science Letters. 251 (3–4): 334–345. Bibcode:2006E&PSL.251..334S. doi:10.1016/j.epsl.2006.09.016.
- ^ "Ch. 20". Shriver and Atkins' Inorganic Chemistry. Oxford University Press. 2010. ISBN 978-0-19-923617-6.
- ^ Saha, Amrita; Majumdar, Partha; Goswami, Sreebrata (2000). "Low-spin manganese(II) and cobalt(III) complexes of N-aryl-2-pyridylazophenylamines: new tridentate N,N,N-donors derived from cobalt mediated aromatic ring amination of 2-(phenylazo)pyridine. Crystal structure of a manganese(II) complex". Journal of the Chemical Society, Dalton Transactions (11): 1703–1708. doi:10.1039/a909769d.
- ^ Rayner-Canham, Geoffrey and Overton, Tina (2003) Descriptive Inorganic Chemistry, Macmillan, p. 491, ISBN 0-7167-4620-4.
- ^ Schmidt, Max (1968). "VII. Nebengruppe". Anorganische Chemie II (in الألمانية). Wissenschaftsverlag. pp. 100–109.
- ^ Temple, R. B.; Thickett, G. W. (1972). "The formation of manganese(v) in molten sodium nitrite". Australian Journal of Chemistry. 25 (3): 55. doi:10.1071/CH9720655.
- ^ Luft, J. H. (1956). "Permanganate – a new fixative for electron microscopy". Journal of Biophysical and Biochemical Cytology. 2 (6): 799–802. doi:10.1083/jcb.2.6.799. PMC 2224005. PMID 13398447.
- ^ languagehat (28 May 2005). "MAGNET". languagehat.com (in الإنجليزية). Retrieved 18 June 2020.
- ^ Calvert, J. B. (2003-01-24). "Chromium and Manganese". Archived from the original on 31 December 2016. Retrieved 2009-04-30.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ Chalmin, Emilie; Menu, Michel; Vignaud, Colette (2003). "Analysis of rock art painting and technology of Palaeolithic painters". Measurement Science and Technology. 14 (9): 1590–1597. doi:10.1088/0957-0233/14/9/310.
- ^ Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006). "Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure" (PDF). Applied Physics A. 83 (12): 213–218. Bibcode:2006ApPhA..83..213C. doi:10.1007/s00339-006-3510-7. hdl:2268/67458. S2CID 9221234.
- ^ Sayre, E. V.; Smith, R. W. (1961). "Compositional Categories of Ancient Glass". Science. 133 (3467): 1824–1826. Bibcode:1961Sci...133.1824S. doi:10.1126/science.133.3467.1824. PMID 17818999. S2CID 25198686.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةItGlass - ^ Rancke-Madsen, E. (1975). "The Discovery of an Element". Centaurus. 19 (4): 299–313. Bibcode:1975Cent...19..299R. doi:10.1111/j.1600-0498.1975.tb00329.x.
- ^ Alessio, L.; Campagna, M.; Lucchini, R. (2007). "From lead to manganese through mercury: mythology, science, and lessons for prevention". American Journal of Industrial Medicine. 50 (11): 779–787. doi:10.1002/ajim.20524. PMID 17918211.
- ^ أ ب ت Couper, John (1837). "On the effects of black oxide of manganese when inhaled into the lungs". Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci. 1: 41–42.
- ^ Olsen, Sverre E.; Tangstad, Merete; Lindstad, Tor (2007). "History of omanganese". Production of Manganese Ferroalloys. Tapir Academic Press. pp. 11–12. ISBN 978-82-519-2191-6.
- ^ Preisler, Eberhard (1980). "Moderne Verfahren der Großchemie: Braunstein". Chemie in unserer Zeit (in الألمانية). 14 (5): 137–148. doi:10.1002/ciuz.19800140502.
- ^ Bhattacharyya, P. K.; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984). "Geochemistry of braunite and associated phases in metamorphosed non-calcareous manganese ores of India". Contributions to Mineralogy and Petrology. 87 (1): 65–71. Bibcode:1984CoMP...87...65B. doi:10.1007/BF00371403. S2CID 129495326.
- ^ أ ب USGS Mineral Commodity Summaries 2009
- ^ Cook, Nigel J.; Ciobanu, Cristiana L.; Pring, Allan; Skinner, William; Shimizu, Masaaki; Danyushevsky, Leonid; Saini-Eidukat, Bernhardt; Melcher, Frank (2009). "Trace and minor elements in sphalerite: A LA-ICPMS study". Geochimica et Cosmochimica Acta (in الإنجليزية). 73 (16): 4761–4791. Bibcode:2009GeCoA..73.4761C. doi:10.1016/j.gca.2009.05.045.
- ^ Wang, X; Schröder, HC; Wiens, M; Schlossmacher, U; Müller, WEG (2009). "Manganese/polymetallic nodules: micro-structural characterization of exolithobiontic- and endolithobiontic microbial biofilms by scanning electron microscopy". Micron. 40 (3): 350–358. doi:10.1016/j.micron.2008.10.005. PMID 19027306.
- ^ United Nations Ocean Economics and Technology Office, Technology Branch, United Nations (1978). Manganese Nodules: Dimensions and Perspectives. Vol. 41. Springer. p. 343. Bibcode:1981MGeol..41..343C. doi:10.1016/0025-3227(81)90092-X. ISBN 978-90-277-0500-6.
{{cite book}}:|journal=ignored (help)CS1 maint: multiple names: authors list (link) - ^ "Manganese Mining in South Africa – Overview". MBendi.com. Archived from the original on 5 February 2016. Retrieved 2014-01-04.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ Elliott, R; Coley, K; Mostaghel, S; Barati, M (2018). "Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals". JOM. 70 (5): 680–690. Bibcode:2018JOM...tmp...63E. doi:10.1007/s11837-018-2769-4. S2CID 139950857.
{{cite journal}}: CS1 maint: bibcode (link) - ^ Corathers, L. A.; Machamer, J. F. (2006). "Manganese". Industrial Minerals & Rocks: Commodities, Markets, and Uses (7th ed.). SME. pp. 631–636. ISBN 978-0-87335-233-8.
- ^ Zhang, Wensheng; Cheng, Chu Yong (2007). "Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide". Hydrometallurgy. 89 (3–4): 137–159. doi:10.1016/j.hydromet.2007.08.010.
- ^ Chow, Norman; Nacu, Anca; Warkentin, Doug; Aksenov, Igor & Teh, Hoe (2010). "The Recovery of Manganese from low grade resources: bench scale metallurgical test program completed" (PDF). Kemetco Research Inc. Archived from the original (PDF) on 2 February 2012.
- ^ "The CIA secret on the ocean floor". BBC News (in الإنجليزية البريطانية). 2018-02-19. Retrieved 2018-05-03.
- ^ "Project Azorian: The CIA's Declassified History of the Glomar Explorer". National Security Archive at George Washington University. 2010-02-12. Retrieved 2013-09-18.
- ^ Hein, James R. (January 2016). Encyclopedia of Marine Geosciences - Manganese Nodules. Springer. pp. 408–412. Retrieved 2 February 2021.
- ^ Hoseinpour, Vahid; Ghaemi, Nasser (1 December 2018). "Green synthesis of manganese nanoparticles: Applications and future perspective–A review". Journal of Photochemistry and Photobiology B: Biology. 189: 234–243. doi:10.1016/j.jphotobiol.2018.10.022. PMID 30412855. S2CID 53248245. Retrieved 2 February 2021.
- ^ International Seabed Authority. "Polymetallic Nodules" (PDF). isa.org. International Seabed Authority. Retrieved 2 February 2021.
- ^ Oebius, Horst U; Becker, Hermann J; Rolinski, Susanne; Jankowski, Jacek A (January 2001). "Parametrization and evaluation of marine environmental impacts produced by deep-sea manganese nodule mining". Deep Sea Research Part II: Topical Studies in Oceanography. 48 (17–18): 3453–3467. Bibcode:2001DSRII..48.3453O. doi:10.1016/s0967-0645(01)00052-2. ISSN 0967-0645.
- ^ Thompson, Kirsten F.; Miller, Kathryn A.; Currie, Duncan; Johnston, Paul; Santillo, David (2018). "Seabed Mining and Approaches to Governance of the Deep Seabed". Frontiers in Marine Science. 5. doi:10.3389/fmars.2018.00480. S2CID 54465407.
- ^ أ ب Ray, Durbar; Babu, E. V. S. S. K.; Surya Prakash, L. (2017-01-01). "Nature of Suspended Particles in Hydrothermal Plume at 3°40'N Carlsberg Ridge:A Comparison with Deep Oceanic Suspended Matter". Current Science. 112 (1): 139. doi:10.18520/cs/v112/i01/139-146. ISSN 0011-3891.
- ^ أ ب Hernroth, Bodil; Tassidis, Helena; Baden, Susanne P. (March 2020). "Immunosuppression of aquatic organisms exposed to elevated levels of manganese: From global to molecular perspective". Developmental & Comparative Immunology. 104: 103536. doi:10.1016/j.dci.2019.103536. ISSN 0145-305X. PMID 31705914. S2CID 207935992.
- ^ أ ب Sim, Nari; Orians, Kristin J. (October 2019). "Annual variability of dissolved manganese in Northeast Pacific along Line-P: 2010–2013". Marine Chemistry. 216: 103702. doi:10.1016/j.marchem.2019.103702. ISSN 0304-4203. S2CID 203151735.
- ^ Bartlett, Richmond; Ross, Donald (2005). "Chemistry of Redox Processes in Soils". In Tabatabai, M.A.; Sparks, D.L. (eds.). Chemical Processes in Soils. SSSA Book Series, no. 8. Madison, Wisconsin: Soil Science Society of America. pp. 461–487. LCCN 2005924447.
- ^ Dixon, Joe B.; White, G. Norman (2002). "Manganese Oxides". In Dixon, J.B.; Schulze, D.G. (eds.). Soil Mineralogy with Environmental Applications. SSSA Book Series no. 7. Madison, Wisconsin: Soil Science Society of America. pp. 367–386. LCCN 2002100258.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
- ^ Law, N.; Caudle, M.; Pecoraro, V. (1998). Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity. Advances in Inorganic Chemistry. Vol. 46. p. 305. doi:10.1016/S0898-8838(08)60152-X. ISBN 9780120236466.
- ^ Takeda, A. (2003). "Manganese action in brain function". Brain Research Reviews. 41 (1): 79–87. doi:10.1016/S0165-0173(02)00234-5. PMID 12505649. S2CID 1922613.
- ^ Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). "Chapter 7. Manganese in Health and Disease". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 199–227. doi:10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMC 6589086. PMID 24470093.
- ^ Hernroth, Bodil; Krång, Anna-Sara; Baden, Susanne (February 2015). "Bacteriostatic suppression in Norway lobster (Nephrops norvegicus) exposed to manganese or hypoxia under pressure of ocean acidification". Aquatic Toxicology. 159: 217–224. doi:10.1016/j.aquatox.2014.11.025. ISSN 0166-445X. PMID 25553539.
- ^ أ ب Institute of Medicine (US) Panel on Micronutrients (2001). "Manganese". Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium. National Academy Press. pp. 394–419. ISBN 978-0-309-07279-3. PMID 25057538.
- ^ See "Manganese". Micronutrient Information Center. Oregon State University Linus Pauling Institute. 2014-04-23.
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals, European Food Safety Authority, 2006, http://www.efsa.europa.eu/sites/default/files/efsa_rep/blobserver_assets/ndatolerableuil.pdf
- ^ "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982" (PDF).
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (May 2011). "Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å" (PDF). Nature. 473 (7345): 55–60. Bibcode:2011Natur.473...55U. doi:10.1038/nature09913. PMID 21499260. S2CID 205224374.
- ^ Dismukes, G. Charles; Willigen, Rogier T. van (2006). "Manganese: The Oxygen-Evolving Complex & Models". Manganese: The Oxygen-Evolving Complex & Models Based in part on the article Manganese: Oxygen-Evolving Complex & Models by Lars-Erik Andréasson & Tore Vänngård which appeared in the Encyclopedia of Inorganic Chemistry, First Edition, First Edition. Encyclopedia of Inorganic Chemistry. doi:10.1002/0470862106.ia128. ISBN 978-0470860786.
- ^ "Safety Data Sheet". Sigma-Aldrich. Retrieved 26 July 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Hasan, Heather (2008). Manganese. The Rosen Publishing Group. p. 31. ISBN 978-1-4042-1408-8.
- ^ "Manganese Chemical Background". Metcalf Institute for Marine and Environmental Reporting University of Rhode Island. April 2006. Archived from the original on 28 August 2006. Retrieved 2008-04-30.
- ^ "Risk Assessment Information System Toxicity Summary for Manganese". Oak Ridge National Laboratory. Retrieved 2008-04-23.
- ^ Ong, K. L.; Tan, T. H.; Cheung, W. L. (1997). "Potassium permanganate poisoning – a rare cause of fatal self poisoning". Emergency Medicine Journal. 14 (1): 43–45. doi:10.1136/emj.14.1.43. PMC 1342846. PMID 9023625.
- ^ Young, R.; Critchley, J. A.; Young, K. K.; Freebairn, R. C.; Reynolds, A. P.; Lolin, Y. I. (1996). "Fatal acute hepatorenal failure following potassium permanganate ingestion". Human & Experimental Toxicology. 15 (3): 259–61. doi:10.1177/096032719601500313. PMID 8839216. S2CID 8993404.
- ^ أ ب "Safety and Health Topics: Manganese Compounds (as Mn)". U.S. Occupational Safety and Health Administration.
- ^ "NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)". Centers for Disease Control. Retrieved 2015-11-19.
- ^ Yin, Z.; Jiang, H.; Lee, E. S.; Ni, M.; Erikson, K. M.; Milatovic, D.; Bowman, A. B.; Aschner, M. (2010). "Ferroportin is a manganese-responsive protein that decreases manganese cytotoxicity and accumulation" (PDF). Journal of Neurochemistry. 112 (5): 1190–8. doi:10.1111/j.1471-4159.2009.06534.x. PMC 2819584. PMID 20002294.
- ^ أ ب Bouchard, M. F; Sauvé, S; Barbeau, B; Legrand, M; Bouffard, T; Limoges, E; Bellinger, D. C; Mergler, D (2011). "Intellectual impairment in school-age children exposed to manganese from drinking water". Environmental Health Perspectives. 119 (1): 138–143. doi:10.1289/ehp.1002321. PMC 3018493. PMID 20855239.
- ^ Barceloux, Donald; Barceloux, Donald (1999). "Manganese". Clinical Toxicology. 37 (2): 293–307. doi:10.1081/CLT-100102427. PMID 10382563.
- ^ Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994). "Dystonia, hyperintense basal ganglia, and high whole blood manganese levels in Alagille's syndrome". Gastroenterology. 106 (4): 1068–71. doi:10.1016/0016-5085(94)90769-2. PMID 8143974.
- ^ Agency for Toxic Substances and Disease Registry (2012) 6. Potential for human exposure, in Toxicological Profile for Manganese, Atlanta, GA: U.S. Department of Health and Human Services.
- ^ Pourkhabbaz, A; Pourkhabbaz, H (2012). "Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues". Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smoke". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. PMC 3084482. PMID 21556207.
- ^ Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). "Metals in cigarette smoke". IUBMB Life. 57 (12): 805–9. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
- ^ Baselt, R. (2008) Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, pp. 883–886, ISBN 0-9626523-7-7.
- ^ Normandin, Louise; Hazell, A. S. (2002). "Manganese neurotoxicity: an update of pathophysiologic mechanisms". Metabolic Brain Disease. 17 (4): 375–87. doi:10.1023/A:1021970120965. PMID 12602514. S2CID 23679769.
- ^ أ ب Cersosimo, M. G.; Koller, W.C. (2007). "The diagnosis of manganese-induced parkinsonism". NeuroToxicology. 27 (3): 340–346. doi:10.1016/j.neuro.2005.10.006. PMID 16325915.
- ^ Lu, C. S.; Huang, C.C; Chu, N.S.; Calne, D.B. (1994). "Levodopa failure in chronic manganism". Neurology. 44 (9): 1600–1602. doi:10.1212/WNL.44.9.1600. PMID 7936281. S2CID 38040913.
- ^ أ ب Guilarte TR, Gonzales KK (August 2015). "Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson's Disease: Environmental and Genetic Evidence". Toxicological Sciences (Review). 146 (2): 204–12. doi:10.1093/toxsci/kfv099. PMC 4607750. PMID 26220508.
- ^ أ ب Kwakye GF, Paoliello MM, Mukhopadhyay S, Bowman AB, Aschner M (July 2015). "Manganese-Induced Parkinsonism and Parkinson's Disease: Shared and Distinguishable Features". Int J Environ Res Public Health (Review). 12 (7): 7519–40. doi:10.3390/ijerph120707519. PMC 4515672. PMID 26154659.
- ^ Peres TV, Schettinger MR, Chen P, Carvalho F, Avila DS, Bowman AB, Aschner M (November 2016). "Manganese-induced neurotoxicity: a review of its behavioral consequences and neuroprotective strategies". BMC Pharmacology & Toxicology (Review). 17 (1): 57. doi:10.1186/s40360-016-0099-0. PMC 5097420. PMID 27814772.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Lazrishvili, I.; et al. (2016). "Manganese loading induces mouse-killing behaviour in nonaggressive rats". Journal of Biological Physics and Chemistry. 16 (3): 137–141. doi:10.4024/31LA14L.jbpc.16.03.
- ^ "Drinking Water Contaminants". US EPA. Retrieved 2 February 2015.
- ^ Prabhakaran, K.; Ghosh, D.; Chapman, G.D.; Gunasekar, P.G. (2008). "Molecular mechanism of manganese exposure-induced dopaminergic toxicity". Brain Research Bulletin. 76 (4): 361–367. doi:10.1016/j.brainresbull.2008.03.004. ISSN 0361-9230. PMID 18502311. S2CID 206339744.
وصلات خارجية
- CS1 errors: generic name
- CS1 errors: periodical ignored
- CS1 الألمانية-language sources (de)
- CS1 maint: url-status
- CS1 maint: bot: original URL status unknown
- CS1 maint: bibcode
- CS1 الإنجليزية البريطانية-language sources (en-gb)
- CS1 maint: unflagged free DOI
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles containing إنگليزية-language text
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from May 2019
- Chembox container only
- منجنيز
- عناصر كيميائية
- فلزات انتقالية
- Deoxidizers
- معادن غذائية
- نازعات الأكسجين
- سلامة وصحة مهنية
- علما الأحياء والأدوية للعناصر الكيميائية
- عوامل مختزلة
- Chemical elements with body-centered cubic structure
- Native element minerals