سرطان البروستاتا
| Prostate cancer | |
|---|---|
| الأسماء الأخرى | Prostate carcinoma |
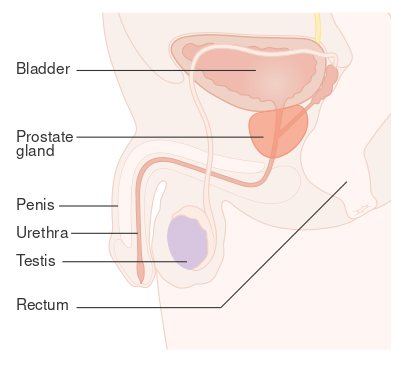 | |
| Location of the prostate | |
| التخصص | Oncology, urology |
| الأعراض | Typically none. Sometimes trouble urinating, erectile dysfunction, or pain in the back/pelvis. |
| البداية المعتادة | Age > 40 |
| عوامل الخطر | Older age, family history, race |
| الطريقة التشخيصية | PSA test followed by tissue biopsy |
| التشخيص المفاضل | Benign prostatic hyperplasia |
| العلاج | Active surveillance, prostatectomy, radiation therapy, hormone therapy, chemotherapy |
| Prognosis | Depends on stage, five-year survival rate 97%[1] |
| التردد | Around 1.2 million new cases per year[2] |
| الوفيات | Around 350,000 per year[2] |
سرطان البروستاتا Prostate cancer هو مرض ينشأ فيه السرطان في غدة البروستاتا, في الجهاز التناسلي الذكري. ويحدث عندما تتحور الخلايا لغدة البروستاتا وتبدأ في الإنقسام بدون إنتظام. وهذه الخلايا يمكنها أن (تنتشر) ورم ثانوى من البروستاتا إلى أجزاء أخرى من الجسم، وعلى وجه الخصوص العظام و العقد الليمفاوية. سرطان البروستاتا يمكن أن يسبب الألم، صعوبة في التبول , وصعوبة أثناء الممارسة الجنسية , عدم القدرة على الإنتصاب. ومشاكل أخرى يمكن أن تنشأ خلال مراحل متأخرة من المرض .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تعريف
سرطان البروستاتا انقسام الخلايا دون ضبط أو نظام في غدة البروستاتا، وهي عضو داخلي في حجم حبة الكستناء في الجهاز التناسلي لدى الذكور. يقتل سرطان البروستاتا في الولايات المتحدة الأمريكية، عددًا أكبر من الرجال أكثر مما يفعله أي سرطان آخر باستثناء سرطان الرئة، ويسجل الأمريكيون من أصل إفريقي، أعلى نسبة للإصابة بسرطان البروستاتا في العالم.وقد تتضخم غدة البروستاتا المصابة بالسرطان وتضغط على الإحليل، وهو القناة التي يمر بها البول حتى يخرج من الجسم. ويمكن للبروستاتا المتضخمة أيضًا أن تضغط على المثانة. ويستشير العديد من مرضى سرطان البروستاتا الطبيب، لأن هذا الضغط يؤدي إلى حالات التبول المتكرر أو إلى صعوبة في خروج البول من الجسم.وقد تتضخم غدة البروستاتا المصابة بالسرطان وتضغط على الإحليل، وهو القناة التي يمر بها البول حتى يخرج من الجسم. ويمكن للبروستاتا المتضخمة أيضًا أن تضغط على المثانة. ويستشير العديد من مرضى سرطان البروستاتا الطبيب، لأن هذا الضغط يؤدي إلى حالات التبول المتكرر أو إلى صعوبة في خروج البول من الجسم.
الكشف
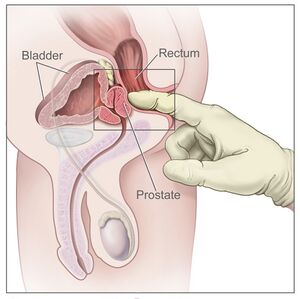
يجري الأطباء بعض الفحوص لتحديد ما إذا كانت هذه الأعراض ناتجة عن السرطان، أو عن تضخم البروستاتا الحميد، وهو أحد الأمراض الأخرى الشائعة. وأول هذه الفحوص، في الغالب، الفحص الأصبعي للمستقيم. يقوم الطبيب في هذا الفحص بتحسس غدة البروستاتا مباشرة عن طريق إدخال أحد الأصابع المغطاة بقفاز مزيت في مستقيم المريض. وقد يشير وجود ورم أو منطقة صلبة إلى الإصابة بالسرطان. وإحدى الوسائل الأخرى لتشخيص سرطان البروستاتا، هي فحص الدم الذي يقيس البروتين المسمى مستضد البروستاتا النوعي PSA . فقد يشير وجود مستويات مرتفعة من مستضد البروستاتا النوعي، الذي ينتج داخل غدة البروستاتا فقط، إلى الإصابة بالسرطان. غالبًا ما يتبع الفحص الأصبعي، أو فحص مستضد البروستاتا النوعي، إجراء فحص الموجات فوق الصوتية، الذي يستخدم الموجات الصوتية لعمل صورة مفصلة للبروستاتا. تساعد هذه الصورة الطبيب في الحصول على عينات جراحية صغيرة من أنسجة الغدة. فإذا وجدت الأنسجة سرطانية، لزم إجراء المزيد من الفحوص لتحديد ما إذا كان السرطان محصورًا في البروستاتا، أو أنه قد انتشر إلى أجزاء أخرى من الجسم.
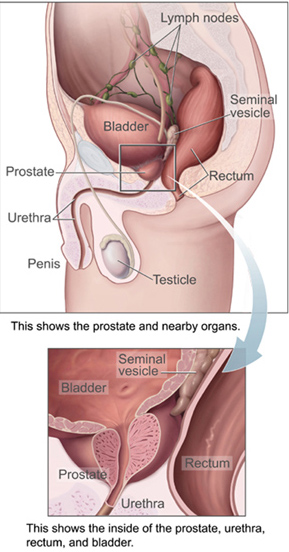
البروستاتا
غدةالبروستاتا هى جزء من التناسل عضو التى تساعد على تصنيع و تخزين السائل المنوي. في الرجل البالغ, يبلغ طول غدة البروستاتا ثلاثة سنتيمترات و تزن حوالى عشرون جراما .[3] هى تكمن في الحوض , خلف المثانة البولية و أمام المستقيم. البروستاتا تحيط بجزء من المثانة, القناة التى تحمل البول من المثانة خلال التبول و السائل المنوى خلال القذف.[4] ونظرا لموقعها, فإن مرض غدة البروستات يؤثر على التبول, و القذف, ونادرا ما تؤثر على التبرز. تحتوى غدة البروستاتا على غدد صغيرة تشكل حوالى 20% من محتوى السائل المنوى.[5] في سرطان البروستاتا فإن خلايا تلك الغدة تتحور إلى خلايا سرطانية. إن غدة البروستاتا تحتاج إلى هورمونات يطلق عليها أندروجينات كي تعمل بكفاءة. والأندروجينات تشمل التيستستيرون , الذى يتم إنتاجه فىالخصية ; ديهيدروإبي أندروستيرون , ويتم إنتاجه في الغدة الكظرية وداي هيدروتيستستيرون , الذى يتم تحويله من تيستستيرون داخل غدة البروستات نفسها. الأندروجينات أيضا, مسئولة عن صفات الجنس الثانوية مثل شعر الوجه و زيادة كتلة العضلات بالجسم.
منذ عدة سنوات بدأ معدل الوفيات بسرطان الپروستاتا (الموثة) بالتراجع في الولايات المتحدة , إلا أن هذا المرض مازال يحصد أعدادا كبيرة من الناس. ويتوقع أنه أصاب نحو500 184 رجل في عام 1998 مؤديا إلى وفاة 200 39 منهم، مما يجعل سرطان الپروستات ثاني سرطان قاتل للرجال بعد سرطان الرئة . لهذه الأسباب نعكف وآخرون على متابعة العمل لتحسين التعامل مع هذا المرض الذي يشيع خاصة بين الذين يتجاوزون الخامسة والستين من العمر. ومع أننا لا ندعي امتلاكنا الحل المثالي الذي يناسب كل مريض، فقد تحقق مؤخرا العديد من الاكتشافات المثيرة التي تستوجب التنويه.
تعالج بعض هذه المكتشفات الحديثة مشكلة عدم كفاية الاختبار غير الباضع noninvasive الوحيد المتوفر لدينا لتقصي سرطان الپروستاتا وهو في مرحلته المكروية (المجهرية) ، وهو الشكل الأكثر استجابة للمعالجة الشافية. يقيس هذا الاختبار مستوى المستضد النوعي للپروستاتا prostate-specific antigen (PSA) في الدم، وهو بروتين تنتجه خلايا الپروستاتا ؛ إذ تقوم خلايا الپروستاتا السليمة والخبيثة على حد سواء بإنتاج هذا البروتين، إلا أن مستواه في الدورة الدموية (الدَّوَران) غالبا ما يرتفع عند الإصابة بسرطان الپروستات . تنبه المستويات المرتفعة من هذا البروتين إلى أن غدة الپروستات مصابة بالسرطان، حتى عندما يكون الورم صغيرا جدا إلى حد يصعب على الطبيب كشفه. وتستطيع طريقة التقصي الأساسية الأخرى، وهي الجس الإصبعي للمستقيم (المس الشرجي) digital rectal exam، فقط كشف الأورام التي تجاوزت المرحلة المكروية. ففي هذا الفحص يدخل الطبيب إصبعه في المستقيم ويقوم بجس الغدة من خلال جداره بحثا عن كتلة أو قساوة في نسيجها.
ولسوء الحظ فإن اختبار المستضد PSA ليس نوعيا تماما؛ إذ تكون مستويات المستضد PSA ضمن الحدود الطبيعية ( ≥ 4 نانوغرام/ مليلتر دم) عند نحو 25% من المصابين بسرطان الپروستات . وفي الوقت نفسه نجد أكثر من نصف الرجال ذوي المستويات الأعلى من المستضد PSA خالين تماما من السرطان.
قبل مناقشة أفضل السبل لإنقاص مجال الخطأ في هذا الاختبار، علينا أن نقر بأن استعمال اختبار المستضد PSA من أجل المسح الاستقصائي الواسع كان مثارًا للجدل وسيبقى الموثة» خلاصة القول إن بعض الأطباء، في أوروبا خاصة، يشككون في جدوى الحاجة إلى الكشف عن سرطان الپروستاتا وهو في مرحلته المكروية، والذي ينجم عندما تستطيع إحدى خلايا الپروستات التخلص من الضوابط المعتادة على انقسامها وهجرتها. ويشير هؤلاء إلى أن الأورام المكروية عادة ما تنمو ببطء شديد لدرجة يندر معها أن تتسبب في أعراض خلال حياة المرء أو تؤثر في بُقْياه. وبالتالي فقد يكون ضرر تعريض عدد كبير من الرجال إلى هذا الفحص أكبر من نفعه، إذا أخذنا بعين الاعتبار وجوب متابعة الذين يُبدون مقادير غير طبيعية بإجراء استقصاءات لاحقة (مثل التصوير بالموجات فوق الصوتية والخزعة biopsy )، ومن ثم تعريض من يَثبت وجود ورم كامن لديه للآثار الجانبية للمعالجة.
علم الوظائف المرضي

عوامل الإصابة
عند معرفة عوامل خطر الإصابة ب سرطان البروستاتا يمكنك تحديد كيف ومتى يمكنك البدء بالكشف عن سرطان البروستاتا وفحصه، ومن العوامل الرئيسية ما يلي:
العمر
كلما تقدمت في العمر، يزداد خطر إصابتك بسرطان البروستاتا، ومع بلوغ الخمسين من عمرك يزداد خطر الإصابة به بشكل كبير.
تاريخ العائلة
إذا كان أحد أفراد عائلتك كأبيك أو أخيك مصابا بسرطان البروستاتا، فيزداد خطر إصابتك بالمرض.
النظام الغذائي
إن النظام الغذائي الغني بالدهون والبدانة قد يزيد من خطر إصابتك بسرطان البروستاتا، إذ أظهرت الدراسات أن الدهون تزيد من إنتاج هرمون التستوستيرون، والذي يحفز نمو خلايا سرطانية في البروستاتا.
الخضوع لجراحة (قطع قناة المني)
على الرغم من أن الدراسات تظهر ازدياد خطر إصابة من أجرى عملية قطع قناة المني بسرطان البروستات، إلا أنه لا توجد أدلة قاطعة على ذلك، وما زال البحث مستمرا.
زيادة مستوى التستوستيرون
نظرا لقيام هرمون التستوستيرون بزيادة نمو غدة البروستاتا ، فإن الرجال الذين يكون لديهم مستويات عالية من هرمون التستوستيرون، مثل هؤلاء الذين يعانون من ضعف المناسل أو الذين يستخدمون هرمون التستوستيرون كعلاج على الأرجح أن يصابوا بسرطان البروستاتا أكثر من الرجال الذين تكون مستويات هرمون التستوستيرون لديهم منخفضة، وقد وجد أن العلاج بهرمون التستوستيرون لفترة طويلة يؤدي إلى تضخم البروستاتا.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العلامات والأعراض
في العادة لا تظهر على المصاب بسرطان البروستاتا أية أعراض في مراحله المبكرة، لذا في كثير من الحالات لا يتم الكشف عن الإصابة بسرطان البروستاتا إلا عندما يصبح منتشرًا إلى أماكن أخرى عدا البروستات.
وعندما تبدأ العلامات والأعراض بالظهور، تكون كالتالي:
- ألم مستمر غير حاد عند المنطقة السفلية من الحوض.
- الحاجة الضرورية للتبول.
- الصعوبة في البدء بالتبول.
- ألم خلال التبول.
- مجرى ورذاذ ضعيف في البول.
- تقطع مجرى البول.
- الشعور بأن المثانة لا تفرغ من البول.
- التبول المتكرر في الليل.
- وجود الدم في البول.
- قذف مؤلم.
- ألم بشكل عام أسفل الظهر، أو الأوراك أو الأفخاذ.
- فقدان الشهية والوزن.
- ألم مستمر للعظام. [6]
مضاعفات الإصابة
تعلق مضاعفات الإصابة بسرطان البروستاتا بكل من المرض وعلاجه، إذ من أكثر الأمور التي تخيف الرجال الذين يعانون من سرطان البروستات هو أن يجعلهم العلاج ضعيفين جنسيا أو مفرطين جنسيا، ولحسن الحظ توجد علاجات تساعد على التعامل مع هذه الحالات.
ومن المضاعفات الشائعة للإصابة بسرطان البروستاتي ما يلي:
انتشار السرطان
قد ينتشر سرطان البروستاتي إلى الأعضاء المجاورة والعظام ومن الممكن أن يهدد الحياة.
الألم
على الرغم من أن المراحل المبكرة من سرطان البروستاتي غير مؤلمة، ولكنها حالما تصيب العظام فقد يظهر ألم شديد، والعلاجات الموجهة لتقليص السرطان قد تساعد على تخفيف الألم.
عدم استمساك البول
تؤدي الإصابة بسرطان البروستاتي وعلاجه إلى عدم استمساك البول، إذ يعاني بعض الرجال من ذلك بعد إجراء عملية استئصال البروستاته، ويعتمد علاج ذلك على نوع عدم استمساك البول الذي تعاني منه ومدى شدته واحتمالية تحسنه مع الوقت.
عسر عملية الانتصاب أو العقم
كما هو الحال في عدم استمساك البول، قد يحدث عسر الانتصاب نتيجة الإصابة بسرطان البروستاتي أو علاجه، بما في ذلك العلاج بالجراحة أو الإشعاع أو الهرمون، ومع ذلك فهناك أدوية تساعد على حل هذه المشكلة.
الإكتئاب
قد يصاب كثير من الرجال بحالات من الاكتئاب بعد تشخيصهم بسرطان البروستاتا أو بعد المحاولة للتعامل مع الآثار الجانبية الناتجة عن علاجه. وقد تظهر هذه المشاعر لفترة قصيرة أو قد تأتي وتذهب، وقد تلازم المريض لأسابيع أو حتى أشهر.
التشخيص
Men suspected of having prostate cancer may undergo several tests to help assess the prostate. One common procedure is the digital rectal examination, in which a doctor inserts a lubricated finger into the rectum to feel the nearby prostate.[7][8] Tumors feel like stiff, irregularly shaped lumps against the rest of the prostate. Hardening of the prostate can also be due to benign prostatic hyperplasia; around 20–25% of those with abnormal findings on their rectal exams have prostate cancer.[9]
A diagnosis of prostate cancer requires a biopsy of the prostate. Prostate biopsies are typically taken by a needle passing through the rectum or perineum, guided by transrectal ultrasound imaging, magnetic resonance imaging (MRI), or a combination of the two.[10][8] Ten to twelve samples are taken from several regions of the prostate to improve the chances of finding any tumors.[8] Biopsies are examined under a microscope by a pathologist, who determines the type and extent of cancerous cells present. Cancers are first classified based on their appearance under a microscope. Over 95% of prostate cancers are classified as adenocarcinomas (resembling gland tissue), with the rest largely squamous-cell carcinoma (resembling squamous cells, a type of epithelial cell) and transitional cell carcinoma (resembling transitional cells).[11]
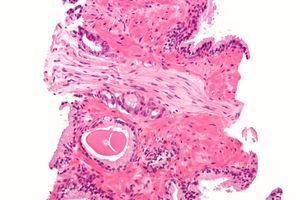
Next tumor samples are graded based on how much the tumor tissue differs from normal prostate tissue; the more different the tumor appears, the faster the tumor is likely to grow. The Gleason grading system is commonly used, where the pathologist assigns a number from 1 (most similar to healthy prostate tissue) to 5 (least similar) for the most common pattern observed under the microscope, then does the same for the second-most common pattern. The sum of these two numbers is the Gleason score.[11] The total scores of 2 through 5 are no longer commonly used in practice, making the lowest score 6, and the highest score 10. Scores are commonly grouped into Gleason grade groups: a score of 6 or lower is Gleason grade group 1; a score of 7 with the first number (from the most common pattern) 3 and the second number 4 is grade group 2; the reverse – first number 4, second number 3 – is grade group 3; a score of 8 is grade group 4; a score of 9 or 10 is grade group 5.[11] Higher Gleason scores and higher grade groups represent cancer cases likely to be more aggressive with worse prognosis.[11]
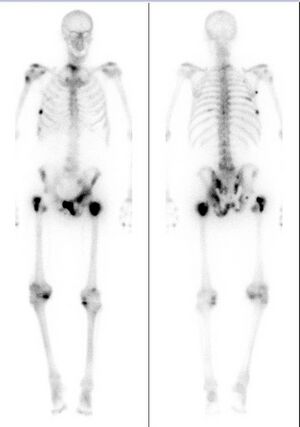
Extent of cancer spread is assessed by MRI or PSMA scan – a positron emission tomography (PET) imaging technique where a radioactive label that binds the prostate protein prostate-specific membrane antigen is used to detect metastases distant from the prostate.[12][8] CT scans may also be used, but are less able to detect spread outside the prostate than MRI. Bone scintigraphy is used to test for spread of cancer to bones.[12]
المراحل
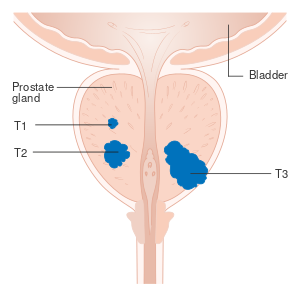
After diagnosis, the tumor is staged to determine the extent of its growth and spread. Prostate cancer is typically staged using the American Joint Committee on Cancer's (AJCC) three-component TNM system, with scores assigned for the extent of the tumor (T), spread to any lymph nodes (N), and the presence of metastases (M).[13] Scores of T1 and T2 represent tumors that remain within the prostate: T1 is for tumors not detectable by imaging or digital rectal exam; T2 is for tumors detectable by imaging or rectal exam, but still confined within the prostate.[14] T3 is for tumors that grow beyond the prostate – T3a for tumors with any extension outside the prostate; T3b for tumors that invade the adjacent seminal vesicles. T4 is for tumors that have grown into organs beyond the seminal vesicles.[14] The N and M scores are binary (yes or no). N1 represents any spread to the nearby lymph nodes. M1 represents any metastases to other body sites.[14]
The AJCC then combines the TNM scores, Gleason grade group, and results of the PSA blood test to categorize cancer cases into one of four stages, and their subdivisions. Cancer cases with localized tumors (T1 or T2), no spread (N0 and M0), Gleason grade group 1, and PSA less than 10 ng/mL are designated stage I. Those with localized tumors and PSA between 10 and 20 ng/mL are desigated stage II – subdivided into IIA for Gleason grade group 1, IIB for grade group 2, and IIC for grade group 3 or 4. Stage III is the designation for any of three higher risk factors: IIIA is for a PSA level about 20 ng/mL; IIIB is for T3 or T4 tumors; IIIC is for a Gleason grade group of 5. Stage IV is for cancers that have spread to lymph nodes (N1, stage IVA) or other organs (M1, stage IVB).[13]
| AJCC Stage | TNM scores | Gleason grade group | PSA |
|---|---|---|---|
| Stage I | T1 or T2, N0, M0 | 1 | <10 ng/mL |
| Stage IIA | T1 or T2, N0, M0 | 1 | 10-20 ng/mL |
| Stage IIB | 2 | ||
| Stage IIC | 3 or 4 | ||
| Stage IIIA | T1 or T2, N0, M0 | 3 or 4 | > 20 ng/mL |
| Stage IIIB | T3 or T3, N0, M0 | 10-20 ng/mL | |
| Stage IIIC | T1 or T2, N0, M0 | 5 | |
| Stage IVA | Any T, N1 | Any group | Any PSA |
| Stage IVB | Any T, M1 |
The United Kingdom National Institute for Health and Care Excellence recommends a five-stage system based on disease prognosis called the Cambridge Prognostic Group, with prognostic groups CPG 1 to CPG 5.[15] CPG 1 is the same as AJCC stage I. Cases with localized tumors (T1 or T2) and either Gleason grade group 2 or higher PSA levels (10 to 20 ng/mL) are designated CPG 2. CPG 3 represents either Gleason grade group 3, or the combination of the CPG 2 criteria. CPG 4 is similar to AJCC stage 3 – any of Gleason grade group 4, PSA levels above 20 ng/mL, or a tumor that has grown beyond the prostate (T3). CPG 5 is for the highest risk cases: either a T4 tumor, Gleason grade group 5, or any two of the CPG 4 criteria.[16]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الوقاية
لا يمكن تجنب الإصابة بسرطان البروستاتي لعدم معرفة الأسباب المباشرة للإصابة به، ولكن يمكنك اتباع الإجراءات الوقائية لتخفيف خطر الإصابة به، ومن أهم الخطوات التي يتوجب عليك اتباعها هي المحافظة على صحتك بتناول الطعام الصحي والمحافظة على لياقتك، وزيارة الطبيب بشكل منتظم. يوصي الأطباء بأن يجري الرجال الذين بلغوا منتصف العمر فحصًا أصبعيًا سنويًا للمستقيم لاكتشاف أي سرطان في البروستاتا قبل أن يتسبب في حدوث أي أعراض. كما يوصي العديد من الأطباء أيضًا بإجراء فحص سنوي لمستضد البروستاتا النوعي، الذي يتيح كشف الأورام الصغيرة، قبل أن يصبح تحسسها ممكنًا. ويخشى بعض الأطباء من أن يؤدي فحص مستضد البروستاتا النوعي إلى الكشف عن بعض أنواع السرطان البطيئة النمو، التي لن يقدر لها مطلقًا أن تصبح مهددة لحياة المريض. وعلاج مثل هذه الأنواع من السرطان قد يعرض المرضى لمخاطر الجراحة أو الإجراءات العلاجية الأخرى غير الضرورية. ولكن ليس في مقدور الأطباء حتى الآن التنبؤ بشأن أي أنواع الأورام ستكون مهددة للحياة.
التصنيف المرحلي
عند اكتشاف الإصابة بالمرض يتعين عندها على الأطباء تحديد مرحلته stage (أي مدى انتشاره). والتقييم الصحيح لمرحلة الإصابة بالغ الأهمية، إذ يعتمد عليه تقرير المعالجة المناسبة. وكثيرا ما تقدم لنا وسائل التشخيص المتوافرة صورة غير دقيقة عن مدى تقدم الورم، غير أن ظهور طرائق جديدة بدأ يساعد على حل هذه المعضلة الجدية.
وتتجلى فائدة هذه الطرائق عندما تكون العلاقة بين المرحلة والمعالجة واضحة لا لبس فيها. ومن أشيع أنظمة التصنيف المرحلي لهذا المرض ما يدعى بالتصنيف TNM. فالورم البدئي (tumor: T) يقسم بحسب هذا النظام إلى أربع مراحل (تنقسم بدورها إلى مراحل فرعية). وعموما تعني المرحلة T1 أن الورم لايزال مكرويا (مجهريا) ولا يمكن جسه بفحص المستقيم. أما المرحلة T2 فتعني أن الورم مجسوس ومتوضع بكلّيته ضمن الغدة. وأما سرطانات المرحلة T3 فتكون قد تجاوزت الغدة إلى الأنسجة الضامة المحيطة أو قامت بغزو الحويصلات المنوية seminal vesicles (البنى الخازنة للمني) المحيطة بالغدة. وأما الأورام في المرحلة T4 فتكون ممتدة إلى أبعد من ذلك.
كما يتيح هذا النظام تحديد ما إذا كان المرض قد انتقل إلى العقد اللمفاوية الحوضية (node: N) أو إلى أبعد من ذلك (metastases: M). والنقائل عبارة عن أورام نتجت من انفلات خلايا سرطانية من الورم الأصلي لتنتقل عبر الدورة الدموية أو اللمفاوية إلى مواقع بعيدة وتباشر الانقسام فيها.
كقاعدة عامة فإن الورم المحدود بغدة الپروستاتا (4)، أي في المرحلتين T1 و T2، يكون قابلا للشفاء بعملية استئصال الپروستاتا prostatectomy (جراحة تجرى لاستئصال الپروستاتة ، وهي عضو غير أساسي). كما يمكن شفاء ورم كهذا بالإشعاع الموضعي local radiation لتدمير الورم أو بإشراك المعالجة الجراحية أو الإشعاعية بالمعالجة الهرمونية الجهازية(5) systemic hormonal therapy. تعتمد المعالجة الهرمونية على حقيقة أن الأندروجينات androgens ـ كالتستوستيرون وهرمونات الذكورة الأخرى ـ تُؤَجِّج نمو أورام الپروستاتة . تهدف هذه المعالجة إلى منع الجسم من إنتاج الأندروجينات أو إلى إحصار block تأثيرها في خلايا الپروستاتة ، أو كليهما معا. غالبا ما تموت الخلايا السرطانية في الپروستاتة بغياب التنشيط الإندروجيني. وهكذا فإن المعالجة الهرمونية تساعد على انكماش الأورام وتدمير الخلايا السرطانية التي لم تَطَلْها المعالجات الأخرى، مع أنه من المستبعد أن تكون هذه المعالجة كافية وحدها للقضاء على سرطانات الپروستاتلالتي تجاوزت المرحلة المكروية.
العلاج
يعالج الأطباء في الغالب السرطان الذي يبقى محصورًا في البروستاتا باستخدام العلاج الإشعاعي أو الاستئصال الجراحي للغدة. وكلا العلاجين قد يؤثران على قدرة الرجل على ممارسة العلاقات الجنسية، أو قد يسببان سلس البول (عدم القدرة على ضبط البول). وقد طور الجراحون عملية جراحية قد تتيح الفرصة لتجنب المشاكل الجنسية عن طريق المحافظة على الأعصاب المهمة للأداء الجنسي. ويعمل الأطباء، بإذن الله، على إطالة حياة المرضى الذين انتشر السرطان لديهم إلى خارج غدة البروستاتا عن طريق إعطائهم علاجات تقلل من مستويات هورمونات الذكورة؛ حيث تحتاج خلايا سرطان البروستاتا إلى هورمونات الذكورة لكي تعيش وتنمو. هناك أكثر من طريقة واحدة لعلاج سرطان البروستاتي، ولبعض المرضى قد يكون علاجهم بمجموعة من العلاجات مثل القيام بعملية جراحية يليها الإشعاع أو إشعاع مع علاج بالهرمون جيدا جدا، ويعتمد العلاج الأفضل لكل رجل على عدة عوامل تشمل: مدى سرعة نمو السرطان، ومدى انتشاره، والعمر، بالإضافة إلى الآثار الجانبية الناتجة عن العلاج.
ومن أكثر العلاجات شيوعا ما يلي:
الإشعاع
يمكن للمريض أن يخضع للعلاج الإشعاعي من خلال الأشعة الخارجية أو زرع أنسجة ذات نشاط إشعاعي.
العلاج الهرموني
عندما يصاب الشخص بسرطان البروستاتا، فمن الممكن أن تحث الهرمونات الذكرية نمو الخلايا السرطانية، ومن هذه الهرمونات الذكرية الرئيسية الهرمون الذكري التستوستيرون، لذا يكون العلاج الهرموني إما باستخدام الأدوية لإيقاف الجسم عن إنتاج الهرمونات الجنسية الذكرية أو القيام بعملية جراحية لإزالة الخصيتين اللتين تنتجان هذا الهرمون، وهذا النوع من العلاج يمنع الهرمونات من الوصول إلى الخلايا السرطانية.
العلاج الجراحي
لا تزال الجراحة هي حجر الأساس في معالجة الآفات السرطانية المحدودة بالغدة لأنها حققت أعلى معدلات البُقْيا في الدراسات الطويلة الأمد. ومع ذلك ـ كما سنرى لاحقا ـ فإن المعالجات الإشعاعية المتطورة والطرائق الحديثة الأخرى تبشر بالوصول إلى معدلات نجاح مماثلة للجراحة في الكثير من الحالات.
عندما يجتاز الورم السطحَ الخارجي للغدة (في المرحلتين T3 و T4)، يصبح الاستئصال الجراحي للغدة غير كافٍ للتخلص من الورم بمجمله. عندها تكون المعالجة الإشعاعية هي المختارة، مع إمكانية مشاركتها بالمعالجة الهرمونية. وفي الواقع فإن عددا من هذه الأورام المتقدمة (المستفحلة) يكون قابلا للشفاء، ولكن احتمالات الشفاء تكون أقل بكثير من الأورام المحدودة بالغدة. تنخفض احتمالات الشفاء لأن هذه الأورام غالبا ما تكون كبيرة الحجم؛ وكثيرا ما تقاوم الأورامُ الكبيرة تأثير الأشعة والأدوية. كما أن الكثير من هذه الأورام يشخص بعد أن يكون قد أعطى نقائل مكروية صعبة الكشف.
الإستئصال الجذرى للبروستاتا
يتم بهذه الطريقة علاج سرطان البروستاتي بإزالة غدة البروستاته المصابة بالسرطان جراحيا، حيث يستخدم الجراح تقنيات خاصة لإزالة البروستاته والعقد الليمفاوية تماما وفي الوقت ذاته المحافظة على العضلات والأعصاب التي تسيطر على التبول والوظيفة الجنسية.
العلاج الكيميائي
تستخدم هذه الطريقة المواد الكيميائية للقضاء على الخلايا ذات النمو السريع، وقد تكون هذه الطريقة فعالة جدًا في معالجة سرطان البروستاتي، ولكنها لا تشفي المريض منه.
المعالجة بالتبريد
تستخدم هذه الطريقة للقضاء على الخلايا عن طريق تبريد الأنسجة.
الانتشار
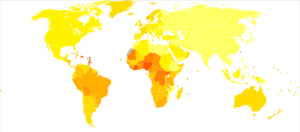
Prostate cancer is the second-most frequently diagnosed cancer in men, and the second-most frequent cause of cancer death in men (after lung cancer).[2][18] Around 1.2 million new cases of prostate cancer are diagnosed each year, and 350,000 men die of the disease.[2] One in eight men are diagnosed with prostate cancer in their lifetime, and around one in forty die of the disease.[18] Rates of prostate cancer rise with age. Due to this, prostate cancer rates are generally higher in parts of the world with higher life expectancy, which also tend to be areas with higher gross domestic product and higher human development index.[2] Australia, Europe, North America, New Zealand, and parts of South America have the highest incidence. South Asia, Central Asia, and sub-Saharan Africa have the lowest incidence of prostate cancer; though incidence is increasing in these regions at among the fastest rates in the world.[2] Prostate cancer is the most diagnosed cancer in men in over half of the world's countries, and the leading cause of cancer death in men in around a quarter of countries.[19]
Prostate cancer is rare in those under 40 years old.[20] The overwhelming majority of cases are diagnosed in those over 60 years,[2] with the average person diagnosed at 67.[21] The average person who dies from prostate cancer is 77.[21] Only a minority of prostate cancer cases are ever diagnosed. Autopsies of men who died at various ages have shown cancer in the prostates of over 40% of men over age 50. Incidence rises with age, and nearly 70% of men autopsied at age 80–89 had cancer in their prostates.[22]
الوراثة
Prostate cancer is more common in some families. Men with an affected first-degree relative (father or brother) have more than twice the risk of developing prostate cancer, and those with two first-degree relatives have a five-fold greater risk compared with men with no family history.[23] Increased risk also runs in some ethnic groups, with men of African and African-Caribbean ancestry at particularly high risk – having prostate cancer at higher rates, and having more-aggressive prostate cancers that develop at earlier ages.[24] Large genome-wide association studies have identified over 100 gene variants associated with increased prostate cancer risk.[25] The greatest risk increase is associated with variations in BRCA2 (up to an eight-fold increased risk) and HOXB13 (three-fold increased risk), both of which are involved in repairing DNA damage.[25] Variants in other genes involved in DNA damage repair have also been associated with an increased risk of developing prostate cancer – particularly early-onset prostate cancer – including BRCA1, ATM, NBS1, MSH2, MSH6, PMS2, CHEK2, RAD51D, and PALB2.[25] Additionally, variants in the genome near the oncogene MYC are associated with increased risk.[25] As are single-nucleotide polymorphisms in the vitamin D receptor common in African-Americans, and in the androgen receptor, CYP3A4, and CYP17 involved in testosterone synthesis and signaling.[23] Together known gene variants are estimated to cause around 25% of prostate cancer cases, including 40% of early-onset prostate cancers.[23]
الجسد ونمط الحياة
Men who are taller are at a slightly increased risk for developing prostate cancer, as are men who are obese.[26] High levels of blood cholesterol are also associated with increased prostate cancer risk; consequently, those who take the cholesterol-lowering drugs, statins, have a reduced risk of advanced prostate cancer.[27] Chronic inflammation can cause various cancers. Potential links between infection (or other sources of inflammation) and prostate cancer have been studied but none definitively found, with one large study finding no link between prostate cancer and a history of gonorrhea, syphilis, chlamydia, or infection with various human papillomaviruses.[28]
Regular vigorous exercise may reduce one's chance of developing advanced prostate cancer, as can several dietary interventions.[29] Those with a diet rich in cruciferous vegetables, fish, genistein, or lycopene (found in tomatoes) are at a reduced risk of symptomatic prostate cancer.[23][30] Conversely, those who consume high levels of dietary fats, polycyclic aromatic hydrocarbons (from cooking red meats), or calcium may be at an increased risk of developing advanced prostate cancer.[23][31] Several dietary supplements have been studied and found not to impact prostate cancer risk, including selenium, vitamin C, vitamin D, and vitamin E.[32][31]
التاريخ
.[33] الإستئصال الجراحى للخصيتين (orchiectomy) لعلاج سرطان البروستاتا أجرى أول مرة عام 1890, لكن بنجاح محدود. Transurethral resection of the prostate (TURP) تم إحلاله بالإستئصال الجذرى للبروستاتا للتخلص من أعراض الإنسداد لمجرى البول في منتصف القرن العشرين, لإن هذا يمكن أن يحافظ على بقاء القدرة على الإنتصاب . Radical retropubic prostatectomy أبتكر عام1983 بواسطة باتريك والش.[34] هذا التطور الجراحى قد جعل من الممكن إزالة البروستاتا والغدد الليمفاوية مع الإبقاء على كامل القدرة الجنسية . فى 1941 Charles B. Huggins نشر دراسات حول إستعمال الإستروجين لكى يضاد فعل أو وقف إنتاج التستستيرون مع سرطان البروستاتا المنتشر(Metastatic). هذا الإبتكار يدعى" الخصى الكيميائى " won Huggins عام 1966 جائزة نوبل في ظائف الأعضاء و الطب .[35] دور الهورمونات GnRH في عملية التكاثر Andrzej W. Schally و Roger Guillemin , الذين إقتسما جائزة نوبل في الطب أو وظائف الأعضاء 1977 لهذا العمل . مضادات المستقبلات , مثل leuprolide و goserelin, تم أنتاجها وإستعمالها لعلاج سرطان البروستاتا .[36][37]
Radiation therapy for prostate cancer was used occasionally in the early 20th century, with radium implanted into the urethra or rectum to reduce the tumor size and associated symptoms.[38] In the 1950s the advent of more powerful radiation machines allowed for external beam radiotherapy to reach the prostate. By the 1960s, this was often combined with hormone therapy to improve the potency of therapy.[38] In the 1970s, Willet Whitmore pioneered an open surgery technique where needles of Iodine-125 were placed directly into the prostate. This was improved upon by Henrik H. Holm in 1983 by using transcrectal ultrasound to guide the implantation of radioactive material.[38]
The observation that the testicles (and the hormones they secrete) influence prostate size was made as early as the late 18th century via castration experiments in animals. However, occasional experimentation over the next century bore mixed results, likely due to the inability to separate prostate tumors from prostates enlarged due to benign prostatic hyperplasia. In 1941, Charles B. Huggins and Clarence V. Hodges published two studies using surgical castration or oral estrogen to reduce androgen levels and improve prostate cancer symptoms. Huggins was awarded the 1966 Nobel Prize in Physiology or Medicine for this discovery, the first systemic therapy for prostate cancer.[39][40] In the 1960s, large studies showed estrogen therapy to be as effective as surgical castration at treating prostate cancer, but that those on estrogen therapy were at increased risk of suffering blood clots.[39] Through the 1980s, Andrzej W. Schally's studies of GnRH led to the development of GnRH agonists, which were found to be as effective as estrogen without the increased risk of clotting.[39][41] Schally was awarded the 1977 Nobel Prize in Physiology or Medicine for his work on GnRH and prostate cancer.[39]
Systemic chemotherapy for prostate cancer has been studied since the 1950s, with clinical trials failing to show benefits in most people who receive the drug.[42] In 1996, the US Food and Drug Administration approved the systemic chemotherapy mitoxantrone for those with castration-resistant prostate cancer based on trials showing that it improved symptoms even though it failed to enhance survival.[43] In 2004, docetaxel was approved as the first chemotherapy to increase survival in those with castration-resistant prostate cancer.[43] After additional trials in 2015, docetaxel use was extended to those with castration-sensitive prostate cancer.[44]
Jonathan Simons and his laboratories at Johns Hopkins and Emory made original contributions in the molecular biology of cytokines in human prostate cancer metastasis, and in the molecular pharmacology and genetic therapy of metastatic prostate cancer.
المجتمع والثقافة
Prostate cancer screening and awareness have been widely promoted since the early 2000s by Prostate Cancer Awareness Month in September and Movember in November.[45] Analyses of internet searches and social media posts suggest neither event changes the level of prostate cancer interest or discussion, in contrast to the more established Breast Cancer Awareness Month.[45][46] A light blue ribbon is used to promote prostate cancer awareness.
الأبحاث
Prostate cancer is a major topic of ongoing research, with the U.S. National Cancer Institute (NCI, the world's largest funder of cancer research) spending $209 million on prostate cancer research in 2020 – the sixth highest among cancer types.[47] Despite high gross spending, prostate cancer research funding is relatively low for the number of deaths it causes. The NCI spends around $5,700 per prostate cancer death, considerably lower than for brain cancer ($21,000 per death), breast cancer ($13,000 per death) or cancer as a whole ($11,000 per death).[48] A similar trend holds for private nonprofit organizations. Annual revenues of prostate cancer-focused nonprofits rank sixth among cancer types, but prostate cancer nonprofits have lower revenue than would be expected for the number of cases, deaths, and potential years of life lost.[49]
Research into prostate cancer relies on a number of laboratory models to test aspects of the disease. Several prostate immortalized cell lines are widely used, namely the classic lines DU145, PC-3, and LNCaP, as well as more recent cell lines 22Rv1, LAPC-4, VCaP, and MDA-PCa-2a and −2b.[50] Research requiring more complex models of the prostate uses organoids – clusters of prostate cells that can be grown from human prostate tumors or stem cells.[51] Modeling tumor growth and metastasis requires a model organism, typically a mouse. Researchers can either surgically implant human prostate tumors into immunocompromised mice (a technique called a patient derived xenograft),[52] or can induce prostate tumors in mice either with chemical exposure or genetic engineering.[53] These genetically engineered mouse models typically use a Cre recombinase system to disrupt tumor suppressors or activate oncogenes specifically in prostate cells.[54]
المصادر
- ^ "Survival Rates for Prostate Cancer". American Cancer Society. 1 March 2023. Retrieved 12 July 2023.
- ^ أ ب ت ث ج ح خ Rebello et al. 2021, "Epidemiology".
- ^ Aumüller, G. (1979). غدة البروستات والحويصلات المنوية. Springer-Verlag.
{{cite book}}: Unknown parameter|تقع=ignored (help) - ^ Moore, K. (1999). Clinically Oriented التتشريح. بالتيمور, ماريلاند: Lippincott Williams & Wilkins.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Steive, H. (1930). "Männliche Genitalorgane". Handbuch der mikroskopischen Anatomie des Menschen. Vol. VII Part 2. Berlin: Springer. pp. 1–399.
- ^ صحتنا
- ^ "Tests to Diagnose and Stage Prostate Cancer". American Cancer Society. 21 February 2023. Retrieved 18 May 2023.
- ^ أ ب ت ث Rebello et al. 2021, "Diagnosis".
- ^ Scher & Eastham 2022, "Physical Examination".
- ^ Scher & Eastham 2022, "Prostate Biopsy".
- ^ أ ب ت ث Scher & Eastham 2022, "Pathology".
- ^ أ ب Scher & Eastham 2022, "Prostate Cancer Staging".
- ^ أ ب "Prostate Cancer Staging". American Cancer Society. 8 October 2021. Retrieved 14 May 2023.
- ^ أ ب ت Scher & Eastham 2022, "Table 87-1 TNM Classification".
- ^ "Prostate cancer: diagnosis and management. NICE guideline [NG131]". National Institute for Health and Care Excellence (NICE). 9 May 2019. Retrieved 3 October 2022.
- ^ "Prostate cancer risk groups and the Cambridge Prognostic Group (CPG)". Cancer Research UK. 24 May 2022. Retrieved 25 June 2023.
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. Retrieved Nov. 11, 2009.
{{cite web}}: Check date values in:|accessdate=(help) - ^ أ ب Scher & Eastham 2022, "Prostate Cancer".
- ^ Bergengren et al. 2023, "3.1 Epidemiology".
- ^ Pernar et al. 2018, "Risk Factors for Total Prostate Cancer".
- ^ أ ب Stephenson, Abouassaly & Klein 2021, "Age at Diagnosis".
- ^ Dall'Era 2023, "General Considerations".
- ^ أ ب ت ث ج Scher & Eastham 2022, "Epidemiology".
- ^ McHugh et al. 2022, "Introduction".
- ^ أ ب ت ث Rebello et al. 2021, "Genetic Predisposition".
- ^ Pernar et al. 2018, "Risk Factors for Advanced and Fatal Prostate Cancer".
- ^ Pernar et al. 2018, "Statins".
- ^ Stephenson, Abouassaly & Klein 2021, "Inflammation and Infection".
- ^ Pernar et al. 2018, "Exercise".
- ^ Pernar et al. 2018, "Fish".
- ^ أ ب Pernar et al. 2018, "Calcium, Dairy Products, and Vitamin D".
- ^ Scher & Eastham 2022, "No Cancer Diagnosis".
- ^ Young, H. H. أربعة حالات للإستئصال الكامل للبروستاتا. جونز هوبكنز بول. 16, 315 (1905).
- ^ والش, P. C., Lepor, H. & Eggleston, J. C. الإستئصال الكلى للبروستاتا مع الإبقاء على كامل القدرةالجنسية , لعوامل تشريحية و مرضية: . Prostate 4, 473-485 (1983). PMID 6889192
- ^ Huggins, C. B. & Hodges, C. V. دراسات حول سرطان البروستاتا: 1. تأثيرات الخصى, بواسطة الإستيروجينات والأندروجينات بطريق الحقن serum phosphatases في metastatic carcinoma لغدة البروستاتا. Cancer Res. 1, 203 (1941).
- ^ Schally, A. V., Kastin, A. J. & Arimura, A. Hypothalamic FSH and LH-r الهورمونات المنظمة. التكوين,ووظائف الأعضاء, والدراسات السريرية . Fertil. Steril. 22, 703–721 (1971).
- ^ Tolis G, Ackman D, Stellos A, Mehta A, Labrie F, Fazekas AT, Comaru-Schally AM, Schally AV. Tumor إخماد نمو الورم, في المرضى بسرطان البروستاتا و علاجهم بالهورمونات الأنثوية و منشطات إفراز الهورمونات-. Proc Natl Acad Sci U S A. 1982 Mar;79(5):1658–62 PMID 6461861
- ^ أ ب ت Denmeade & Isaacs 2002, "Radiation therapy".
- ^ أ ب ت ث Denmeade & Isaacs 2002, "Androgen-ablation therapy".
- ^ Huggins CB, Hodges CV (1941). "Studies on prostate cancer: 1. The effects of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate". Cancer Res. 1 (4): 293. Archived from the original on 30 June 2017. Retrieved 2 September 2015.
- ^ Tolis G, Ackman D, Stellos A, Mehta A, Labrie F, Fazekas AT, et al. (March 1982). "Tumor growth inhibition in patients with prostatic carcinoma treated with luteinizing hormone-releasing hormone agonists". Proceedings of the National Academy of Sciences of the United States of America. 79 (5): 1658–1662. Bibcode:1982PNAS...79.1658T. doi:10.1073/pnas.79.5.1658. PMC 346035. PMID 6461861.
- ^ Denmeade & Isaacs 2002, "Cytotoxic chemotherapy".
- ^ أ ب Desai, McManus & Sharifi 2021, "Evolution of Treatment".
- ^ Teo, Rathkopf & Kantoff 2019, "Figure 1".
- ^ أ ب Patel et al. 2020, p. 64.
- ^ Johnson et al. 2021, "Abstract".
- ^ "Funding for Research Areas". National Cancer Institute. 10 May 2022. Retrieved 12 July 2023.
- ^ "Estimates of Funding for Various Research, Condition, and Disease Categories (RCDC)". US National Institutes of Health. 31 March 2023. Retrieved 12 July 2023.
- ^ Kamath, Kircher & Benson 2019, "Results".
- ^ Mai et al. 2022, 2.1 Human prostate cancer cell lines.
- ^ Mai et al. 2022, 2.4. Organoids.
- ^ Mai et al. 2022, 2.2 PDX lines.
- ^ Mai et al. 2022, 2.3 Genetically engineered mouse model (GEMM).
- ^ Ittmann et al. 2013, "Introduction".
وصلات الخارجية
- Prostate UK Help us stop prostate diseases ruining lives
- Prostate Cancer & Endothelin: PMAP The Proteolysis Map-animation
- سرطان البروستاتا at the Open Directory Project
- Interactive Health Tutorials Medline Plus: What's Prostate Cancer Using animated graphics and you can also listen to the tutorial
- المصدر 1 en.wikipedia
- المصدر 2 مجلة العلوم الأميريكية