تنگستن
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض رمادي، لامع
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | التنگستن, W, 74 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| النطق | /ˈtʌŋstən/ TUNG-stən; /ˈwʊlfrəm/ WUUL-frəm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقاليا | |||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 6, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الوزن الذري القياسي | 183.84 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [Xe] 4f14 5d4 6s2[1] 2, 8, 18, 32, 12, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| التاريخ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاكتشاف | توربرن برگمان (1781) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| أول عزل | خوان خوسيه إلهويار وفاوستو إلهويار (1783) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الطبيعية | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 19.25 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 17.6 گ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 3695 ك, 3422 °C, 6192 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 5828 ك, 5555 °س, 10031 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||
| النقطة الحرجة | 13892 ك، مپا | |||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 35.3 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 806.7 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية المولية | 24.27 ج·مول−1·ك−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| حالات الأكسدة | 6, 5, 4, 3, 2, 1, 0, −1, −2 (mildly acidic oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| سالبية كهربية | 2.36 (مقياس پولنگ) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأولى: 770 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الثانية: 1700 كج·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري | 139 پم | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 162±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| متفرقات | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | body-centered cubic | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | paramagnetic[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| المقاومية الكهربائية | (20 °C) 52.8 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ناقلية حرارية | 173 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | (25 °س) 4.5 µm·م−1·ك−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل ينگ | 411 گپا | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 161 گپا | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 310 گپا | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة پواسون | 0.28 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 7.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة ڤيكرز | 3430 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 2570 مپا | |||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم تسجيل كاس | 7440-33-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| أكثر النظائر استقراراً | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر التنگستن | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
تنگستن Tungsten عنصر كيميائي يرمز له باللاتينية بالرمز W ،اكتشفه الكيميائي السويدي كارل شيل في عام 1871، وهو عنصر حرارى مهم ويستخدم في صناعة الاسلاك المتوهجة في المصابيح الكهربائية.
العنصر الحر is remarkable for its robustness, especially the fact that it has the highest melting point of all the elements discovered except carbon (which sublimes at normal pressure), melting at 3,422 °C (6,192 °F; 3,695 K). It also has the highest boiling point, at 5,930 °C (10,710 °F; 6,200 K).[3] Its density is 19.25 grams per cubic centimetre,[4] comparable with that of uranium and gold, and much higher (about 1.7 times) than that of lead.[5] Polycrystalline tungsten is an intrinsically brittle[6][7] and hard material (under standard conditions, when uncombined), making it difficult to work. However, pure single-crystalline tungsten is more ductile and can be cut with a hard-steel hacksaw.[8]
Tungsten occurs in many alloys, which have numerous applications, including incandescent light bulb filaments, X-ray tubes, electrodes in gas tungsten arc welding, superalloys, and radiation shielding. Tungsten's hardness and high density make it suitable for military applications in penetrating projectiles. Tungsten compounds are often used as industrial catalysts.
Tungsten is the only metal in the third transition series that is known to occur in biomolecules, being found in a few species of bacteria and archaea. However, tungsten interferes with molybdenum and copper metabolism and is somewhat toxic to most forms of animal life.[9][10]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ والتسمية
اكتشف التنگستن سنة 1781 على يد الكيميائى السويدى كارل ڤيلهلم شيله (Karl Wilhelm Scheele.) . ويطلق عليه هذا الاسم في البلاد الأنگلوسكسونية واللاتينية، في حين يدعى في ألمانية وفي الدول السلافية ـ وُلْفرام Wolfram ومنها أتى رمزه الكيميائي W؛ وكلمة تنغستن من أصل سويدي مشتقة من كلمتي tung ومعناها ثقيل وsten ومعناها حجر. وقد كان الإنتاج العالمي للتنگستن عام 1982 في حدود 45 ألف طن، وازداد ازدياداً كبيراً مع تنوع تطبيقاته فوصل إلى ما يزيد على 600 ألف طن سنوياً، ثم تراجع الإنتاج وأخذ يتذبذب مع الأسعار ووفرته في المناجم المختلفة ومع إمكان إعادة تدويره. وأهم الدول المنتجة له هي الصين وروسيا والولايات المتحدة وكندا وكوريا وأمريكا الجنوبية.
الخصائص
التنگستن أكثر الفلزات الحرارية توافراً وله أعلى نقطة انصهار من بينها جميعا وهى 3410 ْم. وهو معدن لونه أبيض فضي، رمزه W ووزنه الذري (183.75) وعدده الذري (74). قيمه الاتحادية هي (2، 3، 4، 5، 6) وكثافته (19.3). وهو معدن قاسٍ جداً ومتحمل جداً للحرارة، ينصهر بدرجة 3380ْس ويغلي بدرجة 5700ْس تقريباً، ويحافظ على قساوته ومتانته في درجات الحرارة العالية (حتى الدرجة 2000 تقريباً). وهو ثابت في الهواء الجاف بالدرجة العادية من الحرارة ويتحول إلى ثالث أكسيد التنغستن WO3 في الدرجة الحمراء. وهو لا يتأثر بالماء إلا أنه يتأكسد بالبخار متحولاً إلى ثنائي أكسيد التنگستن WO2. ولا يتأثر من الحموض إلا أن سطحه فقط يتأثر من حمض الآزوت ومن الماء الملكي. ينحل ببطء في البوتاس المصهور، وينحل في مزيج منصهر من نترات الصوديوم والصود الكاوي. يؤثر فيه الفلور في الدرجة العادية من الحرارة، أما الكلور فيؤثر فيه بدرجة 250ْ-300ْس فيحوله إلى سداسي كلوريد التنگستن إذا كان الجو خالياً من الهواء أو إلى أوكسي كلوريد التنغستن بوجود الهواء.
الإستخدامات
وفتائل أسلاكه تستخدم في الغالبية العظمى من المصابيح الكهربائية المتوهجة العادية ويشيع استخدامها كذلك في إضاءة المصانع كإلكترودات في لمبات القوس الكهربى، ويستخدم أيضا في معدات لحام القوس بالتنگستن و الغاز الخامل (TIG or GTAW) كإلكترود معمّر يقاوم الانصهار. أما الاستخدام الأكثر شيوعا للتنگستن فهو مركب كربيد التنگستن الداخل في صناعة لقم الثقب والتشغيل وعدد القطع. ويجد كذلك استخدامات كمزلق و مقاوم الأكسدة في البطانات والفوهات لمقاومة البرى وكطلاء واقى وغير ذلك من طرق الاستخدام، ويوجد التنگستن كذلك في أحبار الطباعة و شاشات الأشعة السينية وكيماويات التصوير وفى تجهيز المنتجات البترولية واختبار مقاومة اللهب للمنسوجات. ويستخدم أيضا لمقاومتة وكثافته العاليتين في تطبيقات تتراوح بين ثقالات في دوارات الطائرات المروحية وكقذائف الأسلحة وبين رؤوس مضارب الجولف.
النظائر
 مقالة مفصلة: نظائر التنگستن
مقالة مفصلة: نظائر التنگستن
مركباته
للالتنگستن ثلاثة أكاسيد هي ثنائي أكسيد التنگستن WO2 ويحضر بإرجاع ثالث أكسيد التنگستن بالهدروجين، وأكسيد التنگستن الأزرق W2O3 وثلاثي أكسيد التنگستن WO3 وهو أهم أكاسيده، وهو مسحوق أصفر لا ينحل في الماء وينحل في القلويات مكوّناً التنگستات.[11]
ومن مركبات التنگستن أيضاً حمض التنگستيك WO4H2 وهو مسحوق أصفر أو أخضر مصفر، غير ذواب في الماء، وينحل ببطء في محاليل القلويات. ومن مركباته أيضاً تنگستات الصوديوم Na2WO4, 2H2O وهو مسحوق أبيض ينحل في الماء ولا ينحل في الغول ويستعمل لتحضير النسج التي لا تحترق والتي لا ينفذ منها الماء.
تحضيره
إن المصدرين الرئيسيين اللذين يعوَّل عليهما في تحضير التنغستن هما الشيليت والولفراميت، ويحضر التنگستن منهما بطرائق متعددة منها أن يسخن الفلز مع كربونات الصوديوم ثم تستخلص تنگستات الصوديوم الناتجة بالماء وترسب بعد ذلك بإضافة كلور الكلسيوم بحالة تنغستات الكلسيوم وهذه الأخيرة تعالج بحمض كلور الماء فينفصل أكسيد التنگستن WO3 الذي يرجع بالهدروجين بدرجة حرارة 1200ْس.
الانتاج والتواجد
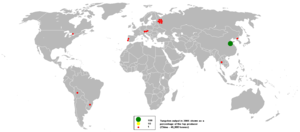
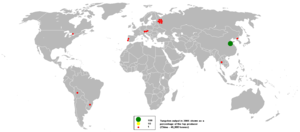
| يتواجد التنگستن في المعادن ولفراميت (تنگستات الحديد-المنگنيز, FeWO4/MnWO4), شيليت (تنگستات الكالسيوم, CaWO4), فربريت و هوبنريت. وتوجد الرواسب الرئيسية لهذه المعادن في الصين (التي تملك 57% من احتياطيات العالم), روسيا, النمسا والبرتغال, حسب المسح الجيولوجي البريطاني. الفلز يتم انتاجه تجارياً باختزال اكسيد التنگستن باستخدام الهيدروجين أو الكربون.
احتياطات العالم من التنگستن تـُقدر بنحو 7 مليون طن (وزن). |
التطبيقات


المواد الصلبة
السبائك
التسلح
التطبيقات الكيميائية
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
استخدامات متخصصة
الالكترونيات
الاحتياطات
يقاوم التنگستن معدن المولبدينيوم استنشاق هذا المعدن يسبب استثارة للرئة والغشاء المخاطى. استثارة العين يسفر عنها احمرار ودموع.التهاب الجلد: الاحمرار والهرش ووجود الندبات.التعرض المتكرر أو على المدى الطويل: لا يوجد هناك ما يفيد تدهور أياً من الحالات الطبية المرضية. لا توجد هناك أية نتائج تشير إلى حدوث تسمم التنجستين من الأطعمة.[12]
مزاعم ببراءة الإختراع
انظر أيضاً
- Field emission gun
- أكسيد التنگستن
- List of chemical elements name etymologies
- List of chemical elements naming controversies
المصادر
- ^ Why does Tungsten not 'Kick' up an electron from the s sublevel ?. Retrieved on 2008-06-15.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Zhang Y; Evans JRG and Zhang S (January 2011). "Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks". J. Chem. Eng. Data. 56 (2): 328–337. doi:10.1021/je1011086.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ "This Chinese Company Proudly Sells Tungsten-Filled Gold Bars". Business Insider. 2012.
- ^ Daintith, John (2005). Facts on File Dictionary of Chemistry (4th ed.). New York: Checkmark Books. ISBN 978-0-8160-5649-1.
- ^ Lassner, Erik; Schubert, Wolf-Dieter (1999). "low temperature brittleness". Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. Springer. pp. 20–21. ISBN 978-0-306-45053-2.
- ^ Gludovatz, B.; Wurster, S.; Weingärtner, T.; Hoffmann, A.; Pippan, R. (2011). "Influence of impurities on the fracture behavior of tungsten". Philosophical Magazine (Submitted manuscript). 91 (22): 3006–3020. Bibcode:2011PMag...91.3006G. doi:10.1080/14786435.2011.558861. S2CID 137145004.
- ^ Stwertka, Albert (2002). A Guide to the elements (2nd ed.). New York: Oxford University Press. ISBN 978-0-19-515026-1.
- ^ McMaster, J. & Enemark, John H. (1998). "The active sites of molybdenum- and tungsten-containing enzymes". Current Opinion in Chemical Biology. 2 (2): 201–207. doi:10.1016/S1367-5931(98)80061-6. PMID 9667924.
- ^ Hille, Russ (2002). "Molybdenum and tungsten in biology". Trends in Biochemical Sciences. 27 (7): 360–367. doi:10.1016/S0968-0004(02)02107-2. PMID 12114025.
- ^ راتب محملجي. "التنغستِن". الموسوعة العربية.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو