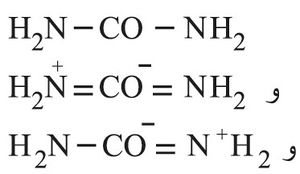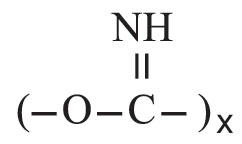يوريا
| |||
|
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| أسماء أخرى
Carbamide, carbonyl diamide, carbonyldiamine, diaminomethanal, diaminomethanone
| |||
| Identifiers | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.286 | ||
| E number | E927b (glazing agents, ...) | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| InChI | InChI={{{value}}} | ||
| SMILES | |||
| الخصائص | |||
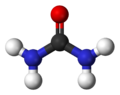
| الصيغة الجزيئية | CH4N2O | ||
| كتلة مولية | 60.05 g mol-1 | ||
| المظهر | White solid | ||
| الكثافة | 1.32 g/cm3 | ||
| نقطة الانصهار | |||
| قابلية الذوبان في الماء | 107.9 g/100 ml (20 °C) 167 g/100ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) | ||
| قابلية الذوبان | 50g/L ethanol, 500g/L glycerol [1] | ||
| القاعدية (pKb) | pKBH+ = 0.18[2] | ||
| البنية | |||
| Dipole moment | 4.56 D | ||
| المخاطر | |||
| نقطة الوميض | Non-flammable | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
8500 mg/kg (oral, rat) | ||
| مركبات ذا علاقة | |||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
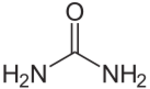
اليوريا إنگليزية: Urea أو المادّة البولية هي مركب عضوي بالصيغة الكيميائية CO(NH2)2. تعرف اليوريا أيضًا باسم الكارباميد، الموصى به في الأسماء الغير إحتكارية العالمية والمستخدم في أوروبا. كمثال: المركب الطبي هيدروكسي-يوريا (هيدروكسي يوريا) (الاسم المصدق عليه قديمًا في إنجلترا) أصبح الآن هيدروكسي كارباميد. من الأسماء الأخرى راتنج الكارباميد إنگليزية: carbamide resin ، أيزويوريا، ثنائي أميد الكربونيل إنگليزية: carbonyl diamide، ثنائي أمين الكربونيل إنگليزية: carbonyldiamine.
هذه المادّة تنتج لدى الكثير من الحيوانات ، كمركّب نهائي لعمليّة استقلاب المركّبات الأزوتيّة (كالأحماض الأمينيّة مثلًا) في دورة اليورٍيا التي تحدث في الكبد ، وتُقصى من الجسم عن طريق البول. اليوريا الصافية هي مادّة بيضاء، كريستالّينيّة، رائحتها قريبة من رائحة الأمّونياك، غير سامّة وحتّى نظافيًّا غير ضارّة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
سماد اليوريا
يتبع سماد اليوريا مجموعة الإميدات ((NH2 وهو عبارة عن حبيبات لؤلؤية بيضاء يتراوح قطرها مابين 2-3 ملليمتر ذات كثافة منخفضة تحتوي على نسبة 46% من الآزوت وتركيبها الكيماوي CO(NH2)2 وهو السماد الآزوتي الأعلى تركيزاً ولقد انتشر استخدامه في الزراعة منذ وقت طويل لرخص سعر وحدة الآزوت فيها. إن سماد اليوريا يذوب بأكمله في التربة ويتحول بسرعة في التربة النشيطة بيولوجيا إلى آزوت امونياكي ثم إلى آزوت نتراتي صالح لامتصاص النبات.
تاريخ الإكتشاف
لقد كانت اليوريا أول مركّب عضوي ينتج اصطناعيًا من مواد بادئة لا عضوية، وذلك الذي أدى إلى هدم مبدأ الحياتية إنگليزية: vitalism أو „vis vitalis“ أي القوّة الحياتيّة باللغة اللاتينيّة.
إكتُشفت المادّة كمادّة بذاتها عام 1773 من قبل هيلار مارين رووٍيلّ Hilaire Rouelle. وفصلها الكيميائي الفرنسي بروست Joseph L.Proust نقية لأول مرة عام 1821 م . وأوّل من قام بتصنيعها كان فريدرٍش فوولر Friedrich Wöhler سنة 1828 عبر عمليّة تفاعل كيميائيّة بين سِيانات البوتاسّيوم وسُلفات الأمّونيوم؛ بهذه الطريقة مهّدت الطريق لفرع الكيمياء العضويّة، بعد إثباتها أنّ الموادّ العضوية ممكن أن تُنتج من أشياء وموادّ غير حيّة.
وكان لهذا الاصطناع أثر كبير على تطور الكيمياء العضوية المعاصرة إذ دحضت به نظرية القوة الحية في الكيمياء العضوية، أما اليوم فليس لهذا الاصطناع سوى الأهمية التاريخية. ويتم الحصول على البولة في الوقت الحاضر بالحلمهة للسياناميد:[3]
أو بتفاعل غاز ثنائي أكسيد الكربون مع محاليل النشادر المائية في الدرجة 200ْس وضغطٍ يعادل 375 ضغط جوي.
الخصائص
الخواص الفيزيائية
الكتلة الجزيئية للبولة 60.06. وهي تتبلور على شكل إبر معينية طويلة أو مواشير قصيرة لالون لها أو ضاربة إلى البياض، عديمة الرائحة وطعمها ملحي، تنصهر في الدرجة 132.7ْس من دون تفكك، تتصعد تحت ضغط منخفض في المجال 120ْ-130ْس من دون أن تتفكك. معلقها في الهواء بتركيز 500 غ/م3 لايتفجر. تذوب في الماء والغول، وتذوب في النشادر وأكسيد الكبريت SO2 السائلين، وهي قليلة الانحلال في الإتير الإتيلي ولا تنحل في الكلوروفورم وخلات الإتيل والفحوم الهدروجينية. تميل محاليلها المائية إلى فوق الإشباع.
الخواص الكيميائية
تعرف البولة بالكرباميد لأنها الأميد التام لحمض الكربون H2CO3. وتعد بنيتها الإلكترونية رنينياً (طنينياً) resonance بين الصيغ الثلاث
والصيغة الأولى أكثرها استعمالاً.
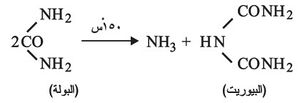
تؤثر الحرارة في البولة معطية نواتج مختلفة باختلاف درجاتها، فهي تحرر النشادر في الدرجة 150ْس معطية البيوريت biuret
ويفقد البيوريت جزيء نشادر جديداً إذا ماارتفعت درجة الحرارة أكثر من 150ْس ويتحول إلى حمض الايزوسيانيك H -N = C = O وثلاثي حمض السيانوريك (NCOH)3 ومتبلمره الخطي السياميليد Cyamelide
وتتفكك البولة جزئياً عند غلي محاليلها المائية، معطية النشادر وثنائي أكسيد الكربون، في حين يؤدي تسخين هذه المحاليل في أنبوب مختوم في الدرجة 180ْس إلى تفككها التام.
لا تتأثر البولة بالحموض والأسس الممددة، في حين تُثَبِّتُ العواملُ المميهةُ وبعضُ العضويات المجهرية كالمكورات البولية Micrococcus urea وبعضُ الأنزيمات (الأورياز) Ureaze، الموجودة في الكثير من الحبوب والعضويات، جُزيئَيْ ماء على البولة معطية كربونات الأمونيوم:
وهذا التفاعل هو سبب الرائحة النشادرية التي تنطلق عن البول بعد زمن من طرحه.
يفكك حمض الآزوتي HNO2 البولة إلى الآزوت وثنائي أكسيد الكربون والماء، ويمكن تقدير البولة كمياً بقياس حجم الآزوت المنطلق. أما مركبات هيبو الهالوجينات NaOX فتعطي، بحسب الشروط التجريبية، الآزوت أو الهدرازين.
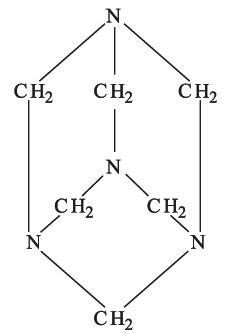
تتفاعل البولة المصهورة مع المعادن القلوية وأميداتها مكونة أملاح السياناميد. وتعطي مع الألكانات النظامية، التي تحوي ست ذرات كربون أو أكثر، ومع مشتقاتها مركبات إضافية بلورية. وتشكل البولة مع الأغوال الأوريتانات urethans، ويؤدي تفاعلها مع بعض الحموض الكربوكسيلية وبلاماءاتها وكلوريداتها وإستراتها إلى تكون الأورئيدات ureids، ومن أهمها مشتقات حمض البربيتوريك barbituric acid. أما أهم تفاعلات البولة فهو تفاعلها مع الفورم ألدهيد الذي يعطي راتنجات اليوريا ـ فورم ألدهيد urea resins-formaldehyde كالهيكساميتيلين تترامين (CH2)6N4 ويطلق عليه اسم يورو تروبين urotropin وصيغته المفصلة:
وتكوِّن البولة مع حمض الآزوت وحمض كلور الماء وحمض الفوسفور وغيرها من الحموض أملاحاً بمشاركة زمرة أمينو واحدة فقط.
إستعمالات اليوريا
تستعمل اليوريا بكثرة كسماد نيتروجينى ، كما تستعمل في تصنيع اللدائن وبعض انواع المذيبات الصناعية وفى صناعة الفورمالدهايد.
تستعمل البولة استعمالاً واسعاً في الصناعة والزراعة. فتعد مادة أولية للحصول على كثير من المركبات الكيمياوية، وتدخل في صناعة المنظفات والمستحضرات التجميلية، كما تستخدم استخداماً كبيراً في صناعة المستحضرات الصيدلانية والصناعات البلاستيكية والصناعات الخشبية. وتستعمل البولة في الزراعة سماداً آزوتياً عالي التركيز (N2 46.55%) سهل التمثل ومناسباً لجميع أنواع التربة والمزروعات. وتضاف البولة إلى أعلاف المجترات.
الإنتاج
تنتج مادة اليوريا من تفاعل غاز الأمونيا مع غاز ثانى اكسيد الكربون تحت ضغط مرتفع (140 كجم/سم2). اليوريا المنتجة عبارة عن حبيبات صلبة بيضاء مكورة (Prilled). جزء كبير من الإنتاج يصدر كسائب. ايضا يمكن تصديرها في اكياس مصنوعة من مادة البولى ايثلين سعة 50 كيلو جرام.
البولة الدموية (يوريا)
تنتج هذه المادة من تقويض الحموض الأمينية، وهذه العملية الاستقلابية هي عملية مستمرة، لذا فإن هذا الإنتاج مستمر مدى الحياة. تتوضع البولة في السوائل داخل الجسم بما فيها المصورة الدموية حيث يبلغ مقدارها فيها في الحالة الطبيعية من 3-7 ميلي مول في الليتر أو 20-40 ملغ في 100 مل منها.
كان لارتفاع مقدار البولة الدموية أثر كبير في الدلالة على الإصابة بالقصور الكلوي، ودام هذا الاعتقاد فترة كبيرة من الزمن، وكان يعد هذا الارتفاع في الدم دليلاً على مقدار هذا القصور وتطوره، كما كانت المعالجات المطبقة للقصور الكلوي تهدف إلى تخفيض قيم هذا المقدار والأكثر من ذلك كان يسمى القصور الكلوي يوريمية الدم uremia إذ كانت تعزى جميع أعراضه السريرية لارتفاع البولة في الدم وهذا ماتبين عدم صحته في الوقت الحاضر.
إلا أن الفهم الحديث للوظيفة الكلوية ولأمراض القصور الكلوي ولأعراضه ولآلية إنتاج البولة الدموية وإطراحها، غيّر الكثير من هذه المفهومات وقلل من الاعتماد على عيار البولة الدموية كوسيلة في تشخيص القصور الكلوي ومراقبة سيره وتطوره وللاستدلال على ما تبقى من الوظيفة الكلوية، وحدث كل هذا خلال الثلاثين سنة الأخيرة.
صحيح أن مقدار البولة يرتفع في الدم حين الإصابة بالقصورات الكلوية المختلفة إلا أنه يرتفع كذلك في حالات كثيرة أخرى. لأن هذا الارتفاع أو الانخفاض ينتج إما من زيادة إنتاج البولة في الكبد وإما من نقصه أو من نقص في إطراحها من الكلية أو زيادة فيه. لذلك يمكن لمقدار البولة الدموية أن يزداد في أحوال كثيرة لا يكون فيها المريض مصاباً بالقصور الكلوي نذكر منهـا: تعرض المريض للشدة stress أو استعماله الكورتيزون مدة طويلة أو في سياق استعمال الأدوية الكيماوية لمعالجة السرطانات، أو لدى الإكثار من تناول البروتينات في الغذاء. كما تلاحظ هذه الزيادة في حالات التجفاف واستعمال المدرات البولية أو بعد الإصابة بالنزوف الهضمية أو قصورات القلب المختلفة. وعلى العكس من ذلك يقل مقدار البولة الدموية عند المصابين بالقصور الكبدي.
وثمة مفهوم آخر يجب تصحيحه بأن ما يشكوه المريض بالقصور الكلوي من أعراض عامة كالوهن والتعب والنعاس والتدهور في حالته الصحية والأعراض الهضمية كالقيء والغثيان والقَمَه ليس عائداً لزيادة مقدار البولة الدموية فقط، بل إنه عائد للخلل في وظائف الأجهزة المختلفة للجسم إثر الإصابة بالقصور الكلوي إذ إن وظائف الكلية العديدة لها أثر أساسي في المحافظة على ثبات الوسط الداخلي للجسم. وخلل هذه الوظائف ينعكس سلباً على هذا الثبات ويؤثر من ثم على وظائف معظم أجهزة الجسم مؤدياً لظهور هذه الأعراض المختلفة.
كانت تستعمل البولة الدموية وسيلةً لتقويم وظيفة الكلية من خلال إجراء اختبار تصفية البولة الدموية، ولم يعد هذا الاختبار ذا قيمة بعد معرفة عدم ثبات إنتاجها وعدم ثبات إطراحها إذ إن هذا الإطراح يتعلق بعوامل أخرى إلى جانب قدرة الكلية الوظيفية.
من كل هذا يمكن الاستنتاج بأن أثر عيار البولة في الدم صار غير أساسي في تشخيص القصور الكلوي ومعالجته بل يمكن استعماله كأحد المؤشرات في ذلك، مع الأخذ بالاعتبار المعلومات المذكورة سابقاً والمؤثرة في اختلاف مقدار البولة زيادةً أو نقصاً.[4]
أنظر أيضا
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
المصادر
- ^ http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~ZAvqWP:1:sol
- ^ Williams, R. (2001-10-24). "pKa Data" (PDF). Retrieved 2009-11-27.
- ^ عدنان شحادة. "البولة". الموسوعة العربية. Retrieved 2012-04-19.
- ^ وليد النحاس. "البولة الدموية". الموسوعة العربية.
وصلات خارجية
- MSDS sheet on urea
- Urea Coating Agent
- Use of urea in hand dyeing
- Urea: synonymes, CAS, formula
- U3K Energy: Patented technology for use of urea as fuel (not SCR additive) for internal combustion engines and fuel cells.
- Free technical references and guidlines for the correct use of AdBlue (urea) as a reductant with the aid of an SCR.]
مراجع للإستزادة
- صلاح يحياوي، الكيمياء العضوية المفتوحة (مطبوعات مديرية جامعة دمشق 1968).
- Morrison and Boyd, Organic Chemistry (Prentice Hall Inc.1992).
- R.J.Ouette and J.D.Rawn, Organic Chemistry (Prentice Hall Inc.1996).
- Pages using Chembox with unknown parameters
- Articles with changed DrugBank identifier
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- CS1 errors: empty citation
- أيض النيتروجين
- يوريات
- مجموعات وظيفية
- كيماويات زراعية
- اخراج
- محسنات التربة
- مركبات عضوية
- مواد كيميائية