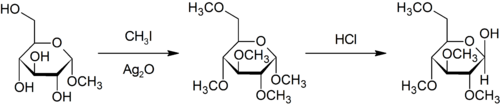مثيلة
في العلوم الكيميائية، تشير المثيلة (methylation)، إلى إضافة مجموعة مثيل على يشير إلى إضافة مجموعة ميثيل على ركيزة، أو استبدال ذرة (أو مجموعة) بمجموعة مثيل. اليثيل هو أحد دأشكال الألكلة، حيث تحل مجموعة المثيل محل ذرة الهيدروجين. تُستخدم هذه المصطلحات بشكل شائع في الكيمياء، الكيمياء الحيوية، علم التربة، والعلوم الحيوية.
في الأنظمة البيولوجية، يتم التحفيز بواسطة الإنزيمات؛ يمكن أن تشارك مثل هذه المثيلة في تعديل الفلزات الثقيلة، وتنظيم التعبير الجيني، وتنظيم وظيفة پروتين، ومعالجة الحمض النووي الريبي. تعد عملية المثيلة في المختبر لعينات الأنسجة أيضًا إحدى طرق تقليل بعض المنتوجات النسيجية المصبوغة. نزع المثيلة هي عكس المثيلة.
في علم الأحياء
في النظم الحيوية، تتم عملية المثيلة بواسطة الإنزيمات. يمكن للمثيل تعديل الفلزات الثقيلة وتنظيم التعبير الجيني ومعالجة الحمض النووي الريبي (RNA) ووظيفة الپروتين. أُعترف بها كعملية أساسية تكمن وراء علم التخلق.
توليد الميثان
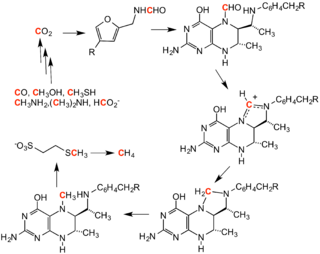
توليد الميثان، هي العملية التي تنتج غاز الميثان من ثاني أكسيد الكربون، وتتضمن سلسلة من تفاعلات المثيلة. وتتأثر هذه التفاعلات بمجموعة من الإنزيمات التي تأويها عائلة من الميكروبات اللاهوائية.[1]
في عملية توليد الميثان العكسي، يعمل الميثان كعامل مثيلة.[citation needed]
ناقلات المثيل-O
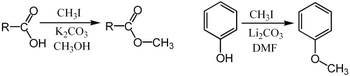
تخضع مجموعة واسعة من الفينولات لعملية مثيلة-O لتعطي مشتقات الأنيسول. هذه العملية، التي تحفزها إنزيمات مثل caffeoyl-CoA O-methyltransferase، هي تفاعل رئيسي في التخليق الحيوي للينول، مركب طليعي للگنين، وهو مكون هيكلي رئيسي للنباتات.
تنتج النباتات مركبات الفلاڤونويد والإيسوفلاڤون مع وجود مثيلات على مجموعات الهيدروكسيل، أي روابط ميثوكسية. يؤثر هذا الميثيل 5-O على قابلية ذوبان الفلاڤونويد في الماء. ومن الأمثلة على ذلك 5-O-methylgenistein، 5-O-methylmyricetin أو 5-O-methylquercetin، المعروف أيضا باسم الأزالياتين.
الپروتينات
جنبا إلى جنب مع اليوبيكويتنة والفسفرة، تعد عملية المثيلة عملية كيميائية حيوية رئيسية لتعديل وظيفة الپروتين. تؤثر مثيلات الپروتين الأكثر شيوعًا على بقايا الأرجينين والليسين من هيستونات معينة. خلاف ذلك، الهيستيدين، الگلوتامات، الأسپاراجين، السيستين عرضة للمثيلة. بعض هذه المنتجات تشمل S-مثيلسستين، واثنين من أيزومرات N-مثيلهيستيدين، واثنين من أيزومرات N-مثيلأرجينين.[2]
سينثاز المثيونين
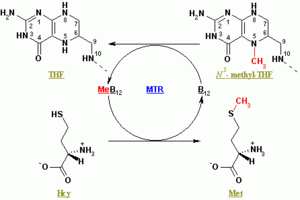
سينثاس المثيونين يجدد المثيونين (Met) من الهوموسيستين (Hcy). يحول التفاعل الكلي 5-مثيل التتراهيدروڤولات (N5-MeTHF) إلى رباعي الهيدروفولات (THF) أثناء نقل مجموعة المثيل إلى Hcy لتكوين Met. يمكن أن تكون تركيبات المثيونين معتمدة على الكوبالامين ومستقلة عن الكوبالامين: تحتوي النباتات على كليهما، وتعتمد الحيوانات على الشكل المعتمد على مثيل الكوبالامين.
في أشكال الإنزيم التي تعتمد على المثيل كوبالامين، يستمر التفاعل بخطوتين في تفاعل پنگ-پونگ. يُحضر الإنزيم في البداية إلى حالة تفاعلية عن طريق نقل مجموعة المثيل من N5-MeTHF إلى Co(I) في كوبالامين (Cob) مرتبط بالإنزيم، مكونًا المثيل كوبالامين (Me-Cob) الذي يحتوي الآن على Me-Co(III) وتنشيط الإنزيم. بعد ذلك، يتفاعل Hcy الذي نسق مع زنك المرتبط بالإنزيم لتكوين ثيولات تفاعلية مع Me-Cob. تُنقل مجموعة الميثيل المنشط من Me-Cob إلى ثيولات Hcy، التي تجدد Co(I) في Cob، ويُطلق Met من الإنزيم.[3]
الفلزات الثقيلة: الزرنيخ، الزئبق، الكادميوم
المثيل الحيوي هو المسار لتحويل بعض العناصر الثقيلة إلى مشتقات أكثر قدرة على الحركة أو أكثر قوة والتي يمكن أن تدخل السلسلة الغذائية. يبدأ المثيل الحيوي لمركبات الزرنيخ بتكوين الميثانيرسونات. وبالتالي، يُجرى مثيلة مركبات الزرنيخ غير العضوية ثلاثية التكافؤ لتعطي ميثانيرسونات. S-أدينوسيلميثيونين هو المتبرع بالمثيل. الميثانايرسونات هي سلائف ثنائي ميثيل أرسونات، مرة أخرى من خلال دورة الاختزال (إلى حمض الميثيلارسونوس) تليها مثيلة ثانية.[4] توجد مسارات ذات صلة في المثيل الميكروبي للزئبق إلى مثيل الزئبق.
المثيلة التخلقية
مثيلة الدنا/الرنا
مثيلة الدنا هي تحويل السيتوزين إلى 5-ميثيل سيتوزين. تكويون Me-CpG يحفزه إنزيم ناقل مثيل الدنا. في الفقاريات، تحدث مثيلة الدنا عادة في مواقع CpG (مواقع السيتوزين-فوسفات-گوانين- أي المواقع التي يتبع فيها السيتوزين مباشرة الگوانين في تسلسل الدنا). في الثدييات، تكون مثيلة الدنا شائعة في خلايا الجسم،[5] ويبدو أن مثيلة مواقع CpG هي الخيار الافتراضي.[6][7] يحتوي الحمض النووي البشري على حوالي 80-90% من مواقع CpG المميثلة، لكن هناك مناطق معينة، تُعرف باسم جزر CpG، غنية بـ CG (محتوى عالي من السيتوزين والگوانين، وتتكون من حوالي 65% بقايا CG)، حيث لا يتم مثليته. وترتبط هذه المحفزات بنسبة 56% من جينات الثدييات، بما في ذلك جميع الجينات المعبر عنها في كل مكان. واحد إلى اثنين بالمائة من الجينوم البشري عبارة عن مجموعات CpG، وهناك علاقة عكسية بين مثيلة CpG ونشاط النسخ. يمكن أن تحدث عملية المثيلة التي تساهم في الوراثة التخلقية إما من خلال مثيلة الدنا أو مثيلة الپروتين. يمكن أن تؤدي عملية المثيلة الغير صحيحة للجينات البشرية إلى تطور المرض،[8][9] بما في ذلك السرطان.[10][11]
في نحل العسل، ترتبط مثيلة الدنا بالربط البديل وتنظيم الجينات بناءً على الأبحاث الجينومية الوظيفية المنشورة عام 2013.[12] بالإضافة إلى ذلك، يرتبط مثيل الدنا بتغيرات التعبير في الجينات المناعية عندما تعرض نحل العسل لعدوى ڤيروسية مميتة.[13] نُشرت العديد من أوراق المراجعة حول موضوعات مثيلة الدنا في الحشرات الاجتماعية.[14][15]
تحدث مثيلة الرنا (RNA) في أنواع مختلفة من viz الرنا tRNA، rRNA، mRNA، tmRNA، snRNA، snoRNA، miRNA، والرنا الفڤروسي. تستخدم استراتيجيات تحفيزية مختلفة لمثيلة الرنا بواسطة مجموعة متنوعة من ناقلات مثيلة الرنا (RNA-methyltransferases). يُعتقد أن مثيلة الرنا كانت موجودة قبل مثيلة ابدنا في الأشكال المبكرة للحياة التي تطورت على الأرض.[16]
N6-Methyladenosine-ميثيل أدينوسين (m6A) هو تعديل المثيلة الأكثر شيوعًا والأكثر وفرة في جزيئات الرنا (mRNA) الموجودة في حقيقيات النوى. 5-ميثيل أسيتوزين (5-mC) يحدث أيضًا بشكل شائع في جزيئات الرنا المختلفة. تشير البيانات الحديثة بقوة إلى أن مثيلة m6A و5-mC RNA تؤثر على تنظيم العمليات الحيوية المختلفة مثل استقرار الرنا ونسخmRNA،[17] وأن مثيلة الرنا الغير طبيعية تساهم في مسببات الأمراض التي تصيب الإنسان.[18]
في الحشرات الاجتماعية مثل نحل العسل، تُدرس مثيلة الرنا كآلية جينية محتملة تكمن وراء العدوان عبر التهجينات المتبادلة.[19]
مثيلة الپروتين
عادة ما تحدث مثيلة الپروتين على بقايا الحمضين الأمينيين الأرجينين أو اللايسين في تسلسل الپروتين.[20]
يمكن مثيلة الأرجينين مرة واحدة (الأرجينين أحادي المثيل) أو مرتين، إما مع مجموعتي اليثيل على نيتروجين طرفي واحد (ثنائي مثيل الأرجينين الغير متماثل) أو مجموعة واحدة على كلا النيتروجينين (ثنائي مثيل الأرجينين المتماثل)، بواسطة پروتين مثيل الأرجينين ترانسفيراز (PRMTs). يمكن مثيلة اللايسين مرة أو مرتين أو ثلاث مرات بواسطة ناقلات مثيل اللايسين. خضعت مثيلة الپروتين للدراسة بشكل أكبر في الهيستونات. يُحفز نقل مجموعات مثيل من S-أدينوسيل مثيونين إلى الهستونات بواسطة إنزيمات تعرف باسم هيستونات ترانسفيراز. يمكن للهستونات التي خضعت للمثيلة في بقايا معينة أن تعمل تخلقياً لقمع أو تنشيط التعبير الجيني.[21][22] مثيلة الپروتين هي أحد أنواع تعديل ما بعد الترجمة.
التطور
استقلاب المثيل قديم جدًا ويمكن العثور عليه في جميع العضيات على وجه الأرض، من الجراثيم إلى البشر، مما يدل على أهمية استقلاب المثيل لعلم وظائف الأعضاء.[23] في الواقع، فإن التثبيط الدوائي للمثيلة العالمية في الأنواع التي تتراوح بين البشر، والفئران، والأسماك، والذباب، والديدان المستديرة، والنباتات، والطحالب، والبكتيريا الزرقاء يسبب نفس التأثيرات على إيقاعاتها الحيوية، مما يدل على الأدوار الفسيولوجية المحفوظة للمثيلة أثناء التطور.[24]
في الكيمياء
يشير مصطلح المثيلة في الكيمياء العضوية إلى عملية ألكلة تستخدم لوصف تسليم مجموعة CH
3.[25]
المثيلة المحبة للإلكترون
عادة ما تجرى عمليات المثيلة باستخدام مصادر مثيل محبة للإلكترون مثل اليودوميثان،[26] كبريتات ثنائي المثيل،[27][28] dimethyl carbonate,[29] كلوريد رباعي ميثيل الأمونيوم.[30] تشمل كواشف الميثيل الأقل شيوعًا ولكنها أكثر قوة (وأكثر خطورة) ثلاثي المثيل،[31] ديازو ميثان،[32] وفلوروسلفونات الميثيل (المثيل السحري). تتفاعل جميع هذه الكواشف عبر الاستبدالات المحبة للنواة SN2. على سبيل المثال، يمكن مثيل الكربوكسيلات على الأكسجين لإعطاء مثيل الإستر؛ يمكن أيضًا مثيل ملح الألكوكسيد RO−
ليعطي أثير، ROCH
3؛ أو يمكن مثيل كيتون الإينولات على الكربون لإنتاج كيتون جديد.
مثيلة پوردي هي مثيلة محددة في الأكسجين للكربوهيدرات باستخدام يودوميثان وأكسيد الفضة.[33]
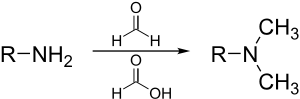
مثيلة إيشڤايلر-كلارك
مثيلة إيشڤايلر-كلارك هي طريقة لمثيلة الأمينات.[34] تتجنب هذه الطريقة خطر quaternization، والذي يحدث عندما تُميل الأمينات مع هاليدات المثيل.
الديازوميثان وثلاثي ميثيل سيليلديازوميثان
الديازوميثان ونظيره الأكثر أمانًا ثلاثي ميثيل سيليلديازوميثان لمثيلة الأحماض الكربوكسيلية، والفينولات، وحتى الكحوليات:
توفر هذه الطريقة ميزة إزالة المنتجات الجانبية بسهولة من خليط المنتج.[35]
المثيلة المحبة للنواة
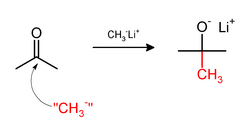
تشتمل عملية المثيل في بعض الأحيان على استخدام كواشف الميثيل محب للنواة. تشتمل عوامل المثيلة القوية النواة على مثيليثيوم (CH
3Li)[36] أو كواشف گرينار مثل بروميد مثيل المغنسيوم (CH
3MgX).[37] على سبيل المثال، سيضيف CH
3Li مجموعات المثيل إلى كربونيل (C=O) الكيتونات أو الألدهيات:
تشمل عوامل المثيل الأكثر اعتدالًا رباعي مثيل القصدير، ثنائي مثيل الزنك، وثلاثي مثيل الألومنيوم.[38]
انظر أيضاً
موضوعات علم الأحياء
- تسلسل ثنائي الكبريتيت - الطريقة الكيميائية الحيوية المستخدمة لتحديد وجود أو عدم وجود مجموعات المثيل في تسلسل الدنا
- MethDB قاعدة بيانات مثيلة الدنا
- ارتحال حراري مكروي – طريقة فيزيائية حيوية لتحديد حالة مثيلة الدنا[39]
موضوعات الكيمياء الحيوية
المصادر
- ^ Thauer, R. K., "Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson", Microbiology, 1998, volume 144, pages 2377-2406.
- ^ Clarke, Steven G. (2018). "The ribosome: A hot spot for the identification of new types of protein methyltransferases". Journal of Biological Chemistry. 293 (27): 10438–10446. doi:10.1074/jbc.AW118.003235. PMC 6036201. PMID 29743234.
- ^ Matthews, R. G.; Smith, A. E.; Zhou, Z. S.; Taurog, R. E.; Bandarian, V.; Evans, J. C.; Ludwig, M. (2003). "Cobalamin-Dependent and Cobalamin-Independent Methionine Synthases: Are There Two Solutions to the Same Chemical Problem?". Helvetica Chimica Acta. 86 (12): 3939–3954. doi:10.1002/hlca.200390329.
- ^ Styblo, M.; Del Razo, L. M.; Vega, L.; Germolec, D. R.; LeCluyse, E. L.; Hamilton, G. A.; Reed, W.; Wang, C.; Cullen, W. R.; Thomas, D. J. (2000). "Comparative toxicity of trivalent and pentavalent inorganic and methylated arsenicals in rat and human cells". Archives of Toxicology. 74 (6): 289–299. doi:10.1007/s002040000134. PMID 11005674. S2CID 1025140.
- ^ Tost J (2010). "DNA methylation: an introduction to the biology and the disease-associated changes of a promising biomarker". Mol Biotechnol. 44 (1): 71–81. doi:10.1007/s12033-009-9216-2. PMID 19842073. S2CID 20307488.
- ^ Lister R, Pelizzola M, Dowen RH, Hawkins RD, Hon G, Tonti-Filippini J, Nery JR, Lee L, Ye Z, Ngo QM, Edsall L, Antosiewicz-Bourget J, Stewart R, Ruotti V, Millar AH, Thomson JA, Ren B, Ecker JR (November 2009). "Human DNA methylomes at base resolution show widespread epigenomic differences". Nature. 462 (7271): 315–22. Bibcode:2009Natur.462..315L. doi:10.1038/nature08514. PMC 2857523. PMID 19829295.
- ^ Stadler MB, Murr R, Burger L, Ivanek R, Lienert F, Schöler A, van Nimwegen E, Wirbelauer C, Oakeley EJ, Gaidatzis D, Tiwari VK, Schübeler D (December 2011). "DNA-binding factors shape the mouse methylome at distal regulatory regions". Nature. 480 (7378): 490–5. doi:10.1038/nature11086. PMID 22170606.
- ^ Rotondo JC, Selvatici R, Di Domenico M, Marci R, Vesce F, Tognon M, Martini F (September 2013). "Methylation loss at H19 imprinted gene correlates with methylenetetrahydrofolate reductase gene promoter hypermethylation in semen samples from infertile males". Epigenetics. 8 (9): 990–7. doi:10.4161/epi.25798. PMC 3883776. PMID 23975186.
- ^ Rotondo JC, Bosi S, Bazzan E, Di Domenico M, De Mattei M, Selvatici R, Patella A, Marci R, Tognon M, Martini F (December 2012). "Methylenetetrahydrofolate reductase gene promoter hypermethylation in semen samples of infertile couples correlates with recurrent spontaneous abortion". Human Reproduction. 27 (12): 3632–8. doi:10.1093/humrep/des319. hdl:11392/1689715. PMID 23010533.
- ^ Rotondo JC, Borghi A, Selvatici R, Magri E, Bianchini E, Montinari E, Corazza M, Virgili A, Tognon M, Martini F (2016). "Hypermethylation-Induced Inactivation of the IRF6 Gene as a Possible Early Event in Progression of Vulvar Squamous Cell Carcinoma Associated With Lichen Sclerosus". JAMA Dermatology. 152 (8): 928–33. doi:10.1001/jamadermatol.2016.1336. PMID 27223861.
- ^ Rotondo JC, Borghi A, Selvatici R, Mazzoni E, Bononi I, Corazza M, Kussini J, Montinari E, Gafà R, Tognon M, Martini F (2018). "Association of Retinoic Acid Receptor β Gene With Onset and Progression of Lichen Sclerosus-Associated Vulvar Squamous Cell Carcinoma". JAMA Dermatology. 154 (7): 819–823. doi:10.1001/jamadermatol.2018.1373. PMC 6128494. PMID 29898214.
- ^ Li-Byarlay et al., "RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee", Proceedings of the National Academy of Sciences 110 (31), 12750-12755, https://doi.org/10.1073/pnas.1310735110
- ^ Li-Byarlay et al. 2020, "Transcriptomic and epigenomic dynamics of honey bees in response to lethal viral infection" Frontiers in genetics 11, 1056, https://doi.org/10.3389/fgene.2020.566320
- ^ Li-Byarlay, "The Function of DNA Methylation Marks in Social Insects" Front. Ecol. Evol., 19 May 2016 Sec. Social Evolution, Volume 4 - 2016 https://doi.org/10.3389/fevo.2016.00057
- ^ Wang & Li-Byarlay, "Chapter Two-Physiological and Molecular Mechanisms of Nutrition in Honey Bees", 2015, Advances in Insect Physiology, 49: 25-58. https://www.sciencedirect.com/science/article/abs/pii/S0065280615000259
- ^ Rana, Ajay K.; Ankri, Serge (2016-01-01). "Reviving the RNA World: An Insight into the Appearance of RNA Methyltransferases". Front Genet. 7: 99. doi:10.3389/fgene.2016.00099. PMC 4893491. PMID 27375676.
- ^ Choi, Junhong; Ieong, Ka-Weng; Demirci, Hasan; Chen, Jin; Petrov, Alexey; Prabhakar, Arjun; O'Leary, Seán E.; Dominissini, Dan; Rechavi, Gideon (February 2016). "N6-methyladenosine in mRNA disrupts tRNA selection and translation-elongation dynamics". Nature Structural & Molecular Biology (in الإنجليزية). 23 (2): 110–115. doi:10.1038/nsmb.3148. ISSN 1545-9993. PMC 4826618. PMID 26751643.
- ^ Stewart, Kendal (15 September 2017). "Methylation (MTHFR) Testing & Folate Deficiency". Archived from the original on 12 October 2017. Retrieved 11 October 2017.
- ^ Bresnahan et al, "Examining parent-of-origin effects on transcription and RNA methylation in mediating aggressive behavior in honey bees (Apis mellifera)" BMC Genomics volume 24, Article number: 315 (2023), https://doi.org/10.1186/s12864-023-09411-4
- ^ Walsh, Christopher (2006). "Chapter 5 – Protein Methylation" (PDF). Posttranslational modification of proteins: expanding nature's inventory. Roberts and Co. Publishers. ISBN 978-0-9747077-3-0. Archived (PDF) from the original on 2022-10-09.[dead link]
- ^ Grewal, S. I.; Rice, J. C. (2004). "Regulation of heterochromatin by histone methylation and small RNAs". Current Opinion in Cell Biology. 16 (3): 230–238. doi:10.1016/j.ceb.2004.04.002. PMID 15145346.
- ^ Nakayama, J. -I.; Rice, J. C.; Strahl, B. D.; Allis, C. D.; Grewal, S. I. (2001). "Role of Histone H3 Lysine 9 Methylation in Epigenetic Control of Heterochromatin Assembly". Science. 292 (5514): 110–113. Bibcode:2001Sci...292..110N. doi:10.1126/science.1060118. PMID 11283354. S2CID 16975534.
- ^ Kozbial, P.Z.; Mushegian, A.R. (2005). "Natural history of S-adenosylmethionine-binding proteins". BMC Struct Biol. 5 (19): 19. doi:10.1186/1472-6807-5-19. PMC 1282579. PMID 16225687.
- ^ Fustin, J.M.; Ye, S.; Rakers, C.; Kaneko, K.; Fukumoto, K.; Yamano, M.; Versteven, M.; Grünewald, E.; Cargill, S.J.; Tamai, T.K.; Xu, Y.; Jabbur, M.L.; Kojima, R.; Lamberti, M.L.; Yoshioka-Kobayashi, K.; Whitmore, D.; Tammam, S.; Howell, P.L.; Kageyama, R.; Matsuo, T.; Stanewsky, R.; Golombek, D.A.; Johnson, C.H.; Kakeya, H.; van Ooijen, G.; Okamura, H. (2020). "Methylation deficiency disrupts biological rhythms from bacteria to humans". Communications Biology. 3 (211): 211. doi:10.1038/s42003-020-0942-0. PMC 7203018. PMID 32376902.
- ^ March, Jerry; Smith, Michael W (2001). March's advanced organic chemistry: reactions, mechanisms, and structure. New York: Wiley. ISBN 978-0-471-58589-3.
- ^ Vyas, G. N.; Shah, N. M. (1951). "Quninacetophenone monomethyl ether". Organic Syntheses. 31: 90. doi:10.15227/orgsyn.031.0090.
- ^ Hiers, G. S. (1929). "Anisole". Organic Syntheses. 9: 12. doi:10.15227/orgsyn.009.0012.
- ^ Icke, Roland N.; Redemann, Ernst; Wisegarver, Burnett B.; Alles, Gordon A. (1949). "m-Methoxybenzaldehyde". Organic Syntheses. 29: 63. doi:10.15227/orgsyn.029.0063.
- ^ Tundo, Pietro; Selva, Maurizio; Bomben, Andrea (1999). "Mono-C-methylathion of arylacetonitriles and methyl arylacetates by dimethyl carbonate: a general method for the synthesis of pure 2-arylpropionic acids. 2-Phenylpropionic acid". Organic Syntheses. 76: 169. doi:10.15227/orgsyn.076.0169.
- ^ Nenad, Maraš; Polanc, Slovenko; Kočevar, Marijan (2008). "Microwave-assisted methylation of phenols with tetramethylammonium chloride in the presence of K2CO3 or Cs2CO3". Tetrahedron. 64 (51): 11618–11624. doi:10.1016/j.tet.2008.10.024.
- ^ Poon, Kevin W. C.; Albiniak, Philip A.; Dudley, Gregory B. (2007). "Protection of alcohols using 2-benzyloxy-1-methylpyridinium trifluoromethanesulfanonate: Methyl (R)-(-)-3-benzyloxy-2-methyl propanoate". Organic Syntheses. 84: 295. doi:10.15227/orgsyn.084.0295.
- ^ Neeman, M.; Johnson, William S. (1961). "Cholestanyl methyl ether". Organic Syntheses. 41: 9. doi:10.15227/orgsyn.041.0009.
- ^ Purdie, T.; Irvine, J. C. (1903). "C.?The alkylation of sugars". Journal of the Chemical Society, Transactions. 83: 1021–1037. doi:10.1039/CT9038301021.
- ^ Icke, Roland N.; Wisegarver, Burnett B.; Alles, Gordon A. (1945). "β-Phenylethyldimethylamine". Organic Syntheses. 25: 89. doi:10.15227/orgsyn.025.0089.
- ^ Shioiri T, Aoyama T, Snowden T (2001). "Trimethylsilyldiazomethane". Encyclopedia of Reagents for Organic Synthesis. e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rt298.pub2. ISBN 978-0-471-93623-7.
- ^ Lipsky, Sharon D.; Hall, Stan S. (1976). "Aromatic Hydrocarbons from aromatic ketones and aldehydes: 1,1-Diphenylethane". Organic Syntheses. 55: 7. doi:10.15227/orgsyn.055.0007.
- ^ Grummitt, Oliver; Becker, Ernest I. (1950). "trans-1-Phenyl-1,3-butadiene". Organic Syntheses. 30: 75. doi:10.15227/orgsyn.030.0075.
- ^ Negishi, Ei-ichi; Matsushita, Hajime (1984). "Palladium-Catalyzed Synthesis of 1,4-Dienes by Allylation of Alkenyalane: α-Farnesene". Organic Syntheses. 62: 31. doi:10.15227/orgsyn.062.0031.
- ^ Wienken CJ, Baaske P, Duhr S, Braun D (2011). "Thermophoretic melting curves quantify the conformation and stability of RNA and DNA". Nucleic Acids Research. 39 (8): e52. doi:10.1093/nar/gkr035. PMC 3082908. PMID 21297115.
وصلات خارجية
- deltaMasses Detection of Methylations after Mass Spectrometry