قانون راؤول
قانون راؤول (بالإنجليزية: Raoult's law) هو قانون في الكيمياء صاغه العالم فرانسوا ماري راؤول (بالإنجليزية). وينص القانون على أن ضغط البخار لسائل مثالي يعتمد على ضغط البخار لكل من مكوناته وأجزائها المولية الموجودة في السائل.[1]
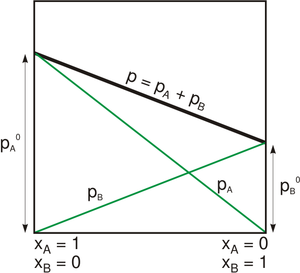
عندما تصل مجزنات السائل حالة التوازن الكيميائي فيمكن صياغة ضغط البخار الكلي p للسائل بالمعادلة:
ويبلغ ضغط بخار كل من مكوناته :
حيث:
- p*i ضغط البخار للمكون النقي،
- xi الجزء المولي للمكون النقي.
مبدأ قانون راؤول
المحاليل الحقيقية
Many pairs of liquids are present in which there is no uniformity of attractive forces, i.e., the adhesive and cohesive forces of attraction are not uniform between the two liquids, so that they deviate from the Raoult's law applied only to ideal solutions.
حيود سالب
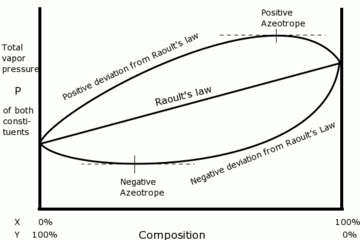
If the vapor pressure of a mixture is lower than expected from Raoult's law, there is said to be a negative deviation.
اقرأ أيضا
- Antoine equation
- Atomic theory
- Azeotrope
- DECHEMA model
- Dühring's rule
- Henry's law
- Köhler theory
- Solubility
المراجع
Chapter 24, D. A. McQuarrie, J. D. Simon Physical Chemistry: A Molecular Approach. University Science Books. (1997)
E. B. Smith Basic Chemical Thermodynamics. Clarendon Press. Oxford (1993)
- ^ A to Z of Thermodynamics by Pierre Perrot. ISBN 0-19-856556-9