الگلوبولين المناعي ج
الگلوبولين المناعي ج (Immunoglobulin G، اختصاراً IgG9، هو نوع من الأجسام المضادة . يمثل IgG ما يقرب من 75 ٪ من الأجسام المضادة في مصل الدم لدى البشر ، وهو النوع الأكثر شيوعًا من الأجسام المضادة الموجودة في الدورة الدموية.[1] يتم إنشاء جزيئات IgG وإطلاقها بواسطة خلايا البلازمة بيتا . يحتوي كل IgG على موقعين لربط المستضد .
الوظيفة
الأجسام المضادة هي المكونات الرئيسية للمناعة الخلطية . IgG هو النوع الرئيسي من الأجسام المضادة الموجودة في الدم والسوائل خارج الخلية ، مما يسمح له بالتحكم في عدوى أنسجة الجسم. عن طريق ربط العديد من مسببات الأمراض مثل الفيروسات والبكتيريا والفطريات ، يحمي IgG الجسم من العدوى.
يفعل ذلك من خلال عدة آليات:
- يتسبب ربط مسببات الأمراض بوساطة IgG في تثبيطها وربطها معًا عن طريق التراص ؛ تسمح تغطية IgG للأسطح الممرضة (المعروفة باسم طهاية ) بالتعرف عليها وابتلاعها بواسطة الخلايا البلعمية مما يؤدي إلى القضاء على العامل الممرض نفسه ؛
- ينشط IgG كل المسار الكلاسيكي لنظام المتممة ، سلسلة من إنتاج البروتين المناعي ينتج عنه القضاء على مسببات الأمراض ؛
- كما تربط IgG الذيفان وتحييده ؛
- كما يلعب IgG دورا هاما في سمية الخلية المعتمدة على الأجسام المضادة بوساطة الخلية (ADCC) و وبين التحلل البروتيني داخل الخلايا بوساطة الجسم المضاد ، الذي يربط TRIM21 (مستقبلات مع أكبر ألفة إلى في IgG البشر) من أجل توجيه الفيروسات الملحوظة إلى جسيم بروتيني في العصارة الخلوية;[2]
- يرتبط IgG أيضًا بتفاعلات فرط الحساسية من النوع الثاني والنوع الثالث.
يتم إنشاء الأجسام المضادة IgG بعد تبديل الفئة ونضوج استجابة الأجسام المضادة ، وبالتالي فإنها تشارك بشكل أساسي في الاستجابة المناعية الثانوية.[3]
يتم إفراز IgG كمونومر صغير الحجم مما يسمح له بتروية الأنسجة بسهولة. وهو النمط الإيسوي الوحيد للجسم المضاد الذي يحتوي على مستقبلات لتسهيل المرور عبر المشيمة البشرية ، وبالتالي توفير الحماية للجنين في الرحم . جنبا إلى جنب مع IgA الذي يفرز في حليب الثدي ، فإن IgG المتبقي الذي يتم امتصاصه من خلال المشيمة يوفر للمواليد مناعة خلطية قبل أن يتطور نظام المناعة الخاص به. اللبأ يحتوي على نسبة عالية من IgG ، وخاصة اللبأ البقري. في الأفراد الذين لديهم مناعة مسبقة لمسببات الأمراض ، يظهر IgG بعد حوالي 24-48 ساعة من التحفيز المستضد.
لذلك ، في الأشهر الستة الأولى من الحياة ، يكون للمولود نفس الأجسام المضادة للأم والطفل يمكن أن يدافع عن نفسه ضد جميع مسببات الأمراض التي واجهتها الأم في حياتها (حتى لو فقط من خلال التطعيم) حتى تتدهور هذه الأجسام المضادة. تعد هذه المجموعة من الگلوبولين المناعي أمرًا بالغ الأهمية للمواليد الجدد الذين لديهم حساسية شديدة للعدوى ، خاصة داخل الجهاز التنفسي والجهاز الهضمي.
يشارك IgG أيضًا في تنظيم تفاعلات الحساسية. وفقًا لـ فينكلمان ، هناك مساران للتأق(فرط الحساسية) الجهازي :[4][5] يمكن للمستضدات أن تسبب الحساسية المفرطة في الفئران من خلال المسار الكلاسيكي عن طريق الربط بين IgE المرتبط بمستقبل الخلايا الصارية FcεRI ، مما يحفز إطلاق كل من الهيستامين و عامل منشط الصفائح الدموية (PAF). في المستضدات البديلة ، تشكل المستضدات معقدات مع IgG ، والتي ترتبط بعد ذلك بمستقبل الخلايا البلعمية FcγRIII وتحفز إطلاق PAF فقط.[4]
يمكن للأجسام المضادة IgG منع الحساسية المفرطة بوساطة IgE عن طريق اعتراض مستضد معين قبل أن يرتبط بـ IgE المرتبط بالخلايا الصارية. ونتيجة لذلك ، فإن الأجسام المضادة IgG تحجب الحساسية المفرطة المستحثة بكميات صغيرة من المستضد ولكنها يمكن أن تتوسط الحساسية المفرطة المستحثة بكميات أكبر .[4]
البُنية
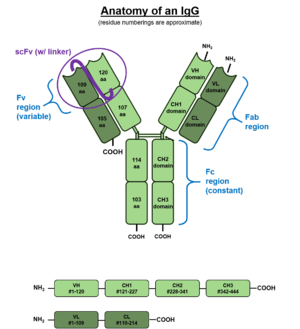
الأجسام المضادة IgG هي بروتينات كروية كبيرة بوزن جزيئي يبلغ حوالي 150 كيلو دالتون مصنوع من أربع سلاسل الببتيد .[6] يحتوي على سلسلتين ثقيلتين γ (جاما) متطابقتين من حوالي 50 كيلو دالتون وسلسلتان خفيفتان متطابقتان من حوالي 25 كيلو دالتون ، وبالتالي هيكل رباعي .[7] ترتبط السلسلتان الثقيلتان ببعضهما البعض وبسلسلة خفيفة كل منهما بروابط ثنائي كبريتيد . يحتوي الشكل الرباعي الناتج على نصفين متطابقين ، يكونان معًا الشكل الذي يشبه Y. تحتوي كل نهاية شوكة على موقع ربط مستضد متطابق. يتم توضيح المناطق والنطاقات المختلفة لـ IgG النموذجي في الشكل إلى اليسار. مناطق Fc من IgGs تتحمل موقع ارتباط الغليكوزيل بذرة نيتروجين محفوظ للغاية في الأسباراجين 297 في المنطقة الثابتة من السلسلة الثقيلة.[8] إن ارتباط الغليكان بذرة نيتروجين المرفقة بهذا الموقع هي في الغالب تراكيب ثنائية الفوكوزيل ثنائية النواة من النوع المعقد .[9]بالإضافة إلى ذلك ، فإن كميات صغيرة من ذرة النيتروجين المرتبطة بالغليكان( N-glycan ) تحمل أيضًا جزيئات جليكانيك وبقايا حمض السياليك المرتبطة بـ α-2،6 .[10] تم ربط تركيبة N-glycan في IgG بالعديد من أمراض المناعة الذاتية والأمراض المعدية والاستقلاب.[11]
التصنيفات الفرعية
هناك أربعة فئات فرعية من IgG1) IgG و 2 و 3 و 4) في البشر ، تم تسميتها حسب وفرتها في المصل (IgG1 هو الأكثر وفرة) . [12]
| الاسم | النسبة | سهولة عبور المشيمة | المنشط المكمل | الإرتباط بمعامل Fc على الخلايا البلعمية | عمر النصف[13] |
| IgG1 | 66% | نعم (1.47)* | ثاني-أعلى | انجذاب مرتفع | 21 يوم |
| IgG2 | 23% | لا (0.8)* | ثالث-أعلى | انجذاب منخفض بشدة | 21 يوم |
| IgG3 | 7% | نعم (1.17)* | مرتفع | انجذاب مرتفع | 7 يوم |
| IgG4 | 4% | نعم (1.15)* | no | انجذاب متوسط | 21 يوم |
| * حصص الدم / تركيزات الأمومة في الدم. استنادًا إلى بيانات من دراسة يابانية حول 228 أمًا.[14] | |||||
ملاحظة: إن ألفة IgG لمستقبلات Fc على الخلايا البلعمية محددة للأنواع الفردية التي يأتي منها الجسم المضاد وكذلك الفئة. يساهم هيكل مناطق المفصلات (المنطقة 6 في الرسم التخطيطي) في الخصائص البيولوجية الفريدة لكل فئة من فئات IgG الأربعة. على الرغم من وجود تشابه 95٪ بين مناطق Fc الخاصة بها ، إلا أن بنية مناطق المفصلات مختلفة نسبيًا.
نظرًا للخصائص المتعارضة للفئات الفرعية IgG (التثبيت والفشل في إصلاح المتممة ؛ الربط والفشل في ربط FcR) ، وحقيقة أن الاستجابة المناعية لمعظم المستضدات تتضمن مزيجًا من الفئات الفرعية الأربعة ، فقد كان من الصعب فهم كيفية IgG يمكن أن تعمل الفئات الفرعية معًا لتوفير مناعة واقية. في عام 2013 ، تم اقتراح النموذج الزمني لوظيفة IgE و IgG البشرية .[15] يشير هذا النموذج إلى ظهور IgG3 (و IgE) مبكرًا في الاستجابة. يسمح IgG3 ، على الرغم من التقارب المنخفض نسبيًا ، للدفاعات بوساطة IgG بالانضمام إلى الدفاعات بوساطة IgM في إزالة المستضدات الغريبة بعد ذلك ، يتم إنتاج ألفة أعلى IgG1 و IgG2. يساعد التوازن النسبي لهذه الفئات الفرعية ، في أي معقدات مناعية تتكون ، في تحديد قوة العمليات الالتهابية التي تتبعها. أخيرًا ، إذا استمر المستضد ، يتم إنتاج IgG4 ذو ألفة عالية ، مما يخفف الالتهاب عن طريق المساعدة في الحد من العمليات التي تتم بوساطة FcRs.
قد تفسر القدرة النسبية لمختلف الفئات الفرعية IgG لإصلاح المكمل لماذا بعض الاستجابات للجسم المضاد للمانحين تضر بالطعم بعد زرع الأعضاء.[16]
في نموذج الفأر لفقر الدم بواسطة الأجسام المضادة الذاتية باستخدام متغيرات النظائر الإيسوية IgG من الأجسام المضادة لمضادات كريات الدم الحمراء ، وجد أن الفأر IgG2a كان متفوقًا على IgG1 في تنشيط المكمل. علاوة على ذلك ، وجد أن نمط IgG2a كان قادرًا على التفاعل بكفاءة عالية مع FcgammaR. ونتيجة لذلك ، كانت هناك حاجة إلى جرعات أعلى 20 مرة من IgG1 ، فيما يتعلق بالأجسام المضادة IgG2a ، للحث على مسار المرض بوساطة الأجسام المضادة [17] من المهم أن نتذكر أنIgG1 للفأر و IgG1 البشري ليسا متشابهين بالضرورة في الوظيفة ، ويجب أن يتم الاستدلال على وظيفة الأجسام المضادة البشرية من دراسات الفأر بعناية كبيرة. ومع ذلك ، يبقى صحيحًا أن كلاً من الأجسام المضادة البشرية والفأر لها قدرات مختلفة على إصلاح مكملات والارتباط بمستقبل Fc
دوره في التشخيص
يمكن أن يكون قياس الگلوبولين المناعي ج أداة تشخيصية لظروف معينة ، مثل التهاب الكبد المناعي الذاتي ، إذا تم تحديده بأعراض معينة .[18] من الناحية السريرية ، تعتبر مستويات الأجسام المضادة IgG المقاسة بشكل عام دليلاً على الحالة المناعية للفرد لمسببات الأمراض المحددة. مثال شائع على هذه الممارسة هو العيار الذي تم رسمه لتوضيح المناعة في المصل بالحصبة والنكاف والحصبة الألمانية (MMR) ، وفيروس التهاب الكبد الوبائي ب ، والحماق (الجدري) ، من بين أمور أخرى .[19]
لم يسمح باختبار IgG لتشخيص الحساسية. .[20][21]
انظر أيضاً
المصادر
- ^ Vidarsson, Gestur; Dekkers, Gillian; Rispens, Theo (2014). "IgG subclasses and allotypes: from structure to effector functions". Frontiers in Immunology. 5: 520. doi:10.3389/fimmu.2014.00520. ISSN 1664-3224. PMC 4202688. PMID 25368619.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC (2010). "Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21)". Proceedings of the National Academy of Sciences, USA. 107 (46): 19985–19990. Bibcode:2010PNAS..10719985M. doi:10.1073/pnas.1014074107. PMC 2993423. PMID 21045130.
- ^ Vidarsson, Gestur; Dekkers, Gillian; Rispens, Theo (2014). "IgG subclasses and allotypes: from structure to effector functions". Frontiers in Immunology. 5: 520. doi:10.3389/fimmu.2014.00520. ISSN 1664-3224. PMC 4202688. PMID 25368619.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت Finkelman, Fred D. (September 2007). "Anaphylaxis: Lessons from mouse models". Journal of Allergy and Clinical Immunology. 120 (3): 506–515. doi:10.1016/j.jaci.2007.07.033. PMID 17765751.
- ^ Khondoun MV, Strait R, Armstrong L, Yanase N, Finkelman FD (2011). "Identification of markers that distinguish IgE-from IgG mediated anaphylaxis". Proceedings of the National Academy of Sciences, USA. 108 (30): 12413–12418. Bibcode:2011PNAS..10812413K. doi:10.1073/pnas.1105695108. PMC 3145724. PMID 21746933.
- ^ Janeway CA Jr; Travers P; Walport M; et al. (2001). "Ch3 Antigen Recognition by B-Cell and T-cell Receptors". Immunobiology: The Immune System in Health and Disease (5th ed.). New York: Garland Science.
- ^ "Antibody Basics". Sigma-Aldrich. Retrieved 2014-12-10.
- ^ Cobb, Brian A. (2019-08-27). "The History of IgG Glycosylation and Where We Are Now". Glycobiology. doi:10.1093/glycob/cwz065. ISSN 1460-2423. PMID 31504525.
- ^ Parekh, R. B.; Dwek, R. A.; Sutton, B. J.; Fernandes, D. L.; Leung, A.; Stanworth, D.; Rademacher, T. W.; Mizuochi, T.; Taniguchi, T.; Matsuta, K. (1–7 August 1985). "Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG". Nature. 316 (6027): 452–457. Bibcode:1985Natur.316..452P. doi:10.1038/316452a0. ISSN 0028-0836. PMID 3927174.
- ^ Stadlmann J, Pabst M, Kolarich D, Kunert R, Altmann F (2008). "Analysis of immunoglobulin glycosylation by LC-ESI-MS of glycopeptides and oligosaccharides". Proteomics. 8 (14): 2858–2871. doi:10.1002/pmic.200700968. PMID 18655055.
- ^ de Haan, Noortje; Falck, David; Wuhrer, Manfred (2019-07-08). "Monitoring of Immunoglobulin N- and O-glycosylation in Health and Disease". Glycobiology. doi:10.1093/glycob/cwz048. ISSN 1460-2423. PMID 31281930.
- ^ Vidarsson, Gestur; Dekkers, Gillian; Rispens, Theo (2014). "IgG subclasses and allotypes: from structure to effector functions". Frontiers in Immunology. 5: 520. doi:10.3389/fimmu.2014.00520. ISSN 1664-3224. PMC 4202688. PMID 25368619.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Bonilla FA Immuno Allergy Clin N Am 2008; 803–819
- ^ Hashira S, Okitsu-Negishi S, Yoshino K (August 2000). "Placental transfer of IgG subclasses in a Japanese population". Pediatrics International. 42 (4): 337–342. doi:10.1046/j.1442-200x.2000.01245.x. PMID 10986861.
- ^ Collins, Andrew M.; Katherine J.L. Jackson (2013-08-09). "A temporal model of human IgE and IgG antibody function". Frontiers in Immunology. 4: 235. doi:10.3389/fimmu.2013.00235. PMC 3738878. PMID 23950757.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Gao, ZH; McAlister, VC; Wright Jr., JR; McAlister, CC; Peltekian, K; MacDonald, AS (2004). "Immunoglobulin-G subclass antidonor reactivity in transplant recipients". Liver Transplantation. 10 (8): 1055–1059. doi:10.1002/lt.20154. PMID 15390333.
- ^ Azeredo da Silveira S, Kikuchi S, Fossati-Jimack L, Moll T, Saito T, Verbeek JS, Botto M, Walport MJ, Carroll M, Izui S (2002-03-18). "Complement activation selectively potentiates the pathogenicity of the IgG2b and IgG3 isotypes of a high affinity anti-erythrocyte autoantibody". Journal of Experimental Medicine. 195 (6): 665–672. doi:10.1084/jem.20012024. PMC 2193744. PMID 11901193.
- ^ Lakos G, Soós L, Fekete A, Szabó Z, Zeher M, Horváth IF, Dankó K, Kapitány A, Gyetvai A, Szegedi G, Szekanecz Z (Mar–Apr 2008). "Anti-cyclic citrullinated peptide antibody isotypes in rheumatoid arthritis: association with disease duration, rheumatoid factor production and the presence of shared epitope". Clinical and Experimental Rheumatology. 26 (2): 253–260. PMID 18565246. Archived from the original on 2014-12-11. Retrieved 2014-02-26.
- ^ Teri Shors (August 2011). "Ch5 Laboratory Diagnosis of Viral Diseases and Working with Viruses in the Research Laboratory". Understanding Viruses (2nd ed.). Jones & Bartlett Publishers. pp. 103–104. ISBN 978-0-7637-8553-6.
- ^ American Academy of Allergy, Asthma, and Immunology. "Five Things Physicians and Patients Should Question" (PDF). Choosing Wisely: an initiative of the ABIM Foundation. American Academy of Allergy, Asthma, and Immunology. Archived from the original (PDF) on November 3, 2012. Retrieved August 14, 2012.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ Cox L, Williams B, Sicherer S, Oppenheimer J, Sher L, Hamilton R, Golden D (2008). "Pearls and pitfalls of allergy diagnostic testing: report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force". Annals of Allergy, Asthma & Immunology. 101 (6): 580–592. doi:10.1016/s1081-1206(10)60220-7. PMID 19119701.