ريڤاروكسابان
 | |
 | |
| البيانات السريرية | |
|---|---|
| الأسماء التجارية | Xarelto, others |
| أسماء أخرى | BAY 59-7939 |
| AHFS/Drugs.com | Monograph |
| License data |
|
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | By mouth |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية | |
| بيانات الحركية الدوائية | |
| التوافر الحيوي | 80–100%; Cmax = 2–4 hours (10 mg oral)[1] |
| الأيض | CYP3A4, CYP2J2 and CYP-independent mechanisms[1] |
| Elimination half-life | 5–9 hours in healthy subjects aged 20 to 45[1][2] |
| الإخراج | 2/3 metabolized in liver and 1/3 eliminated unchanged[1] |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.210.589 |
| Chemical and physical data | |
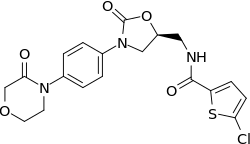
| التركيب | C19H18ClN3O5S |
| الكتلة المولية | 435.882 g/mol |
| 3D model (JSmol) | |
| |
| |
| | |
ريڤاروكسابان Rivaroxaban، يُباع تحت الاسم التجاري إكسارلتو ، هو دواء مضاد للتخثر (ترقق الدم) يستخدم لعلاج ومنع تجلط الدم.[3] على وجه التحديد يستخدم لعلاج الخثار الوريدي العميق والانصمام الرئوي ومنع تجلط الدم في الرجفان الأذيني وبعد جراحة الورك أو الركبة. .[3] يؤخذ عن طريق الفم.[3]
الآثار الجانبية الشائعة تشمل النزيف.[3] قد تشمل الآثار الجانبية الخطيرة الأخرى نزف في العمود الفقري والحساسية المفرطة.[3] ليس من الواضح ما إذا كان الاستخدام في الحمل والرضاعة آمنًا.[4] بالمقارنة مع الوارفارين ، لديه تداخلات أقل مع الأدوية الأخرى .[5] وهو يعمل عن طريق عرقلة نشاط عامل بروتين التخثر Xa.[3]
تمت براءة اختراع ريڤاروكسابان في عام 2007 وتمت الموافقة عليها للاستخدام الطبي في الولايات المتحدة في عام 2011.[6] في الولايات المتحدة ، لن يكون متاحًا كدواء عام حتى عام 2024.[7][8] يكلف الدعم الشهري الخدمة الصحية الوطنية في المملكة المتحدة حوالي 50 جنيهًا إسترلينيًا اعتبارًا من2019.[9] في الولايات المتحدة ، تبلغ التكلفة الإجمالية لهذا المبلغ حوالي 430 دولارا امريكيا.[10] في عام 2016 ، كان ريڤاروكسابان هو الدواء رقم 105 في الولايات المتحدة مع أكثر من سبعة ملايين وصفة طبية .[11]
الاستخدامات الطبية
بالنسبة لأولئك الذين يعانون من رجفان أذيني غير صمامي ، يبدو أنه فعال مثل الوارفارين في الوقاية من السكتات الدماغية واحداث الانسداد.[12] ,. يرتبط ريڤاروكسابان بانخفاض معدلات حدوث نزيف حاد ومميت مقارنة بالوارفارين ، على الرغم من أن ريڤاروكسابان مرتبط بمعدلات أعلى من النزيف في القناة الهضمية.[13]
في يوليو 2012 ، أوصى المعهد الوطني للصحة والتميز السريري في المملكة المتحدة بريڤاروكسابان لمنع وعلاج الجلطات الدموية الوريدية.[14]
موانع الاستعمال
بسبب الصعوبة المرتبطة بالتحكم بالنزيف ، يجب إيقاف دواء الريڤاروكسابان قبل 24 ساعة على الأقل من الجراحة ، ثم إعادة تشغيله بمجرد إنشاء الارقاء الكافي.[15]
لا تنصح توصيات الجرعات الحالية بإعطاء دواء ريڤاروكسابان مع العقاقير المعروفة بأنها مثبطات قوية مشتركة بين مثبطاتCYP3A4 / P-glycoprotein لأن هذا يؤدي إلى تركيزات بلازما أعلى بكثير من عقار ريڤاروكسابان.[16][17]
الاثار الجانبية
التأثير السلبي الأكثر خطورة هو النزيف ، بما في ذلك النزيف الداخلي الحاد.[18][19][20] ويرتبط ريڤاروكسابان مع انخفاض معدلات الأحداث النزفية الخطيرة والمميتة من الوارفارين لكنه يرتبط مع ارتفاع معدلات النزيف في القناةالهضمية.[13] بينما يتوفر الآن عامل انعكاس لـ ريڤاروكسابان (Andexanet alfa / AndexXa) ؛ أمانه وفعاليته ليست راسخة مثل عوامل الانعكاس لمضاد التخثر الأقدم ، الوارفارين (ڤيتامين ك وتركيز البروثرومبين المركّز) ، مما يعني أن النزيف الخطير قد يكون أكثر صعوبة في التحكم به) .قالب:Mcn
لدى ريڤاروكسابان تحذير مغلف لتوضيح أن الأشخاص الذين يستخدمون الدواء يجب ألا يتوقفوا قبل التحدث مع أخصائي الرعاية الصحية لديهم ، لأن التوقف المبكر يمكن أن يزيد من خطر الإصابة بالسكتة الدماغية.[16]
Iفي عام 2015 ، كان ريڤاروكسابان يمثل أكبر عدد من حالات الإصابات الخطيرة المُبلغ عنها بين الأدوية التي يتم رصدها بانتظام لنظام الإبلاغ عن الأحداث الجانبية (AERS) في ادارة الغذاء والدواء.[21]
العامل المعاكس
في أكتوبر 2014 ، أكملت Portola Pharmaceuticals التجارب السريرية للمرحلة الأولى والثانية لـ andexanet alfa كترياق لمثبطات العامل Xa مع القليل من الآثار الضارة ، وبدأت تجارب المرحلة الثالثة.[22][23]كان من المتوقع اعتماد Andexanet alfa في عام 2016.[24] تمت الموافقة على Andexanet alfa من قبل إدارة الغذاء والدواء الأمريكية في مايو 2018 ، تحت الاسم التجاري AndexXa.[25][26]
الية العمل
يمنع ريڤاروكسابان العامل المطلق Xa و Factor Xa المرتبط في مركب البروثرومبيناز.[27] إنه مثبط انتقائي مباشر للعامل Xa مع بداية سريعة للعمل. تثبيط العامل Xa يقاطع المسار الداخلي والخارجي لسلسلة تخثر الدم ، مما يحول دون تكوين الثرومبين وتطور الجلطات. ريڤاروكسابان لا يثبط الثرومبين (العامل المنشط II) ، ولم تظهر أي آثار على الصفائح الدموية.[1] لأنها تتيح منع تخثر الدم وضبط الجرعة يمكن التنبؤ بها ورصد التخثر الروتيني. ; [1] ليست هناك حاجة للقيود الغذائية.[24]
الهپارين غير المجزأ (UFH) ، الهپارين منخفض الوزن الجزيئي (LMWH) ، و فوندابارينوكس يثبطان أيضًا نشاط العامل Xa ، بشكل غير مباشر ، عن طريق الارتباط بمضادات الثرومبين الجائلة (AT III) ويجب حقنه ، في حين أن الوارفارين النشط عن طريق الفم ، والفينوبروكومون ، والاكينوكيومارول هي مضادات ڤيتامين ك (VKA) ، مما يقلل من عدد عوامل التخثر ، بما في ذلك العامل X .[28]
يحتوي ريڤاروكسابان على الحرائك الدوائية التي يمكن التنبؤ بها عبر مجموعة واسعة من المرضى (العمر والجنس والوزن والعرق) ولديه جرعة استجابة ثابتة عبر نطاق جرعة ثمانية أضعاف (من 5 إلى 40 ملغ). (5–40 mg).[29] ينقص التوافر الحيوي عن طريق الفم مع جرعات أعلى ويزيد عند تناوله مع الطعام.[16]
الكيمياء
يحمل ريڤاروكسابان بنية كيميائية مشابهة للمضاد الحيوي لنزوليد: يتشارك كلا العقارين في نفس البنية الأساسية المشتقة من أوكسازوليدينونات. تبعا لذلك ، ، تمت دراسة عقار ريفاروكسابان بحثًا عن أي آثار محتملة مضادة للميكروبات ولإمكانية التسمم بالميتوكوندريا ، وهو أحد المضاعفات المعروفة لاستخدام لاينزوليد طويل الأجل. وجدت الدراسات أن لا ريڤاروكسابان ولا مستقلباته لها أي تأثير مضاد حيوي ضد الجراثيم إيجابية الگرام .بالنسبة إلى سمية الميتوكوندريا ، وجدت الدراسات المختبرية التي نُشرت قبل عام 2008 أن المخاطر منخفضة.[30]
التاريخ
تم تطوير ريڤاروكسابان في البداية بواسطة باير. في الولايات المتحدة ، يتم تسويقه بواسطة Janssen Pharmaceutica (جزء من جونسون أند جونسون). هذا هو أول مثبط مباشر لعامل Xa النشط المتوفر عن طريق الفم
المجتمع والثقافة
اقتصاد
إن استخدام ريڤاروكسابان بدلاً من الوارفارين يكلف أكثر 70 مرة ، وفقًا لشركة Express Scripts Holding ، أكبر مدير لإعانات الصيدليات في الولايات المتحدة.[24] اعتبارا من عام 2016 ، ادعى باير أن الدواء مرخص في 130 دولة وأنه تم علاج أكثر من 23 مليون مريض.[31]
الموافقة
في سبتمبر 2008 ، منحت Health Canada تفويضًا للتسويق من أجل ريڤاروكسابان لمنع الجلطات الدموية الوريدية (VTE) لدى الأشخاص الذين خضعوا لاستبدال مفصل الورك الكامل أو جراحة استبدال الركبة بالكامل.[32]
في نفس الشهر ، منحت المفوضية الأوروپية أيضًا إذنًا للتسويق من عقار ريڤاروكسابان لمنع الجلطات الدموية الوريدية لدى البالغين الذين يخضعون لاستبدال مفصل الورك والركبة.[33]
في 1 يوليو 2011 ، وافقت إدارة الغذاء والدواء الأمريكية (FDA) على عقار ريڤاروكسابان للوقاية من التخثر الوريدي العميق (DVT) ، والذي قد يؤدي إلى انصمام رئوي (PE) ، في البالغين الذين يخضعون لجراحة استبدال مفصل الورك والركبة.[34]
في 4 نوفمبر 2011 ، وافقت إدارة الغذاء والدواء الأمريكية على عقار ريڤاروكسابان للوقاية من السكتة الدماغية لدى الأشخاص المصابين بالرجفان الأذيني غير الصمامي.[35]
اجراء قانوني
في 25 مارس 2019 ، تم تسوية أكثر من 25000 دعوى قضائية ضد ريڤاروكسابان في الولايات المتحدة مقابل 775 مليون دولار للحصول على أموال للمتضررين. اتهم المدعون صانعي الأدوية بعدم التحذير من مخاطر النزيف ، مدعين أن إصاباتهم كان يمكن الوقاية منها لو زود الأطباء والمرضى بالمعلومات الكافية.[36]
البحث العلمي
اتهم الباحثون في معهد ديوك للبحوث السريرية بحجب البيانات السريرية المستخدمة في تقييم عقار ريڤاروكسابان.[37] قام ديوك باختبار عقار ريڤاروكسابان في تجربة سريرية معروفة باسم تجربة ROCKET AF trial.[38] التجربة السريرية ، التي نشرت عام 2011 في مجلة نيو إنجلند الطبية[39] برئاسة روبرت كاليف الذي كان آنذاك مفوض إدارة الغذاء والدواء[40][39], وجدت أن عقار الريڤاروكسابان أكثر فاعلية من الوارفارين في تقليل احتمالية الإصابة بالجلطات الدماغية لدى مرضى الرجفان الأذيني.[39] تم التشكيك في صحة هذه الدراسة في عام 2014 عندما كشفت الجهات الراعية للمستحضرات الصيدلانية باير وجونسون آند جونسون أن أجهزة مراقبة الدم INRatio المستخدمة لا تعمل بشكل صحيح ,[37][38]وقد وجد تحليل لاحق من قبل فريق ديوك الذي نشر في فبراير 2016 أن هذا لم يكن له تأثير كبير على الفعالية والسلامة في المحاكمة.[41]
المصادر
- ^ أ ب ت ث ج ح "Xarelto: Summary of Product Characteristics". Bayer Schering Pharma AG. 2008. Retrieved 2009-02-11.
- ^ Abdulsattar Y, Bhambri R, Nogid A (May 2009). "Rivaroxaban (xarelto) for the prevention of thromboembolic disease: an inside look at the oral direct factor xa inhibitor". P & T. 34 (5): 238–44. PMC 2697099. PMID 19561868.
- ^ أ ب ت ث ج ح "Rivaroxaban Monograph for Professionals". Drugs.com (in الإنجليزية). American Society of Health-System Pharmacists. Retrieved 3 March 2019.
- ^ "Rivaroxaban Use During Pregnancy". Drugs.com (in الإنجليزية). Retrieved 3 March 2019.
- ^ Kiser, Kathryn (2017). Oral Anticoagulation Therapy: Cases and Clinical Correlation (in الإنجليزية). Springer. p. 11. ISBN 9783319546438.
- ^ "Generic Xarelto Availability". Drugs.com. Retrieved 9 May 2017.
- ^ "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations". www.accessdata.fda.gov. Retrieved 2019-04-24.
- ^ "Bayer, J&J Win Ruling That Upholds Patent for Xarelto Drug" (in الإنجليزية). 2019-04-22. Retrieved 2019-04-24.
- ^ British national formulary: BNF 76 (76 ed.). Pharmaceutical Press. 2018. pp. 127–128. ISBN 9780857113382.
- ^ "NADAC as of 2019-02-27". Centers for Medicare and Medicaid Services (in الإنجليزية). Retrieved 3 March 2019.
- ^ "The Top 300 of 2019". clincalc.com. Retrieved 22 December 2018.
- ^ Gómez-Outes A, Terleira-Fernández AI, Calvo-Rojas G, Suárez-Gea ML, Vargas-Castrillón E (2013). "Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups". Thrombosis. 2013: 640723. doi:10.1155/2013/640723. PMC 3885278. PMID 24455237.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Brown DG, Wilkerson EC, Love WE (March 2015). "A review of traditional and novel oral anticoagulant and antiplatelet therapy for dermatologists and dermatologic surgeons". Journal of the American Academy of Dermatology. 72 (3): 524–34. doi:10.1016/j.jaad.2014.10.027. PMID 25486915.
- ^ NICE guidance TA261 NICE guidance TA261. National Institute for Health and Clinical Excellence, July 2012
- ^ Sunkara T, Ofori E, Zarubin V, Caughey ME, Gaduputi V, Reddy M (2016). "Perioperative Management of Direct Oral Anticoagulants (DOACs): A Systemic Review". Health Services Insights. 9 (Suppl 1): 25–36. doi:10.4137/HSI.S40701. PMC 5156547. PMID 28008269.
- ^ أ ب ت "Xarelto (rivaroxaban) label" (PDF). U.S. Food and Drug Association.
- ^ Mueck W, Kubitza D, Becka M (September 2013). "Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects". British Journal of Clinical Pharmacology. 76 (3): 455–66. doi:10.1111/bcp.12075. PMC 3769672. PMID 23305158.
- ^ "Medication Guide – Xarelto" (PDF). U.S. Food and Drug Administration. Retrieved 1 September 2014.
- ^ "Xarelto Side Effects". WebMD. Retrieved 1 September 2014.
- ^ "Xarelto Side Effects Center". RxList. Retrieved 1 September 2014.
- ^ Schroeder, C. "ISMP Ranks Xarelto Most Dangerous Drug in the United States". DrugNews. DrugNews. Retrieved 10 August 2016.
- ^ Schroeder, C. "Possible Antidote Could Help Blood Thinner Patients In Bleeding Emergencies". DrugNews. Retrieved 20 August 2015.
- ^ Mo Y, Yam FK (February 2015). "Recent advances in the development of specific antidotes for target-specific oral anticoagulants". Pharmacotherapy. 35 (2): 198–207. doi:10.1002/phar.1532. PMID 25644580.
- ^ أ ب ت Bill Berkrot (December 23, 2015). "New blood thinner 'antidote' to help doctors move past warfarin". Reuters.
- ^ "Accelerated Approval for AndexXa" (PDF). FDA. Retrieved 1 August 2018.
- ^ Inc., Portola Pharmaceuticals. "U.S. FDA Approves Portola Pharmaceuticals' Andexxa®, First and Only Antidote for the Reversal of Factor Xa Inhibitors". GlobeNewswire News Room (in الإنجليزية الأمريكية). Retrieved 1 August 2018.
{{cite news}}:|last=has generic name (help) - ^ Roehrig S, Straub A, Pohlmann J, Lampe T, Pernerstorfer J, Schlemmer KH, Reinemer P, Perzborn E (September 2005). "Discovery of the novel antithrombotic agent 5-chloro-N-({(5S)-2-oxo-3- [4-(3-oxomorpholin-4-yl)phenyl]-1,3-oxazolidin-5-yl}methyl)thiophene- 2-carboxamide (BAY 59-7939): an oral, direct factor Xa inhibitor". Journal of Medicinal Chemistry. 48 (19): 5900–8. doi:10.1021/jm050101d. PMID 16161994.
- ^ Turpie AG (January 2008). "New oral anticoagulants in atrial fibrillation". European Heart Journal. 29 (2): 155–65. doi:10.1093/eurheartj/ehm575. PMID 18096568.
- ^ Eriksson BI, Borris LC, Dahl OE, Haas S, Huisman MV, Kakkar AK, Muehlhofer E, Dierig C, Misselwitz F, Kälebo P (November 2006). "A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement". Circulation. 114 (22): 2374–81. doi:10.1161/CIRCULATIONAHA.106.642074. PMID 17116766.
- ^ European Medicines Agency (2008). "CHP Assessment Report for Xarelto (EMEA/543519/2008)" (PDF). Retrieved 2009-06-11.[dead link]
- ^ "Bayer comments on article in The British Medical Journal (BMJ) regarding Xarelto" (PDF). Bayer AG Communications, Government Relations & Corporate Brand. 29 September 2016.
- ^ "Bayer's Xarelto Approved in Canada" (Press release). Bayer. 2008-09-16. Retrieved 2010-01-31.
- ^ "Bayer's Novel Anticoagulant Xarelto now also approved in the EU" (Press release). Bayer. 2008-02-10. Retrieved 2010-01-31.
- ^ "FDA Approves Xarelto® (rivaroxaban tablets) to Help Prevent Deep Vein Thrombosis in Patients Undergoing Knee or Hip Replacement Surgery" (Press release). Janssen Pharmaceutica. 2011-07-01. Archived from the original on 2011-11-05. Retrieved 2011-07-01.
- ^ "FDA approves Xarelto to prevent stroke in people with common type of abnormal heart rhythm". US Food and Drug Association. 4 November 2011. Retrieved 27 April 2016.
- ^ "Bayer, Johnson & Johnson settle more than 25,000 lawsuits over blood thinner Xarelto for $775 million". washingtonpost.com. Retrieved 7 April 2019.
- ^ أ ب Thomas, Katie (1 March 2016). "Document Claims Drug Makers Deceived a Top Medical Journal". The New York Times. Retrieved 3 May 2016.
- ^ أ ب Patel, Vir. "Duke clinical trial under scrutiny in drug case". The Chronicle. Duke Student Publishing Company.
- ^ أ ب ت Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, Breithardt G, Halperin JL, Hankey GJ, Piccini JP, Becker RC, Nessel CC, Paolini JF, Berkowitz SD, Fox KA, Califf RM (September 2011). "Rivaroxaban versus warfarin in nonvalvular atrial fibrillation". The New England Journal of Medicine. 365 (10): 883–91. doi:10.1056/NEJMoa1009638. PMID 21830957.
- ^ "Meet Robert M. Califf, M.D., Commissioner of Food and Drugs". U.S. Food and Drug Administration. U.S. Food and Drug Administration. Retrieved 3 May 2016.
- ^ Patel MR, Hellkamp AS, Fox KA (February 2016). "Point-of-Care Warfarin Monitoring in the ROCKET AF Trial" (PDF). The New England Journal of Medicine. 374 (8): 785–8. doi:10.1056/NEJMc1515842. PMID 26839968.
وصلات خارجية
- CS1 maint: unflagged free DOI
- CS1 errors: generic name
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- Articles with dead external links from April 2018
- Template:drugs.com link with non-standard subpage
- Articles with changed CASNo identifier
- Articles with changed KEGG identifier
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Infobox drug articles with non-default infobox title
- Drug has EMA link
- Drugboxes which contain changes to verified fields
- RTT
- Direct Xa inhibitors
- Morpholines
- Thiophenes
- كلوروأرينات
- 3-(4-methoxyphenyl)-2-oxazolidinones
- Janssen Pharmaceutica
- Bayer AG