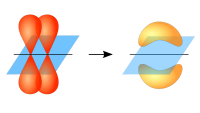رابطة پاي
فى الكيمياء، الرابطة پاي Pi bond، هي الرابطة الكيميائية التي تتم نتيجة انتقال إلكترون من مدار ذري في ذرة مانحة إلى مدار جزيئي مضاد للترابط من النمط π* في ربيطة مستقبلة لإلكترونات پاي π.[1][2] يشيع هذا النوع من الروابط في معقدات الفلزات الانتقالية ذات الربيطات متعددة الذرات.
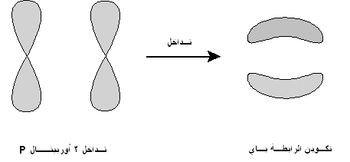
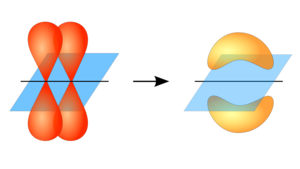
الرابطة پاي تم تسميتها على الحرف الإغريقي "π"، كما في المدار p، حيث أن تشابه المدار للرابطة باي هو نفسه الموجود في المدار p (عند ملاحظتها من أسفل محور الرابطة). وعادة ما تتداخل المدارات p في مثل هذا النوع من الترابط. وعموماً، فإن الأوبيتلات d وحتى الرابطة سيجما يمكن أن يمكن أن تتداخل في الترابط باي.
الروابط پاي عادة ما تكون أضعف من الرابطة سيجما لأن مداراتها تذهب أبعد من الشحنة الموجبة الموجودة في النواة، مما يتطلب طاقة أقل. وأظهرت نظريات الكم أن ضعف الرابطة باي يرجع لقلة التداخل بين المدارات p نظرا لوضعهم الموازي لبعض. وبالرغم من أن الرابطة باي في حد ذاتها أضعف من الرابطة سيجما، فإن الرابطة باي تتواجد في الروابط المتعددة مع وجود رابطة سيجما من ضمن هذه الروابط, وناتج تواجد النوعين معا هو روابط أقوى من الرابطة سيجما المفردة. الذرات التى ترتبط برابطة ثنائية أو رابطة ثلاثي يكون بها رابطة سيجما واحدة، وباقى الروابط تكون من النوع باي. الروابط باي تنتج من تداخل المدارات المتوازية: يتقابل المداران المرتبطان يتقابلا طوليا ويكونا رابطة متوزعة أكثر من الرابطة سيجما. وتسمي الإلكترونات الموجودة في الرابطة باي بالإلكترونات پاي.
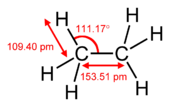
الروابط المتعددة
 |
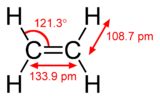 |
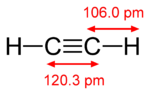 |
| إيثان (1 σ bond) | إثيلين (1 σ bond + 1 π bond) | أستيلين (1 σ bond + 2 π bonds) |
حالات خاصة
انظر أيضاً
المصادر
- ^ Inorganic Chemistry. 1999. p. 338.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help) - ^ Advanced Inorganic Chemistry. 1999.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help)