بركلورات الأمونيوم
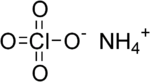
| |
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Ammonium perchlorate
| |
| أسماء أخرى
AP
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.305 |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
| UN number | 1442 |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | NH4ClO4 |
| كتلة مولية | 117.49 ج/مول |
| المظهر | مادة بلورية بيضاء [1] |
| الكثافة | 1.95 ج/سم3 |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 11.56 g/100 مل (0 °س) 20.85 g/100 مل(20 °س) 57.01 ك/100 مل (100 °س) |
| قابلية الذوبان | قابل للذوبان في الميثانول قابل للذوبان جزئياً في الأسيتون، الإيثانول غير قابل للذوبان في ثنائي إيثيل الإيثر[3] |
| البنية | |
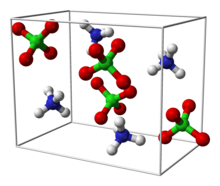
| البنية البلورية | Orthorhombic (<240 °س) مكعب (>240 °س) |
| المخاطر | |
| صفحة بيانات السلامة | External MSDS[4] |
| ن.م.ع. مخطط تصويري |    
|
| ن.م.ع. كلمة الاشارة | Danger |
| H201, H271, H319, H373 | |
| P210, P220, P221, P230, P240, P250, P260, P264, P280, P283, P305+P351+P338, P306+P360, P314, P337+P313, P370+P378, P370+P380, P371+P380+P375, P372, P373, P401, P501 | |
| NFPA 704 (معيـَّن النار) | |
| 240 °C (464 °F; 513 K) | |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كلورات الأمونيوم كلوريد الأمونيوم |
كاتيونات أخرى
|
بركلورات البوتاسيوم بركلورات الصوديوم بركلورات الليثيوم |
مركـّبات ذات علاقة
|
حمض البركلوريك |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
بركلورات الأمونيوم (إنگليزية: Ammonium perchlorate، اختصاراً "AP")، هو مركب غير عضوي صيغته الكيميائية NH4ClO4. وهي مادة صلبة بيضاء اللون أو بلا لون قابل للذوبان في الماء. تستخدم بركلورات الأمونيوم كدافع صاروخي يسمى دافع بركلورات الأومنيوم المركب. تسبب عدم استقرارها في وقوع عدد من الحوادث، مثل كارثة بيبكون.
الإنتاج
تُنتج بركلورات الأمونيوم بواسطة تفاعل بين الأمونيا وحمض الفوق كلوريك (البركلورات). هذه العملية هي الطريقة الرئيسية للإنتاج الصناعي لحمض فوق الكلوريك. يمكن أيضًا إنتاج الملح عن طريق تفاعل التبادل لأملاح الأمونيوم مع بركلورات الصوديوم. تستغل هذه العملية قابلية الذوبان المنخفضة نسبيًا لـ NH4ClO4، التي تمثل قرابة 10% من قابلية ذوبان بركلورات الصوديوم.[5]
تتبلور بركلورات الأمونيوم على شكل موشور سداسي عديم اللون.
محرك صاروخ دافع بالوقود الصلب. ETA : مجمع نقل الانفجار.[6]
مخطط الانسياب لمصنع ينتج 50 طن باليوم بركلورات الأمونيوم.[7]
قسم البلورة في المصنع: CR-1-ammonium-perchlorate (APC) crystallizer: CR-2potassium-perchlorate (KPC) crystallizer, F-1-Netzsch filter for separation of APC crystals: F-2Netzsch filter for separation of KPC crystals; T-1: Mother liquor tank; CP-1, CP-2-centrifugal pumps: VP-1-vacuum pump.[8]
مشروع تجريبي لانتاج بركلورات الأمونيوم (30 طن/سنة) - المبلوِر والمجفِف.[8]
AMMONIUM PERCHLORATE RECOVERY PLANT.[9]
الانحلال
مثل معظم أملاح الأمونيوم، تتحلل بركلورات الأمونيوم قبل الذوبان. ينتج عن التسخين الخفيف إنتاج كلوريد الهيدروجين والنيتروجين والأكسجين والماء.
- 4 NH4ClO4 → 4 HCl + 2 N2 + 5 O2 + 6 H2O
احتراق بركلورات الأمونيوم معقد للغاية ويُجرى دراسته على نطاق واسع. تتحلل بلورات بركلورات الأمونيوم قبل الذوبان، على الرغم من ملاحظة طبقة سائلة رفيعة على الأسطح البلورية أثناء عمليات الاحتراق عالية الضغط.[10] قد يؤدي التسخين الشديد إلى انفجار. ردود الفعل الكاملة لا تترك أي بقايا. البلورات النقية لا يمكنها تحمل اللهب تحت ضغط 2 ميجا باسكال.
بركلورات الأمونيوم هي مادة مؤكسدة من الفئة 4 (يمكن أن تخضع لتفاعل انفجاري) لأحجام الجسيمات التي تزيد عن 15 ميكرومتر[11] وتصنف كمادة مفجرة للجسيمات التي يقل حجمها عن 15 ميكرومترًا.[12][13]
الاستخدامات
يتمثل الاستخدام الأساسي لبركلورات الأمونيوم في صناعة الوقود الصلب.[14] عند خلط بركلورات الأمونيوم مع الوقود (على شكل مسحوق الأمونيوم و/أو مع أداة ربط بوليمر مرنة)، يمكن أن تولد احتراقاً مستداماً ذاتياً عند ضغط أقل بكثير من الضغط الجوي. بركلورات هي مادة مؤكسدة هامة لها تاريخ طويل من الاستخدام في وقود الصواريخ الصلبة - الإطلاق الفضائي (بما في ذلك معزز المكوك الفضائي العامل بالوقود الصلب، الاستخدام العسكري، هواية الصواريخ، وهوايات الصواريخ عالية الطاقة، وكذلك في بعض الألعاب النارية.
تحتوي بعض لاصقات الإيبوكسي على معلقات بركلورات الأمونيوم. عند التسخين إلى 300 درجة مئوية، تعمل بركلورات الأمونيوم على تحليل المادة اللاصقة العضوية، مما يؤدي إلى كسر الوصلة الملصقة.
السمية
تتمتع البركلورات نفسها بسمية حادة محدودة. على سبيل المثال، تحتوي بركلورات الصوديوم على ج.م.50 من 2-4 جم/كجم ويتم التخلص منها بسرعة بعد الابتلاع.[5] ومع ذلك، فقد ثبت أن التعرض المزمن للبركلورات، حتى بتركيزات منخفضة، يسبب مشكلات مختلفة الغدة الدرقية، عند تناوله بدلاً من اليود.
مرئيات
| بيركلورات الأمونيوم، المادة الأساسية في تصنيع وقود الصواريخ الصلبة. |
المصادر
- ^ MSDS. sigmaaldrich.com.
- ^ Liu, L.; Li, F.; Tan, L.; Ming, L.; Yi, Y. (2004), "Effects of Nanometer Ni, Cu, Al and NiCu Powders on the Thermal Decomposition of Ammonium Perchlorate", Propellants, Explosives, Pyrotechnics 29: 34–38, doi:
- ^ John Rumble (18 June 2018). CRC Handbook of Chemistry and Physics (in English) (99th ed.). CRC Press. pp. 4–41. ISBN 978-1138561632.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ Ammonium perchlorate MSDS. Sigma-Aldrich
- ^ أ ب Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. DOI:10.1002/14356007.a06_483
- ^ Robert Lewis Sackheim (2003). "Spacecraft Chemical Propulsion,". Encyclopedia of Physical Science and Technology (Third Edition).
{{cite web}}:|chapter=ignored (help) - ^ Alaa N. Ghanim و Farah Kadhum (2020-09-01). "Properties and Manufacture of Ammonium Perchlorate". researchgate.
- ^ أ ب A. Andri (2007). "Crystallization of Ammonium-Perchlorate from Solution of Electrolytically Produced Sodium-Perchlorate in a Pilot-Scale Plant". semanticscholar.org.
- ^ "AMMONIUM PERCHLORATE RECOVERY PLANT". kaybouvet.com.
- ^ Boggs, T. L. (1970). "Deflagration Rate, Surface Structure and Subsurface Profile of Self-Deflagrating Single Crystals of Ammonium Perchlorate". AIAA Journal. 8 (5): 867–873. Bibcode:1970AIAAJ...8..867B. doi:10.2514/3.5780.
- ^ NFPA 400: Hazardous Materials Code, 2010
- ^ NFPA 495: Explosive Materials Code, 2010
- ^ "Development of an Enhanced Hazard Classification System for Oxidizers Research Project, Technical Report", Safety Engineering Laboratories, Inc., The Fire Protection Research Foundation, 13 April 2006
- ^ "Perchlorate: Overview of Issues, Status, and Remedial Actions" Archived 15 مارس 2012 at the Wayback Machine, ITRC, September 2005
| HClO4 | He | |||||||||||||||||
| LiClO4 | Be(ClO4)2 | B(ClO 4)− 4 B(ClO4)3 |
ROClO3 | N(ClO4)3 NH 4ClO 4 NOClO4 |
H 3OClO 4 |
FClO4 | Ne | |||||||||||
| NaClO4 | Mg(ClO4)2 | Al(ClO4)3 Al(ClO 4)− 4 Al(ClO 4)2− 5 Al(ClO 4)3− 6 |
Si | P | S | ClO− 4 ClOClO3 Cl 2O 7 |
Ar | |||||||||||
| KClO4 | Ca(ClO4)2 | Sc(ClO4)3 | Ti(ClO4)4 | VO(ClO4)3 VO2(ClO4) |
Cr(ClO4)3 | Mn(ClO4)2 | Fe(ClO4)2 Fe(ClO4)3 |
Co(ClO4)2, Co(ClO4)3 |
Ni(ClO4)2 | Cu(ClO4)2 | Zn(ClO4)2 | Ga(ClO4)3 | Ge | As | Se | Br | Kr | |
| RbClO4 | Sr(ClO4)2 | Y(ClO4)3 | Zr(ClO4)4 | Nb(ClO4)5 | Mo | Tc | Ru | Rh(ClO4)3 | Pd(ClO4)2 | AgClO4 | Cd(ClO4)2 | In(ClO4)3 | Sn(ClO4)4 | Sb | TeO(ClO4)2 | I | Xe | |
| CsClO4 | Ba(ClO4)2 | Lu(ClO4)3 | Hf(ClO4)4 | Ta(ClO4)5 TaO(ClO4)3 TaO2ClO4 |
W | Re | Os | Ir | Pt | Au | Hg2(ClO4)2, Hg(ClO4)2 |
Tl(ClO4), Tl(ClO4)3 |
Pb(ClO4)2 | Bi(ClO4)3 | Po | At | Rn | |
| FrClO4 | Ra | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | ||||||||||||||||||
| La | Ce(ClO4)x | Pr(ClO4)3 | Nd(ClO4)3 | Pm | Sm(ClO4)3 | Eu(ClO4)3 | Gd(ClO4)3 | Tb(ClO4)3 | Dy(ClO4)3 | Ho(ClO4)3 | Er(ClO4)3 | Tm(ClO4)3 | Yb(ClO4)3 | |||||
| Ac | Th(ClO4)4 | Pa | UO2(ClO4)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||
- CS1 errors: chapter ignored
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- مركبات الأمونيوم
- فوق كلورات
- مؤكسدات تكنولوجيا نارية
- مؤكسدات صاروخية
- عوامل مؤكسدة
- كيماويات متفجرة


![محرك صاروخ دافع بالوقود الصلب. ETA : مجمع نقل الانفجار.[6]](/w/images/thumb/5/58/Typical_solid_propellant_rocket_motor._ETA_is_the_Explosive_Transfer_Assembly.gif/279px-Typical_solid_propellant_rocket_motor._ETA_is_the_Explosive_Transfer_Assembly.gif)
![مخطط الانسياب لمصنع ينتج 50 طن باليوم بركلورات الأمونيوم.[7]](/w/images/thumb/4/43/Flow-diagram-of-50-ton-per-day-ammonium-perchlorate-plant.png/279px-Flow-diagram-of-50-ton-per-day-ammonium-perchlorate-plant.png)
![قسم البلورة في المصنع: CR-1-ammonium-perchlorate (APC) crystallizer: CR-2potassium-perchlorate (KPC) crystallizer, F-1-Netzsch filter for separation of APC crystals: F-2Netzsch filter for separation of KPC crystals; T-1: Mother liquor tank; CP-1, CP-2-centrifugal pumps: VP-1-vacuum pump.[8]](/w/images/thumb/f/f7/Crystallization_section_of_the_plant_CR-1.png/320px-Crystallization_section_of_the_plant_CR-1.png)
![مشروع تجريبي لانتاج بركلورات الأمونيوم (30 طن/سنة) - المبلوِر والمجفِف.[8]](/w/images/thumb/7/76/Pilot_plant_for_production_of_ammonium-perchlorate_%2830_ton_per_year%29_Crystallizer_and_dryer.png/320px-Pilot_plant_for_production_of_ammonium-perchlorate_%2830_ton_per_year%29_Crystallizer_and_dryer.png)
![AMMONIUM PERCHLORATE RECOVERY PLANT.[9]](/w/images/thumb/c/cb/AMMONIUM_PERCHLORATE_RECOVERY_PLANT.jpg/320px-AMMONIUM_PERCHLORATE_RECOVERY_PLANT.jpg)