كربون 14
| كربون 14 | |
|---|---|
| عام | |
| الاسم والرمز | كربون مشع،14C |
| النيوترونات | 8 |
| الپروتونات | 6 |
| بيانات النيوكليدات | |
| التوافر الطبيعي | 1 جزء لكل ترليون |
| عمر النصف | 5,730 ± 40 سنة |
| كتلة النظير | 14.003241 u |
| سپين | 0+ |
| نمط الانحلال | طاقة الانحلال |
| بيتا | 0.156476[1] MeV |
كربون 14 أو الكربون المشع هو نظير مُشع من نظائر الكربون. وزنه الذري 14، وهو أثقل من الكربون العادي الذي يقدر وزنه الذري بمقدار 12,011. يستخدم الكربون المشعّ لتحديد عمر الأحافير، والأنواع الأخرى من الأشياء القديمة. ويستخدمه الباحثون أيضًا لدراسة بعض العمليات البيولوجية.
يتكون الكربون المشعّ في الطبيعة حينما تندفع الجسيمات الذرية العالية الطاقة، التي تسمَّى الأشعة الكونية إلى جوّ الأرض. وتسبب الأشعة الكونية في الجو تفتت الذرات إلى إلكترونات ونيوترونات وبروتونات وجسيمات أخرى. وترتطم بعض النيوترونات بنويات ذرات النيتروجين في الجو. وتمتص كل من هذه النويات نيوترونًا، ومن ثم تفقد بروتونًا. وتتحول ذرة النيتروجين بهذه الطريقة إلى ذرة كربون مشع.
تحتوي جميع الكائنات الحية على كربون مشع. وفي الجو، توجد ذرة من الكربون المشع في كل تريليون من جزيئات غازثاني أكسيد الكربون. ويمتص النبات الكربون المشع من ثاني أكسيد الكربون في الهواء. ويتناول الناس والحيوانات الأخرى الكربون المشع بصفة رئيسية من الغذاء الذي تمدهم به النباتات.
التأريخ بالكربون المشع
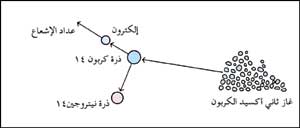 في الطريقة التقليدية تحرق قطعة من الجسم المراد معرفة عمره لتحويله إلى غاز ثاني أكسيد الكربون. تطلق ذرات الكربون المشع (الكربون 14) في الغاز، الإلكترونات بينما يتحول الكربون المشع إلى نيتروجين 14. وتكشف عدادات الإشعاع عدد الإلكترونات المنطلقة والتي تحدد محتوى الكربون المشع في الجسم المراد معرفة عمره. |
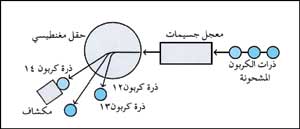 في طريقة حديثة، يطلق معجل الجسيمات ذرات الكربون المشحونة التي تنطلق أساسًا من قطعة من الجسم المراد معرفة عمره إلى حقل مغنطيسي. ويسبب الحقل انحراف ذرات الكربون المختلفة وفصلها حسب وزنها. ومن ثم يرصد مكشاف عدد ذرات الكربون 14 بشكل فردي لتحديد محتوى الكربون المشع في الجسم. |
عملية تستخدم لتحديد عمر الشيء القديم عن طريق قياس محتواه من الكربون المشع، وقد طور هذا الأسلوب، الكيميائي الأمريكي ويلارد ليبي في أواخر أربعينيات القرن العشرين. استخدم علماء الآثار والجيولوجيون طريقة ليبي ليعرفوا كثيرًا عن حياة إنسان ماقبل التاريخ وحيواناته ونباتاته منذ 50,000 سـنة.
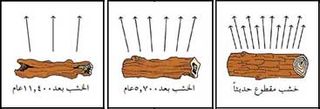
وذرات الكربون، مثل جميع المواد المشعَّة تنحل (تتفكك بإطلاق جسيمات) بمعدل دقيق ومنتظم. وتختفي نصف كمية الكربون المشع بعد نحو 5,700 سنة، ومعنى هذا أنّ الكربون المشع له نصف عمر يعادل تلك الفترة. ويبقى ربع الكمية الأصلية من الكربون المشع بعد 11,400 سنة، وبعد 5,700 عام أخرى يبقى الثُّمن، وهكذا.
يضمحل الكربون المشع في أنسجة الكائن باستمرار مادام الكائن يعيش. وبعد أن يموت الكائن، فإنه لا يتناول الغذاء أو الهواء وبالتالي لا يمتص الكربون المشع. ويستمر الكربون المشع الموجود فعلاً في الجسم في النقصان بمعدل ثابت. ويساعد هذا الانحلال الثابت، الذي يسير بمعدل معروف (نصف عمر 5,700 عام)، العلماء على تحديد عمر الشيء.
وفي إحدى طرق تحديد العمر بالكربون المشع، يحرق العلماء قطعة من الجسم قيد الدراسة ويحولونها إلى غاز ثاني أكسيد الكربون. وينقى غاز ثاني أكسيد الكربون، وتقاس كمية الكربون المشع في ثاني أكسيد الكربون النقي بعدادات الإشعاع. وتكتشف هذه الأجهزة الإلكترونات التي تطلقها ذرات الكربون المشع، وتتحول ثانيةً إلى ذرات نيتروجين. ويشير عدد الإلكترونات المنبعثة إلى محتوى الكربون المشع.
تتضمن الطريقة الأخرى لتحديد العمر بالكربون المشع، استخدام أنواع معينة من معجلات الجسيمات بدلاً من عدادات الإشعاع. ويساعد المعجل العلماء في الكشف المباشر عن ذرات الكربون المشع المفردة وعدها في جزء صغير جدًّا من المادة.
وبعد أن يقيس العلماء محتوى المادة من الكربون المشع، فإنهم يقارنونها مع الكربون المشع بحلقات جذع شجرة أعمارها معروفة. وتساعدهم هذه التقنية على التعويض عن التغيرات الصغيرة في محتوى الجو من الكربون المشع في عصور مختلفة في الماضي. بعد ذلك، يستطيع العلماء أن يحولوا عمر الكربون المشع في المادة إلى تأريخ أكثر دقة.
تكونه أثناء الاختبارات النووية
يحتوي ثاني أكسيد الكربون الموجود في الهواء الكربون 14 الذي يتكون نتيجة للتفاعل النووي بين ذرات آزوت (نيتروجين) الهواء ونترونات الأشعة الكونية:
الكربون المشع في علم الأحياء
يستخدم الكربون المشع عنصرًا مقتفيًا أو عنصرًا استشفافيًا (لتتبع عملية أو تفاعلات معينة) لدراسة مختلف العمليات الأحيائية المعقدة. وفي تلك الأبحاث، يستبدل العلماء ذرة الكربون المشع بذرة الكربون في الجزيء. ثم يستخدمون عدادًا للأشعة لاقتفاء مسار ذرة الكربون المشع خلال تفاعل كيميائي يحدث في الكائن.[5]
ينتج الكربون المشع، الذي يستخدم بمثابة عنصر اكتشافي اصطناعي، في المفاعلات النووية. وقد اكتشف الكربون المشع الاصطناعي لأول مرة، كيميائيان أمريكيان هما مارتن د. كامن وصمويل روبن.
وفي عملية التمثيل اليخضوري يدخل الكربون 14 في تركيب النسج النباتية بحيث تكون نسبة عدد ذراته إلى عدد ذرات الكربون 12، وهو النظير المستقر للكربون، كنسبة 1 إلى 1210. غير أن هذه النسبة تتناقص مع الزمن إذا انقطع التبادل الحيوي في المادة النباتية (بفصل هذه المادة أو قطع النبات) بسبب تفكك الكربون 14 بإصدار أشعة β وفق التفاعل النووي:[6]
وزمن نصف التفكك الإشعاعي (أي عمر النصف) للنظير 14 يساوي 5570 سنة تقريباً. ويستفاد من ذلك لتقدير عمر المادة النباتية بقياس إشعاع الكربون المكوّن لها. فعلى سبيل المثال، لتكن سرعة تحلل disintegration الكربون 14 في قطعة خشب حديثة القطع من شجرتها تساوي 15.6 تحلل في الدقيقة، في حين تساوي هذه السرعة 7.8 تحلل/دقيقة في قطعة خشب قديم لها وزن القطعة الأولى نفسه ويبلغ عمرها 5570 سنة تقريباً؛ أي إنه بتحديد سرعة تحلل الكربون 14 في كلتا القطعتين يمكن تعيين تاريخ قطع الخشب الثاني من شجرته بتقريب جيد.
المصادر
- ^ A.H Waptstra, G. Audi, and C. Thibault. "AME atomic mass evaluation 2003". Retrieved 2007-06-03.
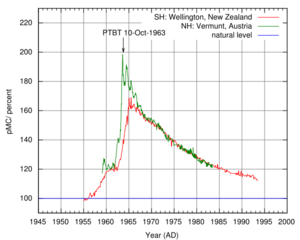
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ "Atmospheric δ14C record from Wellington". Trends: A Compendium of Data on Global Change. Carbon Dioxide Information Analysis Center. Oak Ridge National Laboratory. 1994. Retrieved 2007-06-11.
- ^ Levin, I.; et al. (1994). "δ14C record from Vermunt". Trends: A Compendium of Data on Global Change. Carbon Dioxide Information Analysis Center.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ^ "Radiocarbon dating". University of Utrecht. Retrieved 2008-02-19.
- ^ "الكربون المشع". الموسوعة المعرفية الشاملة. Retrieved 2009-04-08.
- ^ "الكربون". الموسوعة العربية. Retrieved 2011-02-27.
انظر أيضا
المراجع
قراءات أخرى
- Kamen, Martin D. (1985). Radiant Science, Dark Politics: A Memoir of the Nuclear Age. Berkeley: University of California Press. ISBN 0520049292.
{{cite book}}: Cite has empty unknown parameter:|coauthors=(help)
وصلات خارجية
| أخف: كربون-13 |
كربون 14 هو نظير لعنصر كربون |
أثقل: كربون-15 |
| ناتج انحلال: بورون-14، نيتروجين-18 |
سلسلة إنحلال كربون 14 |
انحلالات ل: نيتروجين-14 |