رابطة كيميائية
الرابطة الكيميائي chemical bond هى ظاهرة تواجد الذرات متماسكة معا في الجزيء أو البلورة. وجميع الروابط الكيميائية ترجع لتفاعل الإلكترونات الموجودة في الذرة. وهذه الإلكترونات جزء من المدار الذري للذرة (Atomic Orbital AO), ولكن في الرابطة, يقوموا بتكوين مدار جزيئي (Molecular Orbital MO). وتفاعلات هذه الإلكترونات النووية تنتج من القوى الأساسية للكهرومغناطيسية. وتكون الذرات رابطة لو أن مداراتها أصبحت أقل في الطاقة بعد تفاعلها مع بعضها البعض.
التاريخ
 مقالات مفصلة: تاريخ الكيمياء
مقالات مفصلة: تاريخ الكيمياء- تاريخ الجزيء
نظرة عامة على أنواع رئيسية من الروابط الكيميائية
وهناك 5 أنواع مختلفة من الترابط الكيميائي تستخدم لتصنيف أنواع التفاعلات الذرية. وهذه التصنيفات يتم تعريفها بواسطة التوزيع الإلكتروني ومستويات الطاقة. وللروابط الفعلية خصائص يصعب تقريقها, ولذلك فيمكن أن تكون هناك رابطة تشتمل على نوعين من أنواع الترابط الآتية.
أنواع الترابط الكيميائي الخمسة هي:
- الرابطة الأيونية.
- الرابطة التساهمية.
- الرابطة التساهمية التناسقية.
- الرابطة الفلزية.
- الرابطة الهيدروجينية
ويقال للإلكترونات الموجودة في المدار الجزيئي لرابطة أنها "متمركز" على ذرة/ذرات معينة, أو "غير متمركزة" بين ذرتين أو أكثر. ونوع الرابطة بين ذرتين يعرف بتمركز الكثافة الإلكترونية أو عدم تمركزها بين ذرات المادة.
وعديد من المركبات ترتبط عن طريق الرابطة التساهمية. ويمكن توقع بناء هذه الجزيئات بإستخدام نظرية تكافؤ الرابطة, ونسبة الذرات المتضمنة يمكن تفهمها أبضا عن طريق بعض المفاهيم مثل رقم التأكسد. والمركبات الأخرى التى يكون بنائها أيوني, يمكن تفهم تركيبها عن طريق نظريات الفيزياء التقليدية. وعموما, فإن المركبات الأكثر تعقيدا مثل المعقدات الفلزية تحتاج كيمياء الكم لتفهمها.
وفى حالة الترابط الأيوني, تكون معظم الإلكترونات متمركزة حول ذرات معينة, ولا تنتقل الإلكترونات بين الذرات كثيرا. ويتم تعيين شحنة لكل ذرة حتى يمكن تعريف التوزيع الماردرات الجزيئية لها. وتتميز القوة بين الذرات (أو الأيونات) بكمية موحدة الخواص من الجهد الكهربي الساكن.
وبالعكس, ففى الترابط التساهمي, تكون الكثافة الإلكترونية بين الروابط غير راجعة لذرات معينة, ولكن تكون في حالة عدم تمركز في الماردرات الجزيئية بين الذرات. كما تساعد نظرية الإندماج الخطي للمدارارت الجزيئية المشهورة, على وصف بناء المدارات الجزيئية والطاقات بإستخدام المدارات الذرية للذرات الآتية منها. وبعكس الرابطة الأيونية النقية, فإن الرابطة التساهمية يمكن ان يكون له تباين خواص مباشر.
ويمكن للذرات أيضا أن تكون روابط وسيطة بين الرابطة التساهمية والأيونية. وهذا لأن هذه التعريفات مبنية على درجة عدم تمركز الإلكترونات. فيمكن للإلكترونات أن تكون غير متمركزة جزيئا بين الذرات, ولكن تقضي وقت أطول حول ذرة معين أكثر من ذرة أخرى. وهذا النوع من الترابط غالبا ما يسمي "تساهمي قطبي"
جميع هذه الروابط تكون قوى "بين" الجزيئات وتقوم بإمساك الذرات معا في الجزيء. ويوجد هناك قوى بيج جزيئية والتى تسبب تجاذب أو تنافر الجزيئات. وتتضمه هذه القوى التجاذب الأيوني, الرابطة الهيدروجينية, تجاذب ثنائي قطبي-ثناي قطبي, تجاذب ثنائي قطبي محثوث.
ويعتبر كتاب لينوس باولينج "طبيعة الرابطة الكيميائية" أفضل كتاب على الإطلاق تحدث عن موضوع الروابط الكيميائية.
الرابطة الشاردية (الأيونية)
 مقالة مفصلة: الرابطة الأيونية
مقالة مفصلة: الرابطة الأيونية

يرافق ارتباط الذرات ببعضها تغير في التركيب الإلكتروني لكل من هذه الذرات. فإذا انتقل إلكترون أو أكثر من الذرة الأولى انتقالاً كاملاً إلى الذرة الثانية سميت الرابطة شاردية. تكون الرابطة شاردية عندما ترتبط ذرتان إحداهما ذات كمون تشرد منخفض بأخرى ذات ألفة إلكترونية عالية. مثال ذلك ترابط الكلور مع الصوديوم، حيث ذرة الصوديوم Na ذات كمون تشرد منخفض، والكلور ذو أُلفة إلكترونية عالية. فعندما تقترب الذرتان من بعضهما تتخلى ذرة الصوديوم عن إلكترونها الموجود في الطبقة السطحية، إلى ذرة الكلور التي ترغب بضم هذا الإلكترون إلى طبقتها السطحية كي تمتلئ تلك الطبقة بثمانية إلكترونات. ونتيجة لذلك تصبح ذرة الصوديوم شاردة (أيوناً) موجباً Na+ وتغدو ذرة الكلور شاردة سالبة Cl- ويؤدي تجاذبهما إلى تشكيل رابطة شاردية.
(1) e + (غاز) Na ® Na+ (غاز)
(2) (غاز) Cl + e ® Cl- (غاز)
(3) (صلب) NaCl ® (غاز) Cl- + Na+ (غاز)
تحتاج المرحلة (1) إلى كمية من الطاقة تساوي كمون تشرد الصوديوم، أما المرحلة (2) فتتحرر أثناءها كمية من الطاقة تساوي الألفة الإلكترونية للكلور. كما تتحرر أثناء المرحلة (3) كمية من الطاقة بسبب التجاذب بين الشحنتين المتعاكستين وتدعى الطاقة الشبكية (أو البلورية). وعندما يكون مجموع الطاقتين المتحررتين في (2) و(3) أكبر من الطاقة الممتصة في (1) تتكون الرابطة الشاردية.
تمسك الشوارد المتعاكسة الشحنة بعضها مع بعض بالتجاذب الكهربائي الساكن غير الموجَّه، وتنتظم الشوارد في شبكة بلورية محددة (كما أثبتت طيوف أشعة رونتجن). وبما أن قوى التجاذب الكهرساكن غير موجهة، فإن الترابط الأيوني غير موجّه أيضاً، ويعتمد الشكل البلوري على شحنة الشوارد ونسبة حجمها. ولا يمكن عزل جزيء واحد من المركب، وإنما يمثل المركب الشاردي بأبسط صيغة تدل على نسبة الشوارد في المركب مثل NaCl، CsF، K2S.
وهنالك عدة أنماط تصطف وفقها الشوارد في البلورة بحيث لا يحصل تماس بين الشوارد متماثلة الشحنة، ومن هذه الأنماط النمط المكعبي الذي يتبع له كلوريد الصوديوم وكلوريد السيزيوم وفلوريد الكالسيوم.
ويتبين من الشكل (1) أن كل شاردة تلامس في الواقع الشوارد الست التي تجاورها في الاتجاهات الثلاثة وتعاكسها في الشحنة.

Bent bonds
 مقالة مفصلة: Bent bond
مقالة مفصلة: Bent bond
3c-2e and 3c-4e bonds
الروابط العطرية
 مقالة مفصلة: الأروماتية
مقالة مفصلة: الأروماتية
الرابطة المشتركة (التساهمية)
 مقالة مفصلة: الرابطة التساهمية
مقالة مفصلة: الرابطة التساهمية
لا يمكن في معظم المركبات تفسير الرابطة الموجودة بين الذرات بانتقال الإلكترونات من ذرة إلى أخرى. ففي حالة جزيء الهدروجين، على سبيل المثال، لا يمكن تفسير ارتباط الذرتين ببعضهما عن طريق انتقال الإلكترون من ذرة إلى أخرى وذلك لأنهما تبقيان متماثلتين بعد الارتباط. يفرض في أحوال كهذه أن هنالك اشتراكاً بالإلكترونات بين الذرات المترابطة. وتسمى الرابطة الحاصلة الرابطة المشتركة، وتوجد هذه الرابطة في المركبات العضوية جميعها تقريباً، وفي معظم الأجسام الغازية والسائلة في درجة الحرارة العادية، كما أنها تصادف في بعض المركبات اللاعضوية الصلبة.
وضع لويس Lewis ولانگميير عام 1916 نظرية مفادها أن الرابطة المشتركة تنتج من اشتراك الإلكترونات العزباء بين الذرات المرتبطة، بحيث تشكل هذه الإلكترونات ثنائية إلكترونية يلف كل منهما حول نفسه باتجاه معاكس للآخر بصورة يصبح التشكيل الإلكتروني حول كل ذرة في الجزيء مماثلاً للغاز الخامل ns2np6 أي مثمناً إلكترونياً. وأطلق على هذه النظرية اسم قاعدة الثمانية octet rule أو قاعدة المثمن المنيع.
تنتمي الثنائية الإلكترونية لذرة ما بالقدر نفسه الذي تنتمي فيه للذرة الأخرى المشتركة معها، وتتوضع بين الذرات. والرابطة المشتركة تتوجه وفق محور النواتين للذرتين A وB المشتركتين مثلاً (على خلاف الرابطة الشاردية). يقال إن الرابطة المشتركة بسيطة إذا كان بين الذرتين ثنائية واحدة، وتكون الرابطة ثنائية (مضاعفة) عند ارتباط الذرتين بثنائيتين إلكترونيتين، وقد تكون ثلاثية عند وجود ثلاث ثنائيات إلكترونية بين الذرتين المرتبطتين. إن الرابطة الأحادية بين الذرتين A وB أطول وأضعف من الرابطة الثنائية بينهما، وهذه بدورها أطول وأضعف من الرابطة الثلاثية بينهما.
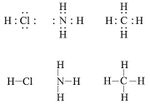
تتحقق صحة قاعدة المثمَّن المنيع، كما في الصيغ المفصلة في الشكل (2) للجزيئات HCl وNH3 وCH4 من أجل الذرات ذات العدد الذري الذي لا يختلف إلا قليلاً عن العدد الذري للغاز النادر، وفي جزيء الهدروجين H2 تتمتع كل ذرة ببنية غاز الهيليوم. ويرمز للرابطة الأحادية في الصيغة المفصّلة إما بثنائية إلكترونية أو بخط.
إن الإلكترونات في الطبقة السطحية فقط هي التي تشترك في تشكيل الرابطة ولذا تدعى هذه الإلكترونات، إلكترونات التكافؤ، ويشار إليها بنقاط توضع حول رمز العنصر.
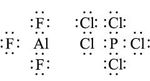
طرحت هذه المفاهيم حول الرابطة المشتركة قبل ولوج الميكانيك الموجي الذي سمح بالتحقق منها، كما أنه فسر الحالات التي لا تنطبق عليها قاعدة المثمن الإلكتروني مثل فلوريد الألمنيوم AlF3 الذي لا يضم فيه محيط الألمنيوم سوى ستة إلكترونات فقط، وكذلك تضم ذرة الفسفور عشرة إلكترونات في خماسي كلوريد الفوسفور PCl5.
وغير ذلك من الحالات التي يكون فيها العدد الكلي للإلكترونات فردياً:
أو غير ذلك من الحالات التي وقفت فيها نظرية لويس عاجزة عن تفسير الظواهر التجريبية. مثال ذلك جزيء الأكسجين ذو الصيغة المفصلة :Ö: :Ö: التي لا تتفق مع خواص الجزيء المغنطيسية. إذ دلت هذه الخواص على وجود إلكترونين فرديين (غير متزاوجين).
يعتمد المفهوم الحديث للرابطة المشتركة على نظريتين أساسيتين هما نظرية رابطة التكافؤ valence bond theory ونظرية المدارات الجزيئية molecular orbital theory وهما تعتمدان على الميكانيك الموجي. وتنتج الرابطة في هاتين الطريقتين من تراكب overlap المدارات الذرية الموافقة للذرات المرتبطة.
تعتبر نظرية المدارات الجزيئية الجزيء وحدة، بحيث أن الإلكترونات تقع تحت تأثير جميع النوى والإلكترونات الأخرى. وتسمى المدارات التي تحتلها الإلكترونات في الجزيء المتشكل مدارات جزيئية وهي مشابهة للمدارات الذرية، ولكل من هذه المدارات سوية طاقة معينة.
نظرية رابطة التكافؤ
 مقالة مفصلة: نظرية رابطة التكافؤ
مقالة مفصلة: نظرية رابطة التكافؤ
وبحسب نظرية رابطة التكافؤ تفقد الإلكترونات الرابطة هويتها الفردية، وتتوضع بين الذرات المؤلفة للرابطة المشتركة المتشكلة بين الذرتين A وB على سبيل المثال. وتبقى المدارات الذرية التي تحوي الإلكترونات التي لا تسهم في الرابطة بتاتاً على حالها.
وتدرس هذه النظرية كل ثنائية إلكترونية بصورة مستقلة عن باقي الجزيء. وبعبارة أخرى، عندما تتشكل الرابطة المشتركة فإن أحد إلكتروناتها العائد لكل ذرة يفقد شخصيته، ويتوضَّع في المدارات الذرية الخارجية للذرتين المؤلِّفتين.
تتغير سويات الطاقة لمعظم الإلكترونات في الذرة عندما تشترك الذرة في تشكيل جزيء ما، مما يجعل طريقة المدارات الجزيئية أدق من طريقة رابطة التكافؤ التي تتميز ببساطتها.
فجزيء الهدروجين H2، وهو أبسط جزيء، مؤلف وفقاً لنظرية المدارات الجزيئية من بروتونين يبعدان عن بعضهما مسافة معينة، وإلكترونين يحتلان مكاناً لهما حول البروتونين يتعين بتأثير الجزيء بكامله. أما حسب الطريقة الثانية، فالجزيء مؤلف من ذرتين قريبتين من بعضهما، بحيث يتداخل المدار s1s من الذرة الأولى مع مدار s1s من الذرة الثانية كما جرى في الطريقة الأولى تماماً، ولكن تبقى كل ذرة محتفظة بمدارها كما لو كانت وحدها والثنائية الإلكترونية متوضِّعة بين الذرتين، وكلا المدارين s1s يمكن أن يحوي إلكترونين معاً لبعض الوقت.
وقد وجد تجريبياً أن النواتين تبعدان عن بعضهما بمقدار 0.74 أنغستروم. إن نصف قطر ذرة الهدروجين في سوية الطاقة الأصغرية يساوي 0.54 أنغستروم، فهذا يدل على أن هناك تداخلاً بين الغمامتين الإلكترونيتين التابعتين لذرتي الهدروجين مما يؤدي إلى منطقة إلكترونية كثيفة نسبياً بين النواتين. تُضعِف هذه الكثافة الإلكترونية التنافرَ بين النواتين، كما تؤدي بسبب جذبها المشترك من النواتين في الوقت ذاته إلى تكوين رابطة موجَّهة وفق الخط الذي يصل بين هاتين النواتين. يضاف إلى ذلك أن اللف الذاتي spin لزوج الإلكترونات متعاكس مما يؤدي إلى تجاذب مغنطيسي بينهما يفوق التنافر الكهربائي، وهو السبب نفسه الذي يجعل مداراً ما يتسع إلى إلكترونين شريطة أن يكون لفاهما الذاتيان متعاكسين.
مقارنة بين رابطة التكافؤ ونظرية المدار الجزيئي
قطبية الروابط
يؤدي اختلاف جذب الذرات المختلفة للإلكترونات المشتركة بين الذرتين في الجزيء المعتدل إلى أن تكون بعض الروابط قطبية polar وبعضها الآخر غير قطبية nonpolar. ففي حالة الجزيئات التي يتألف كل منها من ذرتين، تكون الرابطة غير قطبية إذا كانت الذرتان متماثلتين، وتكون قطبية إذا كانت الذرتان مختلفتين. ففي جزيء الهدروجين، مثلاً، يكون التشارك بالزوج الإلكتروني متساوياً.
أما في حالة HCl فلا ينطبق مركز الشحنة الموجبة على مركز الشحنة السالبة الذي هو أقرب إلى نواة ذرة الكلور منه إلى نواة ذرة الهدروجين. وهكذا تبدو ذرة الهدروجين بالنتيجة وكأنها مشحونة بشحنة موجبة جزئية تساوي بالقيمة المطلقة الشحنة السالبة الكائنة على ذرة الكلور، علماً بأن الجزيء ككل لا يزال معتدلاً كهربائياً.
الكهرسلبية
وجد أنه من الممكن التعبير عددياً عن ميل ذرة ما لجذب الإلكترونات نحوها في الجزيء المعتدل عندما تكون طرفاً في رابطة مشتركة مع غيرها من ذرات العناصر الأخرى. يدعى العدد الذي يعبر عن هذه الخاصة كهرسلبية electronegativity العنصر. وتقوم أبسط الطرق المقترحة للتعبير عن هذه الخاصة على أساس أن كهرسلبية عنصر تساوي الوسط الحسابي لكمون تشرده وألفته الإلكترونية.
قاعدة بولنگ في تحديد نوع الرابطة
إن العامل الرئيس في تحديد نوع الرابطة الموجودة في جزيء ما هو كهرسلبية الذرات التي يحويها ذلك الجزيء. وقد وجد العالم بولنغ Pauling الذي درس الرابطة الكيمياوية دراسة مستفيضة أنه كلما ازداد الفرق في الكهرسلبية بين العنصرين المترابطين ازدادت الصفة الشاردية في المركب الناتج. وبصورة عامة، إذا كان الفرق في الكهرسلبية بين العنصرين يتعدى 1.7 كان المركَّب شاردياً أكثر منه مشتركاً، وإذا كان أصغر من 1.7 غلبت على المركَّب الصفة المشتركة، وإذا قارب الفرق 1.7 كان المركب 50% شاردياً.
وبحسب هذه القاعدة الإجمالية تكون مركبات المعادن الكهرجابية مع اللامعادن مركبات تغلب عليها الصفة الشاردية.
الرابطة المشتركة التساندية
الرابطة المشتركة التساندية coordinate covalent bond هي رابطة مشتركة إلا أن إحدى الذرتين فقط تقدم ثنائية إلكترونية وتقدم الذرة الأخرى مداراً فارغاً، ففي جزيء [[أكسيد الكربون]ي CO، يوجد في ذرة الأكسجين O ستة إلكترونات تكافئية وذرة الكربون أربعة إلكترونات تكافئية، تشارك الذرتان بثنائيتين إلكترونيتين وتتشكل رابطة مشتركة مضاعفة فيصبح حول الأكسجين ثمانية إلكترونات وحول الكربون ستة إلكترونات فقط ويبقى في الكربون مدار ذري فارغ، لذلك تمنح ذرة O ثنائيةً إلكترونية إلى ذرة C فيصبح حول C أيضاً ثمانية إلكترونات. يُرمَز لهذه الرابطة عادة بسهم يتجه من الذرة المانحة donor إلى الذرة المستقبِلة:
تصادف الرابطة التساندية في زمرة كبيرة من المركَّبات تدعى المركبات المعقدة complex أو التساندية coordinate مثل شاردة الفضة النشادرية وشاردة النحاس المميهة .
وفي جميع هذه الأحوال يمنح الجزيء المعتدل NH3)أو (H2O زوج الإلكترونات بينما تقوم الشاردة المعدنية بدور الآخذ acceptor.
أشكال الجزيئات
تستعمل النقاط والخطوط والصيغ الإلكترونية لتمثيل الجزيئات المختلفة، ولكن ذلك لا يعطي أي فكرة عن التوزيع الفراغي للغمامات الإلكترونية وبالتالي لا يدل على شكل الجزيء، فالجزيئات التي تحوي ذرتين فقط خطية دون شك، أما الجزيئات التي تحوي أكثر من ذرتين فأمرها ليس بتلك البساطة. والمعطيات الرئيسة لهذا الأمر هي أشكال الغمامات الإلكترونية للذرات التي تترابط مع بعضها لتشكيل الجزيء. ففي جزيء الماء مثلاً H2O الزاوية HOH تبلغ 31 َ 104 ْ ، والميثان CH4 له شكل رباعي وجوه tetrahedron يحتل الكربون مركزه بينما تقع ذرات الهدروجين في رؤوسه الأربعة، والزاوية HCH تبلغ َ28 109 ْ.
ولكل مركَّب كيمياوي شكل بنيوي معين يتوقف على نوع الرابطة التي تربط بين ذراته وخواص هذه الذرات. وتختلف المركبات الشاردية بصورة رئيسة عن المركبات المشتركة. فالبناء في الأولى عبارة عن شوارد تصطف وفق نظام معين ويحصل الترابط عن طريق التجاذب الكهربائي، بحيث لا يكون هنالك اتجاه معين ترتبط وفقه الشاردة. أما في المركبات المشتركة، فالرابطة موجهة أي ذات اتجاه معين في الفراغ إذ إنه يوجد زوايا معينة ومميزة بين الروابط المختلفة في الجزيء نفسه.
المدارات الهجينة
تعتمد نظريات الرابطة المشتركة على التزاوج الإلكتروني ولا تأخذ بالاعتبار تماثل الروابط الناتجة من حيث المتانة والطول. فعند تشكل BeCl2، على سبيل المثال، تنشأ رابطتان بين ذرة بريليوم وذرتي كلور وذلك نتيجة تحرض إلكترون من s2s 2إلى p2p ليصبح تركيبها التكافئي s2s1p2p1 ، وهذه تشكل رابطتين مع مداري 2p لذرتي كلور، وهنا يبرز السؤال هل الارتباط بين s 2s وp2p يكافئ الارتباط بين ,s2p وp3p. وبما أن شكل المدار s يختلف عن شكل المدار p فإن الرابطتين يجب أن تكونا مختلفتين عن بعضهما من حيث طاقة الرابطة وطولها. إلا أن التجربة أثبتت أن الرابطتين Be−Cl متماثلتان تماماً. لذلك كان لابد من إضافة مفهوم جديد عن الرابطة المشتركة. وقد أدخل سليتر Slater وبولنغ نظرية المدارات الذرية الهجينة لتفسير التماثل في الروابط. تعتمد هذه النظرية على جمع المدارات الذرية أو التوابع الموجية الممثلة لها جمعاً جبرياً فينتج مدارات جديدة متماثلة تدعى المدارات الهجينة، وتسمى العملية نفسها بعملية التهجين hybridization. تتشكل عند اندماج المدارات الذرية التكافئية بعضها مع بعض مدارات هجينة متماثلة يساوي عددها عدد المدارات المندمجة للذرة ذاتها، وتتوزع الإلكترونات التكافئية على المدارات الهجينة كما هي الحال عند توزعها على المدارات الذرية، وتتماثل كافة المدارات الهجينة فيما بينها وتختلف بتوجهها الفراغي الذي تحدده المدارات الموجهة p وd، ويجب أن يكون التنافر بينها أصغرياً أو التباعد بين الإلكترونات التي ستملأ المدارات الهجينة أعظمياً.
يمكن تشبيه عملية التهجين في BeCl2 بصورة تقريبية بمزج علبة من الدهان الأسود مع علبة من الدهان الأبيض بحيث تنتج علبتان من الدهان الذي لا هو أبيض ولا هو أسود وإنما رمادي.
يلجأ إلى عملية التهجين في كثير من المركبات المشتركة، كما يمكن أن يشترك في عملية التهجين عدد مختلف من المدارات يراوح بين الاثنين، كما في BeCl2 والثمانية. ويتوقف الشكل الفراغي للجزيء على نمط التهجين الحاصل فيه.
مقارنة بين صفات المركبات الشاردية والمركبات المشتركة
ـ إن الوحدات البنائية في المركبات الشاردية هي الشوارد أما في المركبات المشتركة فوحدة البناء هي الجزيء نفسه.
ـ إن الترابط بين الوحدات البنائية في المركب الشاردي أقوى بكثير من الترابط بين الوحدات في المركب المشترك. فالترابط الأول شاردي أما الثاني فمن نوع الرابطة الهدروجينية أو التجاذب الكهربائي القطبي أو رابطة فان درفالس. ولذلك فإن المركبات الشاردية هي أجسام صلبة في درجة الحرارة العادية. أما المركبات المشتركة فسوائل أو غازات وقد تكون صلبة ولكن بنيتها تكون هشة ضعيفة، مثال ذلك الزيوت النباتية المهدرجة.
ـ تنقل المركبات الشاردية الكهرباء عندما تكون في الحالة المصهورة أو في حالة محلول، لأن الشوارد تصبح قادرة على الحركة، وبالمقابل فإن المركبات المشتركة نواقل ضعيفة جداً في الحالة المصهورة.
ـ تنحل المركبات الشاردية في الماء إلا عندما تكون الرابطة الشاردية قوية جداً بحيث لا يستطيع جزيء الماء القطبي أن يكسرها. المركبات المشتركة غير القطبية (مثل CH4) ضعيفة الانحلال، بصورة عامة في الماء، والمركبات القطبية (مثل HCl) تنحل في الماء في معظم الأحيان.
الروابط المعدنية
 مقالة مفصلة: الروابط المعدنية
مقالة مفصلة: الروابط المعدنية
هناك نموذجان لتفسير الرابطة المعدنية metallic bond يسمى الأول نموذج الإلكترون الحر ويسمى الثاني نظرية الحزم أو العصائب band theory.
نظرية الإلكترون الحر
تستند هذه النظرية إلى أن المعادن الواقعة إلى اليسار من الجدول الدوري تحتوي على واحد أو اثنين من إلكترونات التكافؤ خارج طبقاتها الممتلئة. ولهذا تصبح الطبقة الممتلئة حاجزاً بين النواة الموجبة الشحنة وإلكترونات التكافؤ، وبهذا تصبح عملية فقدان هذه الذرات لإلكترونات التكافؤ أسهل، وعند تقارب ذرتي معدن كالصوديوم (عدده الذري 11) من بعضهما فإن إلكترونات s3s تبدأ بالتداخل على مسافة بينية واسعة نسبياً، فإذا كان اللفان الذاتيان للإلكترونين متعاكسين، أدى هذا التداخل إلى تشكيل رابطة مشتركة أحادية تحتوي على زوج إلكتروني، وعند اقتراب ذرة صوديوم ثالثة تحتوي على إلكترون ss3s من الذرتين السابقتين فإن هذه الذرة سوف تُرفَض لأن مدار s3s مشبع سلفاً. لذلك يتم تحفيز (رفع) الإلكترون الثالث إلى مستوى طاقة أعلى، أي إلى p3p مثلاً. وعليه فإن الإلكترون الثالث يحتل مداراً مختلفاً عن الاثنين الآخرين وذلك بموجب متطلبات مبدأ باولي Pauli exclusion principle. وبإمكان الإلكترون الثالث في هذا المدار تكوين رابطة مشتركة جديدة مع أي واحد من إلكترونات التكافؤ للذرتين الأوليتين. وبالطريقة نفسها، يتمكن عدد أكبر من الذرات إحاطة ذرة صوديوم واحدة، حيث يتناوب إلكترون الذرة المركزية مع إلكترونات الذرات المحيطة لتكوين رابطة مشتركة، أي زوج إلكتروني مشترك. إن رابطة الزوج الإلكتروني في هذه الحالة ستكون أصغر من رابطة الزوج الإلكتروني الاعتيادية. يمكن وصف هذه الرابطة بكونها رابطة مشتركة غير مشبَعة.
يعطي هذا الشرح الصورة الآتية لنظرية الإلكترون الحر: تصبح الذرات بعد أن تتجرد من إلكترونات تكافئها أيونات موجبة محاطة «ببحر» من الإلكترونات. وهذه الإلكترونات تشكل «غمامة» إلكترونية تتخلل الترتيب الدوري المنتظم للأيونات الموجبة. وهذا الترتيب الكلي يكون مقيداً بقوى التجاذب الكهراكدة الموجودة بين الأيونات المعدنية الموجبة والغاز الإلكتروني السالب. تعتبر هذه النظرية الرابطةَ المعدنية رابطة مشتركة غير مشبعة ومشابهة تقريباً للرابطة الشاردية، ولكنها أضعف من كليهما.
نجحت نظرية الإلكترون الحر في تفسير الخواص الفيزيائية للمعادن، إلا أنها أخفقت في تعليل الخواص المعدنية لبعض البلورات غير المعدنية من دون غيرها من البلورات غير المعدنية الأخرى، كما أنها أخفقت في تعليل بساطة البنية البلورية للمعادن. إذ ثبت بوساطة أشعة رونتجن أن للمعادن بنية متراصة بحيث تلامس كل ذرة ثماني ذرات أو اثنتي عشرة ذرة، أي هي من نوع المكعب أو سداسي الوجوه دون غيرها من البنى البلورية.
نظرية الحزم أو العصائب
تعتمد هذه النظرية على نظرية المدارات الجزيئية، حيث تتداخل المدارات الذرية مع بعضها متحولة إلى مدارات جزيئية تخص البلورة بكاملها. وتدعى هذه المدارات الجزيئية «المشاعة» الحزم الإلكترونية، وهي تابعة إلى البلورة بكاملها وليس إلى الذرات. تتميز ذرات المعادن باحتوائها على مدارات كثيرة وإلكترونات تكافؤ قليلة، لذلك ستكون هذه المدارات الجزيئية الناتجة عن التداخل مملوءة جزئياً بالإلكترونات، وبالتالي تكون هذه الإلكترونات سهلة الحركة مما يفسر الناقلية الكهربائية للمعادن.
إن المدارات الخارجية في المعدن وإلكتروناته في هذه المدارات هي التي تسلك السلوك السابق. أما الإلكترونات في الطبقات الداخلية بذرات المعدن المختلفة فتبقى متوضِّعة في أماكنها في المدارات الذرية. ويمكن النظر إلى البلورة المعدنية، وكأنها اصطفاف هندسي لأيونات المعدن الموجبة في بحر من الإلكترونات المشاعة. وقد نجحت هذه النظرية في تفسير الخواص المعدنية الفيزيائية جميعها.
الترابط بين الجزيئات
 مقالة مفصلة: قوة الجزيئات
مقالة مفصلة: قوة الجزيئات
إن وجود الجزيئات قريبة بعضها من بعض يجعلها عرضة للتجمع الجزيئي. ويندر أن يوجد، في درجة الحرارة العادية، جزيء معزول عزلاً تاماً دون أي ارتباط بالجزيئات الأخرى المجاورة. هذه الروابط الموجودة بين الجزيئات أو بين الشوارد والجزيئات، هي من طبيعة كهربائية، وهي أضعف بكثير من الروابط الموجودة بين الذرات سواء كانت هذه الروابط شاردية أو مشتركة، لأنه لا يوجد في درجة الحرارة العادية جزيئات شاردية منعزلة بل توجد بلورة تنتظم فيها الشوارد وفق ترتيب معين.
ثمة أنواع عدة للترابط الجزيئي أهمها الرابطة الهدروجينية ورابطة فان درفالس.
الرابطة الهدروجينية
توصف هذه الرابطة بالجسر الهدروجيني، وتصادف غالباً بين الجزيئات السائلة أو الصلبة، وهي عبارة عن ثنائي قطب - ثنائي قطب، وتنشأ بين الجزيئات التي تحتوي على الهدروجين وعنصر آخر شديد الكهرسلبية مثل الآزوت، والأكسجين، والفلور. ويعبَّر عن هذه الرابطة بين ذرتين A وB بالشكل المنقط A−H…B، فالرابطة بين الذرة A وH من طبيعة مشتركة بينما هي بين B وH هدروجينية.
ففي فلوريد الهدروجين، على سبيل المثال، الرابطة الهدروجينية واضحة وموجودة حتى بالحالة الغازية، وقد وجد أن غاز فلوريد الهدروجين يتألف من H2F2, H3F3, H4F4, H5F5, H6F6. وهي عبارة عن سلاسل تتناوب فيها شوارد الفلور وشوارد الهدروجين.
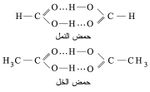
توجد هذه الرابطة أيضاً في المركبات العضوية التي تحوي زمرة الهدروكسيل كما توجد في البروتينات. وقد وجد أن حمض الخل وكذلك حمض النمل يوجدان في الحالة السائلة على شكل وحدات تتألف كل منها من جزيئين من الحمض بسبب تلك الرابطة:
تؤثر الرابطة الهدروجينية تأثيراً واضحاً في الصفات الفيزيائية للمواد التي توجد فيها. ويمكن ملاحظة ذلك من مقارنة درجات غليان المركبات الهدروجينية للفصيلتين VIA وVIIA (الفصيلتين الرئيستين السادسة والسابعة في الجدول الدوري) ودرجات انصهارها (الجدول1). مركبات هدروجينية لعناصر الفصيلة VIA درجة الانصهار (سْ) درجة الغليان (سْ)
مركبات هدروجينية لعناصر الفصيلة VIIA درجة الانصهار (سْ) درجة الغليان (سْ) H2O 0 100 HF -83 19 H2S -85 -61 HCl -111 -85 H2Se -60 -42 HBr -87 -67 H2Te -50 -2 HI -51 -35 الجدول (1)
يتضح من الجدول أن درجات غليان المركبات الهدروجينية لكل من عناصر الفصيلتين VIA وVIIA، ودرجات انصهار هذه المركبات تتناقص بالتدريج بتناقص الوزن الجزيئي، ولكنها ترتفع فجأة بشدة في بداية كل من الفصيلتين بسبب الرابطة الهدروجينية القوية في كل من الماء وفلوريد الهدروجين. فدرجة غليان HF هي 19 ْس بدلاً من -100 ْس التي هي درجة الغليان المتوقعة لولا الرابطة الهدروجينية، وكذلك حالة الماء الذي يتوقع أن تكون درجة غليانه -80 ْ س لولا وجود الرابطة الهدروجينية. تؤدي هذه الرابطة إلى ترابط الجزيئات مع بعضها، الأمر الذي يتطلب طاقة حرارية إضافية لكسر هذا الترابط.
رابطة فان درفالس
وجد أن جميع الجزيئات تتجاذب مع بعضها تجاذباً ضعيفاً نتيجة الفعل المتبادل بين النوى والإلكترونات. ويعود انحراف الغازات الحقيقية عند ضغطها عن قوانين الغازات الكاملة إلى التجاذب الضعيف بين جزيئات هذه الغازات أو ذراتها. وتوجد هذه القوى في السوائل والأجسام الصلبة أيضاً. ويطلق على هذه القوى اسم قوى فان درفالس Van der Waals. فمن الممكن أن تكون الذرة أو الجزيء متناظرة كهربائياً، إلا أن حركة الإلكترونات السريعة والمستمرة يولّد فيها في لحظة معينة ثنائي قطب يتغير مع الزمن في قيمته واتجاهه بحيث تكون محصلته في الذرة الحرة أو الجزيء الحر مساوية الصفر. فإذا وجد جزيئان (أو ذرتا غاز خامل) A وB قريبين من بعضهما، في هذه الحال هنالك عدة قوى تجاذب وتنافر تعمل بين هذين الجزيئين: تنافر بين إلكترونات A وB، تجاذب بين إلكترونات A ونوى أو نواة B، تجاذب بين إلكترونات B ونوى أو نواة A، وأخيراً تنافر بين نوى أو نواة A ونوى أو نواة B. تتوقف شدة هذه القوى على المسافة بين A وB، وقد وجد أن محصلتها هي قوة تجاذب ضعيف عندما تلامس هذه الجزيئات بعضها بعضاً، أما إذا اقتربت أكثر من ذلك فيحصل تنافر بسبب اقتراب الغمامات الإلكترونية للجزيئين من بعضها.
تمكّن هذه القوى الضعيفة من تمييع غاز أو تجميده في درجات منخفضة من الحرارة. وليست درجة الغليان إلا مقياساً للطاقة التي يجب بذلها للتغلب على هذه القوى كي ينطلق الجسم على شكل جزيئات منفردة في معظم الأحيان. وهذا يدل على أن درجة الغليان تزداد بازدياد قوى فان درفالس السائدة بين جزيئات المادة. وبما أن هذه القوى تزداد بازدياد عدد الإلكترونات الموجودة في الجزيء وبالتالي بازدياد الوزن الجزيئي للمادة، فهذا يعني أنه إذا كانت هذه القوى هي الوحيدة التي تربط الجزيئات ببعضها، فإن درجة الغليان تزداد بازدياد الوزن الجزيئي. وقد وجد أن هذه النتيجة صحيحة في كثير من الأحوال خصوصاً في حالة المركِّبات غير القطبية. وقد درس لندن London هذه القوى وفق قوانين نظرية الكم بشكل مفصّل.[1]
الروابط في الصيغ الكيميائية
الروابط الكيميائية القوية
| Typical bond lengths in pm and bond energies in kJ/mol. Bond lengths can be converted to Å by division by 100 (1 Å = 100 pm). Data taken from [1]. | ||
| Bond | Length (pm) |
Energy (kJ/mol) |
|---|---|---|
| H — Hydrogen | ||
| H–H | 74 | 436 |
| H–O | 96 | 366 |
| H–F | 92 | 568 |
| H–Cl | 127 | 432 |
| C — Carbon | ||
| C–H | 109 | 413 |
| C–C | 154 | 348 |
| C–C= | 151 | |
| =C–C≡ | 147 | |
| =C–C= | 148 | |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
| C–N | 147 | 308 |
| C–O | 143 | 360 |
| C–F | 134 | 488 |
| C–Cl | 177 | 330 |
| N — Nitrogen | ||
| N–H | 101 | 391 |
| N–N | 145 | 170 |
| N≡N | 110 | 945 |
| O — Oxygen | ||
| O–O | 148 | 145 |
| O=O | 121 | 498 |
| F, Cl, Br, I — Halogens | ||
| F–F | 142 | 158 |
| Cl–Cl | 199 | 243 |
| Br–H | 141 | 366 |
| Br–Br | 228 | 193 |
| I–H | 161 | 298 |
| I–I | 267 | 151 |
انظر أيضاً
- المدار الذري
- طاقة الترابط
- طاقة تفكك الرابطة
- الرابطة المزدوجة
- الجدول الدوري
- مثلث فان أركيل-كيتلار
- رابطة 3-مركز-2-إلكترون
- الترابط الغير تساهمي
الراجع
- W. Locke (1997). مقدمة لنظرية المدار الجزيئي. 18 مايو 2005.
- كارل أر. نافي. الفيزياء المتقدمة. 18 مايو 2005.
المصادر
- ^ نصوح علايا. "الرابطة الكيمياوية". الموسوعة العربية.
- ويكيبيديا الإنجليزية .
وصلات خارجية
- W. Locke (1997). Introduction to Molecular Orbital Theory. Retrieved May 18, 2005.
- Carl R. Nave (2005). HyperPhysics. Retrieved May 18, 2005.
- Linus Pauling and the Nature of the Chemical Bond: A Documentary History. Retrieved February 29, 2008.