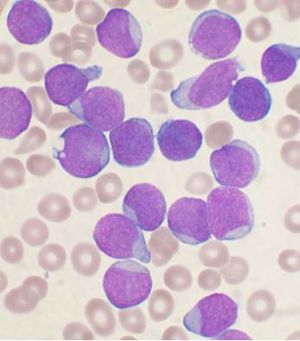
ابيضاض الدم الليمفاوي الحاد
أبيضاض الدم الليمفاوي الحاد إنگليزية: Acute Lymphocytic Leukemia هو مرض سرطاني يحدث بسبب تكاثر غير طبيعي للخلايا الأرومية الليمفاوية في نخاع العظم. يتم تشخيص 4000 حالة سنويا في الولايات المتحدة وبمعدل إصابة 1.4/100000 شخص. يصيب البالغين وخاصة من عمر الخمسين فما فوق، ويعد من أكثر السرطانات شيوعا في مرحلة الطفولة وخاصة ما بين الأطفال من 3-7 سنوات حيث يشكل ما نسبته 30% من الأمراض السرطانية التي تصيب الأطفال.
يعد أبيضاض الدم الليمفاوي الحاد الذي يصيب الخلية الليمفاوية من نوع B الأكثر شيوعا ونسبة الأصابة به ما بين الذكور والإناث متساوية، على عكس المرض الذي يصيب الخلية الليمفاوية من نوع T حيث تظهر الإحصاءات نسبة اصابة أعلى في الذكور من الإناث 1.3: 1.0.
سبب الإصابة
مقالة رئيسية أبيضاض الدم؛ مسببات المرض
لا يعرف ماهو المسبب الرئيسي للمرض إلا أن الإشعاعات الناتجة من القنبلة الذرية وبعض المركبات الكيميائية مثل البنزين يكون لها دور في التسبب بالمرض.
الأعراض
تظهر الأعراض تدريجيا عاى المريض وقد تأخذ أسابيع إلى عدة أشهر وقد تظهر بشكل مفاجئ وحاد. تكون الأعراض بشكل عام:
- شحوب وضيق في النفس وبعض التوعكات وذلك بسبب فقر الدم الحاصل.
- ارتفاع حرارة المريض وذلك بسبب تكاثر الخلايا السرطانية.
- آلام في المفاصل والعظام بسبب تسلل الخلايا السرطانية للسمحاق وتآكل العظم. مما يسبب اضطرابات في المشي وخاصة عند الأطفال مما يجعلهم رافضين للمشي على الأقدام
- كدمات ونزيف تحت الجلد ونزيف من اللثة نتيجة نقص الصفائح الدموية.
- تضخم في الكبد والطحال والغدد الليمفاوية.
- يظهر ما نسبته 2% من حالات الإصابة بالمرض عند الأطفال وجود الخلايا السرطانية في سائل النخاع الشوكي مما يسبب صداع وتقيأ. وما نسبته 10% عند البالغين.
- وجود بعض الأورام في منطقة الصدر وخاصة عند البالغين المصابين بالمرض من نوع السلسلة T.
التصنيف
تم تصنيف المرض بالاعتماد على شكل الخلايا السرطانية أو النمط الظاهري المناعي بواسطة مجموعة من العلماء الفرنسيين والأميركيين والبريطانيين (فاب) إلى:
- تصنيف حسب شكل الخلايا السرطانية:
- L1 وتكون الخلايا الأرومية موحدة الشكل وصغيرة وتتميز أيضا بقلة ومحدودية سائل السايتوبلازم.
- L2 وتكون الخلايا الأرومية أكبر من النوع السابق ومتغير وكذلك وجود نوية ويكون سائل السيتولازم أكثر تعقيدا لاحتوائه على بعض العضيات.
- L3 خلايا أرومية أكبر من الأنواع السابقة مع نوية أكثر بروز ونضج من النوية السابقة وسائل سايتوبلازمي شديد القاعدية ووجود بعض الفجوات فيه.
- النمط الظاهري المناعي:
و يتم تقسيم المرض إلى نوعين وذلك بحسب عناقيد التمايز (Clusters of Differentiation) الموجوده على الخلايا الآرومية
- أبيضاض دم ليمفاوي حاد من نوع B وتصل نسبتها إلى 78% من الحالات.
- أبيضاض دم ليمفاوي حاد من نوع T تشكل 22% من حالات الإصابة.
الإمراض الجزيئي
وجد العديد من الاضطرابات والاعتلالات الجزيئية في مرضى أبيضاض الدم الليمفاوي الحاد من أهمها:
- الإتحاد الجيني ما بين المورثة ABL والمورثة BCR (أو كما يعرف بكروموسوم فيلادلفيا) الناتج من الانتقال المكاني بين الكروموسومين 9 و 22 (t(9;22)q(34;q11 مما يؤدي إلى عمليات نقل إشارة لبروتينات لها دور في نمو الخلايا. 20-30% من حالات الإصابة عند البالغين، بينما لا تتعدى أكثر من 3% في حالات الإصابة عند الأطفال.
- حدوث طفرات جينية في عدد من العوامل الناسخة التي لها دور رئيسي في عملية تكوين الدم. مثل عملية الانتقال المكاني بين الكروموسومين 12 و 21 (t(12;21)q(13;q22 مما ينتج تجاور للمورثتين AML1 و TEL.
- حدوث اضطرابات في المورثات المثبطة للأورام مثل حذف أجزاء من المورثتين (p16(INK4A و(p15(INK4B
توقعات سير المرض
هناك عدة عوامل ممكن أن تحدد مآل المرض كما يبينها الجدول.
| العوامل المحددة لسير المرض
| |||
| العامل | جيد | سيئ | |
|---|---|---|---|
| عدد كريات الدم البيض | منخفض | مرتفع | |
| الجنس | إناث | ذكور | |
| النمط الظاهري المناعي | B | T | |
| العمر | طفل | بالغ | |
| الوراثة الخلوية | صورة طبيعية أو TEL | كروموسوم فيلادلفيا | |
| مدة إزالة الخلايا الأرومية من الدم | أقل من إسبوع | أكثر من إسبوع | |
| مدة تهدئة المرض | أقل من 4 أسابيع | أكثر من 4 أسابيع | |
| وجود أعراض إصابة الجهاز العصبي المركزي | غير موجودة | موجودة | |
| الحد الأدنى من بقايا المرض | غير موجودة من فترة 1-3 شهور | موجودة بعد 3-6 شهور | |
التشخيص المخبري
- عد كامل لمكونات الدم (Complete Blood Count) وقد يظهر هذا الفحص زيادة في أعداد كريات الدم البيضاء وفي بعض الحالات تكون ضمن العدد الطبيعي. ويظهر الفحص أيضا هبوط في مستوى الهيموكلوبين والصفائح.
- أخد خزعة من نخاع العظم لدراسته نسيجيا. معظم الحالات تظهر وجود أعداد كبيرة من الخلايا الآرومية (ما لا يقل عن 90% من الخلايا).
- التهجين الموضعي المتألق وذلك لدراسة الخلايا السرطانية وملاحظة وجود أية اختلالات وراثية (انتقالات مكانية أو حذف لأجزاء من الكروموسومات). معرفة نوع الاضطراب الخلوي قد يساعد الطبيب على توقع مسار المرض.
- النمط الظاهري المناعي: وذلك بدراسة عناقيد التمايز الموجودة على الخلايا الأرومية وتحديد نوع المرض (B أو T) وهذا العامل أيضا له دور في تحديد مسار المرض.
العلاج
يتم علاج المرض بواسطة عدة طرق مثل العلاج الكيميائي والعلاج بالأشعة وزراعة نخاع العظم الخيفي واستخدام الأضداد وحيدة النسيلة (Monoclonal Antibodies) إلا أن العلاج الأخير ما زال تحت التجارب السريرية.
العلاج الكيميائي
تتم تقسيم عملية العلاج إلى عدة مراحل
1. تهدئة المرض: في هذه المرحلة الهدف الرئيسي من العلاج هي محاولة القضاء على الخلايا السرطانية والوصول إلى مرحلة التهدئة وتتمثل بعدم زيادة نسبة الخلايا الأرومية في نخاع العظم عن 5% وصورة طبيعية للدم المحيطي وعدم وجود أية أعراض للمرض. يتم علاج المريض بواسطة بردنيسلون (Prednislone) وديكساميثاسون (Dexamethasone) وفينكريستين (Vincristine) وأسبارجنيز (Asparginase). يتم الوصول إلى التهدئة في 90% من الحالات الإصابة بالمرض عند الأطفال و 80 - 90% من حالات الإصابة عند البالغين.
2. تكثيف العلاج: يتم دمج عدة أدوية مع بعضها وتعطى للمريض بهدف محاولة القضاء على المرض أو تقليل الخلايا السرطانية بشكل كبير إلى مستويات ضئيلة جدا. أدوية مثل فينكريستين (Vincristine) وسيكلوفوسفامايد (cyclophsphamide) وسايتوسين أرابينوسايد (Cytosine Arabinoside) وثايوكوانين (Thioguanine) وإيتوبوسايد (Etoposide) ومركابتوبيورين (Mercaptopurine) تعطى للمريض على شكل توليفات مختلفة حسب حالة المريض وقدرته على التحمل.
3. مداومة العلاج: وتستمر من 2-3 سنوات، يعطى المريض جرعة يومية عن طريق الفم من مركابتوبيورين (Mercaptopurine) وجرعة إسبوعية من ميثوتركسيت (Methotrexate). يتم تقليل العلاج تدريجيا عن التأكد من عدم وجود الحد الأدنى من بقايا المرض (Minimal Residual Disease).
في بعض الحالات التي يتم فيها انتشار الخلايا السرطانية في الجهاز العصبي المركزي يتم علاج المريض بواسطة ميثوتركسيت (Methotrexate) أو عن طريق التشعيع القحفي (Cranial Irradiation) إلا أنه بفضل عدم استخدام التشعيع القحفي مع المصابين من الأطفال.
طرق أخرى للعلاج
- زراعة نخاع العظم الخيفي في بعض الحالات التي لا تبدي أي تقدم أو تحسن عند استخدام العلاج الكيميائي. إلا أن لهذا العلاج يتوجب بعض الشروط مثل عمر المريض وحالته ووجود متبرع مناسب، وينطوي هذا العلاج على بعض المخاطر مثل عدم نجاح الزراعة مما يؤدي إلى تحفيز المريض مناعيا ومرض المريض ضد الطعم.
- استخدام علاج إيمينتاب للمرضى المصابين بكروموسوم فيلادلفيا ويظهرون وجود الإتحاد الجيني BCR-ABL.
- استخدام الأضداد وحيدة النسيلة. ويتم توجيه هذه الأضداد إلى الخلايا السرطانية بحسب عناقيد التمايز التي تظهرها. أظهرت الأبحاث أن استخدام روتكسيماب (Rituximab) -موجه ضد عنقود التمايز 20- وكامباث 1 (Campath-1) - موجه ضد عنقود التمايز 52 - مع العلاج الكيميائي يعطي نتائج جيدة. بعض الأدوية لعناقيد تمايز أخرى ما زالت تحت التجارب السريرية
lj.m,.m,.m,.m,.,m.,m.m,.m,.m,.m,.,m.,m.m,.m,.m,.
المراجع
- Dieter Hoelzer and Nicola Gökbuget, Adult Acute Lymphocytic Leukemia. In Hoffbrand V, Tuddenham E and Catovsky D ed. Postgraduate Haematology. Blackwell Publishing;2005:525-541.
- Der-Cherng Liang and Ching-Hon Pui, Childhood Acute Lymphocytic Leukemia. In Hoffbrand V, Tuddenham E and Catovsky D ed. Postgraduate Haematology. Blackwell Publishing;2005:542-560.
- Hoffbrand V, Moss P, Pettit J. Essential Haematology. Blackwell Publishing;2006:159-167.
- Thai M. Cao and Steven E Courte, Acute Lymphocytic Leukemia in adults. In Greer J, Forester J, Lukens J, Rodgers G, Paraskevas F, Glader B ed. Wintrobe's Clinical Hematology, 11th edition. Lippincott Williams and Wilkins Publishing;2004:2077-2096.
- James A. Whitelock and Paul S Gaynon, Acute Lymphocytic Leukemia in Children. In Greer J, Forester J, Lukens J, Rodgers G, Paraskevas F, Glader B ed. Wintrobe's Clinical Hematology, 11th edition. Lippincott Williams and Wilkins Publishing;2004: 2169-2190.
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةNCI2017Pt - ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةNEJM2015 - ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFer2018 - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةInaba2013 - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMDAnd2016 - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةVora2017 - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةBCDtargetedTherapy - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةPaul 1645–1666 - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةBoer2017 - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةGBD2015De