بطارية ليثيوم-أيون
| Battery specifications | |
|---|---|
 بطارية ليثيوم-أيوم لهاتف نوكيا المحمول. | |
| الطاقة/الوزن | 100-250 W·h/كگ [1] (0.36-0.90 MJ/kg) |
| الطاقة/المقاس | 250-620 واط.س/ليتر [2] (0.90-2.23 MJ/L) |
| القدرة/الوزن | ~250-~340 W/kg[1] |
| الشحن/discharge efficiency | 80-90%[3] |
| الطاقة/سعر المستهلك | 2.5 W·h/US$[4] |
| Self-discharge rate | 8% عند 21 °س 15% عند 40 °س 31% عند 60 °س (شهرياً)[5] |
| Cycle durability | 400-1200 العمر [6] |
| Nominal Cell Voltage | 3.6 / 3.7 V |
 مقالة مفصلة: بطارية ليثيوم-أيون تصميم جديد
مقالة مفصلة: بطارية ليثيوم-أيون تصميم جديد
بطارية ليثيوم-أيون (ويرمز لها بطاريات Li-ion) وهي نوع من البطاريات القابلة للشحن وحيث تتحرك فيها أيونات الليثيوم بين الآنود والكاثود. خلال إفراغ الشحنة وبالعكس من الكاثود إلى الآنود في وقت الشحن.
تعد بطاريات الليثيوم-أيون شائعة في الالكترونيات الاستهلاكية. وهي واحدة من أكثر الأنواع شعبية في الإلكترونيات المحمولة. ولا تحوي أثر الذاكرة، وبطء فقد الشحنة عندما لاتكون قيد الإستخدام. بالإضافة لاستخدامات الالكترونيات الاستهلاكية، تتزايد شعبية بطاريات ليثيوم-أيون لأغراض للدفاع، وفي السيارات، ولإستخدامات الفضاء الجوي نظراً لارتفاع كثافتها للطاقة. غير أن بعض أنواع سوء الإستخدام قد تنفجر.
طُوّر نموذج أولي لبطارية الليثيوم أيون بواسطة أكيرا يوشينو في عام 1985، بناءً على بحث سابق قام به جون گودنف، م. ستانلي ويتنگهام، رشيد يازمي و كويتشي ميزوشيما خلال السبعينيات – ثمانينيات القرن الماضي،[7][8][9] ثم طُور بطارية ليثيوم-أيون التجارية بواسطة فريق سوني وأساهي كاسي بقيادة يوشيو نيشي في عام 1991.[10][11]
تختلف خصائص الكيمياء والأداء والتكلفة والسلامة باختلاف أنواع بطاريات الليثيوم-أيون. تستخدم الإلكترونيات المحمولة في الغالب بطاريات ليثيوم پوليمر (مع هلام بوليمر مثل إلكتروليت)، أكسيد كوبالت الليثيوم (LiCoO 2) مادة كاثود، والگرافيت مادة الأنود، والذي يوفرا معاً كثافة طاقة عالية.[12][13]فوسفات حديد الليثيوم (LiFePO 4)، أكسيد منجنيز الليثيوم (LiMn 2O 4 إسپنيل، أو Li 2MnO 3 - المواد ذات الطبقات الغنية بالليثيوم، LMR-NMC)، وأكسيد الكوبالت والنيكل والمنجنيز الليثيوم (LiNiMnCoO 2 أو NMC) قد توفر وقتاً أطول لفترة حياة البطارية وقد يكون لديها قدرة معدل أفضل. تستخدم هذه البطاريات على نطاق واسع للأدوات الكهربائية والمعدات الطبية والأدوار الأخرى. تستخدم NMC ومشتقاتها على نطاق واسع في السيارات الكهربائية.
تشمل مجالات البحث الخاصة ببطاريات الليثيوم أيون إطالة العمر، وزيادة كثافة الطاقة، وتحسين السلامة، وخفض التكلفة، وزيادة سرعة الشحن،[14] من بين أمور أخرى. يجري البحث في مجال الإلكتروليتات غير القابلة للاشتعال كمسار لزيادة الأمان على أساس القابلية للاشتعال والتطاير للمذيبات العضوية المستخدمة في الإلكتروليت (الكهرل) النموذجي. تتضمن الإستراتيجيات بطاريات أيونات الليثيوم المائية، وإلكتروليتات صلبة من السيراميك، وإلكتروليتات پوليمر، وسوائل أيونية، ومجموعة شديدة الفلوَرة.[15][16][17][18]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
طرحت بطاريات الليثيوم لأول مرة من قبل م. ستانلي وايتنگهام، في جامعة بيگهامتون، بينما كان يعمل لصالح شركة إكسون في السبعينيات.[19]فقد استخدم وتينگهام كبريتيد التيتانيوم الثنائي وفلز الليثيوم كأقطاب كهربائية.
اكتُشف الإقحام في الگرافيت المعكوس[20][21] و الإقحام إلى أكاسيد كاثودية[22][23] أيضاً في السبعينيات من قبل ج.أو. بسنهارد في تي يو ميونخ. اقترح بسنهارد أيضاً التطبيق كخلايا ليثيوم عالية الكثافة للطاقة.[24][25] كان تحلل الإلكتروليت (الكهرل) وإقحام المذيبات في الگرافيت من العيوب الشديدة لعمر دورة البطارية الطويل.
تشكل بطاريات الليثيوم الأولية التي يتكون فيها القطب السالب من الليثيوم المعدني مشكلات تتعلق بالسلامة. نتيجة لذلك، تم تطوير بطاريات الليثيوم أيون حيث يتكون كلا القطبين من مادة تحتوي على أيونات الليثيوم.
في جامعة اوكسفورد، إنگلترة، عام 1979، اقترح جون گودنف وك. ميزوشيما بطارية قابلة للشحن بقدرة عالية في حدود 4 ڤولت باستخدام أكسيد الكوبالت ليثيوم (LiCoO2) كقطب موجب وفلز الليثيوم كقطب سالب.[26] قدم هذا الابتكار مادة القطب الموجب ليصبح من الممكن صناعة بطاريات ليثيوم-أيون. LiCoO2 عبارة عن مادة قطبية موجبة مستقرة تعمل كمانح لأيونات الليثيوم، مما يعني أنه يمكن استخدامها مع مادة القطب السالب بخلاف معدن الليثيوم. من خلال تمكين استخدام مواد القطب السالب المستقرة وسهلة الاستخدام، فتحت LiCoO2 مجموعة جديدة كاملة من الاحتمالات لأنظمة بطاريات قابلة لإعادة الشحن جديدة.
في عام 1977، برهن سمر باسو الإقحام الكهروكيميائي لليثيوم في الجرافيت في جامعة پنسلڤانيا.[27][28] أدى ذلك إلى تطوير قطب كهربائي عملي من الليثيوم مقسم من الگرافيت في معامل بل (LiC6)[29]لتوفير بديل لبطارية الليثيوم ذات القطب الكهربائي.
في عام 1980، أظهر رشيد اليزمي أيضاً التبادل الكهروكيميائي العكسي لليثيوم في الگرافيت.[30][31] ستتحلل الإلكتروليتات (الكهارل) العضوية المتوفرة في ذلك الوقت أثناء الشحن إذا تم استخدامها مع قطب كهربائي سلبي من الگرافيت، مما يمنع التطور المبكر للبطارية القابلة لإعادة الشحن التي تستخدم نظام الليثيوم/الگرافيت. استخدم اليزمي إلكتروليتاً صلباً لإثبات أنه يمكن تقطيع الليثيوم بشكل عكسي في الگرافيت من خلال آلية كهروكيميائية. يعد قطب الجرافيت الذي اكتشفه يازمي حالياً القطب الأكثر استخداماً في بطاريات الليثيوم أيون التجارية.
في عام 1983، حدد الدكتور مايكل ثاكيراي، جودنف، وزملاؤهم في العمل إسپنيل المنجنيز كمادة الكاثود.[32]أظهر عملاً الإسبنيل واعداً، نظراً للتكلفة المنخفضة، والليثيوم الإلكتروني التوصيل الأيوني الجيد، وبنيته ثلاثية الأبعاد ، مما يمنحه استقراراً هيكلياً جيداً. على الرغم من أن إسپنيل المنجنيز النقي يتلاشى مع الدوران، إلا أنه يمكن التغلب على ذلك من خلال التعديل الكيميائي للمادة.[33]يستخدم الإسپنيل المنجنيز حالياً في الخلايا التجارية.[34]
في عام 1985، قام أكيرا يوشينو بتجميع نموذج أولي لخلية باستخدام مادة كربونية يمكن إدخال أيونات الليثيوم فيها كقطب واحد، وأكسيد الكوبالت الليثيوم (LiCoO2)، وهو مستقر في الهواء، مثل الآخر.[35] باستخدام مواد بدون الليثيوم المعدني، تم تحسين السلامة بشكل كبير على البطاريات التي تستخدم معدن الليثيوم. أتاح استخدام أكسيد الكوبالت الليثيوم (LiCoO2) تحقيق الإنتاج على نطاق صناعي بسهولة.
كان هذا ميلاد لبطارية الليثيوم-أيون الحالية.
في يونيو 2012، حصل جون گودنوف، رشيد اليزمي وأكيرا يوشينو على وسام إديسون 2012 من أجل تكنولوجيات السلامة والبيئة لتطوير بطارية الليثيوم-أيون.
وقد حُققت تحسينات كبيرة في كثافة الطاقة في التسعينيات من خلال استبدال أنود الكربون الناعم أولاً بالكربون الصلب ثم لاحقاُ بالگرافيت، وهو مفهوم اقترحه في الأصل يورگن أوتو بيسينهارد في عام 1974 ولكنه اعتبر غير ممكن بسبب عدم التوافق مع الإلكتروليتات التي لم يتم حلها بعد ذلك أثناء الاستخدام.[36][37][38]
في عام 2010، كانت الطاقة الإنتاجية العالمية لبطاريات الليثيوم-أيون 20 گيگاواط/ساعة.[39] بحلول عام 2016، كانت 28 گيگاوات ساعة، مع 16.4 گيگاوات ساعة في الصين.[40] تقدر المصادر المختلفة الإنتاج في عام 2021 بما يتراوح بين 200 و600 گيگاوات ساعي، وتتراوح التوقعات لعام 2023 من 400 إلى 1100 گيگاوات ساعي.[41]
التصميم

بشكل عام، يتكون القطب السالب لخلية بطارية الليثيوم-أيون التقليدية من الكربون. يكون القطب الموجب عادةً عبارة عن أكسيد معدن. المنحل بالكهرباء هو ملح الليثيوم في مذيب عضوي.[42]تنعكس الأدوار الكهروكيميائية للأقطاب بين الأنود والكاثود، اعتماداً على اتجاه تدفق التيار عبر الخلية.
الأنود الأكثر شيوعاً للاستخدام التجاري (القطب السالب) هو الگرافيت، والذي يرتبط في حالته الكاملة الليثية من LiC6 بسعة قصوى تبلغ 372 mAh/g.[43] يكون القطب الموجب عموماً واحداً من ثلاث مواد: أكسيد ذو طبقات (مثل أكسيد الكوبالت الليثيوم)، پوليانيون (مثل فوسفات حديد الليثيوم) أو الإسپنيل (مثل أكسيد المنجنيز الليثيوم).[44]تشتمل المزيد من المواد التجريبية على أقطاب كهربائية تحتوي على الگرافين، على الرغم من أنها لا تزال بعيدة عن كونها مجدية تجارياً نظراً لارتفاع تكلفتها.[45]
يتفاعل الگرافيت الليثي، مثل الليثيوم النقي، بقوة مع الماء لتكوين هيدروكسيد الليثيوم (LiOH) والهيدروجين. وبالتالي، عادةً ما يتم استخدام كهرل غير مائي، والحاوية محكمة الغلق تستبعد الرطوبة من عبوة البطارية. عادةً ما يكون الكهرل غير المائي عبارة عن خليط من الكربونات العضوية مثل كربونات الإيثيلين أو كربونات ثنائي إيثيل يحتوي على معقدات أيونات الليثيوم.[46] دائماً ما يكون الملح هو سداسي فلورو فوسفات الليثيوم (LiPF 6)، والذي يجمع بين الموصلية الأيونية والاستقرار الكيميائي والكهروكيميائي. أملاح أخرى مثل فوق كلورات الليثيوم (LiBF 4)، الليثيوم رباعي فلورو بورات (LiBF 4)، والليثيوم ثنائي فلورو الميثان سلفونليميد (LiC 2F 6NO 4S 2) كثيراً ما تستخدم في البحث لأسباب تتعلق بالتكلفة أو الملاءمة، ولكنها غير قابلة للاستخدام في الخلايا التجارية[47]
اعتماداً على خيارات المواد، يمكن أن يتغير الجهد وكثافة الطاقة وعمر وسلامة بطارية ليثيوم أيون بشكل كبير. كان الجهد الحالي يستكشف استخدام بنى جديدة باستخدام تكنولوجيا النانو التي تم توظيفها لتحسين الأداء. وتشمل مجالات الاهتمام مواد الأقطاب الكهربائية على نطاق النانو وهياكل الأقطاب الكهربائية البديلة.[48]
أدى الطلب المتزايد على البطاريات إلى قيام البائعين والأكاديميين بالتركيز على تحسين كثافة الطاقة درجة حرارة التشغيل، والسلامة، والمتانة، وزمن الشحن، وطاقة الإخراج، والتخلص من متطلبات الكوبالت،[49][50]وتكلفة تكنولوجيا بطارية الليثيوم-أيون.
البطاريات المعاصرة
تطوير بطاريات الليثيوم أيون
تعمل شركات السيارات الكبيرة في العالم على إنتاج السيارات الكهربائية. وعلى هذا السبيل فهي تحتاج إلى تطوير بطاريات الليثيوم أيون بحيث تصلح للاستخدام في تحريك السيارة. وقد اختير هذا النوع من البطاريات حيث أنها تلبطاريات الأخرى بالنسبة إلى كثافة سعتها الكهربائية وانخفاض وزنها نسبيا.
وتتكون بطارية الليثيوم أيون التي ستستعمل في السيارت من مصعد من النحاس ومهبط من الألمونيوم. وتغطي ألواح المصعد والمهبط بطبقة رقيقة 2و0 مليمتر من مخلوط يحتوي على الليثيوم. ثم يغطيها غشاء من السيراميك الخاص يمنع من اشتعال الخلية الكهربائية. وعلى الرغم من أن ذلك الغشاء السيراميكي لا يزيد سمكه عن شعرة رأس فهو يتحمل درجات حرارة حتي 700 درجة مئوية بدون أن يشتعل.
تقطع الأقطاب في مساحة أوراق الكتابة وترص بجانب بعضها بحيث يفصل بينها الكهرل وهو طبقة تشبه اللباد الرقيق مشبعة بمركب يحتوي على الليثيوم.
تستطيع حالياً السيارة الصغيرة التي تعمل ببطارية كهذه وزنها 120 كيلوجرام أن تسير مسافة 150 كيلومتر. وإذا استبدلت بطارية الليثيوم أيون ببطارية نيكل-متالهيدريد (nickel-metal hydride (NiMH فلا تستطيع السيارة السير إلا مسافة 50 كيلومتر. لذلك تعلق الآمال على بطارية الليثيوم أيون لتسيير السيارات الكهربائية في المرحلة القادمة.
في 29 ديسمبر 2021، أعلنت مجموعة نورثڤولت السويدية لتصنيع البطاريات بدء العمل في مصنع ضخم في شمال السويد هو الأول من نوعه لشركة أوروبية في القارة. ويطمح المصنع الواقع في شيليفتيو لمنافسة تسلا الأمريكية والشركات الآسيوية المنتجة لبطاريات الليثيوم-أيون للسيارات الكهربائية. وقام المصنع اليوم السابق بجمع أول بطارية كهربائية، حسبما أعلنت نورثڤولت في بيان.[51]
وقالت الشركة إنها "البطارية الأولى التي يتم تصميمها وتطويرها وجمعها بالكامل في مصنع ضخم من جانب شركة بطاريات أوروبية، ما يمثل فصلا جديدا في تاريخ الصناعة الأوروبية". وعند بلوغه طاقته القصوى يتوقع أن ينتج المصنع ما يكفي من البطاريات لتزويد مليون سيارة كهربائية سنويا، مع قدرة انتاج سنوية تبلغ 60 جيجاوات بالساعة، بحسب الشركة.
وقالت نورثڤولت: "إنها محطة عظيمة لنورثڤولت بذل الفريق جهوداً حثيثة لتحقيقها. بالتأكيد إن هذه البطارية الأولى ليست سوى البداية. نتطلع على مدى السنوات القادمة كي توسع نورثڤولت قدرتها الانتاجية بشكل كبير لتمكين الانتقال الأوروبي إلى الطاقة النظيفة".
من المتوقع أن تطلق تسلا أول مصنع لها في أوروبا في وقت قريب، فيما للمنافسين الآسيويين عمليات كبيرة في بولندا والمجر، لكن حتى الآن لم تكن أي شركة أوروبية قامت بتشغيل منشأة كبيرة. ضمنت نورثڤولت طلبيات بقيمة 30 مليار دولار (26,5 مليار يورو) من كبرى شركات السيارات الأوروبية مثل الألمانيتين بي إم دبليو وفولكسڤاگن وڤولڤو السويدية التي تعتزم أن تؤسس معها مصنعاً أوروبياً ثانياً.
والمصنع الجديد الذي أطلق عليه "نورثڤولت إيت" (نورثڤولت واحد) بالسويدية، يوظف 500 شخص حالياً ويمكن أن يصل عددهم إلى 3000 عندما يبلغ طاقته القصوى.
يتوقع بدء عمليات التسليم لزبائن تجاريين في الجزء الأول من 2022. والشركة السويدية التي جمعت حتى الآن عدة مليارات اليورو، أسسها عام 2016 السويدي بيتر كارسلون والإيطالي باولو شيروتي، الموظفان السابقان لدى تيسلا.
ومن بين المساهمين فيها فولكسڤاگن وگولدمان ساكس وبي إم دبليو ونورديك فاندز، ومنذ عام 2020 مؤسس سبوتيفاي الملياردير السويدي دانيال إك. إضافة إلى التمويل الخاص، استفادت نورثفولت من قروض أوروبية في وقت تبذل المنطقة جهودا لتسريع قدرتها الانتاجية من السيارات الكهربائية.
وأمام الصين التي تهيمن على السوق، تبلغ حصة أوروبا 3 بالمئة فقط من انتاج البطاريات على مستوى العالم في 2020، لكنها تهدف لبلوغ 25 بالمئة من حصة السوق بنهاية العقد مع خطط لفتح عدد من المصانع. وكان وباء كوڤيد-19 هدد خطط نورثڤولت لبدء الانتاج قبل نهاية العام. وقال فريدريك هيدلوند، رئيس مصنع نورثڤولت الضخم الجديد، لوكالة فرانس برس إن المنشأة يمكن أن تحقق قدرة انتاجية تكفي لـ300 ألف سيارة، أو 16 جيجاوات بالساعة، في غضون السنتين القادمتين. ولن يستهلك المصنع الضخم سوى الطاقة المتجددة، وفق نورثڤولت.
واختير موقع المصنع على بعد 200 كم عن الدائرة القطبية الشمالية، لقربه من مرافق مهمة لانتاج الطاقة المتجددة في شمال السويد ومنها الطاقة المولدة من المياه. وقال هيدلوند إن "قطاع تصنيع البطاريات يتطلب الكثير من الطاقة" مضيفاً "هدفنا تصنيع أكثر البطاريات مراعاة للبيئة على الأرض".
الشحن والتفريغ
أثناء التفريغ، تحمل أيونات الليثيوم (Li+ ) التيار داخل البطارية من القطب السالب إلى القطب الموجب، عبر كهرل غير- مائي والغشاء الفاصل.[52]
أثناء الشحن، يطبق مصدر طاقة كهربائية خارجي (دائرة الشحن) جهداً زائداً (جهد أعلى مما تنتجه البطارية، من نفس القطبية)، مما يؤدي إلى تدفق تيار الشحن داخل البطارية من القطب الموجب للقطب السالب، أي في الاتجاه العكسي لتيار التفريغ في ظل الظروف العادية. ثم تهاجر أيونات الليثيوم من القطب الموجب إلى القطب السالب، حيث تصبح مطمورة في مادة القطب المسامي في عملية تعرف باسم الإدخال.
يمكن أن تصل خسائر الطاقة الناتجة عن مقاومة التلامس الكهربائية عند الأسطح البينية بين طبقات القطب الكهربائي وعند التلامس مع مجمعات التيار إلى 20٪ من إجمالي تدفق الطاقة للبطاريات في ظل ظروف التشغيل النموذجية.[53]
تختلف إجراءات الشحن لخلايا الليثيوم-أيون المفردة وبطاريات الليثيوم-أيون الكاملة قليلاً:
- تيار مستقر (CC).
- جهد مستقر (CV).
- تُشحن بطارية الليثيوم-أيون (مجموعة من خلايا الليثيوم-أيون في سلسلة) على ثلاث مراحل:
- تيار مستقر.
- التوازن (غير مطلوب بمجرد توازن البطارية).
- جهد مستقر.
أثناء مرحلة التيار المستقر، يطبق الشاحن تياراً ثابتاً مستقراً على البطارية بجهد متزايد باطراد، حتى يتم الوصول إلى حد الجهد لكل خلية.
أثناء مرحلة التوازن، يقوم الشاحن بتقليل تيار الشحن (أو دورات الشحن وإيقافه لتقليل متوسط التيار) بينما يتم إحضار حالة شحن الخلايا الفردية إلى نفس المستوى من خلال الموازنة الدائرة، حتى البطارية متوازنة. بعض أجهزة الشحن السريعة تتخطى هذه المرحلة. تحقق بعض أجهزة الشحن التوازن عن طريق شحن كل خلية بشكل مستقل.
أثناء مرحلة الجهد الثابت (المستقر)، يطبق الشاحن جهداً يساوي الحد الأقصى لجهد الخلية مضروباً في عدد الخلايا في السلسلة على البطارية، حيث ينخفض التيار تدريجياً نحو الصفر، حتى يصبح التيار أقل من عتبة محددة تبلغ حوالي 3٪ من تيار الشحن الثابت الأولي.
تتصدر الشحنات الدورية حوالي مرة واحدة لكل 500 ساعة. يوصى ببدء الشحن الأعلى عندما يقل الجهد الكهربائي عن 4.05 V/cell.
يمكن أن يؤدي عدم اتباع قيود التيار والجهد إلى حدوث انفجار.[56][57]
حدود درجة حرارة شحن بطارية الليثيوم-أيون أكثر صرامة من حدود التشغيل. تعمل كيمياء الليثيوم-أيون بشكل جيد في درجات الحرارة المرتفعة ولكن التعرض للحرارة لفترات طويلة يقلل من عمر البطارية. توفر بطاريات الليثيوم-أيون أداء شحن جيداً في درجات حرارة منخفضة وقد تسمح أيضاً بـ الشحن السريع ضمن نطاق درجة حرارة 5 إلى 45 °C (41 إلى 113 °F).[58][مطلوب مصدر أفضل] يجب أن يتم الشحن في نطاق درجة الحرارة هذا. عند درجات حرارة تتراوح من 0 إلى 5 درجات مئوية، يكون الشحن ممكناً، ولكن يجب تقليل تيار الشحن. فأثناء الشحن بدرجة حرارة منخفضة، يكون الارتفاع الطفيف في درجة الحرارة فوق درجة الحرارة المحيطة بسبب مقاومة الخلية الداخلية مفيداً. قد تؤدي درجات الحرارة المرتفعة أثناء الشحن إلى تدهور البطارية، وسيؤدي الشحن عند درجات حرارة أعلى من 45 درجة مئوية إلى تدهور أداء البطارية، بينما في درجات الحرارة المنخفضة قد تزيد المقاومة الداخلية للبطارية، مما يؤدي إلى بطء الشحن وبالتالي فترات شحن أطول.[58][مطلوب مصدر أفضل] لا ينبغي شحن بطاريات الليثيوم-أيون للمستهلكين في درجات حرارة أقل من 0 درجة مئوية (32 درجة فهرنهايت). على الرغم من وجود بطارية[59]قد يبدو أنه يشحن بشكل طبيعي، يمكن أن يحدث الطلاء الكهربائي لليثيوم المعدني في القطب السالب أثناء شحنة تحت التجميد، وقد لا يمكن إزالته حتى عن طريق التدوير المتكرر. ولا تسمح معظم الأجهزة المزودة ببطاريات الليثيوم-أيون بالشحن خارج نطاق 0-45 درجة مئوية لأسباب تتعلق بالسلامة، باستثناء الهواتف المحمولة التي قد تسمح بدرجة معينة من الشحن عند اكتشاف مكالمة طوارئ قيد التنفيذ.[60]
تفريغ البطاريات تدريجياً بشكل ذاتي حتى لو لم تكن موصولة بتيار ناقل. تتميز بطاريات الليثيوم-أيون القابلة لإعادة الشحن بمعدل التفريغ الذاتي الذي تحدده الشركات المصنعة عادةً ليكون 1.5-2٪ شهرياً.[61][62]
يزيد المعدل مع درجة الحرارة وحالة الشحن. وجدت دراسة أجريت عام 2004 أنه بالنسبة لمعظم ظروف دورة الشحن، فقد اعتمد التفريغ الذاتي بشكل أساسي على الوقت; ومع ذلك، بعد عدة أشهر من الوقوف في دائرة مفتوحة أو شحنة عائمة، أصبحت الخسائر المعتمدة على حالة الشحن كبيرة. لم يزد معدل التفريغ الذاتي بشكل رتيب مع حالة الشحن، ولكنه انخفض إلى حد ما في حالات الشحن الوسيطة.[63] قد تزيد معدلات التفريغ الذاتي مع تقدم عمر البطاريات.[64] In 1999, self-discharge per month was measured at 8% at 21 °C, 15% at 40 °C, 31% at 60 °C.[65] بحلول عام 2007، قُدر معدل التفريغ الذاتي الشهري بنسبة 2٪ إلى 3٪،[66] و2[67]–3% بحلول عام 2016.[68]
بالمقارنة، انخفض معدل التفريغ الذاتي لـ بطاريات NiMH، اعتباراً من عام 2017، من ما يصل إلى 30٪ شهرياً للخلايا الشائعة سابقاً[69]إلى حوالي 0.08-0.33٪ شهرياً لبطاريات بطاريات NiMH منخفضة التفريغ الذاتي،[70] وحوالي 10٪ شهرياً في بطاريات نيكل-كادميوم.[بحاجة لمصدر]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الكيمياء الكهربائية
المواد المتفاعلة في التفاعلات الكهروكيميائية في خلية أيون الليثيوم هي مواد من الأنود والكاثود، وكلاهما مركبات تحتوي على ذرات الليثيوم. أثناء الشحن، ينتج عن الأكسدة تفاعل النصف عند القطب الموجب أيونات ليثيوم موجبة الشحنة وإلكترونات سالبة الشحنة. قد ينتج عن تفاعل نصف الأكسدة أيضاً مادة غير مشحونة تبقى عند الأنود. تتحرك أيونات الليثيوم عبر الإلكتروليت، وتتحرك الإلكترونات عبر الدائرة الخارجية، ثم تتحد عند الكاثود (مع مادة الكاثود) في تفاعل نصف اختزال. يوفر المنحل بالكهرباء والدائرة الخارجية وسائط موصلة لأيونات الليثيوم والإلكترونات، على التوالي، لكنهما لا يشتركان في التفاعل الكهروكيميائي. أثناء التفريغ، تتدفق الإلكترونات من القطب السالب (الأنود) نحو القطب الموجب (الكاثود) عبر الدائرة الخارجية. تؤدي التفاعلات أثناء التفريغ إلى تقليل الإمكانات الكيميائية للخلية، لذا فإن التفريغ ينقل الطاقة من الخلية إلى أي مكان يتبدد فيه التيار الكهربائي طاقته، غالباً في الدائرة الخارجية. أثناء الشحن، تسير هذه التفاعلات والنقل في الاتجاه المعاكس: تتحرك الإلكترونات من القطب الموجب إلى القطب السالب عبر الدائرة الخارجية. لشحن الخلية، يجب أن توفر الدائرة الخارجية طاقة كهربائية. يتم تخزين هذه الطاقة بعد ذلك كطاقة كيميائية في الخلية (مع بعض الضياعات، على سبيل المثال، بسبب كفاءة فرداي الأقل من 1).
يسمح كلا القطبين لليثيوم-أيون بالتحرك داخل وخارج هياكلها من خلال عملية تسمى الإقحام (الإدخال) أو الإخراج (إزالة الإدخال )، على التوالي.
نظراً لأن أيونات الليثيوم "تقوم بالتأرجح" ذهاباً وإياباً بين القطبين، تُعرف هذه البطاريات أيضاً باسم "بطاريات الكرسي الهزاز" أو "البطاريات المتأرجحة" (وهو مصطلح قدمته بعض الصناعات الأوروبية).[71][72]
تمثل المعادلات الكيمياء التالية.
إن تفاعل النصف للقطب الموجب (الكاثود) في ركيزة أكسيد الكوبالت المشبع بالليثيوم هو[73][74]
تفاعل النصف للقطب السالب (الأنود) المكون من الگرافيت هو
التفاعل الكامل (من اليسار إلى اليمين: التفريغ، من اليمين إلى اليسار: الشحن)
للتفاعل الكلي حدوده. الإفراط في التفريغ لزيادة تشبع أكسيد الكوبالت الليثيوم، مما يؤدي إلى إنتاج أكسيد الليثيوم،[75] ربما من خلال التفاعل التالي الغير عكوس:
يؤدي الشحن الزائد حتى 5.2 ڤولت إلى تخليق أكسيد الكوبالت (IV)، كما يتضح من حيود الأشعة السينية:[76]
في بطارية ليثيوم-أيون، تُنقل أيونات الليثيوم من وإلى الأقطاب الموجبة أو السالبة عن طريق أكسدة فلز انتقالي، كوبالت ( Co)، في Li 1-xCoO 2 من Co3+ إلى Co4+ أثناء الشحن، والحد من Co4+ إلى Co3+ أثناء التفريغ. تفاعل القطب الكوبالت قابل للانعكاس "فقط" لـ x < 0.5 (x بالوحدات المولية)، مما يحد من عمق التفريغ المسموح به. تم استخدام هذه الكيمياء في خلايا الليثيوم_أيون التي طورتها سوني في عام 1990.[77]
طاقة الخلية تساوي الجهد مضروباً في الشحنة. يمثل كل غرام من الليثيوم ثابت فاراداي / 6.941، أو 13901 كولوم. عند 3 V، ينتج عن هذا 41.7 kJ لكل جرام من الليثيوم، أو 11.6 kWh لكل كيلوجرام من الليثيوم. هذا أكثر قليلاً من حرارة احتراق البنزين، لكنه لا يأخذ في الاعتبار المواد الأخرى التي تدخل في بطارية الليثيوم والتي تجعل بطاريات الليثيوم أثقل عدة مرات لكل وحدة طاقة.
تكون الفولتية الخلوية الواردة في قسم الكيمياء الكهربائية أكبر من الجهد التي يمكن عندها أن تتحلل المحاليل المائية.
تتكون الكهارل السائلة في بطاريات الليثيوم-أيون من أملاح الليثيوم، مثل LiPF 6، LiBF 4 أو LiClO 4 في مذيب عضوي، مثل كربونات الإيثيلين وكربونات ثنائي ميثيل وكربونات ثنائي إيثيل.[78]يعمل الكهرل السائل كمسار موصل لحركة الكاتيونات التي تمر من الأقطاب السالبة إلى الأقطاب الموجبة أثناء التفريغ. الموصلية النموذجية للإلكتروليت السائل في درجة حرارة الغرفة (20 °C (68 °F)) في حدود 10 mS/cm، تزداد بحوالي 30-40٪ عند 40 °C (104 °F) ويتناقص قليلاً عند 0 °C (32 °F).[79] يوفر الجمع بين الكربونات الحلقية والخطية (على سبيل المثال، كربونات الإيثيلين (EC) وكربونات ثنائي ميثيل (DMC)) موصلية عالية و القدرة على التشكيل الطور البيني الصلب بالكهرباء (SEI). وتتحلل المذيبات العضوية بسهولة على الأقطاب الكهربائية السالبة أثناء الشحن. عندما يتم استخدام مذيبات عضوية مناسبة كمحلل إلكتروليت، يتحلل المذيب عند الشحن الأولي ويشكل طبقة صلبة تسمى الطور البيني للإلكتروليت الصلب،[80] وهو عازل كهربائي، ولكنه يوفر موصلية أيونية مهمة. حيث يمنع الطور البيني المزيد من تحلل الإلكتروليت بعد الشحنة الثانية. على سبيل المثال، تتحلل كربونات الإيثيلين بجهد مرتفع نسبياً، 0.7 V مقابل الليثيوم، وتشكل واجهة كثيفة ومستقرة[81] توفر الإلكتروليتات المركبة القائمة على POE (بولي (أوكسي إيثيلين)) واجهة مستقرة نسبياً.[82][83] يمكن أن يكون صلباً (وزن جزيئي مرتفع) ويمكن تطبيقه في خلايا Li-polymer جافة، أو سائل (وزن جزيئي منخفض) ويتم تطبيقه في خلايا ليثيوم-أيون العادية. السائل الأيوني في درجة حرارة الغرفة (RTILs) هي طريقة أخرى للحد من قابلية الاشتعال وتقلب الإلكتروليتات العضوية.[84]
تتضمن التطورات الحديثة في تكنولوجيا البطاريات استخدام مادة صلبة كمادة إلكتروليت. الخزف هو أكثر وعداً.[85] الإلكتروليتات الخزفية الصلبة هي في الغالب فلز أكسيد الليثيوم، والتي تسمح بنقل أيونات الليثيوم عبر المادة الصلبة بسهولة أكبر بسبب الليثيوم الداخلي. تتمثل الفائدة الرئيسية للشوارد الصلبة في عدم وجود خطر حدوث تسربات، وهي مشكلة خطيرة تتعلق بسلامة البطاريات التي تحتوي على إلكتروليتات سائلة.[86] يمكن تقسيم الإلكتروليتات الخزفية الصلبة إلى فئتين رئيسيتين: السيراميك والزجاج. سيراميك الإلكتروليتات الصلبة عبارة عن مركبات مرتبة بدرجة عالية لها تركيب بلوري والتي عادةً ما تحتوي على قنوات نقل أيونية.[87] الإلكتروليتات الخزفية الشائعة هي الليثيوم موصلات أيون فائقة (ليسكون) و پيروڤسكايت. الشوارد الصلبة الزجاجية هي هياكل ذرية غير متبلورة مكونة من عناصر مماثلة للإلكتروليت الخزفي الصلب، ولكن لديها أعلى الموصلة بشكل عام بسبب الموصلية العالية عند حدود النواة.[88] يمكن جعل الإلكتروليتات الزجاجية والسيراميك موصلة للأيونات بشكل أكبر عن طريق استبدال الكبريت بالأكسجين. يسمح نصف القطر الأكبر للكبريت وقدرته العالية على أن يكون الاستقطاب بتوصيل أعلى للليثيوم. هذا يساهم في موصلات الإلكتروليتات الصلبة التي تقترب من التكافؤ مع نظيراتها السائلة، مع معظمها في حدود 0.1 mS/cm والأفضل عند 10 mS/cm.[89] تتمثل إحدى الطرق الفعالة والاقتصادية لضبط خصائص الإلكتروليتات المستهدفة في إضافة مكون ثالث بتركيزات صغيرة، تُعرف باسم مادة مضافة.[90]بإضافة المادة المضافة بكميات صغيرة، لن تتأثر الخصائص الحجمية لنظام الإلكتروليت بينما يمكن تحسين الخاصية المستهدفة بشكل كبير. يمكن تقسيم الإضافات العديدة التي تم اختبارها إلى الفئات المميزة الثلاث التالية: (1) تلك المستخدمة في تعديلات كيمياء SEI; (2) تلك المستخدمة لتحسين خصائص التوصيل الأيوني; (3) تلك المستخدمة لتحسين سلامة الخلية (مثل منع الشحن الزائد).[بحاجة لمصدر]
الكاثود
تُصنّع مواد الكاثود بشكل عام من LiCoO 2 أو LiMn 2O 4. تطور المادة القائمة على الكوبالت هيكلاً شبه رباعي السطوح يسمح بنشر أيون الليثيوم ثنائي الأبعاد.[91] تعتبر الكاثودات القائمة على الكوبالت مثالية بسبب السعة الحرارية النظرية العالية، والقدرة الحجمية العالية، والتفريغ الذاتي المنخفض، والجهد العالي للتفريغ، والأداء الجيد لدورة الشحن. تشمل القيود التكلفة العالية للمادة، والاستقرار الحراري المنخفض.[92]تعتمد المواد القائمة على المنغنيز نظاماً شبكياً بلورياً مكعباً، والذي يسمح بنشر أيون الليثيوم ثلاثي الأبعاد[91] تعتبر كاثودات المنجنيز جاذبة لأن المنجنيز أرخص سعراً ولأنه يمكن نظرياً استخدامه لصنع بطارية أكثر كفاءة وطويلة الأمد إذا أمكن التغلب على قيودها. تشمل القيود ميل المنجنيز إلى الذوبان في الإلكتروليت أثناء ركوب الدراجات مما يؤدي إلى ضعف استقرار الدورة للكاثود.[92] الكاثودات القائمة على الكوبالت هي الأكثر شيوعاً، ولكن يتم البحث عن مواد أخرى بهدف خفض التكاليف وتحسين عمر البطارية.[93]
اعتبارا من 2017[تحديث], LiFePO 4 هو مرشح للإنتاج على نطاق واسع لبطاريات الليثيوم-أيون مثل تطبيقات السيارات الكهربائية نظراً لتكلفتها المنخفضة وأمانها الممتاز ومتانتها العالية. على سبيل المثال، احتفظت بطاريات Sony Fortelion بنسبة 74٪ من سعتها بعد 8000 دورة مع تفريغ بنسبة 100٪.[94] والمطلوب عامل موصل للكربون للتغلب على الموصلية الكهربائية المنخفضة.[95]
| التقنية | الشركة | التطبيق الهدف | الفائدة |
|---|---|---|---|
| أكسيد الليثيوم نيكل منگنيز كوبالت NMC، LiNixMnyCozO2 |
شركة إمارة، نيسان موتور,[96][97] شركة ميكروڤاست، إل جي كيم،[98] نورثڤولت[99] | المركبات الكهربائية، أدوات الطاقة، تخزين طاقة الشبكات | طاقة نوعية جيدة وكثافة قدرة محددة |
| أكسيد الليثيوم نيكل كوبالت ألومنيوم NCA, LiNiCoAlO2 |
پاناسونك،[98] مجموعة سافت[100] سامسونگ[101] | المركبات الكهربائية | طاقة عالية محددة، وعمر جيد |
| أكسيد منجنيز الليثيوم LMO, LiMn2O4 |
LG Chem،[102] إن إي سي، مجموعة سامسونگ،[103] هيتاتشي،[104]نيسان/ AESC،[105] إنردل[106] | السيارة الكهربائية الهجينة، الهواتف الخلوية، حاسوب محمول | |
| فوسفات الحديد الليثيوم LFP, LiFePO4 |
جامعة تكساس/هيدرو-كبك,[107] شركة فوستك ليثيوم، ڤيلنس للتكنولوجيا، A123Systems/MIT[108][109] | سگواي للنقل الفردي، أدوات الطاقة، منتجات الطيران، نظم المركبات الهجينة، تحويلات المركبات الهجينة القابلة للشحن | كثافة معتدلة (2 أمبير-ساعي وخرج 70 أمبير) أمان عالي مقارنة بأنظمة الكوبالت / المنجنيز. درجة حرارة التشغيل >60 °C (140 °F) |
| أكسيد الكوبالت الليثيوم LCO, LiCoO2 |
أول إنتاج تجاري من سوني[110][77] | استخدامات واسعة، الحواسيب المحمولة | طاقة نوعية عالية |
الآنود
تُصنع مواد القطب السالب تقليدياً من الگرافيت ومواد الكربون الأخرى، على الرغم من زيادة استخدام المواد الحديثة القائمة على السيليكون (انظر بطارية نانوية). تُستخدم هذه المواد لأنها وفيرة وهي موصلة كهربائياً ويمكنها إدخال أيونات الليثيوم لتخزين الشحنة الكهربائية مع تمدد حجم بسيط (حوالي 10٪).[111] السبب في أن الگرافيت هو المادة المهيمنة هو بسبب الجهد المنخفض والأداء الممتاز. أُدخلت مواد مختلفة ولكن جهدها مرتفع مما يؤدي إلى كثافة طاقة منخفضة.[112] الجهد المنخفض للمادة هو المطلب الرئيسي; خلاف ذلك، فإن السعة الزائدة عديمة الفائدة من حيث كثافة الطاقة.
| التقنية | الكثافة | التحمل | الشركة | التطبيقات الهدف | تعليقات |
|---|---|---|---|---|---|
| الگرافيت | تارگراي | مادة القطب السالب السائدة المستخدمة في بطاريات الليثيوم-أيون، محدودة بسعة 372 مللي أمبير/غرام.[43] | تكلفة منخفضة وكثافة طاقة جيدة. يمكن أن تستوعب أنودات الگرافيت ذرة ليثيوم واحدة لكل ست ذرات كربون. معدل الشحن محكوم بشكل صفائح الگرافين الطويلة الرفيعة. أثناء الشحن، يجب أن تنتقل أيونات الليثيوم إلى الحواف الخارجية لصفيحة الگرافين قبل أن تستقر (تداخل) بين الألواح. يستغرق المسار الخاص بالدارة وقتاً طويلاً بحيث يواجه احتقاناً حول تلك الحواف.[113] | ||
| تيتانات الليثيوم LTO, Li4Ti5O12 |
توشيبا، ألتيرنانو | السيارات (سيارات فينكس)، الشبكة الكهربائية (PJM منطقة سيطرة منظمة النقل الإقليمية للربط البيني،[114] وزارة دفاع الولايات المتحدة[115])، الحافلات (پروتيرا) | تحسين الخرج وزمن الشحن والمتانة (السلامة ودرجة حرارة التشغيل −50–70 °C (−58–158 °F)).[116] | ||
| الكربون الصلب | Energ2[117] | الإلكترونيات المنزلية | سعة تخزين أكبر. | ||
| سبائك القصدير/الكوبالت | سوني | الأجهزة الإلكترونية الاستهلاكية (بطارية سوني نكسليون) | سعة أكبر من خلية بها گرافيت (بطارية من نوع 3.5 أمبير ساعي 18650). | ||
| السيليكون/الكربون | القياس الحجمي: 580 W·h/l |
أمپريوس[118] | الهواتف الذكية بسعة 5000 مللي أمبير في الساعة | يستخدم < 10wt% أسلاك متناهية الصغر من السليكون مدمجة مع الگرافيت ومواد الحزم. كثافة الطاقة: ~ 74 مللي أمبير / غرام.
طريقة أخرى تستخدم رقائق السليكون الكريستالية المغلفة بالكربون 15 nm. حققت نصف الخلية المختبرة 1.2 Ah/g على مدى 800 دورة.[119] |
نظراً لأن الگرافيت محدود بسعة قصوى تبلغ 372 mAh/g[43] فقد خُصّص الكثير من الأبحاث لتطوير المواد التي تظهر قدرات نظرية أعلى، والتغلب على التحديات التقنية التي تعوق تنفيذها في الوقت الحاضر. مقالة مراجعة شاملة لعام 2007 بقلم Kasavajjula وآخرون.[120] ملخصاً الأبحاث المبكرة حول الأنودات القائمة على السليكون لخلايا الليثيوم-أيون الثانوية. على وجه الخصوص، هونگ لي وآخرون.[121] فقد أظهر في عام 2000 أن الإدخال الكهروكيميائي لأيونات الليثيوم في جسيمات السيليكون النانوية وأسلاك السيليكون النانوية يؤدي إلى تكوين سبيكة ليثيوم-سليكون غير متبلورة. في نفس العام، وصف بو جاو ومستشاره للدكتوراه، البروفيسور أوتو تشو، دورة الخلايا الكهروكيميائية ذات الأنودات التي تتكون من أسلاك نانوية من السيليكون، بسعة عكسية تتراوح من 900 إلى 1500 مللي أمبير / غرام على الأقل.[122]
لتحسين استقرار أنود الليثيوم، اقتُرحت عدة طرق لتركيب طبقة واقية.[123]بدأ النظر إلى السيليكون على أنه مادة أنود لأنه يمكنه استيعاب المزيد من أيونات الليثيوم، وتخزين ما يصل إلى 10 أضعاف الشحنة الكهربائية، إلا أن هذا الخلط بين الليثيوم والسيليكون ينتج عنه توسع كبير في الحجم (حوالي 400٪)،[111] مما يسبب عطلاً كبيراً للبطارية.[124]وقد استُخدم السيليكون كمادة للأنود ولكن إدخال واستخراج يمكن أن يؤدي إلى تشققات في المادة. تعرض هذه الشقوق سطح Si إلى إلكتروليت، مما يتسبب في التحلل وتشكيل الطور البيني للكهرباء الصلبة (SEI) على سطح Si الجديد (الگرافين المجعد المغلف بجزيئات Si النانوية). سيستمر هذا SEI في النمو بشكل أكثر سمكاً، ويستنفد المتاح، ويؤدي إلى تدهور قدرة واستقرار دورة الأنود.
كانت هناك محاولات لاستخدام العديد من الهياكل النانوية السليكونية التي تشمل البطارية النانوية، والأنابيب النانوية، والمجالات الفارغة، والجسيمات النانوية، والمسامات النانوية بهدف تحمُّلها () -إدخال/إزالة دون تشقق كبير. ومع ذلك، لا تزال عملية تشكيل SEI على Si مستمرة بالحدوث. لذلك سيكون الطلاء منطقياً، من أجل حساب أي زيادة في حجم Si، فإن طلاء السطح المحكم غير قابل للتطبيق. في عام 2012، ابتكر باحثون من جامعة نورث وسترن نهجاً لتغليف جزيئات Si النانوية باستخدام أكسيد الگرافين r-GO المشاب. تسمح هذه الطريقة بحماية جزيئات Si النانوية من الإلكتروليت بالإضافة إلى السماح بتمدد Si بدون تمدد بسبب التجاعيد والشوائب في كرات الگرافين.[125]
بدأت هذه الكبسولات كتشتت مائي لجزيئات GO وSi، ثم تُرش في ضباب من القطرات التي تمر عبر فرن أنبوبي. أثناء مرورها عبر مبخر سائل، تُسحب صفائح GO إلى كرة مشابة بواسطة قوى رفيعة جداً وتغليف جزيئات Si معها. يوجد ملف تعريف شحن/تفريغ غلفانيستاتيكي من 0.05 إلى 1 للكثافات الحالية من 0.2 إلى 4 A/g، توصيل 1200 مللي أمبير/جرام عند 0.2 أمبير/جرام.[125]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الكهرل (الإلكتروليت)
تكون الفولتية الخلوية أعلاه أكبر من الجهد الذي يتم عنده استخدام التحليل الكهربائي المحاليل المائية. لذلك، يتم استخدام المحاليل غير المائية.
تتكون الكهارل السائلة في بطاريات ليثيوم أيون من أملاح الليثيوم، مثل LiPF6، LiBF4، أو LiClO4، في مذيب عضوي، مثل الأثير. يوصل الكهرل السائل أيونات الليثيوم، التي تعمل كحامل بين الكاثود والأنود عندما تمرر البطارية تيار كهربائي عبر دائرة خارجية. تكون الموصلات النموذجية للإلكتروليت (كهرل) السائل في درجة حرارة الغرفة (20 oC) في نطاق 10 مللي ثانية/سم، وتزداد بحوالي 30-40٪ عند 40 درجة مئوية oC وتتناقص بمقدار أقل قليلاً عند oC.[126]
لسوء الحظ، تتحلل المذيبات العضوية بسهولة على الأنودات أثناء الشحن. ومع ذلك، عند استخدام المذيبات العضوية مناسب كمحلل إلكتروليت، يتحلل المذيب ويشكل طبقة صلبة تسمى الطور البيني للكهرباء الصلبة (SEI)[127]في الشحن الأول تكون عازلة للكهرباء ولكنها موصلة بشكل كافٍ لأيونات الليثيوم. يمنع الطور البيني تحلل الإلكتروليت بعد الشحنة الثانية. على سبيل المثال، تتحلل كربونات الإيثيلين بجهد مرتفع نسبياً، 0.7 فولت مقابل Li، وتشكل سطح كثيف ومستقر. [بحاجة لمصدر]
لعبت بدائل الكهارل أيضاً دوراً مهماً، على سبيل المثال بطارية ليثيوم پوليمر. تعد كهارل الپوليمر واعدة لتقليل تكوين التغصنات في الليثيوم. فمن المفترض أن تمنع الپوليمرات قصر الدوائر وتحافظ على الموصلية.[123]
تنتشر الأيونات في الكهرل بسبب وجود تغييرات طفيفة في تركيز الكهرل. يؤخذ الانتشار الخطي بعين الاعتبار فقط. التغيير في التركيز c، كدالة للزمن t والمسافة x، هو
تشير العلامة السالبة إلى أن الأيونات تتدفق من تركيز عالٍ إلى تركيز منخفض. في هذه المعادلة، الحرف D هو معامل الانتشار لأيون الليثيوم. له قيمة 7.5×10−10 m2/s في كهرل LiPF 6 . تبلغ قيمة ε، مسامية الإلكتروليت (الكهرل)، 0.724.[128]
التصاميم
الخلايا
تتوفر خلايا ليثيوم-أيون (المميزة عن البطاريات بأكملها) بأشكال مختلفة، والتي يمكن تقسيمها عموماً إلى أربع مجموعات:[129]
- أسطواني صغير (جسم صلب بدون أطراف توصيل، مثل تلك المستخدمة في بطاريات الحاسب المحمول القديمة)
- أسطواني كبير (جسم صلب مع أطراف ملولبة كبيرة)
- مسطح أو بشكل جعبة (جسم ناعم ومسطح، مثل تلك المستخدمة في الهواتف المحمولة وأجهزة الحاسب المحمولة الأحدث; وهي بطاريات ليثيوم أيون پوليمر.[130]
- علبة بلاستيكية صلبة ذات أطراف ملولبة كبيرة (مثل مجموعة جر السيارة الكهربائية)
تصنع الخلايا ذات الشكل الأسطواني بطريقة مميزة " لفة سويسرية" (تُعرف باسم "لفة جيلي" في الولايات المتحدة)، مما يعني أنها "شطيرة" طويلة واحدة من القطب الموجب الملفوف، والفاصل، والقطب السالب، والفاصل في بكرة واحدة. يمكن تقريب شكل لفافة الهلام في خلايا أسطوانية بواسطة لولب أرخميدس. تتمثل إحدى مزايا الخلايا الأسطوانية مقارنة بالخلايا ذات الأقطاب الكهربائية المكدسة في سرعة الإنتاج الأسرع. يمكن أن يكون أحد عيوب الخلايا الأسطوانية هو التدرج الكبير في درجة الحرارة الشعاعية داخل الخلايا التي تتطور عند تيارات التفريغ العالية.
يعطي عدم وجود غلاف لخلايا الحقيبة أعلى كثافة للطاقة الجاذبية; ومع ذلك، بالنسبة للعديد من التطبيقات العملية، لا تزال تتطلب وسيلة خارجية للاحتواء لمنع التوسع عندما يكون مستوى حالة الشحن (SOC) مرتفعاً، [131] وللاستقرار الهيكلي العام لحزمة البطارية التي يشكلون جزءاً منها. يُشار أحياناً إلى كل من الخلايا البلاستيكية الصلبة والخلايا ذات نمط الأكياس بالخلايا المنشورية بسبب أشكالها المستطيلة.[132]يرى محلل تكنولوجيا البطاريات مارك إليس من شركة مونرو وشركاه ثلاثة أنواع أساسية من بطاريات الليثيوم-أيون المستخدمة في بطاريات السيارات الكهربائية الحديثة (~ 2020) على نطاق واسع: الخلايا الأسطوانية (على سبيل المثال، تسلا) ، الحقيبة المنشورية (على سبيل المثال، من إل جي)، وخلايا العلبة المنشورية (على سبيل المثال، من إل جي وسامسونگ وپاناسونك وغيرها). لكل عامل شكل مزايا وعيوب مميزة لاستخدام المركبات الكهربائية.[13]
منذ عام 2011، أعلنت عدة مجموعات بحثية عن عروض بطاريات تدفق الليثيوم-أيون التي تعلق الكاثود أو مادة الأنود في محلول مائي أو عضوي.[133][134]
في عام 2014، ابتكرت پاناسونك أصغر بطارية ليثيوم-أيون. دبوسية الشكل. يبلغ قطرها 3.5 ملم ووزنها 0.6 جرام.[135] يتوافر عامل شكل خلية بشكل عملة مشابهاً لبطاريات الليثيوم العادية منذ عام 2006 لخلايا LiCoO2، وعادةً ما يتم تعيينه بالبادئة "LiR".[136][137]
البطاريات

تتكون البطارية (وتسمى أيضاً مجموعة البطارية) من عدة خلايا ليثيوم أيون متصلة. تحتوي حزم (مجموعات) بطاريات الأجهزة الإلكترونية الاستهلاكية الكبيرة مثل أجهزة الحاسب المحمولة أيضاً على مستشعرات درجة الحرارة، دارات منظم الجهد، مصرفات الجهد، وأجهزة مراقبة حالة الشحن. وتقلل هذه المكونات من مخاطر السلامة مثل ارتفاع درجة الحرارة وحدوث قصر كهربائي.[138] لتشغيل الأجهزة الأكبر حجماً، مثل السيارات الكهربائية، يكون توصيل العديد من البطاريات الصغيرة في دائرة متوازية أكثر فاعلية [139] وأكثر كفاءة من توصيل بطارية واحدة كبيرة.[140]
تصميم جديد
لسنوات عديدة، أمضى مصممي البطاريات أوقاتاً وجهوداً للبحث عن الشيء الكبير المقبل في تكنولوجيا تخزين الطاقة والتي يمكن أن تحل محل بطاريات الليثيوم ايون الموجودة حاليا والمستخدمة في كل شيء تقريبا من أجهزة الكمبيوتر المحمولة إلى الهواتف الذكية إلى حتى السيارات. واتضح أنهم ببساطة قد يكونون بحاجة لإعادة النظر في بطارية ليثيوم أيون الموجودة حاليا.فقام باحثون من جامعة نورث وسترن بإعادة تصميم بطارية الليثيوم ايون التي يمكن أن تدوم شحنتها أكثر عشر مرات من البطاريات المتوافرة حاليا في الأسواق، ويمكن أن تتلقى شحنتها أسرع بعشرة أضعاف.
الخدعة: الأنود الذى أعيد تصميمه والذي تتناول القضيتين الرئيسيتين لبطاريات ليثيوم أيون مرة أخرى --وهما سعة الشحنة ومعدل الشحن. بطاريات الليثيوم أيون تعمل عن طريق تفاعل كيميائي يتم فيه تبديل أيونات الليثيوم بين طرفي البطارية المعروفين باسم (الأنود والكاثود). وحيثما تم إستهلاك طاقة البطارية عن طريق الجهاز كالهاتف الذكى مثلا، فإن الأيونات تنطلق من مكان تخزينها في الأنود من خلال إليكتروليت إلى القطب السالب. في خلال عملية الشحن ،فإن الشحنة يتم تمريرها من خلال دورة عكسية، من الكاثود إلى الآنود.
ويستند التصميم الحالي للأنود على صحائف الگرافين --طبقة سمكها ذرة واحدة من الكربون التي يمكنها القيام بتخزين أيونات الليثيوم. ولكن هذه الأنودات تقوم فقط بتخزين ذرة واحدة من الليثيوم لكل ستة ذرات من الكربون ، بدلا من شحن منخفض الكثافة نوعا ما. وقد جرب المصممين موادا مثل السيليكون ، والتي يمكن أن تجتذب أربعة ذرات من الليثيوم لكل ذرة من السيليكون، ولكن السيليكون يميل إلى التمدد والإتساع بشكل ملحوظ خلال عملية الشحن، الامر الذي يؤدى الى تفتته. وهذا بطبيعة الحال يقلل من عمر الأنود.
التصميم المستند إلى الگرافين يؤدى إلى تباطؤ معدل الشحن أيضا. نظرا لهندسة صحائف الگرافين -- الرقيقة جدا لكنها طويلة بما فيه الكفاية -- أيونات الليثيوم تقوم برحلة طويلة على حواف أوراق الگرافين ثم تقوم بدفعها إلى الداخل. هذا يسبب نوعا من عنق الزجاجة حول حواف الأنود ويبطئ من معدل الشحن بشكل ملحوظ.
تجاوز فريق جامعة نورث ويسترن هذه المشاكل بشكل ملحوظ من خلال إعادة النظر في الأنود ودمجه بتصميم هجين الگرافين-السيليكون الذي يعزز القدرات ومعدل الشحن في نفس الوقت. أولا، إنهم وضعوا طبقات من السيليكون بين صحائف الگرافين، والسماح لأعداد أكبر من ايونات الليثيوم لتستقر هناك. حيث يتمدد السيليكون ويتسع أثناء الشحن والتفريغ، ولكن مرونة الگرافين تكمن في أنه لا يزال يحمل الأنود معه. يمكن لجزىء السيليكون أن يتفتت لكنه يبقى في مكانه، حيث يسمح للأنود بإجراء مزيداً من الشحن.
استخدم الفريق الأكسدة الكيميائية لإحداث ثقوب صغيرة في صحائف الگرافين -- فقط بقطر 10-20 نانومتر -- حتى أيونات الليثيوم يمكنها التحرك من خلال الگرافين بدلاً من الاضطرار للذهاب إلى جميع أنحاء حواف الأنود (حيث تحدث الاختناقات). هذا الاختصار يسمح لأيونات الليثيوم أن تتكوم في الأنود سريعاً في خلال عملية الشحن، معطياً معدلات شحن أكثر من 10 أضعاف السرعة المعتادة.
يقوم الباحثين بإعداد الخطة المقبلة لإعادة التفكير في القطب السالب لمواصلة تعزيز الكفاءة والفعالية لتحسين بطارية ليثيوم-أيون لتغزو الأسواق في السنوات الثلاث إلى الخمس القادمة.[141]
الاستخدامات
تُستخدم الغالبية العظمى من بطاريات ليثيوم-أيون التجارية في الإلكترونيات الاستهلاكية والسيارات الكهربائية.[142] وتشمل هذه الأجهزة:
- الأجهزة المحمولة: تشمل أجهزة الهواتف النقالة والهواتف الذكية والحواسب المحمولة والأجهزة اللوحية والكاميرات الرقمية وكاميرات فيديو والسجائر الإلكترونية ومشغل ألعاب فيديو محمول و مشاعل (مصابيح كهربائية).
- أدوات الطاقة: تُستخدم بطاريات ليثيوم-أيون في أدوات مثل المثاقب اللاسلكية والصنفرة والمناشير ومجموعة متنوعة من معدات الحدائق بما في ذلك أسواط القص ومشاذب الشجيرات.[143]
- السيارات كهربائية: بطاريات السيارة الكهربائية تُستخدم في السيارة الكهربائية،[144] المركبات الهجينة، دراجات نارية وسكوترات كهربائية، الدراجات الكهربائية، عربات نقل شخصية والكراسي الكهربائية المتحركة المتطورة. أيضاً نماذج يُتحكم بها لاسلكياً، نماذج الطائرات، المركبات الفضائية،[145][146][147] وعربة كيريوسيتي الجوالة على سطح المريخ.
المزيد من الاستخدامات المتخصصة تشمل الطاقة الاحتياطية في تطبيقات الاتصالات.[148] تتم أيضاً مناقشة بطاريات ليثيوم-أيون بشكل متكرر كخيار محتمل لتخزين طاقة الشبكة،[149] على الرغم من أنها ليست تنافسية من حيث التكلفة على نطاق واسع.[150]
الأداء
| كثافة الطاقة النوعية | 100 إلى 250 W·h/kg (360 إلى 900 kJ/kg)[151] |
|---|---|
| كثافة الطاقة الحجمية | 250 إلى 680 W·h/L (900 إلى 2230 J/cm³)[2][152] |
| كثافة القدرة النوعية | 300 إلى 1500 W/kg (في 20 ثانية و285 W·h/L)[1][المصدر لا يؤكد ذلك] |
نظراً لأن بطاريات الليثيوم-أيون يمكن أن تحتوي على مجموعة متنوعة من مواد القطب الموجب والسالب، تختلف كثافة الطاقة والجهد وفقاً لذلك.
جهد الدائرة المفتوحة أعلى مما هو عليه في البطاريات المائية (مثل بطارية حمض الرصاص، بطارية هيدريد النيكل والمعدن وبطارية نيكل-كادميوم).[153][المصدر لا يؤكد ذلك] Internal resistance increases with both cycling and age,[154] although this depends strongly on the voltage and temperature the batteries are stored at.[155] يؤدي ارتفاع المقاومة الداخلية إلى انخفاض الجهد في المحطات تحت الحمل، مما يقلل من أقصى سحب للتيار. في نهاية المطاف، ستؤدي المقاومة المتزايدة إلى ترك البطارية في حالة بحيث لا يمكنها بعد الآن دعم تيارات التفريغ العادية المطلوبة منها دون انخفاض الجهد غير المقبول أو ارتفاع درجة الحرارة.
البطاريات ذات الأقطاب الكهربائية الموجبة من فوسفات الحديد الليثيوم والگرافيت والسالبة لها جهد الدائرة المفتوحة الاسمي 3.2 V وبجهد شحن نموذجي 3.6 V. تحتوي الأقطاب الموجبة أكسيد الليثيوم والنيكل والمنجنيز والكوبالت (NMC) مع الأقطاب السالبة الگرافيت على جهد اسمي 3.7 V مع 4.2 V كحد أقصى أثناء الشحن. يُنفّذ إجراء الشحن بجهد ثابت مع دارة محددة للتيار (أي الشحن بتيار ثابت حتى يتم الوصول إلى جهد يبلغ 4.2 V في الخلية ويستمر بجهد ثابت مطبق حتى ينخفض التيار بالقرب من الصفر). عادة، يتم إنهاء الشحن بنسبة 3٪ من تيار الشحن الأولي. في الماضي، لم يكن من الممكن شحن بطاريات الليثيوم-أيون بسرعة وكانت تحتاج إلى ساعتين على الأقل لشحنها بالكامل. يمكن شحن خلايا الجيل الحالي بالكامل في 45 دقيقة أو أقل. في عام 2015، أظهر الباحثون بطارية صغيرة بسعة 600 مللي أمبير في الساعة مشحونة بنسبة 68٪ من السعة في دقيقتين وبطارية 3000 mAh (مللي أمبير في الساعة) مشحونة بنسبة 48 في المائة في خمس دقائق. تبلغ كثافة الطاقة للبطارية الأخيرة 620 واط·ساعة/ لتر. استخدم الجهاز ذرات غير متجانسة مرتبطة بجزيئات الگرافيت في الأنود.[156]
تحسن أداء البطاريات المصنعة بمرور الزمن. على سبيل المثال، في الفترة من 1991 إلى 2005، تحسنت قدرة الطاقة لكل سعر لبطاريات الليثيوم-أيون بأكثر من عشرة أضعاف، من 0.3 واط في الساعة لكل دولار إلى أكثر من 3 واط في الساعة لكل دولار.[157] في الفترة من 2011 إلى 2017، بلغ متوسط التقدم 7.5٪ سنوياً.[158] بشكل عام، بين عامي 1991 و2018، انخفضت أسعار جميع أنواع خلايا الليثيوم-أيون (بالدولار لكل كيلو وات في الساعة) بحوالي 97٪.[159] خلال نفس الفترة الزمنية، تضاعفت كثافة الطاقة أكثر من ثلاثة أضعاف.[159] يمكن أن يكون للخلايا ذات الأحجام المختلفة ذات الكيمياء المماثلة أيضاً كثافة طاقة مختلفة. تحتوي 21700 خلية على طاقة أكثر بنسبة 50٪ من 18650 خلية، والحجم الأكبر يقلل من انتقال الحرارة إلى محيطها.[152]
عمر البطارية
يُعرَّف عمر بطارية الليثيوم-أيون عادةً على أنه عدد دورات الشحن والتفريغ الكاملة للوصول إلى عتبة الفشل من حيث فقد السعة أو ارتفاع الممانعة. تستخدم ورقة بيانات الشركات المصنّعة عادةً كلمة "دورة الحياة" لتحديد العمر من حيث عدد الدورات للوصول إلى 80٪ من سعة البطارية المقدرة.[160] التخزين غير النشط لهذه البطاريات يقلل أيضاً من قدرتها. يتم استخدام التقويم الزمني لتمثيل دورة الحياة الكاملة للبطارية بما في ذلك كل من عمليات الدورة والتخزين غير النشط. يتأثر عمر دورة البطارية بالعديد من عوامل الإجهاد المختلفة بما في ذلك درجة الحرارة، تيار التفريغ، تيار الشحن، وحالة نطاقات الشحن (عمق التفريغ).[161][162]لا تُشحن البطاريات بالكامل ولا تُفرّغ في تطبيقات حقيقية مثل الهواتف الذكية وأجهزة الحواسب المحمولة والسيارات الكهربائية، وبالتالي فإن تحديد عمر البطارية عبر دورات التفريغ الكامل يمكن أن يكون مضللاً. لتجنب هذا الالتباس، يستخدم الباحثون أحياناً التفريغ التراكمي[161]يُعرَّف بأنه إجمالي مقدار الشحن (Ah) أمبير ساعي الذي توفره البطارية خلال عمرها الكامل أو دورات كاملة مكافئة،[163]الذي يمثل مجموع الدورات الجزئية ككسور من دورة الشحن والتفريغ الكاملة. يتأثر تدهور البطارية أثناء التخزين بدرجة الحرارة وحالة شحن البطارية (SOC) والجمع بين الشحن الكامل (100٪ SOC) وارتفاع درجة الحرارة (عادةً > 50 °C)) يمكن أن يؤدي إلى انخفاض حاد في السعة وتوليد الغاز.[164] يعطي مضاعفة التفريغ التراكمي للبطارية بالجهد الاسمي المقنن إجمالي الطاقة التي يتم توفيرها على مدار عمر البطارية. من هذا يمكن حساب التكلفة لكل كيلوواط ساعة من الطاقة (بما في ذلك تكلفة الشحن).
تتحلل البطاريات على مدى عمرها الافتراضي تدريجياً مما يؤدي إلى انخفاض السعة بسبب مجموعة متنوعة من التغييرات الكيميائية والميكانيكية في الأقطاب الكهربائية.[165]تتضمن بعض الآليات الأكثر بروزاً نمو الطبقات المقاومة (الطور البيني للكهرباء الصلبة، أو SEI) على أسطح القطب الكهربائي، وطلاء الليثيوم، والتكسير الميكانيكي لطبقة SEI أو جزيئات القطب، والتحلل الحراري للكهرباء.[165] يعتمد الانحلال بشدة على درجة الحرارة: الانحلال في درجة حرارة الغرفة ضئيل للغاية ولكنه يزيد بالنسبة للبطاريات المخزنة أو المستخدمة في البيئات الساخنة أو الباردة.[166] تسرع مستويات الشحن العالية أيضاً فقدان السعة.[167]تولد البطاريات حرارة عند شحنها أو تفريغها، خاصة في التيارات العالية. حزم البطاريات الكبيرة، مثل تلك المستخدمة في السيارات الكهربائية، مجهزة بشكل عام بأنظمة إدارة حرارية تحافظ على درجة حرارة بين 15 °C (59 °F) و35 °C (95 °F).[168] تعتمد درجات حرارة حاوية البطارية والخلية الأسطوانية خطياً على تيار التفريغ.[169] التهوية الداخلية السيئة قد تزيد من درجات الحرارة. تختلف معدلات الضياعات حسب درجة الحرارة: 6٪ خسارة عند 0 °C (32 °F)، 20٪ عند 25 °C (77 °F)، و35٪ عند 40 °C (104 °F).[بحاجة لمصدر] على النقيض من ذلك، فإن العمر الزمني لخلايا LiFePO 4 لا يتأثر بحالة الشحن العالية.[170][171][المصدر لا يؤكد ذلك]أدى ظهور طبقة SEI إلى تحسين الأداء، ولكنه زاد من التعرض للتدهور الحراري. تتكون الطبقة من إلكتروليت - منتجات تقليل الكربونات التي تعمل كموصل أيوني وعازل إلكتروني. يتشكل على كل من الأنود والكاثود ويحدد العديد من معلمات الأداء. في ظل الظروف النموذجية، مثل درجة حرارة الغرفة وغياب تأثيرات الشحن والملوثات، تصل الطبقة إلى سمك ثابت بعد الشحن الأول، مما يسمح للجهاز بالعمل لسنوات. ومع ذلك، فإن التشغيل خارج هذه الپارامترات يمكن أن يؤدي إلى تدهور الجهاز عبر عدة تفاعلات.[172]بطاريات الليثيوم-أيون عرضة لتلاشي السعة لأكثر من المئات[173] لآلاف الدورات. إنه عن طريق العمليات الكهروكيميائية البطيئة، وتشكيل مرحلة بينية صلبة بالكهرباء (SEI) في القطب السالب. تتشكل SEI بين الشحنة الأولى والتفريغ وينتج عنها استهلاك أيونات الليثيوم. يقلل استهلاك أيونات الليثيوم من كفاءة شحن وتفريغ مادة القطب.[174]ومع ذلك، فإن غشاء SEI هو مذيب عضوي غير قابل للذوبان، وبالتالي يمكن أن يكون مستقراً في محاليل الإلكتروليت العضوية. إذا تمت إضافة المضافات المناسبة إلى الإلكتروليت لتعزيز تكوين SEI، فيمكن منع التضمين المشترك لجزيئات المذيبات بشكل فعال ويمكن تجنب تلف مواد الإلكترود. من ناحية أخرى، يعد SEI انتقائياً ويسمح بمرور أيونات الليثيوم ويمنع مرور الإلكترونات. هذا يضمن استمرارية دورة الشحن والتفريغ.[175] يعمل SEI على إعاقة زيادة استهلاك أيونات الليثيوم وبالتالي يحسن بشكل كبير القطب، بالإضافة إلى أداء الدورة وعمر الخدمة. أظهرت البيانات الجديدة أن التعرض للحرارة واستخدام الشحن السريع يعززان تدهور بطاريات الليثيوم-أيون أكثر من العمر والاستخدام الفعلي.[176] يمكن أن يؤدي شحن بطاريات الليثيوم-أيون إلى ما يزيد عن 80٪ إلى تسريع تدهور البطارية بشكل كبير.[177][178][179][180][181]
يمكن أن تحدث خمسة تفاعلات انحلال طارد للحرارة:[172]
- الاختزال الكيميائي للإلكتروليت (الكهرل) بواسطة الأنود.
- التحلل الحراري للكهارل.
- الأكسدة الكيميائية للإلكتروليت بالكاثود.
- التحلل الحراري بواسطة الكاثود والأنود.
- دائرة قصر داخلية بتأثيرات الشحن.
طبقة SEI التي تتشكل على الأنود عبارة عن خليط من أكسيد الليثيوم، فلوريد الليثيوم وأشباه الكربونات (على سبيل المثال، كربونات ألكيل الليثيوم). في درجات الحرارة المرتفعة، تتحلل كربونات الألكيل في الإلكتروليت إلى Li 2CO 3 غير قابلة للذوبان، مما يزيد من سماكة الغشاء، مما يحد من كفاءة الأنود. هذا يزيد من مقاومة الخلية ويقلل من السعة.[166] يمكن أن تزيد الغازات المتكونة من تحلل الإلكتروليت من الضغط الداخلي للخلية وهي مشكلة محتملة تتعلق بالسلامة في البيئات الصعبة مثل الأجهزة المحمولة.[172] أقل من 25 درجة مئوية، يؤدي طلاء الليثيوم المعدني على الأنودات والتفاعل اللاحق مع الإلكتروليت إلى فقدان الليثيوم القابل للتدوير.[166] يمكن أن يؤدي التخزين الممتد إلى زيادة تدريجية في سماكة الغشاء وفقدان السعة.[172] يمكن أن يؤدي الشحن عند أعلى من 4.2 فولت إلى بدء طلاء Li+ على الأنود، مما ينتج عنه فقد لا رجعة فيه في السعة. ينتج عن عشوائية الليثيوم المعدني المضمن في الأنود أثناء الإقحام تكوين التشعبات. بمرور الوقت يمكن أن تتراكم التشعبات وتخترق الفاصل، مما يتسبب في دائرة قصر مما يؤدي إلى تسخين أو حريق أو انفجار. يشار إلى هذه العملية باسم التسريب الحراري.[172] يمكن أن يؤدي التفريغ الذي يتجاوز 2 فولت أيضاً إلى فقد السعة. يمكن لمجمع تيار الأنود (النحاسي) أن يذوب في المنحل بالكهرباء. عند الشحن، يمكن أن تقل أيونات النحاس على الأنود مثل النحاس المعدني. بمرور الوقت، يمكن أن تتشكل التشعبات النحاسية وتسبب قصراً بنفس طريقة الليثيوم.[172] تؤدي معدلات الدوران العالية وحالة الشحن إلى إجهاد ميكانيكي على شبكة الگرافيت في الأنود. الإجهاد الميكانيكي الناجم عن الإقحام وإزالة الإقحام يخلق شقوقاً وانشقاقات في جزيئات الگرافيت، مما يؤدي إلى تغيير اتجاهها. يؤدي هذا التغيير في الاتجاه إلى فقدان السعة.[172]تشتمل آليات التحلل بالكهرباء على التحلل المائي والتحلل الحراري.[172] عند تركيزات منخفضة تصل إلى 10 جزء في المليون، يبدأ الماء في تحفيز مجموعة من منتجات التحلل التي يمكن أن تؤثر على المنحل بالكهرباء والأنود والكاثود.[172]يشارك LiPF 6 في تفاعل التوازن مع LiF وPF 5. في ظل الظروف النموذجية، يقع التوازن بعيداً عن اليسار. ومع ذلك، فإن وجود الماء يولد كمية كبيرة من LiF، وهو منتج غير قابل للذوبان وعازل كهربائياً. يرتبط LiF بسطح الأنود، مما يزيد من سماكة الغشاء.[172] ينتج عن التحلل المائي LiPF 6 PF 5، وهو حمض لويس قوي يتفاعل مع الأنواع الغنية بالإلكترون، مثل الماء. يتفاعل PF 5 مع الماء لتكوين حمض الهيدروفلوريك (HF) وأوكسي فلوريد الفوسفور. يتفاعل أوكسي فلوريد الفوسفور بدوره لتشكيل HF إضافي وديفلورو هيدروكسي حمض الفوسفوريك. HF يحول غشاء SEI الصلب إلى غشاء هش. على الكاثود، يمكن أن ينتشر مذيب الكربونات على أكسيد الكاثود بمرور الزمن، مما يؤدي إلى إطلاق حرارة ومن المحتمل أن يتسبب في هروب حراري. [172] يبدأ تحلل أملاح الإلكتروليت والتفاعلات بين الأملاح والمذيب عند أدنى مستوى مثل 70 درجة مئوية. يحدث التحلل الكبير في درجات حرارة أعلى. عند 85 درجة مئوية استرة التحويلية تتشكل المنتجات، مثل ثنائي ميثيل 2،5-ديوكساهكسان كربوكسيلات (DMDOHC) من EC تتفاعل مع DMC.[172] تشمل آليات تحلل الكاثود انحلال المنجنيز وأكسدة الإلكتروليت والاضطراب الهيكلي.[172] في LiMnO 4 حمض الهيدروفلوريك يحفز فقدان المنغنيز المعدني من خلال عدم تناسق المنجنيز ثلاثي التكافؤ:[172]
- 2Mn3+ → Mn2++ Mn4+
يؤدي فقدان مادة الإسبينيل إلى تلاشي السعة. درجات حرارة منخفضة تصل إلى 50 درجة مئوية تبدأ في ترسيب Mn2+ على الأنود مثل المنجنيز المعدني مع نفس تأثيرات طلاء الليثيوم والنحاس.[166] تدمر دورة الجهد الأقصى والأدنى النظري الشبكة البلورية عبر تشويه جلن-تلر، والذي يحدث عندما يتم تقليل Mn4+ إلى Mn3+ أثناء التفريغ.[172] ويؤدي تخزين بطارية مشحونة إلى أكثر من 3.6 فولت إلى بدء أكسدة الإلكتروليت بواسطة الكاثود ويحث على تكوين طبقة SEI على الكاثود. كما هو الحال مع الأنود، يشكل تكوين SEI المفرط عازلاً يؤدي إلى تلاشي السعة وتوزيع التيار غير المتكافئ.[172] وينتج عن التخزين عند أقل من 2 فولت انحلال بطيء في كاثودات LiCoO 2 وLiMn 2O 4، وإطلاق الأكسجين وفقدان السعة بشكل غير عكوس.[172]
تسربت الحاجة إلى "التكييف" NiCd وNiMH إلى الفولكلور المحيط ببطاريات الليثيوم-أيون، ولكن لا أساس لها من الصحة. التوصية للتقنيات القديمة هي ترك الجهاز متصلاً لمدة سبع أو ثماني ساعات، حتى لو كان مشحوناً بالكامل.[182] قد يكون هذا خلطًا بين تعليمات معايرة برامج البطارية مع تعليمات "التكييف" لبطاريات NiCd وNiMH.[183]
المزايا والعيوب
المزايا

- مجموعة متنوعة من الأشكال والأحجام الملائمة للأجهزة التي يتم تشغيلها بكفاءة.
- أخف بكثير من الطاقة المكافئة من البطاريات الثانوية الأخرى.[184]
- جهد الدائرة المفتوحة مرتفع بالمقارنة مع البطاريات المائية (مثل حمض الرصاص، هيدريد معدن نيكل و النيكل والكادميوم).[185] هذا مفيد لأنه يزيد من كمية الطاقة التي يمكن نقلها بتيار أقل.
- لا يوجد تأثير الذاكرة.
- التفريغ الذاتي بمعدل 5-10٪ تقريباً شهرياً، مقارنة بأكثر من 30٪ شهرياً في بطاريات هيدريد النيكل الشائعة، حوالي 1.25٪ شهرياً لـ بطاريات NiMH منخفضة التفريغ الذاتي و10٪ شهرياً في بطاريات النيكل-الكادميوم.[165] وفقاً لإحدى الشركات المصنعة، لا تحتوي خلايا أيونات الليثيوم (وبالتالي بطاريات الليثيوم أيون "الغير عملية") على أي تفريغ ذاتي بالمعنى المعتاد لهذه الكلمة.[77]ما يبدو وكأنه تفريغ ذاتي في هذه البطاريات هو فقد دائم في السعة (انظر العيوب). من ناحية أخرى، تقوم بطاريات الليثيوم أيون "الذكية" بالتفريغ الذاتي، بسبب استنزاف دائرة مراقبة الجهد المدمجة.
- المكونات آمنة بيئياً حيث لا يوجد معدن ليثيوم حر في الطبيعة.[بحاجة لمصدر]
العيوب
تأثر عمر البطارية
- يؤدي الشحن إلى تكوين رواسب داخل الإلكتروليت تمنع نقل الأيونات. بمرور الوقت، تتضاءل سعة الخلية. تقلل الزيادة في المقاومة الداخلية من قدرة الخلية على توصيل التيار. هذه المشكلة أكثر وضوحاً في تطبيقات التيار العالي. يعني الانخفاض أن البطاريات القديمة لا تشحن بقدر البطاريات الجديدة (ينخفض وقت الشحن المطلوب بشكل متناسب).
- تعمل مستويات الشحن المرتفعة ودرجات الحرارة المرتفعة (سواء من الشحن أو الهواء المحيط) على تسريع فقدان السعة.[186][153]تنتج حرارة الشحن عن أنود الكربون (عادةً ما يتم استبداله بـ تيتانات الليثيوم مما يقلل بشكل كبير من التلف الناتج عن الشحن، بما في ذلك التمدد وعوامل أخرى).[187]
- تفقد خلية الليثيوم-أيون القياسية (كوبالت) الممتلئة معظم الوقت عند 0 °C (32 °F) بشكل غير عكوس ما يقرب من 20٪ من السعة سنوياً. قد يؤدي ضعف التهوية إلى زيادة درجات الحرارة وتقليل عمر البطارية. تختلف معدلات الفقد حسب درجة الحرارة: 6٪ خسارة عند 0 °C (32 °F)، 20٪ عند 25 °C (77 °F)، و35٪ عند 40 °C (104 °F). عند التخزين عند مستوى شحن 40٪ - 60٪، يتم تقليل فقد السعة إلى 2٪ و4٪ و15٪ على التوالي.[188][بحاجة لمصدر] في المقابل، لا يتأثر العمر التقويمي لخلايا LiFePO4 بالحفاظ عليها في حالة شحن عالي.[189]
المقاومة الداخلية
- تعد المقاومة الداخلية لبطاريات الليثيوم أيون القياسية (الكوبالت) عالية مقارنة بكل من الكيماويات الأخرى القابلة لإعادة الشحن مثل هيدريد معدن النيكل والنيكل والكادميوم وLiFePO4 وخلايا ليثيوم پوليمر.[190] Internal resistance increases with both cycling and age.[153][191][192] يؤدي ارتفاع المقاومة الداخلية إلى انخفاض الجهد في المحطات تحت الحمل، مما يقلل من أقصى سحب للتيار. تعني زيادة المقاومة في نهاية المطاف أن البطارية لم يعد بإمكانها العمل لفترة كافية.
- لتشغيل الأجهزة الأكبر حجماً، مثل السيارات الكهربائية، يكون توصيل العديد من البطاريات الصغيرة في دائرة متوازية أكثر فاعلية[193]وكفاءة من توصيل بطارية واحدة كبيرة.[194]
متطلبات الأمان
في حالة السخونة الزائدة أو الشحن الزائد، قد تعاني بطاريات ليثيوم-أيون من التسرب الحراري وتمزق الخلايا.[195] في الحالات القصوى يمكن أن يؤدي هذا إلى الاحتراق. قد يؤدي التفريغ العميق إلى قصر الدائرة الكهربائية للخلية، وفي هذه الحالة سيكون إعادة الشحن غير آمن.[196]لتقليل هذه المخاطر، تحتوي حزم بطاريات الليثيوم أيون على دائرة كهربائية آمنة من التعطل تعمل على إيقاف تشغيل البطارية عندما يكون جهدها خارج النطاق الآمن البالغ 3-4.2 فولت لكل خلية.[77][165] عند تخزينها لفترات طويلة، قد يؤدي سحب التيار الصغير لدائرة الحماية نفسها إلى استنزاف البطارية إلى ما دون جهد إيقاف التشغيل; ثم تصبح أجهزة الشحن العادية غير فعالة. لا يمكن شحن العديد من أنواع خلايا الليثيوم أيون بأمان أقل من 0 درجة مئوية.[197]
ميزات الأمان الأخرى مطلوبة في كل خلية:[77]
- فاصل الاغلاق (للحرارة الزائدة)
- علامة تبويب تمزيق (للضغط الداخلي)
- تنفيس (تخفيف الضغط)
- المقاطعة الحرارية (التيار الزائد/الشحن الزائد)
تشغل هذه الأجهزة مساحة مفيدة داخل الخلايا، وتضيف نقاط فشل إضافية وتعطيل الخلية بشكل لا رجعة فيه عند تنشيطها. إنها مطلوبة لأن الأنود ينتج الحرارة أثناء الاستخدام، بينما قد ينتج الكاثود الأكسجين. تقلل هذه الأجهزة وتصميمات الأقطاب الكهربائية المحسّنة/تقضي على مخاطر نشوب حريق أو انفجار.
تعمل ميزات الأمان هذه على زيادة التكاليف مقارنة ببطاريات هيدريد معدن النيكل، والتي تتطلب فقط جهاز إعادة تركيب الهيدروجين/الأكسجين (منع الضرر بسبب الشحن الزائد الخفيف) وصمام ضغط احتياطي.[165]
التصميم والمواصفات
- كثافة الطاقة النوعية: 150 إلى 200 Wh/kg (540 إلى 720 kJ/kg)
- كثافة الطاقة الحجمية: 250 إلى 530 Wh/l (900 إلى 1900 J/cm³)
- كثافة القدرة النوعية: 300 إلى 1500 W/kg (@ 20 ثانية [198] و285 Wh/l)
نظراً لأن بطاريات الليثيوم أيون يمكن أن تحتوي على مجموعة متنوعة من مواد الكاثود والأنود، فإن كثافة الطاقة والجهد تختلف من الكيمياء إلى الكيمياء.
تحتوي بطاريات الليثيوم أيون مع كاثود فوسفات الليثيوم وحديد الفوسفات وأنود الگرافيت جهد الدائرة المفتوحة 3.2 V وفولتية شحن نموذجية تبلغ 3.6 ڤولت. مع أنودات الگرافيت لها جهد اسمي 3.7 ڤولت مع شحنة قصوى تبلغ 4.2 فولت. يتم إجراء الشحن بجهد ثابت مع دوائر التيار المحدد. هذا يعني الشحن بتيار ثابت حتى تصل الخلية إلى جهد يبلغ 4.2 ڤولت ويستمر بجهد ثابت مطبق حتى ينخفض التيار بالقرب من الصفر. عادةً ما يتم إنهاء الشحن بنسبة 7٪ من تيار الشحن الأولي. في الماضي، لم يكن من الممكن شحن بطاريات الليثيوم أيون بسرعة وكانت تحتاج عادةً إلى ساعتين على الأقل لشحنها بالكامل. يمكن شحن خلايا الجيل الحالي بالكامل في 45 دقيقة أو أقل; يمكن أن تصل بعض أنواع الليثيوم-أيون إلى 90٪ في أقل من 10 دقائق.[199]
إدخال تحسينات على بطارية ليثيوم أيون
نظرة عامة
تركز التحسينات على عدة مجالات، وغالباً ما تتضمن تطورات في تكنولوجيا النانو والبنى الدقيقة:
- زيادة عمر الدورة والأداء (يقلل المقاومة الداخلية ويزيد من طاقة الخرج) عن طريق تغيير تركيبة المادة المستخدمة في الأنود والكاثود إلى جانب زيادة مساحة السطح الفعالة للأقطاب الكهربائية. (ساعدت تطورات المكثف الفائق المرتبطة.)
- تحسين القدرة عن طريق تحسين الهيكل لدمج المزيد من المواد الفعالة.
- تحسين سلامة بطاريات الليثيوم أيون.
كاثودات الإسپنيل المنجنيز
LG، وهي ثالث أكبر منتج لبطاريات الليثيوم أيون، تستخدم الليثيوم إسپنيل المنجنيز في الكاثود الخاص بها. وهي تعمل مع شركتها الفرعية CPI لتسويق بطاريات الليثيوم أيون التي تحتوي على إسپنيل المنجنيز لتطبيقات HEV.[200] تعمل العديد من الشركات الأخرى أيضاً على إسپنيل المنجنيز، بما في ذلك NEC وسامسونگ.[201]
كاثود فوسفات الحديد الليثيوم مع الأنود التقليدي
رخصت جامعة تكساس براءة اختراعها لأول مرة لكاثودات فوسفات الحديد الليثيوم للمنفعة الكندية هيدرو كيبيك.[202]وقد فُصلت فوستك لاحقاً عن هيدرو-كيبكمن أجل التطوير الوحيد لفوسفات حديد الليثيوم.
تعمل ڤالنس تكنولوجي، الموجودة في أوستن، تكساس، أيضاً على خلايا فوسفات الحديد والليثيوم. منذ مارس 2005، فقد شُحن الناقل الفردي سگواي ببطاريات ليثيوم أيون طويلة المدى[203]المُصنَّع بواسطة ڤالنس تكنولوجي باستخدام مواد كاثود الحديد الفوسفاتي. اختارت شركة سگواي بناء بطاريتها كبيرة الحجم باستخدام مادة الكاثود هذه نظرًا لتحسين سلامتها على مواد أكسيد المعادن.
في نوفمبر 2005، أعلنت نظم إيه 123[204] تطوير خلايا فوسفات الحديد الليثيوم بناءً على بحث مرخص من معهد ماساتشوستس للتكنولوجيا.[205][206]بينما تحتوي البطارية على كثافة طاقة أقل قليلاً من تقنيات ليثيوم أيون المنافسة الأخرى، يمكن لخلية 2 Ahr أن توفر ذروة 70 أمبير دون تلف وتعمل في درجات حرارة أعلى من 60 درجة مئوية. المستخدمة في المنتجات الاستهلاكية بما في ذلك DeWalt الأدوات الكهربائية ومنتجات الطيران والأنظمة الهجينة للسيارات والتحويلات PHEV.
خلايا LiFePO4 متاحة حالياً تجارياً.
كاثود عالي الطاقة باستخدام كوبالت الليثيوم والنيكل والمنجنيز (NMC)
تقوم شركة إمارا، التي يقع مقرها في منلو پارك، كاليفورنيا بتسويق تقنية جديدة "حيادية للمواد" طُبّقت لأول مرة على مادة NMC والتي لها تأثير على تقليل المعاوقة وإطالة عمر الدورة. تتمتع هذه الخلايا ذات القدرة العالية بكثافة طاقة عالية مقارنة بخلايا الطاقة العالية الأخرى في السوق.[207]فقد استُخدمت البطاريات في أدوات كهربائية ومعدات طاقة خارجية ومركبات هجينة.
الكاثود التقليدي مع أنود تيتانات الليثيوم
أعلنت ألتيرنانو، وهي شركة صغيرة مقرها رينو، نـِڤادا، عن مادة الإلكترود تيتانات بحجم النانو لبطاريات الليثيوم أيون. يُزعم أن بطارية النموذج الأولي لديها ثلاثة أضعاف طاقة البطاريات الموجودة ويمكن شحنها بالكامل في ست دقائق. ومع ذلك، تبلغ سعة الطاقة حوالي نصف قدرة خلايا الليثيوم العادية. تقول الشركة أيضاً إن خلايا البطارية حققت الآن عمراً يزيد عن 9000 دورة شحن وما زالت تحتفظ بسعة شحن تصل إلى 85٪، لذا فإن المتانة وعمر البطارية أطول بكثير، ويُقدر بحوالي 20 عاماً أو أربع مرات أطول من الليثيوم العادي بطاريات أيون. يمكن أن تعمل البطاريات من -50 درجة مئوية إلى أكثر من 75 درجة مئوية ولن تنفجر أو تؤدي إلى هروب حراري حتى في ظل الظروف القاسية لأنها لا تحتوي على مادة القطب الموجب المصنوع من المعدن المطلي بالگرافيت.[208] يتم حالياً اختبار البطاريات في سيارة إنتاج جديدة من صنع فينكس موتوركارز والتي كانت معروضة في معرض SEMA للسيارات لعام 2006. يتم اختبارها أيضاً، على مقياس شبكة واحد ميگاواط، في منطقة التحكم في في منطقة التحكم في النقل المجالي للربط البيني PJM[209]في نوريستاون، وPA بالإضافة إلى العديد من فروع وزارة دفاع الولايات المتحدة.[210] بالإضافة إلى ذلك، يتم عرض البطاريات بواسطة Proterra في سيارتها EcoRide BE35 الكهربائية بالكامل، وهي حافلة خفيفة الوزن بطول 35 قدماً.[211] تعمل Altairnano حالياً مع ثلاثة أنظمة كيميائية مختلفة للخلايا، لتطبيقات تخزين الطاقة والطاقة المختلفة، ومن المتوقع إجراء كيمياء خلوية جديدة أخرى في خريف عام 2009. تعد طبيعة مواد الكاثود الأخيرة ملكية خاصة بها حالياً.
تطويرات مجمعة للأنود والكاثود
تعمل إنردل، المملوكة بشكل مشترك لـ Ener1 و دلفي، على تسويق الخلايا التي تحتوي على أنود من التيتانات وكاثود إسپنيل المنجنيز.[212]على الرغم من أن الخلايا تُظهر خصائص حرارية ممتازة وقابلية التدوير، فإن جهدها المنخفض قد يعيق النجاح التجاري.[213]
مزاعم بحثية
في أبريل 2006، أعلنت مجموعة من العلماء في MIT عن عملية تستخدم الفيروسات لتشكيل أسلاك بحجم النانو. يمكن استخدامها لبناء بطاريات ليثيوم أيون فائقة الرقة بثلاثة أضعاف كثافة الطاقة العادية.[214]
اعتباراً من يونيو 2006، ابتكر الباحثون في فرنسا أقطاب بطارية ذات بنية نانوية بعدة أضعاف قدرة الطاقة، من حيث الوزن والحجم، للأقطاب الكهربائية التقليدية.[215]
في عدد سبتمبر 2007 من نيتشر، أبلغ باحثون من جامعة واترلو، كندا، عن كيمياء كاثود جديدة، حيث استُبدلت مجموعة الهيدروكسيد في كاثود فوسفات الحديد بالفلور. [4] يبدو أن المزايا ذات شقين. أولاً، هناك تغيير أقل في حجم الكاثود خلال دورة الشحن مما يشير إلى إمكانية إطالة عمر البطارية. ثانياً، تسمح الكيمياء بإحلال الليثيوم في البطارية محل الصوديوم أو خليط الصوديوم/الليثيوم (ومن هنا جاءت الإشارة إليها كبطارية Alkali-Ion).
في نوفمبر 2007، كشفت سوبارو عن مفهومها للسيارة الكهربائية G4e مع بطارية ليثيوم أيون تعتمد على أكسيد ڤناديوم الليثيوم، مما يعد بضعف كثافة الطاقة لبطارية الليثيوم أيون التقليدية (أكسيد الكوبالت الليثيوم والگرافيت).[5] في المختبر، حققت أنودات أكسيد الڤناديوم الليثيوم، المقترنة بكاثودات أكسيد الكوبالت الليثيوم، 745 واط في الساعة/لتر، أي ما يقرب من ثلاثة أضعاف كثافة الطاقة الحجمية لبطاريات الليثيوم أيون التقليدية. [6]
في ديسمبر 2007، أفاد باحثون في جامعة ستانفورد بتكوين أيون ليثيوم ذات أسلاك متناهية الصغر بكثافة طاقة عشرة أضعاف (كمية الطاقة المتاحة بالوزن) من خلال استخدام أسلاك السيليكون النانوية المترسبة على الفولاذ المقاوم للصدأ كأنود. تستفيد البطارية من حقيقة أن السليكون يمكنه الاحتفاظ بكميات كبيرة من الليثيوم، ويساعد في التخفيف من مشكلة التصدع التي طال أمدها بسبب صغر حجم الأسلاك. [7] للحصول على تحسن عشرة أضعاف في كثافة الطاقة، يجب تحسين الكاثود أيضاً; ومع ذلك، فإن مجرد تحسين القطب الموجب على هذا النحو يمكن أن يوفر "عدة" أضعاف كثافة الطاقة، وفقاً للفريق. يتوقع قائد الفريق، يي كوي، أن يكون قادراً على تسويق التكنولوجيا في حوالي خمس سنوات.[8]. لن يؤدي وجود أنود سعوي كبير إلى زيادة سعة البطارية كما تنبأ المؤلف عندما تكون مادة الكاثود أقل سعوية من الأنود. ومع ذلك، فإن قدرة الليثيوم أيون الحالية محدودة بشكل أساسي بسبب السعة النظرية المنخفضة (372 mAh g−1) من الگرافيت كمادة الأنود، لذا سيكون التحسين مهماً ومحدوداً بواسطة مادة الكاثود بدلاً من الأنود.
هناك تجارب جارية لاستخدام هيدرات المعادن كمواد أنود لبطاريات ليثيوم أيون. فقد أُبلغ عن السعة العملية لقطب كهربائي يصل إلى 1480 mAh g-1.[9]
في أبريل 2009، زعم تقرير في نيو ساينتست أن فريق أنجيلا بيلشر في معهد ماساتشوستس للتكنولوجيا قد نجح في إنتاج أول بطارية ليثيوم أيون بقوة 3 فولت.[216]
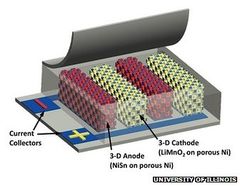
البطاريات الدقيقة
في أبريل 2013، قام فريقي بحثي من جامعة إلينوي بتطوير نوع جديد من البطاريات، يمكن اعتبارها ثورة في عالم البطاريات. قام الباحثون باستخدام أقطاب كهربائية ثلاثية الأبعاد تسمح بصنع بطاريات دقيقة ذات حجم أقل بكثير وطاقة أكبر بكثير عن البطاريات التجارية المتوافرة. يمكن إعادة شحن البطاريات الجديدة 1.000 ضعف سرعة إعادة الشحن الحالية، إلا أنه لا يزال هناك مشكلات متعلقة بالأمان.[217]
يعتقد الباحثون أن البطاريات الدقيقة الجديدة ستكون مناسبة للهواتف الذكية والأجهزة الإلكترونية الأخرى التي تحتوي على مساحة محدودة للبطاريات. تعمل البطاريات بمكونين - قطبين - يمكن الحصول عليهم بتفاعلات كيميائية.
إرشادات لإطالة عمر بطارية ليثيوم أيون
- مثل العديد من البطاريات القابلة لإعادة الشحن، يجب شحن بطاريات الليثيوم أيون مبكراً وبشكل متكرر. ومع ذلك، إذا لم يتم استخدامها لفترة طويلة، فيجب وضعها بمستوى شحن يتراوح بين 40٪ - 60٪
- لا ينبغي تفريغ وإعادة شحن بطاريات الليثيوم أيون بالكامل بشكل متكرر ("ذات دورة شحن عميقة")، ولكن قد يكون هذا ضرورياً بعد كل 30 مرة تقريباً من إعادة الشحن لإعادة معايرة أي شاشة شحن إلكترونية (مثل مقياس البطارية). يسمح هذا لإلكترونيات المراقبة بتقدير شحن البطارية بدقة أكبر.[194] هذا ليس له علاقة بـ تأثير الذاكرة.
- لا ينبغي أبداً استنفاذ بطاريات ليثيوم أيون أقل من الحد الأدنى للجهد، 2.4 فولت إلى 3.0 فولت لكل خلية.
- يجب أن تبقى بطاريات ليثيوم أيون باردة. من الناحية المثالية تُخزّن في الثلاجة. سيؤدي عمر البطارية الكبير إلى ضياعات أسرع بكثير في درجات الحرارة المرتفعة. تتسبب درجات الحرارة المرتفعة الموجودة في السيارات في تدهور بطاريات الليثيوم أيون بسرعة.
- لا ينبغي تجميد بطاريات Li-ion [218] (تتجمد معظم كهارل بطارية الليثيوم أيون عند درجة حرارة -40 درجة مئوية تقريباً; ومع ذلك، فإن هذا يكون أكثر برودة بكثير من أدنى درجة حرارة تصل إليها المجمدات المنزلية).
- يجب شراء بطاريات Li-ion فقط عند الحاجة، لأن عملية التقادم تبدأ بمجرد تصنيع البطارية.[194]
- عند استخدام حاسب مكتبي يعمل من خط طاقة ثابت لفترات طويلة، ضع في اعتبارك إزالة البطارية[219] وتخزينها في مكان بارد حتى لا تتأثر بالحرارة التي ينتجها الحاسب.
الشحن ودرجة حرارة التخزين
يؤدي تخزين بطارية ليثيوم-أيون في درجة الحرارة والشحن الصحيحين إلى إحداث فرق كبير في الحفاظ على سعتها التخزينية. يوضح الجدول التالي مقدار فقد السعة "الدائم" الذي سيحدث بعد التخزين عند مستوى شحن ودرجة حرارة معينين.
| درجة حرارة التخزين | 40% الشحن | 100% الشحن |
|---|---|---|
| 0 °س (32 °ف) | 2% تفقد بعد سنة واحدة | 6% تفقد بعد سنة واحدة |
| 25 °س (77 °ف) | 4% تفقد بعد سنة واحدة | 20% تفقد بعد سنة واحدة |
| 40 °C (104 °F) | 15% تفقد بعد سنة واحدة | 35% تفقد بعد سنة واحدة |
| 60 °C (140 °F) | 25% تفقد بعد سنة واحدة | 80% تفقد بعد 6 أشهر |
| المصدر: BatteryUniversity.com[194] | ||
من المفيد جداً تجنب تخزين بطارية ليثيوم-أيون عند الشحن الكامل. بطارية ليثيوم-أيون المخزنة بنسبة شحن 40٪ تدوم عدة مرات أطول من البطارية المخزنة بنسبة شحن 100٪، خاصة في درجات الحرارة المرتفعة.[194]
إذا خُزنت بطارية ليثيوم-أيون بشحنة منخفضة جداً، فهناك خطر السماح بانخفاض الشحن إلى ما دون عتبة الجهد المنخفض للبطارية، مما يؤدي إلى نفاد البطارية بشكل غير قابل للاسترداد. بمجرد انخفاض الشحن إلى هذا المستوى، قد يكون إعادة الشحن أمراً خطيراً. لذلك تتميز بعض البطاريات بدائرة أمان داخلية تمنع الشحن في هذه الحالة، وستكون البطارية لجميع الأغراض العملية ميتة. [بحاجة لمصدر]
في الظروف التي تتوفر فيها بطارية ليثيوم-أيون ثانية لجهاز معين، يوصى بتفريغ البطارية غير المستخدمة بنسبة 40٪ ووضعها في الثلاجة لإطالة عمرها الافتراضي. بينما يمكن استخدام البطارية أو شحنها على الفور، ستوفر بعض بطاريات ليثيوم-أيون المزيد من الطاقة عند وضعها في درجة حرارة الغرفة.
إطالة الحياة في خلايا متعددة من خلال موازنة الخلايا
تعمل النهايات الأمامية التناظرية التي توازن الخلايا وتزيل عدم تطابق الخلايا في سلسلة أو متوازية بشكل كبير على تحسين كفاءة البطارية وزيادة سعة الحزمة الإجمالية. مع زيادة عدد الخلايا وتيارات الحمل، تزداد أيضاً احتمالية عدم التطابق. هناك نوعان من عدم التطابق في العبوة: حالة الشحن (SOC) وعدم تطابق السعة/الطاقة (C/E). على الرغم من أن عدم تطابق SOC هو أكثر شيوعاً، فإن كل مشكلة تحد من سعة العبوة (مللي أمبير) إلى سعة الخلية الأضعف.
من المهم أن ندرك أن عدم تطابق الخلية ينتج عن قيود في التحكم في العملية والفحص أكثر مما ينتج عن الاختلافات المتأصلة في كيمياء ليثيوم أيون. يمكن أن يؤدي استخدام موازنة الخلايا إلى تحسين أداء خلايا ليثيوم-أيون المتصلة بالسلسلة من خلال معالجة مشكلات SOC و C/E.[220] ويمكن معالجة عدم تطابق SOC عن طريق موازنة الخلية خلال فترة التكييف الأولية وبعد ذلك فقط أثناء مرحلة الشحن. إذ تعتبر معالجات عدم تطابق C/E أكثر صعوبة في التنفيذ وأصعب في القياس وتتطلب الموازنة خلال فترتي الشحن والتفريغ.
- موازنة الخلايا
تُعرّف موازنة الخلايا على أنها تطبيق التيارات التفاضلية على الخلايا الفردية (أو مجموعات الخلايا) في سلسلة متسلسلة. عادة، تتلقى الخلايا في سلسلة متسلسلة تيارات متطابقة. تتطلب حزمة البطارية مكونات ودوائر إضافية لتحقيق التوازن الخلوي. ومع ذلك، فإن استخدام واجهة أمامية تناظرية متكاملة تماماً لموازنة الخلايا[221] يقلل من المكونات الخارجية المطلوبة لمجرد موازنة المقاومات.
هذا النوع من المحاليل يلغي الحاجة إلى المكثفات المنفصلة والصمامات الثنائية (الديودات) ومعظم المقاومات الأخرى لتحقيق التوازن.
تُوازن خلايا حزمة البطارية عندما تستوفي جميع الخلايا الموجودة في حزمة البطارية شرطين:
- إذا كانت جميع الخلايا لها نفس السعة، فستكون متوازنة عندما يكون لها نفس حالة الشحن (SOC)، وفي هذه الحالة يعد جهد الدائرة المفتوحة (OCV) مقياساً جيداً لـ SOC. وإذا كان من الممكن، في حزمة غير متوازنة، شحن جميع الخلايا بشكل تفاضلي إلى السعة الكاملة (متوازنة)، فحينئذٍ ستدور بشكل طبيعي دون أي تعديلات إضافية، هذا في الغالب إصلاح تجربة واحدة.
- إذا كانت الخلايا لها سعات مختلفة، فإنها تعتبر أيضاً متوازنة عندما تكون SOC هي نفسها. ولكن نظراً لأن SOC مقياس نسبي، فإن المقدار المطلق للسعة لكل خلية يختلف. للحفاظ على الخلايا ذات السعات المختلفة في نفس SOC، يجب أن يوفر موازنة الخلية كميات متباينة من التيار للخلايا في سلسلة السلسلة أثناء الشحن والتفريغ في كل دورة.
الأمان
خطر الحريق
يمكن أن تشكل بطاريات الليثيوم-أيون خطراً على السلامة لأنها تحتوي على إلكتروليت (كهرل) قابل للاشتعال وقد تصبح مضغوطة في حالة تلفها. قد تتسبب خلية البطارية المشحونة بسرعة كبيرة في حدوث دائرة قصر، مما يؤدي إلى حدوث انفجارات وحرائق.[222]يمكن أن ينشأ حريق بطارية ليثيوم_أيون بسبب (1) سوء الاستخدام الحراري، على سبيل المثال التبريد السيئ أو الحريق الخارجي، (2) سوء الاستخدام الكهربائي، على سبيل المثال الشحن الزائد أو ماس كهربائى خارجي، (3) إساءة استخدام ميكانيكية، على سبيل المثال الاختراق أو التحطم، أو (4) دائرة قصر داخلية، على سبيل المثال بسبب عيوب التصنيع أو وصول عمر البطارية لأقصى حد.[223][224] بسبب هذه المخاطر، تكون معايير الاختبار أكثر صرامة من تلك الخاصة ببطاريات الإلكتروليت الحمضية، وتتطلب نطاقاً أوسع من ظروف الاختبار واختبارات إضافية خاصة بالبطارية، وهناك قيود على الشحن تفرضها جهات تنظيم السلامة.[56][225][226] فقد حدثت عمليات سحب متعلقة بالبطارية من قبل بعض الشركات، بما في ذلك 2016 مجموعة سامسونگ استدعاء گالاكسي نوت 7 لحرائق البطارية.[227][228]
تحتوي بطاريات الليثيوم أيون على سائل إلكتروليت قابل للاشتعال.[229]يمكن أن تتسبب البطارية المعيبة في حدوث fire. [222] يمكن أن تؤثر أجهزة الشحن المتعطلة على سلامة البطارية لأنها يمكن أن تدمر دائرة حماية البطارية. أثناء الشحن في درجات حرارة أقل من 0 درجة مئوية، يتم طلاء القطب السالب للخلايا بالليثيوم النقي، مما قد يضر بسلامة العبوة بأكملها.
سيؤدي قصر البطارية ارتفاع درجة حرارة الخلية وربما تشتعل فيها النيران.[230] أما بالنسبة للدخان الناتج عن التسرب الحراري في بطارية ليثيوم-أيون فهو قابل للاشتعال وسام.[231]يبلغ محتوى طاقة النار (الكهربائية+الكيميائية) لخلايا أكسيد الكوبالت حوالي 100 إلى 150 كيلو جول/(A·h)، معظمها مادة كيميائية.[55][232]
حوالي عام 2010، أُدخلت بطاريات ليثيوم-أيون كبيرة بدلاً من مواد كيميائية أخرى لأنظمة الطاقة في بعض الطائرات; اعتبارا من يناير 2014[تحديث]، والتي لم تتسبب في حوادث ولكن كان من الممكن التسبب بها.[233][234]حيث تحطمت خطوط يو پي إس للطيران 6 في دبي بعد أن اشتعلت حمولتها من البطاريات تلقائياً.
للحد من مخاطر حدوث حريق، تهدف المشاريع البحثية إلى تطوير إلكتروليتات غير قابلة للاشتعال.
التضرر والحمل الزائد
في حالة تلف بطارية ليثيوم-أيون أو تحطمها أو تعرضها لحمل كهربائي أعلى دون الحاجة إلى حماية الشحن الزائد، فقد تنشأ مشكلات. ويمكن أن يؤدي قصر كهربائى خارجي إلى انفجار البطارية.[235]
في حالة السخونة الزائدة أو الشحن الزائد، قد تعاني بطاريات الليثيوم-أيون من الهروب الحراري وتمزق الخلية.[195][236]في الحالات القصوى، يمكن أن يؤدي ذلك إلى حدوث تسرب أو انفجار أو نشوب حريق. لتقليل هذه المخاطر، تحتوي العديد من خلايا الليثيوم أيون (وحزم البطاريات) على دوائر آمنة للحماية من التعطل تفصل البطارية عندما يكون جهدها خارج النطاق الآمن من 3–4.2 V فولت لكل خلية.[77][69] أو عند الشحن الزائد أو التفريغ. تتعرض حزم بطاريات الليثيوم، سواء أن أُنشئت بواسطة البائع أو المستخدم النهائي، بدون دوائر إدارة فعالة للبطارية، لهذه المشكلات. قد تتسبب دوائر إدارة البطارية سيئة التصميم أو المنفذة أيضاً في حدوث مشكلات; من الصعب التأكد من تنفيذ أي دائرة معينة لإدارة البطارية بشكل صحيح.
حدود الجهد
خلايا الليثيوم أيون عرضة للإجهاد من خلال نطاقات الجهد خارج آمنة بين 2.5 و3.65/4.1/4.2 أو 4.35 فولت (حسب مكونات الخلية). يؤدي تجاوز نطاق الجهد هذا إلى الوصول المبكر للعمر المحدد للبطارية ومخاطر السلامة بسبب المكونات التفاعلية في الخلايا.[237] عند تخزينها لفترات طويلة، قد يؤدي سحب التيار الصغير لدائرة الحماية إلى استنزاف البطارية إلى ما دون جهد الإغلاق; قد تصبح أجهزة الشحن العادية عديمة الفائدة لأن نظام إدارة البطارية (BMS) قد يحتفظ بسجل لهذه البطارية (أو الشاحن) "عطل". لا يمكن شحن العديد من أنواع خلايا الليثيوم-أيون بأمان أقل من 0 °C,[238] لأن هذا يمكن أن يؤدي إلى تصفيح الليثيوم على أنود الخلية، مما قد يسبب مضاعفات مثل مسارات قصر الدائرة الداخلية.[بحاجة لمصدر]
يجب أن تتوفر ميزات الأمان الأخرى[ممن؟] في كل خلية:[77]
- فاصل الاغلاق (لارتفاع درجة الحرارة)
- علامة تبويب التشقق (لتخفيف الضغط الداخلي)
- التنفيس (تخفيف الضغط في حالة إطلاق الغازات الشديدة)
- الانقطاع الحراري (التيار الزائد/الشحن الزائد/التعرض البيئي)
هذه الميزات مطلوبة لأن القطب السالب ينتج حرارة أثناء الاستخدام، في حين أن القطب الموجب قد ينتج الأكسجين. ومع ذلك، فإن هذه الأجهزة الإضافية تشغل مساحة داخل الخلايا، وتضيف نقاط فشل، وقد تعطل الخلية بشكل لا رجعة فيه عند تنشيطها. علاوة على ذلك، تزيد هذه الميزات من التكاليف مقارنة ببطاريات هيدريد معدن النيكل، والتي تتطلب فقط جهاز إعادة تركيب الهيدروجين/الأكسجين وصمام ضغط احتياطي.[69] يمكن للملوثات داخل الخلايا أن تخرب أجهزة السلامة هذه. أيضاً، لا يمكن تطبيق هذه الميزات على جميع أنواع الخلايا، على سبيل المثال لا يمكن تجهيز خلايا التيار العالي المنشورية بفتحة تهوية أو مقاطعة حرارية. يجب ألا تنتج خلايا التيار العالي حرارة زائدة أو أكسجيناً، خشية أن يكون هناك فشل، ربما يكون عنيفاً. بدلاً من ذلك، يجب أن تكون مجهزة بصمامات حرارية داخلية تعمل قبل أن يصل الأنود والكاثود إلى حدودهما الحرارية.[بحاجة لمصدر]
يؤدي استبدال أكسيد الكوبالت الليثيوم الموجب في بطاريات الليثيوم أيون بفوسفات معدن الليثيوم مثل فوسفات الحديد الليثيوم (LFP) إلى تحسين عدد الدورات ومدة الصلاحية والسلامة، ولكنه يقلل من السعة. اعتباراً من عام 2006، استُخدمت بطاريات الليثيوم أيون "الأكثر أماناً" بشكل أساسي في السيارات الكهربائية وغيرها من تطبيقات البطاريات ذات السعة الكبيرة، حيث تكون السلامة أمراً بالغ الأهمية.[239]
الاسترجاعات
- في أكتوبر 2004، استدعت كيوسيرا وايرلس ما يقرب من مليون بطارية هاتف محمول لكونها مزيفة.[240]
- في ديسمبر 2005، استدعت دل ما يقرب من 22000 بطارية حاسوب محمول، و4.1 مليون في أغسطس 2006.[241]
- في عام 2006، سُحب ما يقرب من 10 ملايين بطارية سوني في دل، سوني، أپل، لينوڤو، پاناسونك، توشيبا، هيتاتشي، فوجيتسو و شارپ من أجهزة الحاسب المحمولة. وُجد أن البطاريات كانت عرضة للتلوث الداخلي بالجزيئات المعدنية أثناء التصنيع. في ظل بعض الظروف، يمكن أن تخترق هذه الجسيمات الفاصل، مما يتسبب في حدوث دارة قصر خطيرة.[242]
- في مارس 2007، قامت الشركة المصنعة لأجهزة حاسب لينوڤو بسحب ما يقرب من 205000 بطارية معرضة لخطر الانفجار.
- في أغسطس 2007، استرجعت شركة تصنيع الهواتف المحمولة نوكيا أكثر من 46 مليون بطارية معرضة لخطر السخونة الزائدة والانفجار.[243]وقعت إحدى هذه الحوادث في الفلپين فيما يتعلق بجهاز خليوي نوكيا إن 91، والتي استخدمت بطارية BL-5C.[244]
- في سبتمبر 2016، استرجعت سامسونگ ما يقرب من 2.5 مليون هاتف گالاكسي نوت 7 بعد 35 حالة حريق مؤكدة.[228] كان الاسترداد بسبب خطأ في تصميم التصنيع في بطاريات سامسونگ مما تسبب في حدوث تلامس بين الأقطاب الداخلية الموجبة والسالبة.[245]

القيود المفروضة على وسائل النقل
في يناير 2008، أصدرت وزارة النقل في الولايات المتحدة، قاعدة جديدة تسمح للركاب على متن الطائرات التجارية بحمل بطاريات الليثيوم في أمتعتهم المسجلة، فقط إذا تم تركيبها في جهاز.[246] الغرض من هذا التقييد هو أنه يقلل بشكل كبير من فرص حدوث قصر في الدائرة والتسبب في نشوب حريق. الأنواع الوحيدة من البطاريات المتأثرة بهذه القاعدة هي تلك التي تحتوي على الليثيوم، بما في ذلك الليثيوم أيون، ليثيوم پوليمر، وأكسيد الكوبالت الليثيوم. يمكن حمل عدد محدود من البطاريات البديلة في حقائب اليد بشرط الاحتفاظ بها في عبواتها الواقية الأصلية أو في حاويات فردية أو أكياس بلاستيكية.[247]
الاستخدامات
في جميع أنحاء العالم، تتسابق شركات تصنيع السيارات الكبرى، بما في ذلك جنرال موتورز وبي واي دي للسيارات وفورد وهيونداي وتويوتا وتاتا موتورز من أجل أن تكون أول من يبيع السيارات الكهربائية التي تعمل ببطاريات ليثيوم أيون.[248] وتقدم شركة تسلا موتورز الأمريكية بالفعل سيارة BEV تسلا رودستر التي تعمل ببطارية ليثيوم أيون.[249] في أسواق خدمات ما بعد البيع، جُهزت طرازات مثل پريوس ببطاريات ليثيوم أيون.[250]
التأثير البيئي
يمثل استخراج الليثيوم والنيكل والكوبالت وتصنيع المذيبات ومنتجات التعدين الثانوية مخاطر بيئية وصحية كبيرة.[251][252][253] يمكن أن يكون استخراج الليثيوم مميتاً للحياة المائية بسبب تلوث المياه.[254]من المعروف أنه يتسبب في تلوث المياه السطحية، وتلوث مياه الشرب، ومشاكل في الجهاز التنفسي، وتدهور النظام البيئي، وتلف المناظر الطبيعية.[251] كما يؤدي إلى استهلاك غير مستدام للمياه في المناطق القاحلة (1.9 مليون لتر لكل طن من الليثيوم).[251] ينتج عن إنتاج المنتجات الثانوية الضخمة لاستخراج الليثيوم أيضاً مشاكل لم يتم حلها، مثل الكميات الكبيرة من المغنسيوم ونفايات الجير.[255]
يُعدَّن الليثيوم في أمريكا الشمالية والجنوبية وآسيا وجنوب إفريقيا وأستراليا والصين.[256]
يُستخرَج الكوبالت لبطاريات الليثيوم-أيون إلى حد كبير في الكونگو (انظر أيضاً صناعة التعدين في جمهورية الكونغو الديمقراطية)
يتطلب تصنيع كيلوغرام من بطارية الليثيوم-أيون حوالي 67 ميگا جول (MJ) من الطاقة.[257][258] تعتمد إمكانية الاحترار العالمي لتصنيع بطاريات الليثيوم-أيون بشدة على مصدر الطاقة المستخدم في عمليات التعدين والتصنيع، ويصعب تقديرها، ولكن إحدى الدراسات لعام 2019 قدرتها بـ 73 kg CO2e/kWh.[259]ويمكن أن تؤدي إعادة التدوير الفعالة إلى تقليل البصمة الكربونية للإنتاج بشكل كبير.[260]
النفايات الصلبة وإعادة التدوير
نظراً لاحتواء بطاريات الليثيوم-أيون على معادن سامة أقل من الأنواع الأخرى من البطاريات التي قد تحتوي على الرصاص أو الكادميوم ،[77] يتم تصنيفها بشكل عام على أنها نفايات غير خطرة. تعتبر عناصر بطارية ليثيوم-أيون بما في ذلك الحديد والنحاس والنيكل والكوبالت آمنة بالنسبة للمحارق ومقالب القمامة.[بحاجة لمصدر] يمكن إعادة تدوير هذه المعادن،[261][262] عادة عن طريق حرق المواد الأخرى،[263] ولكن يبقى التعدين بشكل عام أرخص من إعادة التدوير;[264]قد تكلف إعادة التدوير $3/kg،[265]وفي عام 2019، تم إعادة تدوير أقل من 5٪ من بطاريات الليثيوم-أيون.[266] منذ عام 2018، تمت زيادة محصول إعادة التدوير بشكل كبير، ويمكن استعادة الليثيوم والمنجنيز والألمنيوم والمذيبات العضوية للكهارل والگرافيت على المستويات الصناعية.[267] أما الكوبالت فهو أغلى معدن مشارك في بناء الخلية. الليثيوم أقل تكلفة من المعادن الأخرى المستخدمة ونادراً ما يعاد تدويره،[263] لكن إعادة التدوير هذه يمكن أن تمنع حدوث نقص في المستقبل.[261]
يمثل تراكم نفايات البطاريات تحديات فنية ومخاطر صحية.[268]نظراً لأن التأثير البيئي للسيارات الكهربائية يتأثر بشدة بإنتاج بطاريات الليثيوم-أيون، فإن تطوير طرق فعالة لإعادة استخدام النفايات يعد أمراً بالغ الأهمية.[266] إعادة التدوير عملية متعددة الخطوات، تبدأ بتخزين البطاريات قبل التخلص منها، يليها الاختبار اليدوي، والتفكيك، وأخيراً الفصل الكيميائي لمكونات البطارية. يُفضل إعادة استخدام البطارية على إعادة التدوير الكامل حيث يوجد طاقة متجسدة أقل في العملية. نظراً لأن هذه البطاريات أكثر تفاعلاً من نفايات المركبات التقليدية مثل الإطارات المطاطية، فهناك مخاطر كبيرة لتخزين البطاريات المستعملة.[269]
الإصلاح المعدني الحراري
تستخدم طريقة المعادن الحرارية فرناً عالي الحرارة لتقليل مكونات أكاسيد المعادن في البطارية إلى سبيكة من الكوبالت، والنحاس، والحديد، والنيكل. هذه هي الطريقة التجارية الأكثر شيوعاً لإعادة التدوير ويمكن دمجها مع بطاريات أخرى مماثلة لزيادة كفاءة الصهر وتحسين الديناميكا الحرارية. تساعد المعادن مجمعات التيار الكهربائي في عملية الصهر، مما يسمح بإذابة الخلايا أو الوحدات بأكملها في وقت واحد.[270] ناتج هذه الطريقة عبارة عن مجموعة من السبائك المعدنية، الخبث، والغاز. عند درجات الحرارة المرتفعة، تحترق الپوليمرات المستخدمة لتثبيت خلايا البطارية معاً ويمكن فصل السبيكة المعدنية من خلال عملية المعالجة المعدنية المائية إلى مكوناتها المنفصلة. يمكن تكرير الخبث أو استخدامه في صناعة الأسمنت. هذه العملية خالية من المخاطر نسبياً، كما أن تفاعل هو طارد للحرارة ناتج من احتراق الپوليمر والذي يقلل من طاقة الإدخال المطلوبة. ومع ذلك، في هذه العملية، سيتم فقد البلاستيك، الكهارل وأملاح الليثيوم.[271]
استخلاص المعادن من معالجة المعادن
تتضمن هذه الطريقة استخدام المحاليل المائية لإزالة المعادن المرغوبة من الكاثود. الكاشف الأكثر شيوعاً هو حمض الكبريتيك.[272] تشمل العوامل التي تؤثر على معدل النض (الترشيح) تركيز الحمض والوقت ودرجة الحرارة ونسبة المادة الصلبة إلى السائل وعامل الاختزال.[273] ثبت تجريبياً أن H2O2 يعمل كعامل اختزال لتسريع معدل الترشيح خلال التفاعل:[بحاجة لمصدر]
2LiCoO2(s) + 3H2SO4 + H2O2 → 2CoSO4(aq) + Li2SO4 + 4H2O + O2
بمجرد الترشيح، يمكن استخلاص المعادن من خلال تفاعلات الترسيب التي يتم التحكم فيها عن طريق تغيير مستوى الأس الهيدروجيني للمحلول. يمكن بعد ذلك استعادة الكوبالت، وهو المعدن الأغلى ثمناً، في شكل كبريتات، أو أكسالات، أو هيدروكسيد، أو كربونات. [75] في الآونة الأخيرة، جربت طرق إعادة التدوير الإنتاج المباشر للكاثود من الفلزات المرشحة. في هذه الإجراءات، يتم قياس تركيزات المعادن المتسربة المختلفة مسبقاً لتتناسب مع الكاثود المستهدف ثم تُصنّع الكاثودات مباشرة.[274]
ومع ذلك، فإن المشكلات الرئيسية في هذه الطريقة هي الحاجة إلى حجم كبير من المذيب وارتفاع تكلفة المعادلة. على الرغم من أنه من السهل تمزيق البطارية، إلا أن مزج الكاثود والأنود في البداية يعقد العملية، لذلك يجب أيضاً فصلهما. لسوء الحظ، فإن التصميم الحالي للبطاريات يجعل العملية معقدة للغاية ويصعب فصل المعادن في نظام بطارية مغلق الحلقة. قد يحدث التقطيع والذوبان في مواقع مختلفة.[275]
إعادة التدوير المباشر
إعادة التدوير المباشر هو إزالة القطب السالب أو الأنود من القطب، وتجديده، ثم إعادة استخدامه في بطارية جديدة. يمكن إضافة أكاسيد المعادن المختلطة إلى القطب الجديد مع تغيير بسيط للغاية في الشكل البلوري. تتضمن العملية بشكل عام إضافة الليثيوم الجديد لتجديد فقدان الليثيوم في الكاثود بسبب الانحلال الناتج عن التدوير. يتم الحصول على شرائط الكاثود من البطاريات المفككة، ثم نقعها في NMP، وتخضع لعملية وضع تحت الأمواج الصوتية لإزالة الرواسب الزائدة. يتم معالجته بالحرارة المائية بمحلول يحتوي على LiOH/Li2SO4 قبل التلدين.[276]
هذه الطريقة فعالة للغاية من حيث التكلفة بالنسبة للبطاريات التي لا تعتمد على الكوبالت لأن المواد الخام لا تشكل الجزء الأكبر من التكلفة. تتجنب إعادة التدوير المباشر خطوات التنقية الباهظة والتي تستغرق وقتاً طويلاً، وهو أمر رائع بالنسبة للكاثودات منخفضة التكلفة مثل LiMn2O4 وLiFePO4. بالنسبة لهذه الكاثودات الأرخص تكلفة، ترتبط معظم التكلفة والطاقة المضمنة والبصمة الكربونية بالتصنيع بدلاً من المواد الخام.[277] ثبت تجريبياً أن إعادة التدوير المباشر يمكن أن ينتج خصائص مماثلة للگرافيت الأصلي.
يكمن عيب الطريقة في حالة البطارية المتوقفة عن العمل. في حالة كون البطارية صحية نسبياً، يمكن لإعادة التدوير المباشر استعادة خصائصها بثمن بخس. ومع ذلك، بالنسبة للبطاريات حيث تكون حالة الشحن منخفضة، فقد لا تستحق إعادة التدوير المباشر الاستثمار. يجب أيضاً أن تكون العملية مخصصة لتكوين الكاثود المحدد، وبالتالي يجب تهيئة العملية لنوع واحد من البطاريات في كل مرة.[278] أخيراً، في وقت تتطور فيه تقنية البطاريات سريعاً، قد لا يكون تصميم البطارية اليوم مرغوباً فيه بعد عقد من الآن، مما يجعل إعادة التدوير المباشر غير فعالة.
تأثير حقوق الإنسان
قد يمثل استخراج المواد الخام لبطاريات الليثيوم-أيون مخاطر على السكان المحليين، وخاصة السكان الأصليين المقيمين على الأرض.
غالباً ما يُستخرَج الكوبالت الذي يتم الحصول عليه من جمهورية الكونغو الديمقراطية بواسطة العمال باستخدام أدوات يدوية مع القليل من احتياطات السلامة، مما يؤدي إلى إصابات ووفيات متكررة.[279]عرّض التلوث الناجم عن هذه المناجم الناس لمواد كيميائية سامة يعتقد مسؤولو الصحة أنها تسبب تشوهات خلقية وصعوبات في التنفس.[280]وقد زعم نشطاء حقوق الإنسان والصحافة الاستقصائية تأكيدهم،[281][282]أنه يتم استخدام عمالة الأطفال في هذه المناجم.[283][284]
أشارت دراسة عن العلاقات بين شركات استخراج الليثيوم والشعوب الأصلية في الأرجنتين إلى أن الدولة ربما لم تحمي حق الشعوب الأصلية في الموافقة الحرة المسبقة والمستنيرة، وأن شركات الاستخراج تسيطر عموماً على المجتمع الوصول إلى المعلومات وتحديد شروط مناقشة المشاريع وتقاسم المنافع.[285]
واجه تطوير منجم ثاكر پاس لليثيوم في نيفادا بالولايات المتحدة الأمريكية احتجاجات ودعاوى قضائية من عدة قبائل أصلية قالت إنها لم تحصل على موافقة مسبقة ومستنيرة مجاناً وأن المشروع يهدد المواقع الثقافية والمقدسة.[286] كما دفعت الروابط بين استخراج الموارد ونساء الشعوب الأصلية المفقودات والمقتولات التابعة للمجتمعات المحلية للتعبير عن مخاوفها من أن المشروع سيخلق مخاطر على نساء السكان الأصليين.[287] يحتل المتظاهرون موقع المنجم المقترح منذ يناير 2021.[288][289]
الأبحاث
يعمل الباحثون بنشاط لتحسين كثافة الطاقة، والسلامة، ومتانة دورة البطارية (عمر البطارية)، ووقت إعادة الشحن، والتكلفة، والمرونة، وغيرها من الخصائص، بالإضافة إلى طرق البحث والاستخدامات لهذه البطاريات.
انظر أيضاً
- Battery balancer
- حامل البطارية
- إعادة تدوير البطارية
- بطارية ليثيوم
- بطارية فوسفات-حديد-ليثيوم
- بطارية نانوية
- Power-to-weight ratio
- بطارية أكسيد الفضة
- Superpolymer
- بطارية پوليمر الليثوم
- Borate oxalate
- Comparison of commercial battery types
- European Battery Alliance
- Gigafactory 1
- Lithium as an investment
- بطارية نانوية
- بطارية الحالة الصلبة
- Thin film lithium-ion battery
المصادر
- ^ أ ب ت "Rechargeable Li-Ion OEM Battery Products". Panasonic.com. Retrieved 2010-04-23. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "PanaLI" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب "Panasonic Develops New Higher-Capacity 18650 Li-Ion Cells; Application of Silicon-based Alloy in Anode". greencarcongress.com. Retrieved 2011-01-31. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "greencarcongress" معرف أكثر من مرة بمحتويات مختلفة. - ^ Valøen & Shoesmith (2007). The effect of PHEV and HEV duty cycles on battery and battery pack performance (PDF). 2007 Plug-in Highway Electric Vehicle Conference: Proceedings. Retrieved 2010-06-11.
- ^ 11.10V,6600Mah, Li-Ion, Replacement Laptop Battery For Dell (etc). Amazon.com Online Store. Retrieved 2010-06-11.
- ^ H. Abea, T. Muraia and K. Zaghibb (1999). Vapor-grown carbon fiber anode for cylindrical lithium ion rechargeable batteries. Journal of Power Sources 77:2, February 1999, pp. 110-115. DOI:10.1016/S0378-7753(98)00158-X. Retrieved 2010-06-11.
- ^ Battery Types and Characteristics for HEV ThermoAnalytics, Inc., 2007. Retrieved 2010-06-11.
- ^ "IEEE Medal for Environmental and Safety Technologies Recipients". IEEE Medal for Environmental and Safety Technologies. Institute of Electrical and Electronics Engineers. Retrieved 29 July 2019.
- ^ "The Nobel Prize in Chemistry 2019". Nobel Prize. Nobel Foundation. 2019. Retrieved 1 January 2020.
- ^ "NIMS Award Goes to Koichi Mizushima and Akira Yoshino". National Institute for Materials Science. 2016-09-14. Retrieved 9 April 2020.
- ^ "Yoshio Nishi". National Academy of Engineering. Retrieved 12 October 2019.
- ^ Ballon, Massie Santos (14 October 2008). "Electrovaya, Tata Motors to make electric Indica". cleantech.com. Archived from the original on 9 May 2011. Retrieved 11 June 2010.
- ^ Mauger, A; Julien, C.M. (28 June 2017). "Critical review on lithium-ion batteries: are they safe? Sustainable?" (PDF). Ionics. 23 (8): 1933–1947. doi:10.1007/s11581-017-2177-8. S2CID 103350576.
- ^ أ ب Mark Ellis, Sandy Munro (4 June 2020). Sandy Munro on Tesla's Battery Tech Domination (video). E for Electric. Event occurs at 3:53–5:50. Retrieved 29 June 2020 – via YouTube.
- ^ Eftekhari, Ali (2017). "Lithium-Ion Batteries with High Rate Capabilities". ACS Sustainable Chemistry & Engineering. 5 (3): 2799–2816. doi:10.1021/acssuschemeng.7b00046.
- ^ Hopkins, Gina (16 November 2017). "Watch: Cuts and dunks don't stop new lithium-ion battery - Futurity". Futurity. Retrieved 10 July 2018.
- ^ Chawla, N.; Bharti, N.; Singh, S. (2019). "Recent Advances in Non-Flammable Electrolytes for Safer Lithium-Ion Batteries". Batteries. 5: 19. doi:10.3390/batteries5010019.
- ^ Yao, X.L.; Xie, S.; Chen, C.; Wang, Q.S.; Sun, J.; Wang, Q.S.; Sun, J. (2004). "Comparative study of trimethyl phosphite and trimethyl phosphate as electrolyte additives in lithium ion batteries". Journal of Power Sources. 144: 170–175. doi:10.1016/j.jpowsour.2004.11.042.
- ^ Fergus, J.W. (2010). "Ceramic and polymeric solid electrolytes for lithium-ion batteries". Journal of Power Sources. 195 (15): 4554–4569. Bibcode:2010JPS...195.4554F. doi:10.1016/j.jpowsour.2010.01.076.
- ^ Whittingham, M. S. (1976). "Electrical Energy Storage and Intercalation Chemistry". Science. 192 (4244): 1126–7. Bibcode:1976Sci...192.1126W. doi:10.1126/science.192.4244.1126. PMID 17748676.
- ^ J.O.Besenhard and H.P. Fritz, Cathodic Reduction of Graphite in Organic Solutions of Alkali and NR 4+ Salts, J. Electroanal. Chem., 53, 329 (1974)
- ^ J.O. Besenhard, The Electrochemical Preparation and Properties of Ionic Alkali Metal and NR 4+ Graphite Intercalation Compounds in Organic Electrolytes, Carbon, 14, 111 (1976)
- ^ R. Schallhorn, R. Kuhlmann, and J.O. Besenhard, Topotactic Redox Reactions and Ion Exchange of Layered MoO3 Bronzes,, Mat. Res. Bull., 11, 83 (1976)
- ^ J.O. Besenhard and R. Schallhorn, The Discharge Reaction Mechanism of the MoO3 Electrode in Organic Electrolytes" J. Power Sources, 1, 267 (1976/77)
- ^ J.O. Besenhard and G. Eichinger, High Energy Density Lithium Cells. Part I. Electrolytes and Anodes, J. Electroanal. Chem., 68, 1 (1976); and G. Eichinger
- ^ J.O. Besenhard, High Energy Density Lithium Cells. Part II. Cathodes and Complete Cells, J. Electroanal. Chem., 72, 1 (1976)
- ^ "USPTO search for inventions by "Goodenough, John"". Patft.uspto.gov. Retrieved 8 October 2011.
- ^ M. Zanini, S. Basu, J.E. Fischer Carbon, "Alternate Synthesis & Reflectivity Spectrum of Stage 1 Lithium-Graphite Intercalation Compound", vol. 16, 1978 (Elsevier), pp. 211–212
- ^ S. Basu, C. Zeller, P.J. Flanders, C.D. Fuerst, W.D. Johnson, J.E. Fischer Materials Science & Eng. "Synthesis & Prop. of Lithium-Graphite Intercalated Compounds," vol. 38, 1979 (Elsevier), pp. 275–283
- ^ قالب:Ref patent
- ^ International Meeting on Lithium Batteries, Rome, 27–29 April 1982, C.L.U.P. Ed. Milan, Abstract #23
- ^ Journal of Power Sources (April–May 1983), 9 (3–4), 365–371
- ^ M.M. Thackeray, W.I.F. David, P.G. Bruce, and J.B. Goodenough (4 February 1983). "Lithium insertion into manganese spinels". Materials Research Bulletin. Elsevier. 18 (4): 461–472. doi:10.1016/0025-5408(83)90138-1.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Gholamabbas Nazri, Gianfranco Pistoia (2004). Lithium batteries: science and ... – Google Books. Springer. ISBN 978-1-4020-7628-2. Retrieved 8 October 2009.
- ^ Voelcker, John (September 2007). Lithium Batteries Take to the Road IEEE Spectrum.
- ^ قالب:Ref patent
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماة:5 - ^ Besenhard, J. O.; Eichinger, G. (1976). "High energy density lithium cells". Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 68: 1–18. doi:10.1016/S0022-0728(76)80298-7.
- ^ Eichinger, G.; Besenhard, J. O. (1976). "High energy density lithium cells". Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 72: 1–31. doi:10.1016/S0022-0728(76)80072-1.
- ^ "Lithium-ion batteries for mobility and stationary storage applications" (PDF). European Commission. Archived (PDF) from the original on 14 July 2019.
global lithium-ion battery production from about 20GWh (~6.5bn€) in 2010
- ^ "Switching From Lithium-Ion Could Be Harder Than You Think". 19 October 2017. Retrieved 20 October 2017.
- ^ National Blueprint for Lithium Batteries. U.S. Department of Energy. October 2020. p. 12. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. https://www.energy.gov/sites/default/files/2021-06/FCAB%20National%20Blueprint%20Lithium%20Batteries%200621_0.pdf. - ^ Silberberg, M. (2006). Chemistry: The Molecular Nature of Matter and Change, 4th Ed. New York (NY): McGraw-Hill Education. p. 935, ISBN 0077216504.
- ^ أ ب ت G. Shao et al.: Polymer-Derived SiOC Integrated with a Graphene Aerogel As a Highly Stable Li-Ion Battery Anode ACS Appl. Mater. Interfaces 2020, 12, 41, 46045–46056
- ^ Thackeray, M. M.; Thomas, J. O.; Whittingham, M. S. (2011). "Science and Applications of Mixed Conductors for Lithium Batteries". MRS Bulletin. 25 (3): 39–46. doi:10.1557/mrs2000.17.
- ^ El-Kady, Maher F.; Shao, Yuanlong; Kaner, Richard B. (July 2016). "Graphene for batteries, supercapacitors and beyond". Nature Reviews Materials. 1 (7): 16033. doi:10.1038/natrevmats.2016.33.
- ^ MSDS: National Power Corp Lithium Ion Batteries Archived 26 يونيو 2011 at the Wayback Machine (PDF). tek.com; Tektronix Inc., 7 May 2004. Retrieved 11 June 2010.
- ^ Xu, Kang (1 October 2004). "Nonaqueous Liquid Electrolytes for Lithium-Based Rechargeable Batteries". Chemical Reviews. 104 (10): 4303–4418. doi:10.1021/cr030203g.
- ^ Joyce, C.; Trahy, L.; Bauer, S.; Dogan, F.; Vaughey, J. (2012). "Metallic Copper Binders for Lithium-Ion Battery Silicon Electrodes". Journal of the Electrochemical Society. 159 (6): 909–914. doi:10.1149/2.107206jes.
- ^ "COBRA | CObalt-free Batteries for FutuRe Automotive Applications". Cobra.
- ^ "CORDIS | European Commission".
- ^ "نورثفولت السويدية تفتتح أول مصنع ضخم لانتاج البطاريات الأوروبية في القارة". فرانس 24. 2021-12-29. Retrieved 2021-12-29.
- ^ Linden, David and Reddy, Thomas B. (eds.) (2002). Handbook of Batteries 3rd Edition. McGraw-Hill, New York. chapter 35. ISBN 0-07-135978-8.
- ^ Zhai, C; et al. (2016). "Interfacial electro-mechanical behaviour at rough surfaces" (PDF). Extreme Mechanics Letters. 9: 422–429. doi:10.1016/j.eml.2016.03.021.
- ^ Chung, H. C. (2021). "Charge and discharge profiles of repurposed LiFePO4 batteries based on the UL 1974 standard". Scientific Data. 8: 165. doi:10.1038/s41597-021-00954-3.
- ^ أ ب "How to rebuild a Li-Ion battery pack" (PDF). Electronics Lab. 24 March 2016. Archived from the original on 3 January 2012. Retrieved 29 October 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ أ ب Schweber, Bill (4 August 2015). "Lithium Batteries: The Pros and Cons". GlobalSpec. GlobalSpec. Retrieved 15 March 2017.
- ^ "Design Review For: Advanced Electric Vehicle Battery Charger, ECE 445 Senior Design Project". 090521 courses.ece.illinois.edu. Archived from the original on 4 May 2013.
- ^ أ ب "Lithium Ion Rechargeable Batteries. Technical Handbook" (PDF). Archived from the original (PDF) on 11 April 2009.
- ^ "Custom Lithium ion Battery Pack Manufacturer". LargePower. Retrieved 16 March 2015.
- ^ Siemens CL75 user manual. Siemens AG. 2005. p. 8.
- ^ Sanyo: Overview of Lithium Ion Batteries. Archived 3 مارس 2016 at the Wayback Machine, listing self-discharge rate of 2%/mo.
- ^ Sanyo: Harding energy specification. Archived 27 ديسمبر 2015 at the Wayback Machine, listing self-discharge rate of 0.3%/mo.
- ^ Zimmerman, A. H. (2004). "Self-discharge losses in lithium-ion cells". IEEE Aerospace and Electronic Systems Magazine. 19 (2): 19–24. doi:10.1109/MAES.2004.1269687. S2CID 27324676.
- ^ Weicker, Phil (1 November 2013). A Systems Approach to Lithium-Ion Battery Management. Artech House. p. 214. ISBN 978-1-60807-659-8.
- ^ Abe, H.; Murai, T.; Zaghib, K. (1999). "Vapor-grown carbon fiber anode for cylindrical lithium ion rechargeable batteries". Journal of Power Sources. 77 (2): 110–115. Bibcode:1999JPS....77..110A. doi:10.1016/S0378-7753(98)00158-X.
- ^ Battery performance characteristics, MPower UK, 23 February 2007. Information on self-discharge characteristics of battery types.
- ^ Redondo-Iglesias, Eduardo; Venet, Pascal; Pelissier, Serge (2016). "Measuring Reversible and Irreversible Capacity Losses on Lithium-Ion Batteries". 2016 IEEE Vehicle Power and Propulsion Conference (VPPC). p. 7. doi:10.1109/VPPC.2016.7791723. ISBN 978-1-5090-3528-1. S2CID 22822329.
- ^ Vetter, Matthias; Lux, Stephan (2016). "Rechargeable Batteries with Special Reference to Lithium-Ion Batteries" (PDF). Storing Energy. Fraunhofer Institute for Solar Energy Systems ISE. p. 205. doi:10.1016/B978-0-12-803440-8.00011-7. ISBN 9780128034408.
- ^ أ ب ت Winter & Brodd 2004, p. 4259
- ^ "Best rechargeable batteries (10+ charts, overviews and comparisons )". eneloop101.com. 14 February 2017. Retrieved 9 February 2019.
- ^ Guyomard, Dominique; Tarascon, Jean-Marie (1994). "Rocking-chair or lithium-ion rechargeable lithium batteries". Advanced Materials. 6 (5): 408–412. doi:10.1002/adma.19940060516. ISSN 1521-4095.
- ^ Megahed, Sid; Scrosati, Bruno (1994). "Lithium-ion rechargeable batteries". Journal of Power Sources. 51 (1–2): 79–104. Bibcode:1994JPS....51...79M. doi:10.1016/0378-7753(94)01956-8.
- ^ Bergveld, H. J.; Kruijt, W. S.; Notten, P. H. L. (2002). Battery Management Systems: Design by Modelling. Springer. pp. 107–108, 113. ISBN 978-94-017-0843-2.
- ^ Dhameja, S (2001). Electric Vehicle Battery Systems. Newnes Press. p. 12. ISBN 978-075-06991-67.
- ^ Choi, H. C.; Jung, Y. M.; Noda, I.; Kim, S. B. (2003). "A Study of the Mechanism of the Electrochemical Reaction of Lithium with CoO by Two-Dimensional Soft X-ray Absorption Spectroscopy (2D XAS), 2D Raman, and 2D Heterospectral XAS−Raman Correlation Analysis". The Journal of Physical Chemistry B. 107 (24): 5806–5811. doi:10.1021/jp030438w.
- ^ Amatucci, G. G. (1996). "CoO 2, the End Member of the Li xCoO 2 Solid Solution". Journal of the Electrochemical Society. 143 (3): 1114–1123. doi:10.1149/1.1836594.
- ^ أ ب ت ث ج ح خ د "Lithium Ion technical handbook" (PDF). Gold Peak Industries Ltd. November 2003. Archived from the original (PDF) on 7 October 2007.
{{cite journal}}: Cite journal requires|journal=(help) - ^ Younesi, Reza; Veith, Gabriel M.; Johansson, Patrik; Edström, Kristina; Vegge, Tejs (2015). "Lithium salts for advanced lithium batteries: Li–metal, Li–O2, and Li–S". Energy Environ. Sci. 8 (7): 1905–1922. doi:10.1039/c5ee01215e.
- ^ Wenige, Niemann, et al. (30 May 1998). Liquid Electrolyte Systems for Advanced Lithium Batteries (PDF). cheric.org; Chemical Engineering Research Information Center(KR). Retrieved 11 June 2010.
- ^ Balbuena, P. B., Wang, Y. X. (eds) (2004). Lithium Ion Batteries: Solid Electrolyte Interphase, Imperial College Press, London. ISBN 1860943624.
- ^ Fong, R. A. (1990). "Studies of Lithium Intercalation into Carbons Using Nonaqueous Electrochemical Cells". Journal of the Electrochemical Society. 137 (7): 2009–2010. Bibcode:1990JElS..137.2009F. doi:10.1149/1.2086855.
- ^ Syzdek, J. A.; Borkowska, R.; Perzyna, K.; Tarascon, J. M.; Wieczorek, W. A. A. (2007). "Novel composite polymeric electrolytes with surface-modified inorganic fillers". Journal of Power Sources. 173 (2): 712–720. Bibcode:2007JPS...173..712S. doi:10.1016/j.jpowsour.2007.05.061.
- ^ Syzdek, J. A.; Armand, M.; Marcinek, M.; Zalewska, A.; Żukowska, G. Y.; Wieczorek, W. A. A. (2010). "Detailed studies on the fillers modification and their influence on composite, poly(oxyethylene)-based polymeric electrolytes". Electrochimica Acta. 55 (4): 1314–1322. doi:10.1016/j.electacta.2009.04.025.
- ^ Reiter, J.; Nádherná, M.; Dominko, R. (2012). "Graphite and LiCo1/3Mn1/3Ni1/3O2 electrodes with piperidinium ionic liquid and lithium bis(fluorosulfonyl)imide for Li-ion batteries". Journal of Power Sources. 205: 402–407. doi:10.1016/j.jpowsour.2012.01.003.
- ^ Can, Cao; Zhuo-Bin, Li; Xiao-Liang, Wang (2014). "Recent Advances in Inorganic Solid Electrolytes for Lithium Batteries". Frontiers in Energy Research. 2: 1–10. doi:10.3389/fenrg.2014.00025.
- ^ Zogg, Cornelia (14 June 2017). "A solid-state electrolyte that is able to compete with liquid electrolytes for rechargeable batteries". Phys.org. Retrieved 24 February 2018.
- ^ Can, Cao; Zhuo-Bin, Li; Xiao-Liang, Wang (2014). "Recent Advances in Inorganic Solid Electrolytes for Lithium Batteries". Frontiers in Energy Research. 2: 2–4. doi:10.3389/fenrg.2014.00025.
- ^ Can, Cao; Zhuo-Bin, Li; Xiao-Liang, Wang (2014). "Recent Advances in Inorganic Solid Electrolytes for Lithium Batteries". Frontiers in Energy Research. 2: 6–8. doi:10.3389/fenrg.2014.00025.
- ^ Tatsumisago, Masahiro; Nagao, Motohiro; Hayashi, Akitoshi (2013). "Recent development of sulfide solid electrolytes and interfacial modification for all-solid-state rechargeable lithium batteries". Journal of Asian Ceramic Societies. 1 (1): 17. doi:10.1016/j.jascer.2013.03.005.
- ^ Haregewoin, Atetegeb Meazah; Wotango, Aselefech Sorsa; Hwang, Bing-Joe (2016-06-08). "Electrolyte additives for lithium ion battery electrodes: progress and perspectives". Energy & Environmental Science. 9 (6): 1955–1988. doi:10.1039/C6EE00123H. ISSN 1754-5706.
- ^ أ ب "Lithium-Ion Batteries". Sigma Aldrich. Sigma Aldrich.
- ^ أ ب Nitta, Naoki; Wu, Feixiang; Lee, Jung Tae; Yushin, Gleb (2015). "Li-ion battery materials: present and future". Materials Today. 18 (5): 252–264. doi:10.1016/j.mattod.2014.10.040.
- ^ Fergus, Jeffrey (2010). "Recent developments in cathode materials for lithium ion batteries". Journal of Power Sources. 195 (4): 939–954. Bibcode:2010JPS...195..939F. doi:10.1016/j.jpowsour.2009.08.089.
- ^ The Sony Lithium Ion Iron Phosphate (LFP) advantage Sony’s Energy Storage System
- ^ Eftekhari, Ali (2017). "LiFePO4/C Nanocomposites for Lithium-Ion Batteries". Journal of Power Sources. 343: 395–411. Bibcode:2017JPS...343..395E. doi:10.1016/j.jpowsour.2017.01.080.
- ^ "Imara Corporation website". Imaracorp.com. Archived from the original on 22 July 2009. Retrieved 8 October 2011.
- ^ O'Dell, John (17 December 2008). Fledgling Battery Company Says Its Technology Boosts Hybrid Battery Performance Green Car Advisor; Edmunds Inc. Retrieved 11 June 2010.
- ^ أ ب LeVine, Steve (27 August 2015). "Tesla's coattails are carrying along Panasonic, but a battle for battery supremacy is brewing". Quartz. Retrieved 19 June 2017.
- ^ Peplow, Mark (13 December 2019). "Northvolt is building a future for greener batteries". Chemical & Engineering News. 97 (48).
- ^ Blomgren, George E. (2016). "The Development and Future of Lithium Ion Batteries". Journal of the Electrochemical Society. 164: A5019–A5025. doi:10.1149/2.0251701jes.
- ^ "Samsung INR18650-30Q datasheet" (PDF).
- ^ Jost, Kevin [ed.] (October 2006). Tech Briefs: CPI takes new direction on Li-ion batteries (PDF). aeionline.org; Automotive Engineering Online.
- ^ Voelcker, John (September 2007). Lithium Batteries Take to the Road Archived 27 مايو 2009 at the Wayback Machine. IEEE Spectrum. Retrieved 15 June 2010.
- ^ Loveday, Eric (23 April 2010). "Hitachi develops new manganese cathode, could double life of li-ion batteries". Retrieved 11 June 2010.
- ^ Nikkei (29 November 2009). Report: Nissan On Track with Nickel Manganese Cobalt Li-ion Cell for Deployment in 2015 Green Car Congress (blog). Retrieved 11 June 2010.
- ^ EnerDel Technical Presentation (PDF). EnerDel Corporation. 29 October 2007..
- ^ Elder, Robert and Zehr, Dan (16 February 2006). Valence sued over UT patent Austin American-Statesman (courtesy Bickle & Brewer Law Firm)..
- ^ Bulkeley, William M. (26 November 2005). "New Type of Battery Offers Voltage Aplenty, at a Premium". The Day. p. E6.
- ^ A123Systems (2 November 2005). A123Systems Launches New Higher-Power, Faster Recharging Li-Ion Battery Systems Green Car Congress; A123Systems (Press release). Retrieved 11 May 2010.
- ^ "Keywords to understanding Sony Energy Devices – keyword 1991". Archived from the original on 4 March 2016.
- ^ أ ب Hayner, CM; Zhao, X; Kung, HH (1 January 2012). "Materials for Rechargeable Lithium-Ion Batteries". Annual Review of Chemical and Biomolecular Engineering. 3 (1): 445–471. doi:10.1146/annurev-chembioeng-062011-081024. PMID 22524506.
- ^ Eftekhari, Ali (2017). "Low Voltage Anode Materials for Lithium-Ion Batteries". Energy Storage Materials. 7: 157–180. doi:10.1016/j.ensm.2017.01.009.
- ^ "Northwestern researchers advance Li-ion batteries with graphene-silicon sandwich | Solid State Technology". Electroiq.com. November 2011. Archived from the original on 15 March 2018. Retrieved 3 January 2019.
Zhao, X.; Hayner, C. M.; Kung, M. C.; Kung, H. H. (2011). "In-Plane Vacancy-Enabled High-Power Si-Graphene Composite Electrode for Lithium-Ion Batteries". Advanced Energy Materials. 1 (6): 1079–1084. doi:10.1002/aenm.201100426. - ^ "... Acceptance of the First Grid-Scale, Battery Energy Storage System" (Press release). Altair Nanotechnologies. 21 November 2008. Archived from the original on 3 August 2020. Retrieved 8 October 2009.
- ^ Ozols, Marty (11 November 2009). Altair Nanotechnologies Power Partner – The Military. Systemagicmotives (personal webpage)[محل شك]. Retrieved 11 June 2010.
- ^ Gotcher, Alan J. (29 November 2006). "Altair EDTA Presentation" (PDF). Altairnano.com. Archived from the original (PDF) on 16 June 2007.
- ^ Synthetic Carbon Negative electrode Boosts Battery Capacity 30 Percent | MIT Technology Review. Technologyreview.com (2 April 2013). Retrieved 16 April 2013.
- ^ Newman, Jared (23 May 2013). "Amprius Begins Shipping a Better Smartphone Battery". Time. Retrieved 4 June 2013.
- ^ Coxworth, Ben (22 February 2017). "Silicon sawdust – coming soon to a battery near you?". newatlas.com. Retrieved 26 February 2017.
- ^ Kasavajjula, U.; Wang, C.; Appleby, A.J. C.. (2007). "Nano- and bulk-silicon-based insertion anodes for lithium-ion secondary cells". Journal of Power Sources. 163 (2): 1003–1039. Bibcode:2007JPS...163.1003K. doi:10.1016/j.jpowsour.2006.09.084.
- ^ Li, H.; Huang, X.; Chenz, L. C.; Zhou, G.; Zhang, Z. (2000). "The crystal structural evolution of nano-Si anode caused by lithium insertion and extraction at room temperature". Solid State Ionics. 135 (1–4): 181–191. doi:10.1016/S0167-2738(00)00362-3.
- ^ Gao, B.; Sinha, S.; Fleming, L.; Zhou, O. (2001). "Alloy Formation in Nanostructured Silicon". Advanced Materials. 13 (11): 816–819. doi:10.1002/1521-4095(200106)13:11<816::AID-ADMA816>3.0.CO;2-P.
- ^ أ ب Girishkumar, G.; McCloskey, B.; Luntz, A. C.; Swanson, S.; Wilcke, W. (2 July 2010). "Lithium−Air Battery: Promise and Challenges". The Journal of Physical Chemistry Letters. 1 (14): 2193–2203. doi:10.1021/jz1005384. ISSN 1948-7185.
- ^ "A Better Anode Design to Improve Lithium-Ion Batteries". Berkeley Lab: Lawrence Berkeley National Laboratory. Archived from the original on 4 March 2016.
- ^ أ ب Luo, Jiayan; Zhao, Xin; Wu, Jinsong; Jang, Hee Dong; Kung, Harold H.; Huang, Jiaxing (2012). "Crumpled Graphene-Encapsulated Si Nanoparticles for Lithium Ion Battery Anodes". The Journal of Physical Chemistry Letters. 3 (13): 1824–1829. doi:10.1021/jz3006892. PMID 26291867.
- ^ http://www.cheric.org/PDF/Symposium/S-J2-0063.pdf
- ^ Balbuena, P.B., Wang, Y.X., eds. Lithium Ion Batteries: Solid Electrolyte Interphase 2004 Imperial College Press, London
- ^ Summerfield, J. (2013). "Modeling the Lithium Ion Battery". Journal of Chemical Education. 90 (4): 453–455. Bibcode:2013JChEd..90..453S. doi:10.1021/ed300533f.
- ^ Andrea 2010, p. 2.
- ^ "How is a Lithium Ion Pouch Cell Manufactured in the Lab?". KIT Zentrum für Mediales Lernen. 6 June 2018.
Creative Commons Attribution license
- ^ Andrea 2010, p. 234.
- ^ "Prismatic cell winder". University of Michigan. 25 June 2015.
- ^ Wang, Y.; He, P.; Zhou, H. (2012). "Li-Redox Flow Batteries Based on Hybrid Electrolytes: At the Cross Road between Li-ion and Redox Flow Batteries". Advanced Energy Materials. 2 (7): 770–779. doi:10.1002/aenm.201200100.
- ^ Qi, Zhaoxiang; Koenig, Gary M. (15 August 2016). "A carbon-free lithium-ion solid dispersion redox couple with low viscosity for redox flow batteries". Journal of Power Sources. 323: 97–106. Bibcode:2016JPS...323...97Q. doi:10.1016/j.jpowsour.2016.05.033.
- ^ Panasonic unveils 'smallest' pin-shaped lithium ion battery, Telecompaper, 6 October 2014
- ^ Erol, Salim (5 January 2015). "Electrochemical Impedance Spectroscopy Analysis and Modeling of Lithium Cobalt Oxide/Carbon Batteries". Retrieved 10 September 2018.
{{cite journal}}: Cite journal requires|journal=(help) - ^ "Rechargeable Li-Ion Button Battery: Serial LIR2032" (PDF). AA Portable Power Corp.
- ^ Goodwins, Rupert (17 August 2006). "Inside a notebook battery pack". ZDNet. Retrieved 6 June 2013.
- ^ Andrea 2010, p. 229.
- ^ "Lithium-ion laptop battery". Ultrabook Batteries. Ritz Stefan. Retrieved 23 March 2014.
- ^ New Li-ion Battery Design Boosts Energy Capacity and Charge Rate 10-Fold
- ^ Xiao, Maya (June 2019). "Lithium-Ion Battery Market Poised for Strong Growth in Europe; Energy Storage Applications will be Fastest Growing Sector". Interact Analysis (in الإنجليزية). Retrieved 2021-12-21.
{{cite web}}: CS1 maint: url-status (link) - ^ "A Guide to Choosing Best Power Tool Battery for Your Cordless Tools". Best Power Tools For Sale, Expert Reviews and Guides. 25 October 2018. Retrieved 31 October 2018.
- ^ Miller, Peter (10 January 2015). "Automotive Lithium-Ion Batteries". Johnson Matthey Technology Review. 59 (1): 4–13. doi:10.1595/205651315x685445.
- ^ "Silent 2 Electro". Alisport. Archived from the original on 17 February 2015. Retrieved 6 December 2014.
- ^ "Pipistrel web site". Archived from the original on 2 July 2017. Retrieved 6 December 2014.
- ^ "Ventus-2cxa with FES propulsion system". Schempp-Hirth. Archived from the original on 2 April 2015. Retrieved 11 March 2015.
- ^ GR-3150-CORE, Generic Requirements for Secondary Non-Aqueous Lithium Batteries.
- ^ Hesse, Holger; Schimpe, Michael; Kucevic, Daniel; Jossen, Andreas (2017-12-11). "Lithium-Ion Battery Storage for the Grid—A Review of Stationary Battery Storage System Design Tailored for Applications in Modern Power Grids". Energies (in الإنجليزية). 10 (12): 2107. doi:10.3390/en10122107. ISSN 1996-1073.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Grey, Clare P.; Hall, David S. (December 2020). "Prospects for lithium-ion batteries and beyond—a 2030 vision". Nature Communications (in الإنجليزية). 11 (1): 6279. doi:10.1038/s41467-020-19991-4. ISSN 2041-1723. PMC 7722877. PMID 33293543.
- ^ "Overview of lithium ion batteries" (PDF). Panasonic. Jan 2007. Archived from the original (PDF) on 7 November 2011. Retrieved 13 November 2013.
- ^ أ ب Quinn, Jason B.; Waldmann, Thomas; Richter, Karsten; Kasper, Michael; Wohlfahrt-Mehrens, Margret (19 October 2018). "Energy Density of Cylindrical Li-Ion Cells: A Comparison of Commercial 18650 to the 21700 Cells". Journal of the Electrochemical Society. 165 (14): A3284–A3291. doi:10.1149/2.0281814jes.
- ^ أ ب ت Winter & Brodd 2004, p. 4258
- ^ Andrea 2010, p. 12.
- ^ Stroe, Daniel-Ioan; Swierczynski, Maciej; Kar, Soren Knudsen; Teodorescu, Remus (2017-09-22). "Degradation Behavior of Lithium-Ion Batteries During Calendar Ageing—The Case of the Internal Resistance Increase". IEEE Transactions on Industry Applications. 54 (1): 517–525. doi:10.1109/TIA.2017.2756026. ISSN 0093-9994.
- ^ Turpen, Aaron (16 November 2015). "New battery tech gives 10 hours of talk time after only 5 minutes on charge". www.gizmag.com. Retrieved 3 December 2015.
- ^ Smith, Noah (16 January 2015). "Get Ready For Life Without Oil". bloombergview.com. Retrieved 31 July 2015.
- ^ Randall, Tom; Lippert, John (24 November 2017). "Tesla's Newest Promises Break the Laws of Batteries". Bloomberg.com. Retrieved 13 February 2018.
- ^ أ ب Ziegler, Micah S.; Trancik, Jessika E. (2021). "Re-examining rates of lithium-ion battery technology improvement and cost decline". Energy & Environmental Science (in الإنجليزية). 14 (4): 1635–1651. arXiv:2007.13920. doi:10.1039/D0EE02681F. ISSN 1754-5692. S2CID 220830992.
- ^ "Lithium-ion Battery DATA SHEET Battery Model : LIR18650 2600 mAh" (PDF).
- ^ أ ب Wang, J.; Liu, P.; Hicks-Garner, J.; Sherman, E.; Soukiazian, S.; Verbrugge, M.; Tataria, H.; Musser, J.; Finamore, P. (2011). "Cycle-life model for graphite-LiFePO4 cells". Journal of Power Sources. 196 (8): 3942–3948. Bibcode:2011JPS...196.3942W. doi:10.1016/j.jpowsour.2010.11.134.
- ^ Saxena, S.; Hendricks, C.; Pecht, M. (2016). "Cycle life testing and modeling of graphite/LiCoO2 cells under different state of charge ranges". Journal of Power Sources. 327: 394–400. Bibcode:2016JPS...327..394S. doi:10.1016/j.jpowsour.2016.07.057.
- ^ Saxena, S.; Hendricks, C.; Pecht, M. (2016). "Cycle life testing and modeling of graphite/LiCoO2 cells under different state of charge ranges". Journal of Power Sources. 327: 394–400. Bibcode:2016JPS...327..394S. doi:10.1016/j.jpowsour.2016.07.057..
- ^ Sun, Y.; Saxena, S.; Pecht, M. (2018). "Derating Guidelines for Lithium-Ion Batteries". Energies. 11 (12): 3295. doi:10.3390/en11123295.
- ^ أ ب ت ث ج Hendricks, C.; Williard, N.; Mathew, S.; Pecht, M. (2016). "A failure modes, mechanisms, and effects analysis (FMMEA) of lithium-ion batteries". Journal of Power Sources. 327: 113–120. doi:10.1016/j.jpowsour.2015.07.100.. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "ReferenceA" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب ت ث Waldmann, T.; Wilka, M.; Kasper, M.; Fleischhammer, M.; Wohlfahrt-Mehrens, M. (2014). "Temperature dependent ageing mechanisms in Lithium-ion batteries – A Post-Mortem study". Journal of Power Sources. 262: 129–135. Bibcode:2014JPS...262..129W. doi:10.1016/j.jpowsour.2014.03.112.
- ^ Leng, Feng; Tan, Cher Ming; Pecht, Michael (6 August 2015). "Effect of Temperature on the Aging rate of Li Ion Battery Operating above Room Temperature". Scientific Reports. 5 (1): 12967. Bibcode:2015NatSR...512967L. doi:10.1038/srep12967. PMC 4526891. PMID 26245922.
- ^ Jaguemont, Joris; Van Mierlo, Joeri (October 2020). "A comprehensive review of future thermal management systems for battery-electrified vehicles". Journal of Energy Storage (in الإنجليزية). 31: 101551. doi:10.1016/j.est.2020.101551.
- ^ Waldmann, T.; Bisle, G.; Hogg, B. -I.; Stumpp, S.; Danzer, M. A.; Kasper, M.; Axmann, P.; Wohlfahrt-Mehrens, M. (2015). "Influence of Cell Design on Temperatures and Temperature Gradients in Lithium-Ion Cells: An in Operando Study". Journal of the Electrochemical Society. 162 (6): A921. doi:10.1149/2.0561506jes..
- ^ Andrea 2010, p. 9.
- ^ Liaw, B. Y.; Jungst, R. G.; Nagasubramanian, G.; Case, H. L.; Doughty, D. H. (2005). "Modeling capacity fade in lithium-ion cells". Journal of Power Sources. 140 (1): 157–161. Bibcode:2005JPS...140..157L. doi:10.1016/j.jpowsour.2004.08.017.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ Voelker, Paul (22 April 2014). "Trace Degradation Analysis of Lithium-Ion Battery Components". R&D. Retrieved 4 April 2015.
- ^ "How to prolong your cell phone battery's life span". phonedog.com. 2011-08-07. Retrieved 2020-07-25.
- ^ Alexander K Suttman.(2011).Lithium Ion Battery Aging Experiments and Algorithm Development for Life Estimation. Published by The Ohio State University and OhioLINK
- ^ Matthew B. Pinson1 and Martin Z. Bazant. Theory of SEI Formation in Rechargeable Batteries: Capacity Fade, Accelerated Aging and Lifetime Prediction. Massachusetts Institute of Technology, Cambridge, MA 02139
- ^ "New Data Shows Heat & Fast-Charging Responsible For More Battery Degradation Than Age Or Mileage". CleanTechnica. 16 December 2019.
- ^ "How iOS 13 Will Save Your iPhone's Battery (by Not Fully Charging It)". www.howtogeek.com.
- ^ "How Often Should I Charge My Phone To Prolong The Battery Life?". 21 February 2019.
- ^ Jary, Simon. "Battery charging tips and tricks for prolonged life". Tech Advisor.
- ^ Reynolds, Matt (4 August 2018). "Here's the truth behind the biggest (and dumbest) battery myths". Wired UK – via www.wired.co.uk.
- ^ "Why You Should Stop Fully Charging Your Smartphone Now". Electrical Engineering News and Products. 9 November 2015.
- ^ Tip: Condition your new cell phone’s battery to make it last longer (but be sure to condition it properly). Dottech.org (24 December 2011). Retrieved 16 April 2013.
- ^ Yadav, Antriksh (31 December 2010) Top 5 lithium-ion battery myths. Rightnowintech.com.
- ^ Winter & Brodd 2004, pp. 4256, 4258
- ^ , Winter & Brodd 2004, p. 4254
- ^ Aging - capacity loss BatteryUniversity.com.[unreliable source?]
- ^ Altair Nano: Power & Energy Systems[dead link]
- ^ . Battery University: Fig. 1 Non-recoverable capacity loss[unreliable source?]
- ^ Battery Management Systems for Large Lithium-Ion Battery Packs page 9
- ^ "A123 M1 cell specifications" (PDF).
- ^ Battery Management Systems for Large Lithium-Ion Battery Packs page 12
- ^ Buchmann, Isidor (200804). "Choosing a battery that will last". Isidor Buchmann (CEO of Cadex Electronics Inc.).
{{cite web}}: Check date values in:|date=(help)[unreliable source?] - ^ Battery Management Systems for Large Lithium-Ion Battery Packs page 229
- ^ أ ب ت ث ج Buchmann, Isidor (2006). "BatteryUniversity.com: How to prolong lithium-based batteries". Cadex Electronics Inc.
{{cite web}}: Unknown parameter|month=ignored (help)[unreliable source?] - ^ أ ب Spotnitz, R.; Franklin, J. (2003). "Abuse behavior of high-power, lithium-ion cells". Journal of Power Sources. Elsevier. 113: 81–100. doi:10.1016/S0378-7753(02)00488-3. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "Spotnitz:2003a" معرف أكثر من مرة بمحتويات مختلفة. - ^ Buchmann, Isidor (February 2003). "Advanced battery analyzers". Isidor Buchmann. Retrieved 2009-12-26.[unreliable source?]
- ^ "Lithium-ion Battery Charging Basics". PowerStream Technologies. Retrieved 4 December 2010.
- ^ http://www.e-one.com.tw/News_2005_e.htm
- ^ AeroVironment Achieves Electric Vehicle Fast Charge Milestone Test Rapidly Recharges a Battery Pack Designed for Use in Passenger Vehicles. 10 Minute Re-Charge Restores Enough Energy to Run Electric Vehicle for Two Hours at 60 Miles Per Hour
- ^ http://www.aei-online.org/automag/techbriefs/10-2006/1-114-10-16.pdf
- ^ IEEE Spectrum: Lithium Batteries Take to the Road
- ^ Bickel & Brewer - A law firm devoted exclusively to the resolution of complex commercial disputes. Bickel & Brewer was formed with a singular goal: to serve clients in significant, disputed matters that involve substantial dollar or business exposures...: Detail
- ^ http://www.segway.com/personal-transporter/lithium_ion.html
- ^ http://www.a123systems.com/html/news/articles/051102_news.html
- ^ Green Car Congress: A123Systems Launches New Higher-Power, Faster Recharging Li-Ion Battery Systems
- ^ Yahoo! Groups
- ^ [http://www.imaracorp.com
- ^ Microsoft PowerPoint - 061125 Altair EDTA Presentation
- ^ [1]
- ^ [2]
- ^ [3]
- ^ Welcome to Ener1
- ^ Microsoft PowerPoint - EnerDel Technical Presentation.ppt [Read-Only]
- ^ Science Express (preprint) http://www.sciencemag.org/cgi/content/abstract/1122716
- ^ Technology Review: Higher-Capacity Lithium-Ion Batteries
- ^ Zandonella, Catherine (11 April 2009). "Battery grown from "armour plated" viruses". New Scientist. Tribune media Services International. 202 (2703): 1.
- ^ "Super-powered battery breakthrough claimed by US team". بي بي سي. 2013-04-18. Retrieved 2013-04-18.
- ^ L.M. Cristo, T. B. Atwater. Characteristics and Behavior of 1M LiPF6 1EC:1DMC Electrolyte at Low Temperatures. Fort Monmouth, NJ: U.S. Army Research.
- ^ How to prolong lithium-based batteries
- ^ AN1333
- ^ ISL9208 Multi-Cell Li-ion Battery Pack OCP/Analog Front End
- ^ أ ب Hislop, Martin (1 March 2017). "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough". North American Energy News. The American Energy News. Retrieved 15 March 2017.
- ^ Bisschop, Roeland; Willstrand, Ola; Rosengren, Max (2020-11-01). "Handling Lithium-Ion Batteries in Electric Vehicles: Preventing and Recovering from Hazardous Events". Fire Technology (in الإنجليزية). 56 (6): 2671–2694. doi:10.1007/s10694-020-01038-1. ISSN 1572-8099. S2CID 225315970.
- ^ Bisschop, Roeland; Willstrand, Ola; Amon, Francine; Rosenggren, Max (2019). Fire Safety of Lithium-Ion Batteries in Road Vehicles. RISE Research Institutes of Sweden. ISBN 978-91-88907-78-3.
- ^ Millsaps, C. (10 July 2012). Second Edition of IEC 62133: The Standard for Secondary Cells and Batteries Containing Alkaline or Other Non-Acid Electrolytes is in its Final Review Cycle. Retrieved from Battery Power Online (10 January 2014)
- ^ IEC 62133. Secondary cells and batteries containing alkaline or other non-acid electrolytes – Safety requirements for portable sealed secondary cells, and for batteries made from them, for use in portable applications (2.0 ed.). International Electrotechnical Commission. December 2012. ISBN 978-2-83220-505-1.
- ^ Kwon, Jethro Mullen and K. J. (2 September 2016). "Samsung is recalling the Galaxy Note 7 worldwide over battery problem". CNNMoney. Retrieved 13 September 2019.
- ^ أ ب "Samsung recall for Galaxy Note 7". news.com.au. 2 September 2016. Archived from the original on 2 September 2016.
- ^ Kanellos, Michael (15 August 2006). "Can anything tame the battery flames?". Cnet. Retrieved 14 June 2013.
- ^ Electrochem Commercial Power (9 September 2006). "Safety and handling guidelines for Electrochem Lithium Batteries" (PDF). Rutgers University. Retrieved 21 May 2009.
- ^ Willstrand, Ola; Bisschop, Roeland; Blomqvist, Per; Temple, Alastair; Anderson, Johan (2020). Toxic Gases from Fire in Electric Vehicles. RISE Research Institutes of Sweden. ISBN 978-91-89167-75-9.
- ^ Mikolajczak, Celina; Kahn, Michael; White, Kevin & Long, Richard Thomas (July 2011). "Lithium-Ion Batteries Hazard and Use Assessment" (PDF). Fire Protection Research Foundation. pp. 76, 90, 102. Archived from the original (PDF) on 13 May 2013. Retrieved 27 January 2013.
- ^ Topham, Gwyn (18 July 2013). "Heathrow fire on Boeing Dreamliner 'started in battery component'". The Guardian.
- ^ "Boeing 787 aircraft grounded after battery problem in Japan". BBC News. 14 January 2014. Retrieved 16 January 2014.
- ^ Chen, Mingyi; Liu, Jiahao; He, Yaping; Yuen, Richard; Wang, Jian (October 2017). "Study of the fire hazards of lithium-ion batteries at different pressures". Applied Thermal Engineering. 125: 1061–1074. doi:10.1016/j.applthermaleng.2017.06.131. ISSN 1359-4311.
- ^ Finegan, D. P.; Scheel, M.; Robinson, J. B.; Tjaden, B.; Hunt, I.; Mason, T. J.; Millichamp, J.; Di Michiel, M.; Offer, G. J.; Hinds, G.; Brett, D. J. L.; Shearing, P. R. (2015). "In-operando high-speed tomography of lithium-ion batteries during thermal runaway". Nature Communications. 6: 6924. Bibcode:2015NatCo...6.6924F. doi:10.1038/ncomms7924. PMC 4423228. PMID 25919582.
- ^ Väyrynen, A.; Salminen, J. (2012). "Lithium ion battery production". The Journal of Chemical Thermodynamics. 46: 80–85. doi:10.1016/j.jct.2011.09.005.
- ^ "Lithium-ion Battery Charging Basics". PowerStream Technologies. Retrieved 4 December 2010.
- ^ Cringely, Robert X. (1 September 2006). "Safety Last". The New York Times. Retrieved 14 April 2010.
- ^ "Kyocera Launches Precautionary Battery Recall, Pursues Supplier of Counterfeit Batteries" (Press release). Kyocera Wireless. 28 October 2004. Archived from the original on 7 January 2006. Retrieved 15 June 2010.
- ^ Tullo, Alex (21 August 2006). "Dell Recalls Lithium Batteries". Chemical and Engineering News. 84 (34): 11. doi:10.1021/cen-v084n034.p011a.
- ^ Hales, Paul (21 June 2006). Dell laptop explodes at Japanese conference. The Inquirer. Retrieved 15 June 2010.
- ^ "Nokia issues BL-5C battery warning, offers replacement". Wikinews. 14 August 2007. Retrieved 8 October 2009.
- ^ Nokia N91 cell phone explodes. Mukamo – Filipino News (27 July 2007). Retrieved 15 June 2010.
- ^ "Samsung pins explosive Galaxy Note 7 on battery flaw". Retrieved 18 September 2016.
- ^ http://www.atbatt.com/blog/31.asp
- ^ Galbraith, R. "U.S. Department of Transportation revises Lithium battery rules press release". Retrieved 2009-05-11.
- ^ http://www.cleantech.com/news/3694/electrovaya-tata-motors-make-electric-indica
- ^ http://www.teslamotors.com
- ^ http://www.calcars.org/priusplus.html
- ^ أ ب ت Amui, Rachid (February 2020). "Commodities At a Glance: Special issue on strategic battery raw materials" (PDF). United Nations Conference on Trade and Development. 13 (UNCTAD/DITC/COM/2019/5). Retrieved 10 February 2021.
- ^ Application of Life-Cycle Assessment to Nanoscale Technology: Lithium-ion Batteries for Electric Vehicles. Washington, DC: U.S. Environmental Protection Agency (EPA). 2013. EPA 744-R-12-001. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. https://www.epa.gov/saferchoice/partnership-conduct-life-cycle-assessment-lithium-ion-batteries-and-nanotechnology. - ^ "Can Nanotech Improve Li-ion Battery Performance". Environmental Leader. 30 May 2013. Archived from the original on 21 August 2016. Retrieved 3 June 2013.
- ^ Katwala, Amit. "The spiralling environmental cost of our lithium battery addiction". Wired. Condé Nast Publications. Retrieved 10 February 2021.
- ^ Draper, Robert. "This metal is powering today's technology—at what price?". National Geographic. No. February 2019. National Geographic Partners. Retrieved 10 February 2021.
- ^ Franco, Alejandro (7 April 2015). Rechargeable lithium batteries : from fundamentals to applications. Franco, Alejandro A. Cambridge, UK. ISBN 9781782420989. OCLC 907480930.
{{cite book}}: CS1 maint: location missing publisher (link) - ^ "How "Green" is Lithium?". 16 December 2014.
- ^ "European Commission, Science for Environment Policy, News Alert Issue 303" (PDF). October 2012.
- ^ "Analysis of the climate impact of lithium-ion batteries and how to measure it" (PDF).
{{cite web}}: CS1 maint: url-status (link) - ^ Buchert, Matthias (14 December 2016). "Aktualisierte Ökobilanzen zum Recyclingverfahren LithoRec II für Lithium-Ionen-Batterien" (PDF).
- ^ أ ب Hanisch, Christian; Diekmann, Jan; Stieger, Alexander; Haselrieder, Wolfgang; Kwade, Arno (2015). "27". In Yan, Jinyue; Cabeza, Luisa F.; Sioshansi, Ramteen (eds.). Handbook of Clean Energy Systems – Recycling of Lithium-Ion Batteries (5 Energy Storage ed.). John Wiley & Sons, Ltd. pp. 2865–2888. doi:10.1002/9781118991978.hces221. ISBN 9781118991978.
- ^ Hanisch, Christian. "Recycling of Lithium-Ion Batteries" (PDF). Presentation on Recycling of Lithium-Ion Batteries. Lion Engineering GmbH. Retrieved 22 July 2015.
- ^ أ ب Morris, Charles (27 August 2020). "Li-Cycle recovers usable battery-grade materials from shredded Li-ion batteries". chargedevs.com. Archived from the original on 16 September 2020. Retrieved 31 October 2020.
thermally treat them—they're burning off plastic and electrolyte in the batteries and are not really focused on the material recovery. It's mainly the cobalt, the nickel and the copper that they can get via that method. Lithium-ion is quite a bit more complex, than lead–acid
- ^ Kamyamkhane, Vaishnovi. "Are lithium batteries sustainable to the environment?". Alternative Energy Resources. Archived from the original on 17 September 2011. Retrieved 3 June 2013.
- ^ "R&D Insights for Extreme Fast Charging of Medium- and Heavy-Duty Vehicles" (PDF). NREL. 27–28 August 2019. p. 6.
Some participants paid $3/kg to recycle batteries at end of life
- ^ أ ب Jacoby, Mitch (July 14, 2019). "It's time to get serious about recycling lithium-ion batteries". Chemical & Engineering News.
- ^ "ATZ WORLDWIDE". uacj-automobile.com. Retrieved 14 June 2019.
- ^ Jacoby, Mitch (July 14, 2019). "It's time to get serious about recycling lithium-ion batteries". Chemical & Engineering News.
The enormousness of the impending spent-battery situation is driving researchers to search for cost-effective, environmentally sustainable strategies for dealing with the vast stockpile of Li-ion batteries looming on the horizon.; Cobalt, nickel, manganese, and other metals found in batteries can readily leak from the casing of buried batteries and contaminate soil and groundwater, threatening ecosystems and human health...The same is true of the solution of lithium fluoride salts (LiPF6 is common) in organic solvents that are used in a battery's electrolyte
- ^ Doughty, Daniel H.; Roth, E. Peter (2012-01-01). "A General Discussion of Li Ion Battery Safety". Electrochemical Society Interface. 21 (2): 37. Bibcode:2012ECSIn..21b..37D. doi:10.1149/2.f03122if. ISSN 1944-8783.
- ^ Georgi-Maschler, T.; Friedrich, B.; Weyhe, R.; Heegn, H.; Rutz, M. (2012-06-01). "Development of a recycling process for Li-ion batteries". Journal of Power Sources. 207: 173–182. doi:10.1016/j.jpowsour.2012.01.152. ISSN 0378-7753.
- ^ Lv, Weiguang; Wang, Zhonghang; Cao, Hongbin; Sun, Yong; Zhang, Yi; Sun, Zhi (2018-01-11). "A Critical Review and Analysis on the Recycling of Spent Lithium-Ion Batteries". ACS Sustainable Chemistry & Engineering. 6 (2): 1504–1521. doi:10.1021/acssuschemeng.7b03811. ISSN 2168-0485.
- ^ Ferreira, Daniel Alvarenga; Prados, Luisa Martins Zimmer; Majuste, Daniel; Mansur, Marcelo Borges (2009-02-01). "Hydrometallurgical separation of aluminium, cobalt, copper and lithium from spent Li-ion batteries". Journal of Power Sources. 187 (1): 238–246. Bibcode:2009JPS...187..238F. doi:10.1016/j.jpowsour.2008.10.077. ISSN 0378-7753.
- ^ He, Li-Po; Sun, Shu-Ying; Song, Xing-Fu; Yu, Jian-Guo (June 2017). "Leaching process for recovering valuable metals from the LiNi 1/3 Co 1/3 Mn 1/3 O 2 cathode of lithium-ion batteries". Waste Management. 64: 171–181. doi:10.1016/j.wasman.2017.02.011. ISSN 0956-053X. PMID 28325707.
- ^ Sa, Qina; Gratz, Eric; Heelan, Joseph A.; Ma, Sijia; Apelian, Diran; Wang, Yan (2016-04-04). "Synthesis of Diverse LiNixMnyCozO2 Cathode Materials from Lithium Ion Battery Recovery Stream". Journal of Sustainable Metallurgy. 2 (3): 248–256. doi:10.1007/s40831-016-0052-x. ISSN 2199-3823. S2CID 99466764.
- ^ "Li-ion battery recycling company Li-Cycle closes Series C round". Green Car Congress. 29 November 2020. Archived from the original on 19 November 2020.
{{cite web}}:|archive-date=/|archive-url=timestamp mismatch; 29 نوفمبر 2020 suggested (help) - ^ Shi, Yang; Chen, Gen; Liu, Fang; Yue, Xiujun; Chen, Zheng (2018-06-26). "Resolving the Compositional and Structural Defects of Degraded LiNixCoyMnzO2 Particles to Directly Regenerate High-Performance Lithium-Ion Battery Cathodes". ACS Energy Letters. 3 (7): 1683–1692. doi:10.1021/acsenergylett.8b00833. ISSN 2380-8195. S2CID 139435709.
- ^ Dunn, Jennifer B.; Gaines, Linda; Sullivan, John; Wang, Michael Q. (2012-10-30). "Impact of Recycling on Cradle-to-Gate Energy Consumption and Greenhouse Gas Emissions of Automotive Lithium-Ion Batteries". Environmental Science & Technology. 46 (22): 12704–12710. Bibcode:2012EnST...4612704D. doi:10.1021/es302420z. ISSN 0013-936X. PMID 23075406.
- ^ "Recycle spent batteries". Nature Energy. 4 (4): 253. April 2019. Bibcode:2019NatEn...4..253.. doi:10.1038/s41560-019-0376-4. ISSN 2058-7546. S2CID 189929222.
- ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (2018-02-28). "Perspective - The hidden costs of cobalt mining". The Washington Post (in الإنجليزية الأمريكية). ISSN 0190-8286. Retrieved 2018-03-07.
- ^ Todd C. Frankel (September 30, 2016). "THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers' phones and laptops". The Washington Post.
- ^ Crawford, Alex. Meet Dorsen, 8, who mines cobalt to make your smartphone work. Sky News UK. Retrieved on 2018-01-07.
- ^ Are you holding a product of child labour right now? (Video). Sky News UK (2017-02-28). Retrieved on 2018-01-07.
- ^ Frankel, Todd C. (2016-09-30). "Cobalt mining for lithium ion batteries has a high human cost". The Washington Post. Retrieved 2016-10-18.
- ^ Child labour behind smart phone and electric car batteries. Amnesty International (2016-01-19). Retrieved on 2018-01-07.
- ^ Marchegiani, Morgera, and Parks (November 21, 2019). "Indigenous peoples'rights to natural resources in Argentina: the challenges of impact assessment, consent and fair andequitable benefit-sharing in cases of lithium mining". The International Journal of Human Rights.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Price, Austin (Summer 2021). "The Rush for White Gold". Earth Island Journal.
- ^ Chadwell, Jeri (July 21, 2021). "Judge to decide on injunction request to halt work on Thacker Pass lithium mine". This is Reno. Retrieved October 12, 2021.
- ^ "The Lithium Gold Rush: Inside the Race to Power Electric Vehicles". The New York Times. 6 May 2021. Retrieved 6 May 2021.
- ^ "Thacker Pass Lithium mine approval draws around-the-clock protest". Sierra Nevada Ally. January 19, 2021. Retrieved March 16, 2021.
{{cite news}}: CS1 maint: url-status (link)
للاستزادة
- Andrea, Davide (2010). Battery Management Systems for Large Lithium-Ion Battery Packs. Artech House. p. 234. ISBN 978-1608071043. Retrieved 3 June 2013.
- Winter, M; Brodd, RJ (2004). "What Are Batteries, Fuel Cells, and Supercapacitors?". Chemical Reviews. 104 (10): 4245–69. doi:10.1021/cr020730k. PMID 15669155.
وصلات خارجية
- Lithium-ion Battery على موسوعة بريتانيكا.
- List of World's Largest Lithium-ion Battery Factories (2020).
- Energy Storage Safety at National Renewable Energy Laboratory (NREL).
- New More Efficient Lithium-ion Batteries The New York Times. September 2021.
- NREL Innovation Improves Safety of Electric Vehicle Batteries, NREL, October 2015.
- Degradation Mechanisms and Lifetime Prediction for Lithium-Ion Batteries, NREL, July 2015.
- Impact of Temperature Extremes on Large Format Li-ion Batteries for Vehicle Applications, NREL, March 2013.
- CS1 maint: bot: original URL status unknown
- مقالات ذات عبارات محل شك
- CS1 maint: url-status
- CS1 maint: unflagged free DOI
- Articles with unsourced statements from September 2009
- Articles with dead external links from October 2009
- CS1 errors: unsupported parameter
- Articles with unsourced statements from October 2009
- Articles with unsourced statements from May 2010
- CS1 maint: location missing publisher
- CS1 errors: archive-url
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- Articles with hatnote templates targeting a nonexistent page
- مقالات ينقصها مصادر موثوقة
- مقالات ينقصها مصادر موثوقة from November 2016
- كل المقالات بدون مراجع موثوقة
- كل المقالات بدون مراجع موثوقة from August 2014
- Articles with unsourced statements from October 2017
- مقالات ذات عبارات بحاجة لمصادر
- مقالات فيها عبارات متقادمة منذ 2017
- جميع المقالات التي فيها عبارات متقادمة
- Articles with unsourced statements from February 2018
- Articles with unsourced statements from March 2011
- مقالات فيها عبارات متقادمة منذ يناير 2014
- Articles with specifically marked weasel-worded phrases from July 2020
- Articles with unsourced statements from October 2021
- Articles with unsourced statements from June 2021
- بطاريات ليثيوم-أيون
- حواسب محمولة
- سحب منتجات
- مواد قابلة للتدوير
- فضائح سلامة منتجات
- الصفحات التي تستخدم تنسيقا مهملا للعلامات الكيميائية