هندسة وراثية
| جزء من سلسلة عن |
| علم الوراثة |
|---|
 |
| المكونات الرئيسية |
| التاريخ والموضوعات |
| الأبحاث |
| الطب الشخصي |
| الطب الشخصي |
الهندسة الوراثية Genetic engineering، هي التقنية التي تتعامل مع الجينات، البشرية منها والحيوانية بالإضافة إلى جينات الأحياء الدقيقة، أو الوحدات الوراثية المتواجدة على الكروموزومات فصلاً ووصلاً وإدخالاً لأجزاء منها من كائن إلى آخر بغرض إحداث حالة تمكن من معرفة وظيفة (الجين) أو بهدف زيادة كمية المواد الناتجةعن التعبير عنه أو بهدف استكمال ما نقص منه في خلية مستهدفة.
أدت الوراثة دوراً مهماً في تطوير تقانات تستخدم لإجراء تغييرات في المنظومات الحيوية (البيولوجية) biological systems بغية تكوين كائنات حية ذات أنماط وراثية ومظهرية جديدة وغير مألوفة. ويتم تكوين هذه الكائنات لأغراض تجريبية أو لأهداف وراثية مثل إنتاج سلالات متميزة من الحيوانات والنباتات أو جزيئات تستخدم في معالجة الأمراض البشرية. وسابقاً كانت الطفرة وإعادة ترتيب المورثات القاعدتين الأساسيتين للتغيير الوراثي، ومن ثم المظهري، ولكن ذلك غالباً ما كان عشوائياً ومعقداً. ومنذ السبعينات تم تطوير تقانات يمكن بوساطتها تغيير النمط الوراثي أو توجيهه وجهة محددة مسبقاً، ويدعى ذلك الهندسة الوراثية genetic engineering أو تقانة الدنا المأشوب recombinant DNA (rDNA)، وتمكِّن من عزل شدف من الدنا، ووصلها بعضها ببعض في تراكيب جديدة، ومن ثم إدخال الجزيئات المأشوبة مجدداً في الكائن الحي، ومن ثم تتمكن الهندسة الوراثية من تغيير نوعية أو كمية البروتينات التي يستطيع الفرد إنتاجها، وبالتالي تمكنه من إنتاج مواد جديدة أو تنفيذ وظائف معينة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
مع اكتشاف الكروموزمات تم التوصل إلى معرفة الجينات على أنها أشرطة مسجل عليها صفات الكائن أو الخلية المادية. و هذه الجينات ما هي إلا سلم مزدوج من الحمض الريبي النووي منقوص الأوكسجين DNA كما يعرف بحامل الشيفرات الوراثية.
1- أن DNA هو حامل الشفرة الوراثية .
2- أن الصفات التي يحملها تترجم منه إلى بروتينات تتجسد على هيئة الصفة المطلوب تنفيذها.
3- أن كل خيط يمكن أن يكون قالباً يتكون عليه خيط جديد يتزاوج معه مستخدماً وحداته البنائية من السيتوبلازم .
4- أنه يمكن قطع ووصل هذا اللولب المزدوج بوسائل تقنية متعددة وفي أماكن مختلفة . كما يمكن بسهولة فصل زوجي اللولب.
5- أنه يمكن قص ولصق قطعة منه من مكان لآخر.
6- أن تغييراً أو تدميراً يشوه هذا النظام يؤدي إلى: إما نتيجة قاتلة للكائن أو حالة مرضية مترتبة على تعطل صفة من صفاته والتي تختلف من حيث أهميته
7- إن تركيب DNA ومكوناته هي [ سكر ، وأدنين ، وفوسفات ] وهذه التركيبة مشتركة في جميع الكائنات من الأحياء الدقيقة إلى الفيل .
المنهجية
تتم الهندسة الوراثية بعدة طرق تكون بشكل أساسي مؤلفة من 4 خطوات:
1- عزل الجين المرغوب: يتم العزل من خلال تحديد الجين المرغوب إدخاله إلى الخلايا من خلال معلومات مسبقة عن الجينات والتي يتم الحصول عليها إما من خلال عمل مكتبات من en:cDNA أو en:gDNA و من ثم تتم مضاعفة هذه الجينات باستخدام تفاعل سلسلة البوليميرز.
2- إدخال أو تحميل الجين المرغوب في حامل مناسب مثل بلازميد. كما يمكن استخدام حوامل أخرى مثل الحوامل الفيروسية أو الليبوزوم.
3- إدخال الحامل في خلايا المتعضية المراد تعديلها. و تتم بعدة طرق منها بندقية الدنا.
4- عزل و فصل الخلايا او المتعضيات التي تعدلات وراثياً بنجاح من الطبيعية. و تتم بعدة طرق منها: استخدام مسبار الدنا للتحري عن الجين المدخل أو باستخدام المعلمات التمييزية Selectable marker للتحري عن صفة مقاومة موجودة مع الحامل و تكون مميزة بمقاومتها لصفة معينة كالمعلمات التمييزية التي تكسب مقاومة لمضاد حيوي معين.
فصل المورث
البناء
استهداف المورث
التحول
الاختيار
التجدد
التأكيد
إنزيمات التقييد
إنزيمات التقييد restriction enzymes هي إنزيمات قاطعة للدنا في مواقع محددة منه، تتوافر في بعض البكتريا وتؤخذ منها.
يعود الفضل في اكتشاف هذه الإنزيمات إلى ثلاثة علماء حازوا عام 1978 جائزة نوبل في الفيزيولوجيا أو الطب، وهم:
ـ ورنر آربر Werner Arber الذي كان أول من افترض وجود هذه الإنزيمات، ومن ثم عزل أول إنزيم تقييد من النموذج I.
ـ هاملتون سميث Hamilton Smith الذي كان أول من اكتشف أول إنزيم من النموذج II هو HindII من البكتريا Haemophilus influenzae وحدد خصائصه.
ـ دانيل ناثانز Daniel Nathans الذي كان أول من استخدم ذلك الإنزيم لقطع دنا الفيروس SV40 إلى أجزاء محددة، ومن ثم استخدمها لدراسة البيولوجيا الجزيئية لهذا الفيروس في القرد.[1]
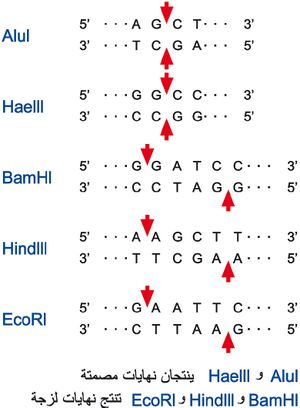
يتعرف إنزيم تقييد معين على تتالٍ محدد من النوَويدات nucleotides ويقطع الدنا عنده. فمثلاً تنتج البكتريا Hemophilus aegypticus إنزيماً يدعى Hae III يقطع الدنا حينما يصادف التتالي الآتي فيه:
'n5`GGCC 3
'n3`CCGG 5
ويكون القطع بين C وG المتتاليين (الشكل 1)، ويحدث 11 مرة في الدنا الحلقي للفيروس phiX174، وعلى هذا فإن معاملة هذا الدنا بالإنزيم المذكور تنتج 12 شدفة صبغية، كل منها ذات طول معين دقيق وتتالٍ محدد من النوويدات، ويمكن فصل هذه الشدف بعضها عن بعض ومن ثم تحديد تتاليات القواعد ضمن كل منها.
يقطع إنزيما التقييد Hae III و Alu I النوويدات بشكل مستقيم، منتجين ما يدعى نهايات مصمتة blunt ends، ولكن إنزيمات تقييد كثيرة أخرى تقطعها بشكل ملتوٍ منتجة ما يسمى نهايات لزجة sticky ends لقدرتها على تكوين أزواج من القواعد مع أي جزيء دنا يحتوي على نهاية لزجة مكملة complementary. وإن أي مصدر آخر من الدنا سينتج مثل هذه الجزيئات إذا عومل بالإنزيم ذاته.
وإذا مزجت معاً فإن هذه الجزيئات يمكنها الارتباط بعملية ازدواج القواعد بين نهاياتها اللزجة. ويمكن أن يجعل هذا الارتباط مستداماً باستخدام إنزيم ربط يدعى ليغاز الدنا DNA ligase يشكل روابط تساهمية covalent bonds منتجة جزيئاً من الدنا المأشوب.
بعد زمن قصير من اكتشاف إنزيمات التقييد أوضحت دراسات بالمجهر الإلكتروني أن الشدف الناتجة بفعل هذه الإنزيمات تشكل تلقائياً حلقات، ويمكن جعل هذه الحلقات مستقيمة مرة أخرى بالتسخين (الشكل 2)، ولكن إذا عوملت الحلقات بـ «ليغاز دنا الإشريكية القولونية» E. coli الذي يربط مجموعتي 3' -OH و5'-P فإن النهايات تصبح مرتبطة تساهمياً.
يتعرف معظم إنزيمات التقييد على تتالي التقييد بغض النظر عن مصدر الدنا، وبهذا فإن شدف الدنا المتحصل عليها من كائن ما سيكون لها النهايات اللزجة نفسها كالتي يحصل عليها من كائن آخر، فيما إذا كانت منتجة باستخدام إنزيم التقييد ذاته، ويُعد هذا المبدأ من الأسس المهمة في تقانة الدنا المأشوب.
هنالك ثلاثة نماذج من إنزيمات التقييد هي:
1ـ النموذج I: ويتعرف على تتالٍ معين من القواعد على الدنا ولكنه يقطعها في مواقع عشوائية فيما يخص هذا التتالي. وتحتاج إنزيمات هذا النموذج إلى تميمي عوامل cofactors هما: ثالث فسفات الأدينوزين Adenosine Triphosphate (ATP) و س- أدينوسيلميسيل أيونين S- adenosylmethionine. وبسبب الطبيعة العشوائية للقطع بالإنزيمات لهذا النموذج فإن المنتجات هي شدف غير متجانسة من الدنا.
2ـ النموذج II: لاتحتاج إنزيمات هذا النموذج إلى تمائم عوامل، ويقوم الواحد منها بقطع التتالي الذي يتعرف عليه في موقع محدد منه. وهذه الخاصية تحديداً أعطت إنزيمات هذا النموذج أهمية فائقة في بحوث الدنا، وخاصة في إنتاج الدنا المأشوب.
يُعرف من هذا النموذج أكثر من 1200 إنزيم، وأمكن تحديد نحو 1500 موقع للقطع الإنزيمي، وتراوح أطوال التتاليات التي تتعرف عليها بين 4- 8 نوويدات.
3 ـ النموذج III: قع خواص إنزيمات هذا النموذج بين خواص إنزيمات النموذجين السابقين، وهي تتعرف إلى تتالٍ محدد من القواعد ولكنها تقطع الدنا على مسافة قصيرة منه، وتحتاج إلى ثالث فسفات الأدينوزين من دون أن تقوم بعملية حلمهة hydrolysis، ويزداد نشاطها بتوفر س- أدينوسيلميسيل أيونين، ولكنه لايعدّ ضرورة حتمية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
جزيئات الدنا المأشوب
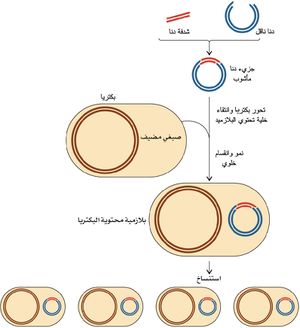
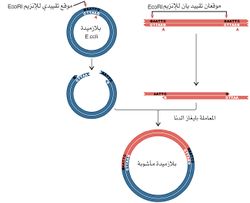
الناقل: الناقل vector هو جزيء دنا يمكن نسخ شدفة دنا في داخله، ومن ثم يمكن أن يتكاثر في كائن حي مُضيفٍ مناسب. وفي الهندسة الوراثية تُضم شدفة دنا أو مورثة مرغوبة إلى دنا الناقل، ومن ثم يوضع هذا الجزيء المأشوب ضمن خلية يمكن للتكاثر أن يتم في داخلها (الشكل 3)، وحينما يتم انتقاء خلية مناسبة وعزلها فإن تتاليات الدنا أو المورثات المرتبطة بالناقل يُقال عنها إنها نُسخت.
يمتلك أكثر النواقل شيوعاً الخواص الآتية:
ـ القدرة على إدخال دنا الناقل إلى خلية العائل cell host.
ـ يستطيع الناقل التكاثر ضمن العائل.
ـ سهولة انتقاء الخلايا المحتوية على العائل، والأسهل في هذا الصدد أن يكون ذلك عبر مظهر قابل للاصطفاء مثل مقاومة صادة (مضاد حيوي) antibiotic تُعطَى للعائل من مورثات موجودة في الناقل.
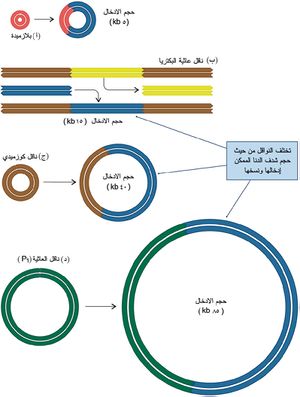
تختلف النواقل في أحجام أشداف الدنا التي يمكن إدخالها فيها. ويوضح الشكل (4) نواقل شائعة الاستخدام للنسخ في الأشريكية القولونية E.coli، وهي:
ـ نواقل بلازميدية plasmid vectors: مناسبة لنسخ أشداف صغيرة من الدنا (5 -10 kb).
ـ عاثيات البكتريا bacteriophages: تمتلك مواقع تقييدية مناسبة لنزع الجزء الأوسط من العاثية واستبدال الدنا المرغوب به.
ـ النواقل الكوزميدية cosmid vectors: تستطيع نسخ أشداف دنا قد يصل حجمها إلى40 kb.
ـ نواقل العاثية P1 phage vectors (P1): تستطيع نسخ أشداف دنا قد يبلغ حجمها حتى 85 kb.
وصل (ضم) شُدف الدنا:
مصدر الدنا، ومن ثم فإن شدف الدنا المعزولة من كائنين مختلفين يمكن وصلهما بدقة، وفي المثال الذي يبينه الشكل (5) يُفترض أن الإنزيم EcoRI استخدم لقطع الدنا من مصدر ما، ولقطع بلازميد بكتيري يمتلك موقعاً تحديدياً واحداً فقط. حينما تمزج الأشداف معاً (من الدنا ومن البلازميد) تتشكل جزيئات مأشوبة بسبب اقتران قواعد نهايات الأشداف. وفي هذه المرحلة تتم معاملة الدنا بإنزيم ليغاز لوصل النهايات، وإن هذه الخاصية المتمثلة بالقدرة على وصل شدف دنا مرغوب بناقل معين هي أساس تقانة الدنا المأشوب.
إن وصل النهايات اللزجة لاينتج دوماً دنا يمتلك مورثات فعالة. فمثلاً جزيء دنا تتالياته ABCD، تم شطره إلى أربع أشداف: A,B,C,D، فإن إعادة ترتيب القطع المذكورة هو غالباً بترتيب الجزيء الأساسي، ولكن إذا كان لـ B وC أزواج النهايات اللزجة ذاتها تتكون جزيئات ذات ترتيبات مختلفة (الشكل 6)، متضمنة ترتيبات تكون فيها واحدة أو أكثر من القطع المحددة منقلبة inverted في اتجاهاتها (مبينة في الشكل برموز مقلوبة). كما أن قطعاً تحديدية من الناقل يمكن أن تتصل معاً بترتيب غير صحيح، ولكن هذه المشكلة يمكن التغلب عليها باستخدام ناقل له موقع تحديدي واحد لإنزيم تحديدي معين. وعندما يكون لجزيء حلقي موقع تحديدي واحد لإنزيم تحديدي معين، فإن القطع بهذا الإنزيم يفتح الحلقة في هذا الموقع حيث يمكن إدخال أي شدفة دنا مرغوبة فيه. ويتوافر في المختبرات العلمية عدد من البلازميدات الممتلكة لموقع تحديدي واحد (وقد تم تكوين كثير منها بالهندسة الوراثية). ويمتلك عدد من النواقل مواقع خاصة بعدة إنزيمات تحديدية مختلفة، ولكن إنزيماً واحداً فقط يستعمل في وقت واحد.
يمكن أيضاً وصل جزيئات دنا لاتمتلك نهايات لزجة، وذلك باستخدام إنزيم ليغاز دنا مصنوع من بكتيريا Ecoli phage T4، القادر على وصل أشداف دنا ذوات نهايات مستقيمة.
الهندسة الوراثية للنبات والحيوان
انطلقت أعمال الهندسة الوراثية للنبات على نحو سريع، ويعود ذلك لأسباب عدة من أهمها أنها كانت أعمالاً تجارية: فقد وفر المزارعون لسنوات كثيرة سوقاً واسعةً للأصناف الجديدة من البذور. وفي القرون القليلة المنصرمة أدت أعمال الاصطفاء والتهجين إلى تحسين كبير في إنتاج النباتات المختلفة في الوقت الذي تضاعف فيه عدد سكان العالم بين عامي 1960- 1990. وكانت الثورة الخضراء في الزراعات الاستوائية عملية وراثية إلى حد كبير. وعلى الرغم من ذلك كانت هذه الأعمال «عمياء» إلى حد كبير: ويأتي السؤال عن الزيادة الممكن تحقيقها بالتعامل الدقيق مع المورثات ذاتها! ومن جهة أخرى استفاد الباحثون في تطوير أعمال الهندسة الوراثية للنبات من سهولة تكاثرها ونسخها. كما استفادوا من مصادفة جيدة تمثلت في اكتشاف البكتريا المسماة أغروباكتِريوم Agrobacterium التي تميزت بقدرتها على عدوى النباتات بحلقات صغيرة loops من الدنا تدعى البلازميدات ت آي plasmids Ti فقد كان الأغروبكتريوم ناقلاً جيداً للمورثات، وبعد أن تتم «عدوى» النبات فإنه يصبح قادراً على نقل المورثات الجديدة في بذوره إلى نسله. ومن ثم تمّ عام 1983 تحوير وراثي بهذه الطريقة لنبات تبغ، ثم نبات بتونيا، ثم نبات قطن.
لم يكن ممكناً استخدام الأغروباكتريوم في الحبوب cereals، وتأخر العمل بها حتى اختراع طريقة أخرى وهي قذف المورثات إلى داخل الخلية وهي محمولة على جزيئات بالغة الدقة من الذهب وذلك باستخدام جهاز مسارعٍ خاص، وصارت هذه التقانة شائعة الاستعمال في الهندسة الوراثية للنبات.
تلقت الحاصلات المهندسة وراثياً معارضة كبيرة عندما نقلت إلى أوربا من الولايات المتحدة، وخاصة في بريطانيا حيث أضحت عام 1999 قضية مهمة للمعارضين، أي بعد ثلاث سنوات من انتشارها في الولايات المتحدة. وارتكبت شركة مونسانتو Monsanto الأمريكية العملاقة خطأ في بريطانيا باستخدام حاصلات محوّرة وراثياً لجعلها منيعة ضد مبيد أعشاب تنتجه أيضاً، واسمه راوندآب Roundup. فكانت بذلك تشجع على استخدام البذار المحوّر وراثياً ومبيد الأعشاب المذكور في آن واحد حاصدة أرباحاً طائلة أثارت غضب كثير من المهتمين بالبيئة الذين قاموا آنذاك بتخريب حقول تجريبية للحاصلات المحوّرة وراثياً، وصارت هذه القضية واحداً من الاهتمامات الرئيسة لمؤسسة السلام الأخضر Greenpeace المهمة، مما يؤكد الاهتمام الشعبي الواسع بها.
يمكن القول إن الهندسة الوراثية سليمة وخطرة بقدر سلامة المورثات التي يتم تحويرها أو خطورتها، فمثلاً إن النباتات المقاومة للمبيد رواندآب يمكن أن تكون غير صديقة للبيئة من حيث إنها تشجع زيادة استخدام مبيد الأعشاب أو تنقل صفة المقاومة لبعض الأعشاب، في حين يمكن عدّ البطاطا المقاومة للحشرات صديقة للبيئة من حيث حاجتها إلى عدد أقل من الرش بالمبيدات، وكميات أقل من المحروقات اللازمة للجرارات التي سترش المبيدات، وهكذا.
أجريت آلاف من التجارب المأمونة من دون أن تُظهر آثاراً سيئة، ويقول كثيرون إن تربية النبات أو الحيوان إنما يرتكز على تغيير المورثات التي تمتلكها هذه الكائنات، ولاسيما باستخدام الطفرات[ر] mutations، وفي كثير من الأحيان بصورة عشوائية. وإن «تسييس» موضوعات الهندسة الوراثية أمر غير مرغوب فيه. وجدير بالذكر أنه في عام 1992 أدخلت إحدى أكبر شركات إنتاج البذور الأمريكية مورثة من الفول السوداني (فستق العبيد) البرازيلي في فول الصويا، وذلك لجعله أفضل غذائياً بتصحيح النقص في الحمض الأميني ميثيونين methionine فيه. وتبين فيما بعد أن عدداً قليلاً من الناس أصيب بأعراض الحساسية allergy للفول السوداني البرازيلي، وبعد اختبارات متعددة على هذا الموضوع وثباته قامت الشركة المذكورة بإبلاغ السلطات المختصة ونشر النتائج العلمية وإيقاف المشروع. وهذه الحساسية يمكن أن تسبب موت بضعة أشخاص في السنة في حين يمكن أن تنقذ مئات الآلاف في أنحاء العالم من سوء التغذية. وعلى الرغم من ذلك، فإنه بدلاً من أن يصبح هذا الأمر مثالاً للحذر العلمي فقد استغله بعض البيئيين على أنه مثال لأخطار الهندسة الوراثية.
الهندسة الوراثية للحيوان أمر ممكن ويستعمل أساساً لأغراض طبية أو صناعية، وقد صار وضع مورثة في حيوان ما -حيث يمكن تحويره وتحوير نسله وراثياً على نحو دائم - أمراً ممكناً. والفأر هو الحيوان المفضل للتحوير الوراثي لأسباب متعددة، فهو مثلاً يسمح للباحثين بتعرف المورثات، ويمكن أن تكون المورثة المنقولة من حيوان يتبع جنساً آخر، بما في ذلك الإنسان. فمثلاً إذا كان الفأر عرضة للإصابة بالسرطان فإنه يمكن جعله سليماً بنقل مورثة معينة من الصبغي 18 من الإنسان إليه.
ليست الحيوانات المحوّرة وراثياً كالأغنام والأبقار والخنازير والدواجن مفيدة للباحثين فحسب بل هي تستخدم أيضاً لتطبيقات تجارية. لقد نقلت مورثة بشرية خاصة بعامل تخثر إلى الأغنام بقصد الحصول على كميات منه في حليبها لاستخدامه في علاج أمراض مثل الناعور. وقامت شركة كندية بعزل مورثة خاصة بإنتاج ألياف شبكة العنكبوت إلى المعز بغية الحصول على كميات وافرة من هذه الألياف المتينة في الحليب، وصار إنتاج هرمون النمو البقري المأشوب أمراً ممكناً لاستخدامه في حالات علاجية، وكذلك بغية زيادة إنتاج الحليب من الأبقار (وهذا معمول به في الولايات المتحدة فقط، وغير مسموح به في أوربا ودول أخرى). وهنالك دراسات عديدة مبشرة حول استخدام الهندسة الوراثية لتحسين الإنتاج الحيواني وإنتاج بعض الهرمونات واللقاحات، إضافة إلى استخدامها لعلاج عدد من الأمراض [ر: الوراثية (المعالجة ـ)].
التطبيقات
هنالك العديد من التطبيقات للهندسة الوراثية نذكر منها:
- إنتاج بعض الأدوية بكميات كبيرة:يعتبر الإنسولين أول الأدوية البشرية المصنعة بطريق الهندسة الوراثية عام 1982.كما أُمكن من خلال هذه الهندسة الحصول على عامل التجلط البشري وعوامل إذابة الجلطة.
- إنتاج الهرمونات بكميات وافرة: مثل هرمون النمو عند الإنسان.
- إنتاج بعض اللقاحات مثل لقاح التهاب الكبد الفيروسي النمط ب.
- إنتاج متعضيات معدلة وراثياً: مثل الخضروات المقاومة للطاعون و العدوى لجرثومية كما و تبقى طازجة لمدة أطول من الخضروات الطبيعية.
الطب
الأبحاث
الصناعة
الزراعة

أهم الحاصلات المحوّرة المزروعة عالمياً:
ـ في عام 2006، السنة الأولى من العقد التجاري الثاني (2006- 2015) للحاصلات المحورة وراثياً استمر تزايد مساحات هذه المحاصيل تزايداً ملحوظاً. وبلغت المساحة المزروعة بها في 22 بلداً (11 بلداً صناعياً و11 بلداً نامياً) في عام 2006 نحو 102 مليون هكتار (الشكل 7). وقد بلغ عدد مزارعي هذه الحاصلات نحو 10.3 ملايين، في حين كان هذا العدد نحو 8.5 ملايين عام 2005.
ـ بلغت المساحة التراكمية لهذه المحاصيل بين عامي 1996- 2006 نحو 577 مليون هكتار، بزيادة غير مسبوقة بلغت 60 ضعفاً بين العامين المذكورين.
ـ لم يكن إقبال الدول الأوربية على هذه الزراعات كبيراً، وكان عدد الدول الأوربية التي زرعت المحاصيل المهندسة وراثياً ست دول عام 2006 من أصل 25 دولة في السوق الأوربية المشتركة، كانت اسبانيا في مقدمتها (60000 هكتار).
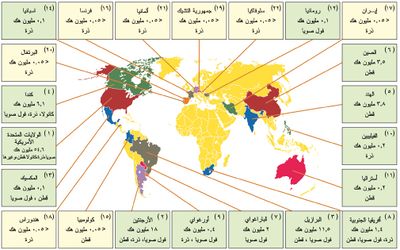
ـ احتل فول الصويا soybean المساحة المزروعة الأولى (58.0 مليون هكتار: نحو57% من المساحة الكلية)، وتلته الذرة (52.2 مليون هكتار: 25%)، والقطن (13.4 مليون هكتار: 13%) ثم الكانولا canola ن(4.8 مليون هكتار: 5%).
ـ قُدرت الفوائد الاقتصادية الصافية للعام 2005 لمزارعي المحاصيل المحورة وراثياً بنحو 6.2 مليار دولار أمريكي، والفوائد التراكمية للعقد (1996- 2006) بنحو 27 ملياراً.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تطبيقات أخرى
جدل ونقد
تُصنف المخاوف من استخدام الهندسة الوراثية في النبات والحيوان في ثلاث فئات:
أ - مخاوف بيئية: مثل الخوف من احتمال أن تقتل النباتات المقاومة للطفيليات أيضاً بعض الحشرات النافعة، أو أن ينتشر بعض المورثات المنقولة إلى نباتات معينة إلى نباتات أخرى مجاورة.
ب - مخاوف صحية: مثل احتمالات حدوث أمراض حساسية قد تكون شديدة حين تناول بعض الناس أغذية محتوية على مورثات معينة، مثل الفول السوداني البرازيلي الذي سبق الحديث عنه.
ج - مخاوف إقتصادية: إن إنتاج الكائنات المحورة وراثياً واختباراتها المختلفة يتطلب نفقات باهظة، ولأن الشركات التي أنتجتها ترغب في الحصول على أرباح وافرة، فإنها عادة تفرض أسعاراً باهظة لها أو لبذارها. ومن ثم فإن مزارعي البلدان الفقيرة، وهم الذين يفترض استفادتهم من هذه التقنية، لن يتمكنوا من استخدامها بسبب ارتفاع أسعارها.
يجب أن توجه جميع الجهود والإمكانات إلى تحسين إنتاج الغذاء وسلامته في الدول النامية ، وأن تهتم في الوقت ذاته بمعالجة مشكلات الفقر والبيئة المحلية والبنيات التحتية والاستقرار السياسي وأمور التجارة الدولية وغيرها، وأن يكون الاهتمام كبيراً بتقنيات التحوير الوراثي لتحسين الإنتاج الزراعي نوعاً وكماً في هذه الدول. ويُفترض أن تطبيق التقانات الحيوية في القطاع الزراعي سيؤدي إلى تحسين الأمن الغذائي عبر جعل الحاصلات الزراعية المختلفة أكثر تحملاً للمناخات والبيئات القاسية وشروط الترب المحلية وزيادة القدرة على مقاومة الحشرات والطفيليات وتحمل الشروط الغذائية الرديئة. وهذا يعني افتراض كون الحاصلات الزراعية المحورة وراثياً أكثر فائدة للمزارعين والفقراء في البلدان النامية.
يتوقع أن يزداد عدد سكان العالم زيادة ملحوظة في النصف الأول من القرن الواحد والعشرين، ويجب أن يرافق ذلك زيادة مناسبة في إنتاج الغذاء والعلف لتحقيق الأمن الغذائي الإنساني والحيواني. ولتحاشي الإضرار بالبيئة - الذي يمكن حدوثه فيما إذا كانت زيادة الغذاء ستتحقق على حساب الموارد البيئية الطبيعية بتحويلها إلى أراضٍ زراعية - فإنه لابد من تحقيق هذه الزيادة من الأراضي الزراعية المتوفرة حالياً، وهنا يبدو أن التقانات الحيوية، ومنها الهندسة الوراثية تمتلك إمكانات كبيرة للإسهام في تحقيق الأمن الغذائي وسلامة البيئة في البلدان كافة، ولاسيما النامية منها.
ومثل أي تقانة حديثة، فإن الهندسة الوراثية قد تمتلك أخطاراً ذاتية. ولابد من تقييم أمور سلامة الغذاء والبيئة على نحو علمي دقيق. إضافة إلى ذلك ضرورة إجراء التحاليل الاقتصادية للعائدات والكلف لتقييم الإمكانات الاقتصادية والاجتماعية لتطبيق تقانات حيوية معينة.
يبدو أن للهندسة الوراثية إمكانات واعدة كثيرة في البلدان النامية، إلا أن هنالك في الوقت ذاته عوائق عدة تصادف تقبلها وتنفيذها. وهذا أساساً عائد إلى عدم توفر القدرات البحثية والتقنية والمؤسساتية والتنظيمية في هذه البلدان.
إن من المؤكد أن تقبل المستهلك لأمر ما يرتبط ارتباطاً وثيقاً بمستوى تعليمه والإرشاد الذي يتلقاه، ويزداد بازديادهما. ولهذا فمن المتوقع أن تكون قرارات المستهلكين بالغة الأهمية في تفضيل زيادة استهلاك منتجات محوّرة غذائياً وسليمة.
انظر أيضا
- هندسة حيوية
- Marker assisted selection, a way to select suitable offspring without using genetic engineering
- Regulation of the release of genetic modified organisms
- Paratransgenesis
المصادر
- ^ "الهندسة الوراثية". الموسوعة العربية. Retrieved 2011-11-19.
{{cite web}}: Unknown parameter|Author=ignored (|author=suggested) (help) - ^ Jan Suszkiw (1999.). "Tifton, Georgia: A Peanut Pest Showdown". Agricultural Research magazine. Retrieved 2008-11-23.
{{cite web}}: Check date values in:|year=(help); Unknown parameter|month=ignored (help)
قراءات إضافية
- British Medical Association (1999). The Impact of Genetic Modification on Agriculture, Food and Health. BMJ Books. ISBN 0-7279-1431-6.
- Donnellan, Craig (2004). Genetic Modification (Issues). Independence Educational Publishers. ISBN 1-86168-288-3.
- Morgan, Sally (2003). Superfoods: Genetic Modification of Foods (Science at the Edge). Heinemann. ISBN 1-4034-4123-5.
- Smiley, Sophie (2005). Genetic Modification: Study Guide (Exploring the Issues). Independence Educational Publishers. ISBN 1-86168-307-3.
- Watson, James D. (2007). Recombinant DNA: Genes and Genomes: A Short Course. San Francisco: W.H. Freeman. ISBN 0-7167-2866-4.
- Zaid, A (2001). Glossary of Biotechnology for Food and Agriculture - A Revised and Augmented Edition of the Glossary of Biotechnology and Genetic Engineering. Available in English, French, Spanish, Arabic. روما، إيطاليا: FAO. ISBN 92-5-104683-2.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)
وصلات خارجية
- Genetic Engineering on In Our Time at the BBC. (listen now)
- GMO Safety - Information about research projects on the biological safety of genetically modified plants.
- Genetic Engineering A UK site for students, with case studies and ethical responses
- Introduction to Genetic Engineering Covers general information on Genetic Engineering including cloning, stem cells and DNA.
- European Food and Safety Authority
- GMO-compass, news on GMO en EU