تفاعل الپوليمريز المتسلسل
تفاعل الپوليمريز المتسلسل إنگليزية: Polymerase chain reaction و اختصاره PCR. هي عملية حيوية تهدف بالأساس لزيادة كمية الدنا الموجودة. تتم هذه العملية بصنع خليط من: دنا العينة، والإنزيمات، والنيوكليوتيدات والمشرعات وبعض المحاليل الأخرى بتراكيز مختلفة. ثم توضع في جهاز يقوم تلقائيا برفع درجة الحرارة وخفضها، وتكرار العملية تباعاً؛ حتى الوصول إلى تركيز أكبر من الدنا. وهو من الطرائق الهامة والشائعة في البيولوجيا الجزيئية المعاصرة. جاء اسمه من أحد مكوناته، وهو إنزيم پوليمريز الـDNA المستعمل في التنسُّخ الإنزيمي للـDNA. خلال التفاعل يخدم DNA مرصافاً لنفسه، فيحدث تفاعل تسلسلي حين تتضاعف كمية المرصاف وسرعة التفاعل مع كل طور، مما يسمح بالحصول على ملايين النسخ من سلسلة DNA خلال فترة وجيزة لتحليله.
تفاعل البوليميراز المتسلسل ( PCR ) هو طريقة تستخدم على نطاق واسع لجعل الملايين إلى مليارات النسخ من عينة معينة من الدنا بسرعة ، مما يسمح للعلماء بأخذ عينة صغيرة جدًا من الحمض النووي وتضخيمها إلى كمية كبيرة بما يكفي للدراسة بالتفصيل. تم اختراع تفاعل الپوليمريز المتسلسل في عام 1984 من قبل الكيميائي الحيوي الأمريكي كاري موليس في شركة سيتوس . إنه أساسي لكثير من الاختبارات الجينية بما في ذلك تحليل العينات القديمة من الدنا وتحديد العوامل المعدية. باستخدام تفاعل الپوليمريز المتسلسل ، يتم تضخيم نسخ كميات صغيرة جدًا من تسلسلات الحمض النووي بشكل كبير في سلسلة من دورات تغيرات درجة الحرارة. تفاعل الپوليمريز المتسلسل هو الآن أسلوب شائع ولا غنى عنه في كثير من الأحيان يستخدم في المختبرات الطبية والبحوث المخبرية السريرية لمجموعة واسعة من التطبيقات بما في ذلك البحوث الطبية الحيوية والطب الشرعي الجنائي.[1][2]
تعتمد غالبية طرق فاعل الپوليمريز المتسلسل على التدوير الحراري . تعرض الدورة الحرارية المواد المتفاعلة لدورات متكررة من التدفئة والتبريد للسماح بتفاعلات مختلفة تعتمد على درجة الحرارة - على وجه التحديد ، انصهار الدنا وتناسخ الحمض النووي الريبي منقوص الأكسجين المتحكم عن طريق الإنزيم . يستخدم تفاعل الپوليمريز المتسلسل كاشفين رئيسيين - المشرعات (وهي عبارة عن قطع شريط الدنا قصير واحد يعرف باسم قليل النوكليوتيد الذي هو تسلسل مكمل لمنطقة الدنا المستهدفة) و بوليميراز الدنا . في الخطوة الأولى من تفاعل البوليميراز المتسلسل ، يتم فصل شريطي الحلزون المزدوج للحمض النووي مادياً عند درجة حرارة عالية في عملية تسمى إفساد الدنا . في الخطوة الثانية ، تنخفض درجة الحرارة وترتبط المشرعات بالتسلسلات التكميلية للدنا. ثم أصبحت شرائط الدنا اثنين من القوالب لبلمرة الدنا إلى إنزيمي تجميع شريط الدنا الجديد من النيوكليوتيدات الحرة ، لبنات جزيئات الدنا. مع تقدم تفاعل الپوليمريز المتسلسل ، يتم استخدام الدنا المولّد نفسه كقالب للنسخ المتماثل ، مما يؤدي إلى تنشيط تفاعل تسلسلي يتم فيه تضخيم قالب الدنا الأصلي بشكل كبير .
تستخدم جميع تطبيقات تفاعل الپوليمريز المتسلسل تقريبًا بوليميراز الدنا المستقر بالحرارة ، مثل پوليمريز المستحرة المائية ، وهو إنزيم معزول في الأصل عن البكتيريا المحبة للحرارة المستحرة المائية . إذا كانت البلمرة المستخدمة عرضة للحرارة ، فسوف ينجرف تحت درجات الحرارة العالية لخطوة التمسخ. قبل استخدام پوليمريز المستحرة المائية ، كان يجب إضافة بوليميراز الدنا يدويًا في كل دورة ، والتي كانت عملية شاقة ومكلفة.[3]
تشمل تطبيقات التقنية استنساخ الدنا من أجل التسلسل ، واستنساخ الجينات ومعالجتها ، وتطفير الجينات ؛ بناء شجرة المحتد المستندة إلى الدنا، أو التحليل الوظيفي للجينات ؛ تشخيص ورصد الأمراض الوراثية ؛ تضخيم الحمض النووي القديم ;[4] تحليل البصمات الوراثية لتنميط الدنا (على سبيل المثال ، في علم الطب الشرعي واختبار النسب ) ؛ والكشف عن الممراض في اختبارات الدنا لتشخيص الأمراض المعدية

. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
مبادئ تفاعل الپوليمريز المتسلسل وطريقة الإجراء


يضخم تفاعل الپوليمريز المتسلسل منطقة معينة من شريط الدنا (الدنا المستهدف). تضخم معظم طرق تفاعل الپوليمريز المتسلسل اجزاء الدنا التي يتراوح طولها بين 0.1 و 10 كيلو زوج قاعدي (kbp) ، على الرغم من أن بعض التقنيات تسمح بتضخيم اجزاء تصل إلى 40 كيلو زوج قاعدي kbp .[5] يتم تحديد كمية المنتج المضخم بواسطة الركائز المتاحة في التفاعل ، والتي تصبح محدودة مع تقدم التفاعل .[6]
يتطلب إعداد تفاعل الپوليمريز المتسلسل الأساسي العديد من المكونات والكواشف ,[7] بما في ذلك:
- قالب DNA يحتوي على منطقة الدنا المستهدفة لتضخيمها
- بوليميراز الدنا . إنزيم بلمرة شرائط دنا جديدة ؛ پوليمريز المستحرة المائية المقاوم للحرارة شائع بشكل خاص,[8] لأنه من المرجح أن يظل سليماً أثناء عملية إفساد الدنا ذات درجة الحرارة العالية
- اثنين من المشرعات الدنا المتممة للنهايات 3 '' (ثلاث مراحل رئيسية) لكل من نهاية نفس الاتجاة او الاتجاه المعاكس لشرائط الحمض النووي المستهدف (يمكن أن يرتبط بوليميراز الحمض النووي ويستطيل فقط من منطقة الشرائط المزدوجة من الحمض النووي ؛ بدون مشرع هناك لا يوجد موقع بدء مزدوج الشرائط حيث يمكن أن يرتبط البوليميراز) [9] يتم اختيار المشرعات المحددة المكملة للمنطقة المستهدفة للدنا مسبقًا ، وغالبًا ما يتم تصنيعها بشكل مخصص في المختبر أو شراؤها من موردي الكيمياء الحيوية التجاريين
- دي أوكسي نيوكليوزيد ثلاثي الفوسفات ، أو dNTPs (يسمى أحيانًا "دي أوكسي نيوكليوتايد ثلاثي الفوسفات" ؛ النيوكليوتيدات التي تحتوي على مجموعات ثلاثي الفوسفات) ، وهي اللبنات التي يقوم منها بوليميراز الدنا بتوليف شريط دنا جديد
- محلول منظم يوفر بيئة كيميائية مناسبة للنشاط الأمثل والاستقرار لبوليميراز الدنا
- الهوابط ثنائية التكافؤ ، عادة أيونات المغنيسيوم (Mg) أو المنجنيز (Mn) ؛ Mg 2+ هو الأكثر شيوعًا ، ولكن يمكن استخدام Mn 2+ في الطفرات الوراثية للوسيط بواسطة تفاعل الپوليمريز المتسلسل ، حيث يزيد التركيز Mn 2+ الأعلى من معدل الخطأ أثناء تخليق الدنا [10] والهوابط أحادية التكافؤ ، أيونات البوتاسيوم (K)
عادة ما يتم التفاعل في حجم 10-200 ميكرولتر في أنابيب التفاعل الصغيرة (0.2-0.5 مل الأحجام) في المدورالحراري . يقوم المدور الحراري بتسخين وتبريد أنابيب التفاعل لتحقيق درجات الحرارة المطلوبة في كل خطوة من خطوات التفاعل (انظر أدناه). تستخدم العديد من أجهزة التدوير الحرارية الحديثة تأثير بلتيير ، الذي يسمح بتسخين وتبريد الكتلة التي تمسك أنابيب تفاعل الپوليمريز المتسلسل ببساطة عن طريق عكس التيار الكهربائي. تسمح أنابيب التفاعل ذات الجدران الرقيقة بالتوصيل الحراري المناسب للسماح بالموازنة الحرارية السريعة. تحتوي معظم أجهزة التدوير الحرارية على أغطية ساخنة لمنع التكثف في الجزء العلوي من أنبوب التفاعل. تتطلب أجهزة التدوير الحرارية القديمة التي تفتقر إلى غطاء ساخن طبقة من الزيت فوق خليط التفاعل أو كرة من الشمع داخل الأنبوب.
الاجراء

عادة ، يتكون تفاعل الپوليمريز المتسلسل من سلسلة من 20-40 تغيرات متكررة في درجة الحرارة ، تسمى الدورات الحرارية ، وتتكون كل دورة بشكل شائع من خطوتين أو ثلاث درجات حرارة منفصلة (انظر الشكل أدناه). غالبًا ما يسبق التدوير خطوة درجة حرارة واحدة عند درجة حرارة عالية جدًا (> 90 °C (194 °F) ، ويتبعها تعليق واحد في النهاية للتمديد النهائي للمنتج أو التخزين القصير. تعتمد درجات الحرارة المستخدمة وطول المدة التي يتم تطبيقها فيها في كل دورة على مجموعة متنوعة من المتثابتات ، بما في ذلك الإنزيم المستخدم في تخليق الدنا ، وتركيز الأيونات ثنائية التكافؤ و dNTPs في التفاعل ، ودرجة حرارة الانصهار ( T m )للمشرعات.[11] الخطوات الفردية الشائعة لمعظم طرق تفاعل الپوليمريز المتسلسل هي كما يلي:
- التهيئة : هذه الخطوة مطلوبة فقط لبوليمرات الدنا التي تتطلب التنشيط الحراري بواسطة تفاعل الپوليمريز المتسلسل البادئ .[12]وتتكون من تسخين غرفة التفاعل إلى درجة حرارة 94–96 °C (201–205 °F) ، أو 98 °C (208 °F) إذا تم استخدام بلمرات شديدة الحرارة ، يتم الاحتفاظ بها بعد ذلك لمدة 1-10 دقائق.
- الإفساد: هذه الخطوة هي أول دورة تدوير منتظمة وتتكون من تسخين غرفة التفاعل إلى 94–98 °C (201–208 °F) لمدة 20-30 ثانية. يؤدي هذا إلى ذوبان الدنا ، أو إفساد ، من قالب الدنا مزدوج الشرائط عن طريق كسر روابط الهيدروجين بين القواعد التكميلية ، مما ينتج جزيئين من الدنا أحادي الشريط.
- التلدين : في الخطوة التالية ، تنخفض درجة حرارة التفاعل إلى 50–65 °C (122–149 °F) لمدة 20-40 ثانية ، مما يسمح بتلديين المشرعات إلى كل من قوالب الدنا أحادية الشريط. عادة ما يتم تضمين اثنين من المشرعات المختلفة في خليط التفاعل: واحد لكل من المتممات الذين تقطعت بهم السبل واحد يحتوي على المنطقة المستهدفة. المشرعات هي شرائط مفردة السلاسل نفسها ، ولكنها أقصر بكثير من طول المنطقة المستهدفة ، تكمل فقط تسلسلات قصيرة جدًا في نهاية 3 'من كل شريط.
- من الضروري تحديد درجة حرارة مناسبة لخطوة التلدين لأن الكفاءة والخصوصية تتأثر بشدة بدرجة حرارة التلدين. يجب أن تكون درجة الحرارة هذه منخفضة بما يكفي للسماح بتهجين المشرع إلى الشريط ، ولكنها مرتفعة بما يكفي ليكون التهجين محددًا ، أي يجب أن يرتبط المشرع فقط بجزء مكمل تمامًا من الشريط ، وليس في أي مكان آخر. إذا كانت درجة الحرارة منخفضة جدًا ، فقد يكون المشرع غير كامل. إذا كانت عالية جدًا ، فقد لا يلتصق المشرع على الإطلاق. تبلغ درجة حرارة التلدين النموذجية حوالي 3-5 ° C أقل من درجة الانصهار م من المشرعات المستخدمة. لا تتكون روابط الهيدروجين المستقرة بين القواعد التكميلية إلا عندما يتطابق تسلسل المشرع مع تسلسل القالب. خلال هذه الخطوة ، يرتبط البلمرة بالهجين القالب المشرع ويبدأ في تكوين الدنا
- التمديد / الاستطالة : تعتمد درجة الحرارة في هذه الخطوة على بوليميراز الدنا المستخدم ؛ درجة حرارة النشاط المثلى لبوليميراز الدنا للحرارة من البلمرة پوليمريز المستحرة المائية حوالي 75–80 °C (167–176 °F) [13][14] علي الرغم من ان درجة حرارة 72 °C (162 °F) شائعة الاستخدام مع هذا الإنزيم. في هذه الخطوة ، يقوم بوليميراز الدنا بتكوين شريط الدنا جديد مكمل لشريط قالب الدنا عن طريق إضافة dNTPs حرة من خليط التفاعل المكمّل للقالب في الاتجاه من 5 إلى 3 ، مما يكثف مجموعة 5'- الفوسفات من dNTPs مع مجموعة 3'- هيدروكسي في نهاية شريط الدنا الوليد (الممدود). يعتمد الوقت الدقيق المطلوب للاستطالة على بوليميراز الدنا المستخدم وعلى طول المنطقة المستهدفة في الدنا لتضخيمها. كقاعدة عامة ، عند درجة الحرارة المثلى ، تبلمر معظم بلمرة الدنا ألف قاعدة في الدقيقة. في ظل الظروف المثلى (على سبيل المثال ، إذا لم تكن هناك قيود بسبب الحد من الركائز أو الكواشف) ، في كل خطوة تمديد / استطالة ، يتم مضاعفة عدد التسلسلات المستهدفة للدنا. مع كل دورة متتالية ، تصبح شرائط القالب الأصلية بالإضافة إلى جميع الشرائط التي تم إنشاؤها حديثًا شرائط قالب للجولة التالية من الاستطالة ، مما يؤدي إلى تضخيم أسي (هندسي) لمنطقة الحمض النووي المستهدفة المحددة.
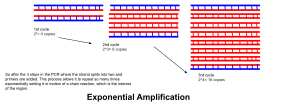
- تشكل عمليات الإفساد والتمديد والتصليب دورة واحدة. تحصل الدورات المتعددة عندما يستوجب تضخيم منطقة الدنا المستهدفة إلى ملايين النسخ. الصيغة المستخدمة لحساب عدد نسخ الدنا المتشكلة بعد عدد معين من الدورات هي 2n، حيث n هو عدد الدورات. ومن ثم فإن التفاعل الذي يحصل على 30 دورة ينتج عنه 230، أو 1073741824، نسخة من منطقة الدنا ثنائي الشريط المستهدف.
- الاستطالة النهائية : هذه الخطوة الفردية اختيارية ، ولكن يتم تنفيذها عند درجة حرارة 70–74 °C (158–165 °F) (نطاق درجة الحرارة المطلوب للنشاط الأمثل لمعظم البوليمرات المستخدمة في تفاعل البوليميراز المتسلسل) لمدة 5-15 دقيقة بعد دورة تفاعل البوليميراز المتسلسل الأخيرة لضمان إطالة أي شريط دنا مفرد متبقي عالق بالكامل.
- التعليق النهائي : الخطوة الأخيرة تبرد غرفة التفاعل إلى 4–15 °C (39–59 °F) لفترة غير محددة ، ويمكن استخدامها للتخزين قصير المدى لمنتجات ال تفاعل الپوليمريز المتسلسل

للتحقق ما إذا كان ال PCR ولد المنطقة المتوقعة المستهدفة في الدنا بنجاح (كما يشار إليها أحيانا باسم المكبر أو أمبليكون )، الرحلان الكهربائي باستخدام جيل الأغاروز يمكن أن تستخدم لفصل حجم المنتجات ال PCR. يتم تحديد حجم (أحجام) منتجات ال PCR عن طريق المقارنة مع سلم الدنا ، علامة الوزن الجزيئي التي تحتوي على أجزاء الدنا ذات الحجم المعروف التي تعمل على الجل إلى جانب منتجات ال PCR.
المراحل
كما هو الحال مع التفاعلات الكيميائية الأخرى ، يتأثر معدل التفاعل وكفاءة تفاعل البوليميراز المتسلسل بعوامل محددة. وبالتالي ، يمكن تقسيم عملية تفاعل الپوليمريز المتسلسل بالكامل إلى ثلاث مراحل بناءً على تقدم التفاعل:
- تضخيم أسي : في كل دورة ، يتم مضاعفة كمية المنتج (بافتراض كفاءة رد فعل 100 ٪). بعد 30 دورة ، يمكن زيادة نسخة واحدة من الدنا حتى 1،000،000،000 (مليار) نسخة. بمعنى ما ، يتم التلاعب في تكرار سلسلة منفصلة من الدنا في أنبوب تحت ظروف خاضعة للرقابة.[15] التفاعل حساس للغاية: يجب أن تكون الكميات الدقيقة فقط من ادنا موجودة.
- مرحلة التسوية : يتباطأ التفاعل مع فقدان بوليميراز الدنا للنشاط ، كما يؤدي استهلاك الكواشف ، مثل dNTPs والمشرعات ، إلى جعلها أكثر محدودية
- الاستقرار: لا يتراكم المزيد من المنتجات بسبب استنفاد الكواشف والإنزيم.
التحسين
من الناحية العملية ، يمكن أن يفشل تفاعل البوليميراز المتسلسل (PCR) لأسباب مختلفة ، ويرجع ذلك جزئيًا إلى حساسيته للتلوث مما يؤدي إلى تضخيم منتجات الدنا الزائفة. وبسبب هذا ، تم تطوير عدد من التقنيات والإجراءات لتحسين ظروف تفاعل الپوليمريز المتسلسل [16][17] يتم توجيه التلوث بالدنا الدخيل من خلال بروتوكولات وإجراءات المختبر التي تفصل مخاليط ما قبل تفاعل البوليميراز المتسلسل من ملوثات الدنا المحتملة.[7] يتضمن هذا عادةً الفصل المكاني لمناطق إعداد ال PCR من مناطق لتحليل أو تنقية منتجات PCR ، واستخدام المواد البلاستيكية التي تستخدم لمرة واحدة ، وتنظيف سطح العمل تمامًا بين إعدادات التفاعل. تعتبر تقنيات التصميم التمهيدي مهمة في تحسين إنتاجية منتج ال PCR وتجنب تكوين منتجات زائفة ، ويمكن أن يساعد استخدام مكونات العازلة البديلة أو إنزيمات البلمرة في تضخيم مناطق طويلة أو خلاف ذلك من الدنا. قد تؤدي إضافة الكواشف ، مثل فورماميد ، في الأنظمة العازلة إلى زيادة خصوصية وإنتاج ال PCR.[18]يمكن إجراء المحاكاة الحاسوبية لنتائج تفاعل الپوليمريز المتسلسل النظرية ( تفاعل الپوليمريز المتسلسل الإلكتروني ) للمساعدة في تصميم المشرع.[19]
الاستخدام
عزل الحمض النووي الانتقائي
يسمح PCR بعزل أجزاء الدنا من الدنا الجينومي من خلال التضخيم الانتقائي لمنطقة معينة من الدنا. يزيد هذا الاستخدام من تفاعل البوليميراز المتسلسل (PCR) من عدة طرق ، مثل توليد مسبارات التهجين للتهجين الجنوبي أو الشمالي واستنساخ الدنا ، والتي تتطلب كميات أكبر من الدنا ، تمثل منطقة معينة من الدنا. يزود ال PCR هذه التقنيات بكميات كبيرة من الدنا النقي ، مما يتيح تحليل عينات الدنا حتى من كميات صغيرة جدًا من مادة البدء.
تتضمن التطبيقات الأخرى لـ تفاعل الپوليمريز المتسلسل تسلسل الدنا لتحديد تسلسل مضخم تفاعل الپوليمريز المتسلسل غير معروف حيث يمكن استخدام أحد مشرعات التضخيم في تسلسل Sanger ، وعزل تسلسل الدنا لتسريع تقنيات الحمض النووي المؤتلف التي تنطوي على إدخال تسلسل الدنا في البلازميد ، والعاثية ، أو كوزميد (حسب الحجم) أو المادة الوراثية لكائن آخر. يمكن فحص المستعمرات البكتيرية (مثل الإشريشيا معوية ) بسرعة عن طريق تفاعل البوليميراز المتسلسل من أجل تركيب ناقلات الحمض النووي الصحيحة.[20] يمكن أيضًا استخدام تفاعل الپوليمريز المتسلسل للبصمات الوراثية ؛ تقنية الطب الشرعي المستخدمة لتحديد الشخص أو الكائن الحي من خلال مقارنة الحمض النووي التجريبي من خلال الأساليب المختلفة القائمة على تفاعل الپوليمريز المتسلسل.
تتمتع بعض طرق "بصمات الأصابع" في تفاعل الپوليمريز المتسلسل بقوة تمييزية عالية ويمكن استخدامها لتحديد العلاقات الجينية بين الأفراد ، مثل الوالدين والطفل أو بين الأشقاء ، ويتم استخدامها في اختبار الأبوة (الشكل 4). يمكن استخدام هذه التقنية أيضًا لتحديد العلاقات التطورية بين الكائنات الحية عند استخدام ساعات جزيئية معينة (على سبيل المثال ، 16S rRNA وجينات recA للكائنات الحية الدقيقة.[21]
تضخيم وتحديد الحمض النووي
لأن ال PCR يضخم مناطق الحمض النووي التي يستهدفها ، يمكن استخدام تفاعل الپوليمريز المتسلسل لتحليل كميات صغيرة للغاية من العينة. هذا أمر بالغ الأهمية في كثير من الأحيان لتحليل الطب الشرعي ، عندما يتوفر فقط كمية ضئيلة من الحمض النووي كدليل. يمكن أيضًا استخدام تفاعل الپوليمريز المتسلسل في تحليل الحمض النووي القديم الذي يعود تاريخه إلى عشرات الآلاف من السنين. تم استخدام هذه التقنيات المستندة إلى تفاعل الپوليمريز المتسلسل بنجاح على الحيوانات ، مثل الماموث البالغ من العمر أربعين ألف عامًا ، وكذلك على الحمض النووي البشري ، في تطبيقات تتراوح من تحليل المومياوات المصرية إلى تحديد القيصر الروسي وجسم الملك الإنجليزي ريتشارد الثالث.[22]
تسمح طرق تفاعل الپوليمريز المتسلسل الكمي أو تفاعل الپوليمريز المتسلسل بالزمن الحقيقي (qPCR) ,[23] بعدم الخلط بينه وبين تفاعل البوليمراز المتسلسل للنسخ العكسي ) بتقدير كمية تسلسل معين موجود في العينة - وهي تقنية غالبًا ما يتم استخدامها لتحديد مستويات التعبير الجيني كمياً. ال تفاعل الپوليمريز المتسلسل الكمي هو أداة راسخة لقياس كمية الحمض النووي التي تقيس تراكم منتج الحمض النووي بعد كل جولة من تضخيم تفاعل الپوليمريز المتسلسل.
يسمح qPCR بالتحديد الكمي لكشف تسلسل دنا معين وكشفه في الوقت الفعلي لأنه يقيس التركيز أثناء عملية التوليف. هناك طريقتان للكشف المتزامن والقياس الكمي. تتكون الطريقة الأولى من استخدام الأصباغ الفلورية التي يتم الاحتفاظ بها بشكل غير محدد بين الشرائط المزدوجة. تشتمل الطريقة الثانية على مسبارات تقوم بتشفير تسلسلات محددة ويتم تمييزها بشكل فلوري. لا يمكن رؤية الكشف عن الحمض النووي باستخدام هذه الطرق إلا بعد تهجين المسبارات باستخدام الحمض النووي التكميلي. مزيج من التقنيات المثيرة للاهتمام هو تفاعل الپوليمريز المتسلسل يالزمن الحقيقي والنسخ العكسي. تسمح هذه التقنية المتطورة ، المسماة RT-qPCR ، بتحديد كمية صغيرة من الرنا. من خلال هذه التقنية المدمجة ، يتم تحويل مرسال الحمض الريبي النووي إلى دنا مكمل ، والذي يتم قياسه باستخدام qPCR. تقلل هذه التقنية من احتمالية الخطأ عند نقطة نهاية تفاعل البوليميراز المتسلسل,[24] مما يزيد من فرص اكتشاف الجينات المرتبطة بالأمراض الجينية مثل السرطان .[4] تستخدم المختبرات RT-qPCR لغرض قياس تنظيم الجينات بحساسية .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التطبيقات الطبية والتشخيصية
يمكن اختبار الآباء المحتملين لكونهم حاملين وراثيين، أو قد يخضع أطفالهم للفحص في حال كونهم مصابين فعلياً بأحد الأمراض. يمكن الحصول على عينات الدنا لفحص ما بعد الولادة عن طريق البذل السلي amniocentesis، فحص الزغابات المشيمية chorionic villus sampling، أو حتى عن طريق تحليل خلايا الجنين النادرة المنتشرة في مجرى دم الأم. كما يعتبر تحليل تفاعل الپوليمريز المتسلسل(PCR) أساسياً للتحليل الوراثي السابق للانغراس، حيث يتم اختبار الخلايا الفردية للجنين النامي بحثاً عن طفرات.
- قد يستخدم تحليل الپي سي آر أيضاً كجزء من اختبار الحساسية للتطابق النسيجي، الذي يعتبر أساسياً لزراعة الأعضاء. اعتباراً من 2008، كان هناك مقترحاً باستبدال الفحوصات التقليدية المعتمدة على الأجسام المضادة لفصيلة الدم بفحوصات تعتمد على تفاعل الپوليمريز المتسلسل (PCR).[25]
- تتضمن العديد من أشكال السرطان تعديلات على الجينات السرطانية. باستخدام الاختبارات المستندة إلى تفاعل الپوليمريز المتسلسل(PCR) لدراسة هذه الطفرات ، يمكن في بعض الأحيان تخصيص أنظمة العلاج بشكل فردي للمريض. يسمح تفاعل الپوليمريز المتسلسل(PCR)بالتشخيص المبكر للأمراض الخبيثة مثل ابيضاض الدم و لمفومة، والتي تعد حاليًا الأعلى تطورًا في أبحاث السرطان ويتم استخدامها بالفعل بشكل روتيني. يمكن إجراء فحوصات تفاعل الپوليمريز المتسلسل (PCR) مباشرة على عينات الحمض النووي الجيني للكشف عن الخلايا الخبيثة الخاصة بنقل الدم بحساسية أعلى بما لا يقل عن 10000 مرة من تلك الموجودة في الطرق الأخرى[26] تفاعل الپوليمريز المتسلسل(PCR) مفيد للغاية في المجال الطبي لأنه يسمح بعزل وتضخيم مثبطات الورم. يمكن استخدام تفاعل الپوليمريز المتسلسل (PCR) الكمي ، على سبيل المثال ، لقياس وتحليل الخلايا المفردة ، بالإضافة إلى التعرف على تأكيدات وتركيبات الدنا (DNA) و مرسال الحمض النووي الريبي(mRNA) والبروتين.
التطبيقات في مجال الأمراض المعدية
يسمح تفاعل البوليميريز المتسلسل (PCR) بالتشخيص السريع والدقيق للغاية للأمراض المعدية ، بما في ذلك الأمراض التي تسببها البكتيريا أو الفيروسات.[27] يسمح تفاعل الپوليمريز المتسلسل(PCR) أيضًا بتحديد الكائنات الحية الدقيقة غير القابلة للزراعة أو الميكروبات بطيئة النمو مثل المتفطرات و جراثيم لاهوائية أو الفيروسات من فحوصات زراعة الأنسجة والنماذج الحيوانية. أساس التطبيقات التشخيصية لتفاعل الپوليمريز المتسلسل(PCR)في علم الأحياء الدقيقة هو الكشف عن العوامل المعدية والتمييز بين السلالات الغير ممرضة من السلالات الممرضة بحكم جينات محددة.[27][28]
أحدثت عملية الكشف عن الكائنات الحية المعدية وكشفها ثورة في تفاعل الپوليمريز المتسلسل(PCR) بالطرق التالية:
- ڤيروس نقص المناعة البشرية (أو متلازمة نقص المناعة المكتسبة) ، هدف صعب العثور عليه والقضاء عليه. اعتمدت الاختبارات المبكرة للعدوى على وجود أجسام مضادة للفيروس منتشر في مجرى الدم. ومع ذلك ، لا تظهر الأجسام المضادة حتى أسابيع عديدة بعد الإصابة ، والأجسام المضادة للأمهات تغطي علي إصابة المولود بالعدوي ، ولا تؤثر العوامل العلاجية لمحاربة العدوى على الأجسام المضادة. تم تطوير اختبارات تفاعل الپوليمريز المتسلسل(PCR) التي يمكنها اكتشاف ما لا يقل عن جينوم فيروسي واحد بين الحمض النووي لأكثر من 50000 خلية مضيفة.[29] يمكن الكشف عن العدوى في وقت مبكر ، ويمكن فحص الدم الخاص بالمتبرع مباشرة لوجود الفيروس ، ويمكن فحص الأطفال حديثي الولادة على الفور للعدوى ، ويمكن قياس آثار العلاجات المضادة للفيروسات .
- يصعب أخذ عينات من بعض الكائنات الحية المسببة للمرض ، مثل السل ، من المرضى ويتباطأ نموها في المختبر. سمحت الاختبارات القائمة على تفاعل الپوليمريز المتسلسل(PCR) للكشف عن أعداد صغيرة من الكائنات الحية (سواء الحية أو الميتة) ، في عينات مناسبة. يمكن أيضًا استخدام التحليل الجيني المفصل للكشف عن مقاومة المضادات الحيوية ، مما يسمح بالعلاج الفوري والفعال. يمكن أيضًا تقييم آثار العلاج على الفور.
- يمكن مراقبة انتشار كائن حي ممرض من خلال تجمعات الحيوانات الأليفة أو البرية عن طريق اختبار تفاعل الپوليمريز المتسلسل(PCR). في كثير من الحالات ، يمكن الكشف عن ظهور أنواع فرعية جديدة خبيثة ومراقبتها. يمكن أيضًا تحديد الأنواع الفرعية للكائن المسؤول عن الأوبئة المبكرة عن طريق تحليل تفاعل الپوليمريز المتسلسل(PCR).
- يمكن الكشف عن الحمض النووي الفيروسي بواسطة تفاعل الپوليمريز المتسلسل(PCR). يجب أن تكون البادئات المستخدمة خاصة بالتسلسلات المستهدفة في الحمض النووي (الدنا)للفيروس ، ويمكن استخدام تفاعل الپوليمريز المتسلسل(PCR) للتحليل التشخيصي أو تسلسل الحمض النووي للجينوم الفيروسي. تسمح الحساسية العالية لتفاعل الپوليمريز المتسلسل(PCR) باكتشاف الفيروس بعد فترة وجيزة من الإصابة وحتى قبل ظهور المرض.[30] قد يمنح هذا الكشف المبكر الأطباء مهلة زمنية كبيرة في العلاج. يمكن أيضًا قياس كمية الفيروس ("الحمل الفيروسي") في المريض من خلال تقنيات قياس الحمض النووي القائمة على تفاعل الپوليمريز المتسلسل(PCR) (انظر أدناه).
- أمراض مثل الشاهوق (أو السعال الديكي) تسببها بكتيريا بورديتيلة السعال الديكي. تتميز هذه البكتيريا بعدوى تنفسية حادة خطيرة تصيب العديد من الحيوانات والبشر وتؤدي إلى وفاة العديد من الأطفال الصغار. سم السعال الديكي هو بروتين خارجي يرتبط بمستقبلات الخلايا بعاملين ويتفاعل مع أنواع مختلفة من الخلايا مثل الخلايا اللمفاوية التائية التي تلعب دورًا في مناعة الخلايا.[31] تفاعل الپوليمريز المتسلسل(PCR) هو أداة اختبار مهمة يمكنها اكتشاف التسلسلات الموجودة داخل جين سم السعال الديكي. هذا لأن تفاعل الپوليمريز المتسلسل(PCR) لديه حساسية عالية للسموم وقد أظهر وقت استجابة سريع. تفاعل الپوليمريز المتسلسل(PCR) فعال جدا لتشخيص السعال الديكي عند مقارنته بالزراعة.[32]
تطبيقات الطب الشرعي
شهد تطوير بروتوكولات بصمات الأصابع الجينية (أو الدنا ) القائمة على PCR تطبيقًا واسعًا في الطب الشرعي :
- في أكثر أشكالها تميزًا ، يمكن أن تميز البصمات الوراثية بشكل فريد أي شخص من جميع سكان العالم . يمكن عزل عينات دقيقة من الحمض النووي من مسرح الجريمة ، ومقارنتها مع المشتبه بهم ، أو من قاعدة بيانات الحمض النووي للأدلة السابقة أو المدانين. غالبًا ما تُستخدم الإصدارات الأبسط من هذه الاختبارات لاستبعاد المشتبه بهم بسرعة أثناء التحقيق الجنائي. يمكن اختبار الأدلة المستمدة من الجرائم التي استمرت لعقود ، وتأكيد أو تبرئة الأشخاص المدانين أصلاً.
- لقد كان تنميط الحمض النووي للطب الشرعي طريقة فعالة لتحديد أو تبرئة المشتبهين الجنائيين بسبب تحليل الأدلة المكتشفة في مسرح الجريمة. يحتوي الجينوم البشري على العديد من المناطق المتكررة التي يمكن العثور عليها في تسلسل الجينات أو في المناطق غير المشفرة من الجينوم. على وجه التحديد ، ما يصل إلى 40 ٪ من الحمض النووي البشري متكرر.[4] هناك فئتان مميزتان لهذه المناطق المتكررة غير المشفرة في الجينوم. تسمى الفئة الأولى التكرارات الترادفية ذات الرقم المتغير (VNTR) ، والتي يتراوح طولها بين 10-100 زوج أساسي وتسمى الفئة الثانية التكرارات الترادفية القصيرة (STR) وتتكون من أقسام زوجية أساسية متكررة 2-10. يستخدم تفاعل الپوليمريز المتسلسل لتضخيم العديد من VNTRs و STRs المعروفة باستخدام المشرع الذي يحيط بكل منطقة متكررة. ستشير أحجام الاجزاء التي تم الحصول عليها من أي فرد لكل من تقارير المعاملات المشبوهة إلى الأليلات الموجودة. من خلال تحليل العديد من تقارير المعاملات المشبوهة للفرد ، سيتم العثور على مجموعة من الأليلات لكل شخص أنه من المحتمل إحصائيًا أن يكون فريدًا.[4] حدد الباحثون التسلسل الكامل للجينوم البشري. يمكن الوصول إلى هذا التسلسل بسهولة من خلال موقع NCBI ويستخدم في العديد من التطبيقات الواقعية. على سبيل المثال ، قام مكتب التحقيقات الفدرالي بتجميع مجموعة من مواقع علامات الحمض النووي المستخدمة في تحديد الهوية ، وتسمى هذه قاعدة بيانات الحمض النووي لنظام فهرس الحمض النووي المشترك (CODIS) [4]يمكّن استخدام قاعدة البيانات هذه من استخدام التحليل الإحصائي لتحديد احتمال تطابق عينة من الحمض النووي. تفاعل الپوليمريز المتسلسل هو أداة تحليلية قوية ومهمة للغاية لاستخدامها في تنميط الطب الشرعي للحمض النووي لأن الباحثين يحتاجون فقط إلى كمية صغيرة جدًا من الحمض النووي المستهدف لاستخدامها في التحليل. على سبيل المثال ، يحتوي شعر بشري واحد مع بصيلات شعر ملحقة على ما يكفي من الحمض النووي لإجراء التحليل. وبالمثل ، يمكن أن يوفر عدد قليل من الحيوانات المنوية وعينات الجلد من تحت الأظافر أو كمية صغيرة من الدم ما يكفي من الحمض النووي للتحليل القاطع.[4]
- أقل الاشكال تمييزًا بصمة الحمض النووي يمكن أن تساعد في اختبار الأبوة بالدنا ، حيث يتطابق الفرد مع أقاربهم. يمكن اختبار الحمض النووي من بقايا بشرية مجهولة الهوية ومقارنتها بالآباء أو الأشقاء أو الأطفال المحتملين. يمكن استخدام اختبار مماثل لتأكيد الوالدين البيولوجيين لطفل تم تبنيه (أو اختطافه). يمكن أيضًا تأكيد الأب البيولوجي الفعلي لحديثي الولادة (أو استبعاده).
- لقد ثبت أن تصميم PCR AMGX / AMGY ليس فقط تسهيل تضخيم تسلسلات الحمض النووي من كمية ضئيلة جدًا من الجينوم. ومع ذلك ، يمكن استخدامه أيضًا لتحديد الجنس في الوقت الحقيقي من عينات عظام الطب الشرعي. وهذا يوفر لنا طريقة قوية وفعالة لتحديد جنس العينات القديمة فقط ولكن أيضًا المشتبه بهم الحاليين في الجرائم.[33]
أحدثت عملية الكشف عن الكائنات الحية المعدية وكشفها ثورة في تفاعل الپوليمريز المتسلسل(PCR) بالطرق التالية:
- ڤيروس نقص المناعة البشرية (أو متلازمة نقص المناعة المكتسبة) ، هدف صعب العثور عليه والقضاء عليه. اعتمدت الاختبارات المبكرة للعدوى على وجود أجسام مضادة للفيروس منتشر في مجرى الدم. ومع ذلك ، لا تظهر الأجسام المضادة حتى أسابيع عديدة بعد الإصابة ، والأجسام المضادة للأمهات تغطي علي إصابة المولود بالعدوي ، ولا تؤثر العوامل العلاجية لمحاربة العدوى على الأجسام المضادة. تم تطوير اختبارات تفاعل الپوليمريز المتسلسل(PCR) التي يمكنها اكتشاف ما لا يقل عن جينوم فيروسي واحد بين الحمض النووي لأكثر من 50000 خلية مضيفة.[34] يمكن الكشف عن العدوى في وقت مبكر ، ويمكن فحص الدم الخاص بالمتبرع مباشرة لوجود الفيروس ، ويمكن فحص الأطفال حديثي الولادة على الفور للعدوى ، ويمكن قياس آثار العلاجات المضادة للفيروسات .
- يصعب أخذ عينات من بعض الكائنات الحية المسببة للمرض ، مثل السل ، من المرضى ويتباطأ نموها في المختبر. سمحت الاختبارات القائمة على تفاعل الپوليمريز المتسلسل(PCR) للكشف عن أعداد صغيرة من الكائنات الحية (سواء الحية أو الميتة) ، في عينات مناسبة. يمكن أيضًا استخدام التحليل الجيني المفصل للكشف عن مقاومة المضادات الحيوية ، مما يسمح بالعلاج الفوري والفعال. يمكن أيضًا تقييم آثار العلاج على الفور.
- يمكن مراقبة انتشار كائن حي ممرض من خلال تجمعات الحيوانات الأليفة أو البرية عن طريق اختبار تفاعل الپوليمريز المتسلسل(PCR). في كثير من الحالات ، يمكن الكشف عن ظهور أنواع فرعية جديدة خبيثة ومراقبتها. يمكن أيضًا تحديد الأنواع الفرعية للكائن المسؤول عن الأوبئة المبكرة عن طريق تحليل تفاعل الپوليمريز المتسلسل(PCR).
- يمكن الكشف عن الحمض النووي الفيروسي بواسطة تفاعل الپوليمريز المتسلسل(PCR). يجب أن تكون البادئات المستخدمة خاصة بالتسلسلات المستهدفة في الحمض النووي (الدنا)للفيروس ، ويمكن استخدام تفاعل الپوليمريز المتسلسل(PCR) للتحليل التشخيصي أو تسلسل الحمض النووي للجينوم الفيروسي. تسمح الحساسية العالية لتفاعل الپوليمريز المتسلسل(PCR) باكتشاف الفيروس بعد فترة وجيزة من الإصابة وحتى قبل ظهور المرض.[35] قد يمنح هذا الكشف المبكر الأطباء مهلة زمنية كبيرة في العلاج. يمكن أيضًا قياس كمية الفيروس ("الحمل الفيروسي") في المريض من خلال تقنيات قياس الحمض النووي القائمة على تفاعل الپوليمريز المتسلسل(PCR) (انظر أدناه).
- أمراض مثل الشاهوق (أو السعال الديكي) تسببها بكتيريا بورديتيلة السعال الديكي. تتميز هذه البكتيريا بعدوى تنفسية حادة خطيرة تصيب العديد من الحيوانات والبشر وتؤدي إلى وفاة العديد من الأطفال الصغار. سم السعال الديكي هو بروتين خارجي يرتبط بمستقبلات الخلايا بعاملين ويتفاعل مع أنواع مختلفة من الخلايا مثل الخلايا اللمفاوية التائية التي تلعب دورًا في مناعة الخلايا.[36] تفاعل الپوليمريز المتسلسل(PCR) هو أداة اختبار مهمة يمكنها اكتشاف التسلسلات الموجودة داخل جين سم السعال الديكي. هذا لأن تفاعل الپوليمريز المتسلسل(PCR) لديه حساسية عالية للسموم وقد أظهر وقت استجابة سريع. تفاعل الپوليمريز المتسلسل(PCR) فعال جدا لتشخيص السعال الديكي عند مقارنته بالزراعة.[37]
الاستخدامات البحثية
تم تطبيق تفاعل الپوليمريز المتسلسل على العديد من مجالات البحث في علم الوراثة الجزيئي:
- يسمح تفاعل البلمرة التسلسلي (PCR) بالإنتاج السريع للقطع القصيرة من الدنا ، حتى عندما لا يعرف اكثر من تسلسل مشرعيين . هذه القدرة من تفاعل الپوليمريز المتسلسل تقوي العديد من الطرق، مثل توليد مسبارات تهجين للطختي نورثرن وساوثرن. يزود PCR هذه التقنيات بكميات كبيرة من الحمض النووي النقي ، أحيانًا كشريط واحد ، مما يتيح التحليل حتى من كميات صغيرة جدًا من مادة البدء.
- يساعد تفاعل البوليمراز التسلسلي أيضًا وظيفة تسلسل الدنا. يمكن بسهولة إنتاج الأجزاء المعروفة من الحمض النووي من مريض يعاني من طفرة مرضية وراثية. يمكن للتعديلات في تقنية التضخيم أن تستخرج شرائح من جينوم غير معروف تمامًا ، أو يمكن أن تولد فقط سلسلة واحدة من منطقة المرغوب نسخها.
- يحتوي PCR على العديد من التطبيقات لعملية استنساخ الحمض النووي الأكثر تقليدية. يمكنه استخراج أجزاء لإدخالها في ناقل من جينوم أكبر ، والتي قد تكون متاحة فقط بكميات صغيرة. باستخدام مجموعة واحدة من "المشرعات الناقلة" ، يمكنها أيضًا تحليل أو استخراج الأجزاء التي تم إدخالها بالفعل في الناقلات. يمكن أن تؤدي بعض التعديلات على بروتوكول PCR إلى حدوث طفرات (عامة أو موجهة نحو الموقع) للجزء المدرج.
- مواقع واصمات التسلسل عمليةٌ يُستخدَم فيها تفاعل البوليمراز المتسلسل بمثابة مؤشر لوجود قطعة محددة من الجينوم في نسيلة معينة. وجد مشروع الجينوم البشري هذا التطبيق شديد الأهمية لرسم خرائط النسائل الكونية للسلاسل، ولتنسيق النتائج من المختبرات المختلف
- أحد التطبيقات المثيرة لـ تفاعل الپوليمريز المتسلسل هو التحليل التطوري للحمض النووي من المصادر القديمة ، مثل تلك الموجودة في عظام النياندرتال المستعادة ، من أنسجة الماموث المجمدة ، أو من دماغ المومياوات المصرية. تم تضخيمها وتسلسلها[15]في بعض الحالات ، يمكن إعادة تجميع الحمض النووي المتحلل للغاية من هذه المصادر خلال المراحل الأولى من التضخيم.
- أحد التطبيقات الشائعة لـتفاعل الپوليمريز المتسلسل هو دراسة أنماط التعبير الجيني . يمكن تحليل الأنسجة (أو حتى الخلايا الفردية) في مراحل مختلفة لمعرفة الجينات التي أصبحت نشطة ، أو التي تم إيقاف تشغيلها. يمكن لهذا التطبيق أيضًا استخدام تفاعل الپوليمريز المتسلسل الكمي لقياس المستويات الفعلية للتعبير
- إن قدرة PCR على تضخيم عدة مواقع في وقت واحد من الحيوانات المنوية الفردية[38] قد عززت بشكل كبير المهمة الأكثر تقليدية لرسم الخرائط الجينية من خلال دراسة عمليات الانتقال الكروموسومية بعد الانتصاف . تمت ملاحظة أحداث تداخل نادرة بين مواقع قريبة جدًا عن طريق تحليل آلاف الحيوانات المنوية الفردية. وبالمثل ، يمكن تحليل عمليات الحذف أو الإدخالات أو الترحيل أو الانقلابات غير العادية ، كل ذلك دون الحاجة إلى الانتظار (أو الدفع) لعمليات الإخصاب الطويلة ، وخلق الأجنة ، وما إلى ذلك.
- الطفرات الموجهة نحو الموقع : يمكن استخدام PCR لإنشاء جينات متحولة مع طفرات يختارها العلماء حسب الرغبة. يمكن اختيار هذه الطفرات من أجل فهم كيفية قيام البروتينات بوظائفها ، وتغيير وظيفة البروتين أو تحسينها.
المزايا
تفاعل الپوليمريز المتسلسل لديه عدد من المزايا. من السهل جدًا فهم واستخدام النتائج وتحقيقها بسرعة. هذه التقنية حساسة للغاية مع إمكانية إنتاج ملايين إلى مليارات النسخ من منتج معين للتسلسل والاستنساخ والتحليل. يشترك qRT-PCR في نفس مزايا PCR ، مع ميزة إضافية تتمثل في تحديد كمية المنتج المركب. لذلك ، فإن لها استخداماتها لتحليل التغيرات في مستويات التعبير الجيني في الأورام أو الميكروبات أو حالات المرض الأخرى .[39]
تفاعل الپوليمريز المتسلسل هو أداة بحث قوية وعملية للغاية. يتم التعرف على تسلسل مسببات غير معروفة للعديد من الأمراض من خلال PCR. يمكن أن تساعد التقنية في تحديد تسلسل الفيروسات غير المعروفة سابقًا والمتصلة بالفيروسات المعروفة بالفعل ، وبالتالي تعطينا فهمًا أفضل للمرض نفسه. إذا كان بالإمكان تبسيط الإجراء بشكل أكبر ويمكن تطوير أنظمة كشف غير إشعاعية حساسة ، فإن PCR سيحتل مكانًا بارزًا في المختبر السريري لسنوات قادمة .[15]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
القيود
أحد القيود الرئيسية على تفاعل البوليميراز المتسلسل (PCR) هو أن المعلومات السابقة حول تسلسل الهدف ضرورية من أجل توليد المشرعات التي ستسمح بتضخيمها الانتقائي .[40] هذا يعني أنه ، عادةً ، يجب على مستخدمي PCR معرفة التسلسل (التسلسل) الدقيق للمنطقة المستهدفة في كل من القالبين الذين لديهم شريط واحد من أجل التأكد من أن بوليميراز الدنا يرتبط بشكل صحيح بالهجين القالب المشرع ويولد لاحقًا المنطقة المستهدفة بأكملها أثناء توليف الحمض النووي.
مثل جميع الإنزيمات ، فإن بوليميرازات الدنا عرضة أيضًا للخطأ ، والذي يؤدي بدوره إلى حدوث طفرات في أجزاء PCR التي يتم إنشاؤها .[41]
هناك قيود أخرى على تفاعل البوليميراز المتسلسل (PCR) وهي أنه حتى أكبر كمية من الحمض النووي الملوث يمكن تضخيمها ، مما يؤدي إلى نتائج مضللة أو غامضة. لتقليل فرصة التلوث ، يجب على الباحثين حجز غرف منفصلة لإعداد الكاشف ، الPCR ، وتحليل المنتج. يجب الاستغناء عن الكواشف في قسائم الاستخدام الواحد. ويجب استخدام الأنابيب الماصة التي تُستعمل لمرة واحدة والطويلة بشكل روتيني.[15]
البدائل
- تفاعل الپوليمريز المتسلسل الخاص بالأليل: تقنية تشخيصية أو استنساخية تستند إلى اختلافات النوكليوتيدات المفردة (لا يجب الخلط بين SNVs (تغيرات نيوكليوتيدات مفردة) و SNPs (تعدد أشكال النيوكليوتيدات المفردة)) (الاختلافات في قاعدة واحدة في المريض). يتطلب معرفة مسبقة بتسلسل الدنا ، بما في ذلك الاختلافات بين الأليلات ، وتستخدم المشرعات التي تشمل نهاياتها 3 'SNV (المخزن المؤقت لزوج القاعدة حول SNV مدمج عادة). تضخيم PCR في ظل ظروف صارمة أقل كفاءة بكثير في وجود عدم تطابق بين القالب والمشرع، لذا فإن التضخيم الناجح مع وجود إشارات المشرع الخاصة بـ SNP لـ SNP المحدد في تسلسل.[42] انظر التنميط الجيني SNP لمزيد من المعلومات..
- تجميع تفاعل الپوليمريز المتسلسل أو تجميع حلقي للبوليميراز (PCA): توليف اصطناعي لتتابعات الدنا الطويلة من خلال إجراء تفاعل الپوليمريز المتسلسل على مجموعة من النيوكليوتيدات الطويلة ذات الأجزاء المتداخلة القصيرة. تتناقص النوكليوتيدات بين الاتجاهات الحسية والمضادة للحسية ، وتحدد الأجزاء المتداخلة ترتيب أجزاء PCR ، وبالتالي تنتج بشكل انتقائي منتج الحمض النووي الطويل النهائي..[43]
- تفاعل الپوليمريز المتسلسل الغير متماثل: يضخم بشكل تفضيلي شريط دنا واحدًا في قالب دنا مزدوج الشريط. يتم استخدامه في اختبار التسلسل والتهجين حيث يلزم تضخيم واحد فقط من الشريطين التكميليين. يتم إجراء تفاعل البوليميراز المتسلسل (PCR) كالمعتاد ، ولكن مع زيادة كبيرة في امشرع للشريط المستهدف للتضخيم. نظرًا للتضخيم البطيء (الحسابي) لاحقًا في التفاعل بعد استخدام مادة المشرع المحددة ، يتطلب الأمر دورات إضافية من PCR..[44] التعديل الأخير على هذه العملية ، والمعروف باسم تفاعل البوليميراز المتسلسل الخطي بعد الأسي (LATE-PCR) ، يستخدم مشرع محدد مع درجة حرارة انصهار أعلى (Tm) من المشرع الزائد للحفاظ على كفاءة التفاعل مع انخفاض تركيز المشرع المحدد تفاعل متوسط.[45]
- تفاعل الپوليمريز المتسلسل الحملى: طريقة كاذبة - متزامنة لأداء PCR. بدلاً من التسخين والتبريد المتكرر لخليط PCR ، يخضع المحلول إلى تدرج حراري. يؤدي التدفق الحراري الناتج عن عدم الاستقرار الحراري الناتج إلى خلط كاشفات PCR من المناطق الساخنة والباردة بشكل متكرر مما يتيح PCR بشكل متكرر.[46]يمكن تحسين المتثابتات مثل ظروف الحدود الحرارية والهندسة لحاوية PCR لإنتاج PCR قوي وسريع من خلال تسخير ظهور حقول التدفق الفوضوي.[47] يقلل هذا الإعداد PCR للتدفق الحراري بشكل كبير من متطلبات طاقة الجهاز ووقت التشغيل.
- تفاعل الپوليمريز المتسلسل المدرّج إلى أسفل: طريقة متوازية للغاية لاسترداد جزيئات الدنا الدقيقة لتوليف الجينات. يتم تعديل مكتبة معقدة من جزيئات الحمض النووي بعلامات مرافقة فريدة قبل التسلسل المتوازي بشكل كبير. ثم تمكن المشرعات الموجهة بالعلامات من استرجاع الجزيئات بالترتيب المطلوب بواسطة PCR..[48]
- تفاعل الپوليمريز المتسلسل الرقمي (dPCR): يستخدم لقياس كمية تسلسل الحمض النووي المستهدف في عينة الحمض النووي. يتم تخفيف عينة الحمض النووي بشكل كبير بحيث أنه بعد تشغيل العديد من PCRs بالتوازي ، لا يتلقى بعضها جزيء واحد من الحمض النووي المستهدف. يتم حساب تركيز الحمض النووي المستهدف باستخدام نسبة النتائج السلبية. ومن هنا جاء اسم "تفاعل الپوليمريز المتسلسل الرقمي".
- التضخيم المعتمد على الهليكيز: يشبه تفاعل الپوليمريز المتسلسل التقليدي ، ولكنه يستخدم درجة حرارة ثابتة بدلاً من التدوير من خلال دورات الإفساد والتليين / التمديد. يستخدم هيليكيز الدنا ، وهو إنزيم يزيل الحمض النووي ، بدلاً من الإفساد الحراري..[49]
- تفاعل الپوليمريز المتسلسل ذو البداية الساخنة: تقنية تقلل من التضخيم غير المحدد أثناء مراحل الإعداد الأولية لـ PCR. يمكن إجراؤه يدويًا عن طريق تسخين مكونات التفاعل إلى درجة حرارة الإفساد (على سبيل المثال ، 95 درجة مئوية) قبل إضافة البلمرة[50] تم تطوير أنظمة إنزيمية متخصصة تثبط نشاط البلمرة في درجة الحرارة المحيطة ، إما عن طريق ربط جسم مضاد[12][51] إما عن طريق ربط جسم مضاد أو عن طريق وجود مثبطات مرتبطة تساهميًا تتفكك فقط بعد خطوة تنشيط درجة حرارة عالية. يتم تحقيق تفاعل البلمرة المتسلسل (PCR) للبداية الساخنة / الباردة باستخدام بوليمرات هجينة جديدة تكون غير نشطة في درجة الحرارة المحيطة ويتم تنشيطها على الفور عند درجة حرارة الاستطالة
- تفاعل البوليمريز المتسلسل في السليكو (تفاعل البوليمريز المتسلسل الرقمي ، تفاعل البوليمريز المتسلسل الظاهري ، تفاعل البوليمريز المتسلسل الإلكتروني ،) يشير إلى الأدوات الحسابية المستخدمة لحساب نتائج تفاعل سلسلة البلمرة النظرية باستخدام مجموعة محددة من المشرعات (مسابير) لتضخيم تسلسلات الحمض النووي من جينوم متسلسل أو الترنسكربيتوم. تفاعل البوليمريز المتسلسل في السليكو تم اقتراحه كأداة تعليمية لعلم الأحياء الجزيئي.[52]
- تفاعل الپوليمريز المتسلسل الخاص بالتداخل (ISSR): طريقة PCR لبصمة الدنا التي تضخم المناطق بين تكرار تسلسل بسيط لإنتاج بصمة فريدة من أطوال الاجزاء المضخمة..[53]
- تفاعل الپوليمريز المتسلسل المعكوس: يستخدم بشكل شائع لتحديد التسلسلات المحيطة حول إدخالات الجينوم. تتضمن سلسلة من عمليات هضم الحمض النووي والربط الذاتي ، مما يؤدي إلى تسلسلات معروفة في أي من طرفي التسلسل غير المعروف..[54]
- تفاعل تفاعل الپوليمريز المتسلسل بوساطة الربط: يستخدم روابط صغيرة للحمض النووي مرتبطة بالحمض النووي المرغوب به ومشرعات متعددة تربط روابط الحمض النووي تم استخدامه لتسلسل الحمض النووي ، وسير الجينوم ، وبصمة الحمض النووي..[55]
- تفاعل الپوليمريز المتسلسل الخاص بالمثيلة (MSP): تم تطويره بواسطة ستيفن بيلين و جيمس جي. هيرمان في كلية الطب بجامعة جونز هوبكنز,[56] ويستخدم للكشف عن مثيلة جزر CpG في الحمض النووي الجيني. يتم التعامل مع الحمض النووي أولاً باستخدام ثنائي كبريتات الصوديوم ، الذي يحول قواعد السيتوزين غير الممثلة إلى اليوراسيل ، والذي يتعرف عليه مشرعات تفاعل الپوليمريز المتسلسل على أنه ثايمين. ثم يتم تنفيذ اثنين من PCRs على الحمض النووي المعدل ، باستخدام مجموعات المشرعات متطابقة باستثناء في أي جزر CpG ضمن تسلسل المشرع. عند هذه النقاط ، تتعرف مجموعة أولية على الحمض النووي مع السيتوزينات لتضخيم الحمض النووي الميثيل ، ومجموعة أخرى تتعرف على الحمض النووي مع اليوراسيل أو الثايمين لتضخيم الحمض النووي غير الممزوج. يمكن أيضًا تنفيذ MSP باستخدام qPCR للحصول على معلومات كمية بدلاً من معلومات نوعية حول المثيلة.
- تفاعل الپوليمريز المتسلسل ذو المشرع الصغير : يستخدم بوليميراز قابل للحرارة (S-Tbr) يمكن أن يمتد من المشرعات القصيرة ("smalligos") التي تصل إلى 9 أو 10 نيوكليوتيدات. تسمح هذه الطريقة باستهداف تفاعل البوليميراز المتسلسل (PCR) إلى مناطق ربط أولية أصغر ، ويتم استخدامها لتضخيم تسلسلات الحمض النووي المحفوظة ، مثل جين 16R (أو حقيقيات النوى 18S) جين الرنا الريباسي.[57]
- تضخيم المسبار المعتمد على الربط المتعدد (MLPA): يسمح بتضخيم أهداف متعددة مع زوج واحد من المشرع ، وبالتالي تجنب قيود الدقة لتعدد PCR (انظر أدناه).
- تفاعل البوليمريز المتسلسل متعدد الارسال: يتكون من مجموعات أولية متعددة ضمن خليط PCR واحد لإنتاج أمبليكونات ذات أحجام مختلفة خاصة بتسلسلات الدنا المختلفة. من خلال استهداف جينات متعددة في وقت واحد ، يمكن الحصول على معلومات إضافية من اختبار تشغيل واحد يتطلب خلاف ذلك عدة مرات الكواشف والمزيد من الوقت للأداء. يجب تحسين درجات حرارة التلدين لكل مجموعة من مجموعات المشرع للعمل بشكل صحيح ضمن تفاعل واحد وأحجام أمبليكون. أي ، يجب أن يكون طول زوجها الأساسي مختلفًا بما يكفي لتشكيل نطاقات متميزة عند تصورها بواسطة الرحلان الكهربائي للهلام.
- تفاعل الپوليمريز المتسلسل بمساعدة جزيئات نانوية(nanoPCR): يمكن لبعض الجسيمات النانوية (NPs) تعزيز كفاءة PCR (وبالتالي تسمى nanoPCR) ، ويمكن للبعض أن يتفوق على معزز PCR الأصلي. وُجد أن النقاط الكمية (QDs) يمكن أن تحسن نوعية PCR وكفاءته. الأنابيب النانوية الكربونية أحادية الجدار (SWCNTs) والأنابيب النانوية الكربونية متعددة الجدران (MWCNT) فعالة في تعزيز تضخيم PCR الطويل. يمكن أن يحسن مسحوق النانو الكربوني (CNP) من كفاءة PCR المتكرر و PCR الطويل ، في حين تم العثور على أكسيد الزنك وثاني أكسيد التيتانيوم و Ag NPs لزيادة إنتاج PCR. أشارت البيانات السابقة إلى أن NPs غير المعدنية احتفظت بدقة التضخيم المقبولة. بالنظر إلى أن العديد من NPs قادرة على تعزيز كفاءة PCR ، فمن الواضح أنه من المحتمل أن تكون هناك إمكانات كبيرة لتحسين تكنولوجيا nanoPCR وتطوير المنتجات..[58][59]
- تفاعل الپوليمريز المتسلسل العشي: يزيد من نوعية تضخيم الحمض النووي ، عن طريق تقليل الخلفية بسبب التضخيم غير المحدد للحمض النووي. يتم استخدام مجموعتين من المشرعات في اثنين من متتاليات تفاعل البلمرة التسلسلي. في التفاعل الأول ، يتم استخدام زوج واحد من المشرعات لإنشاء منتجات الدنا ، والتي إلى جانب الهدف المقصود ، قد لا تزال تتكون من أجزاء الدنا غير المضخمة بشكل خاص. ثم يتم استخدام المنتج (المنتجات) في PCR ثانٍ مع مجموعة من امشرعات التي تختلف مواقع ربطها كليًا أو جزئيًا عن كل من المشرعات المستخدمة في التفاعل الأول وتقع بشكل كلي. غالبًا ما يكون تفاعل البوليميراز المتسلسل المتداخل أكثر نجاحًا في تضخيم أجزاء الحمض النووي الطويلة على وجه التحديد من تفاعل البوليميراز المتسلسل التقليدي ، ولكنه يتطلب معرفة أكثر تفصيلاً للتسلسل المستهدف.
- تمديد تفاعل الپوليمريز المتسلسل متداخل أو الربط عن طريق تمديد التداخل (SOEing): تقنية الهندسة الوراثية التي تستخدم لدمج جزأين أو أكثر من الحمض النووي التي تحتوي على تسلسلات تكميلية. يتم استخدامه لربط قطع الحمض النووي التي تحتوي على جينات أو تسلسلات تنظيمية أو طفرات. تتيح التقنية إنشاء تراكيب الدنا محددة وطويلة. يمكنه أيضًا إدخال عمليات الحذف أو الإدراج أو الطفرات النقطية في تسلسل الحمض النووي.[60][61]
- تفاعل البوليمريز المتسلسل الاحادي المرتبط بالزمن الحقيقي: يستخدم ظروف متساوية الحرارة للتضخيم ، ويمكن استخدامه في الخلايا الحية..[62][63]
- تفاعل الپوليمريز المتسلسل الكمي (qPCR): يستخدم لقياس كمية التسلسل المستهدف (عادة في الوقت الحقيقي). وهو يقيس كميات البدء من الدنا أو الدنا التكميلي أو الرنا. يستخدم PCR الكمي بشكل شائع لتحديد ما إذا كان تسلسل الحمض النووي موجودًا في العينة وعدد نسخها في العينة. PCR الكمي لديه درجة عالية من الدقة. تستخدم طرق PCR الكمية الأصباغ الفلورية ، مثل Sybr Green أو EvaGreen أو مسابير الحمض النووي المحتوية على الفلوروفور ، مثل TaqMan ، لقياس كمية المنتج المضخم في الوقت الفعلي. كما يتم اختصاره أحيانًا إلى تفاعل البوليمريز المتسلسل للنسخ العكسي-PCR باللزمن الحقيقي) ولكن يجب استخدام هذا الاختصار فقط في النسخ العكسي PCR. qPCR هو الانقباضات المناسبة لـ PCR الكمي (PCR بالزمن الحقيقي).
- تفاعل الپوليمريز المتسلسل للنسخ العكسي (RT-PCR): لتضخيم الدنا من الرنا. تنسخ المستنسخة العكسية عكسيًا الرنا إلى دنا تكميلي ، والذي يتم تضخيمه بواسطة PCR. يستخدم RT-PCR على نطاق واسع في التنميط التعبيري ، لتحديد التعبير عن الجين أو لتحديد تسلسل نسخة الرنا ، بما في ذلك مواقع النسخ والإنهاء. إذا كان تسلسل الحمض النووي الجيني معروفًا للجين ، فيمكن استخدام RT-PCR لتحديد موقع الإكسونات والإنترونات في الجين. عادةً ما يتم تحديد نهاية 5 'للجين (المقابل لموقع بدء النسخ) بواسطة RACE-PCR (التضخيم السريع لنهايات الدنا التكميلي).
- تفاعل الپوليمريز المتسلسل المعتمد على الريبونوكلياز إتش(rhPCR): تعديل لتفاعل البوليميراز المتسلسل الذي يستخدم المشرعات مع كتلة تمديد 3’ يمكن إزالتها بواسطة إنزيم ريبونوكلياز إتشII الثابت حراريًا. يقلل هذا النظام من الدَيْمَرات-مشرع ويسمح بإجراء تفاعلات متعددة مع أعداد أكبر من المشرعات.[64]
- تفاعل الپوليمريز المتسلسل ذو المشرع المفرد المحدد(SSP-PCR): يسمح بتضخيم الحمض النووي مزدوج الشريط حتى عندما تكون معلومات التسلسل متاحة في طرف واحد فقط. تسمح هذه الطريقة بتضخيم الجينات التي تتوفر لها معلومات تسلسل جزئي فقط ، وتسمح بالسير على الجينوم أحادي الاتجاه من مناطق معروفة من الكروموسوم.[65]
- PCR ذو المرحلة الصلبة: يشمل معاني متعددة ، بما في ذلك تضخيم المستعمرة (حيث يتم اشتقاق مستعمرات PCR في مصفوفة هلامية ، على سبيل المثال) تفاعل الپوليمريز المتسلسل الجسر (يتم ربط المشرعات تساهميًا بسطح دعم صلب) ، تفاعل الپوليمريز المتسلسل التقليدي ذو المرحلة الصلبة (حيث يكون تفاعل الپوليمريز المتسلسل غير المتماثل يتم تطبيقه في وجود داعم للصلب حامل مشرع مع تسلسل يتطابق مع واحد من المشرعات المائية) و تفاعل الپوليمريز المتسلسل المحسن للمرحلة الصلبة[66] (حيث يمكن تحسين تفاعل الپوليمريز المتسلسل التقليدي للمرحلة الصلبة من خلال استخدام مشرع داعم صلب عالي درجة انصهاره متداخل مع تطبيق اختياري لـ "خطوة" حرارية لتأييد دعم قوي)
- تفاعل الپوليمريز المتسلسل انتحاري : يستخدم عادة في علم الوراثة القديمة أو دراسات أخرى حيث يكون تجنب الإيجابيات الكاذبة وضمان نوعية الجزء المتضخم هو الأولوية القصوى. تم وصفه في الأصل في دراسة للتحقق من وجود ميكروب يرسينيا بستس في عينات الأسنان التي تم الحصول عليها من قبور القرن الرابع عشر لأشخاص يفترض أنهم قتلوا بسبب الطاعون خلال وباء الطاعون في العصور الوسطى.[67] تصف الطريقة استخدام أي تركيبة مشرع مرة واحدة فقط في تفاعل البوليمريز المتسلسل (ومن هنا كان مصطلح "الانتحار") ، والذي كان يجب ألا يستخدم أبدًا في أي تفاعل تحكم تفاعل البوليمربز السلسلي الإيجابي ، ويجب أن تستهدف المشرعات دائمًا منطقة جينومية لم يتم تضخيمها من قبل في مختبر باستخدام هذا أو أي مجموعة أخرى من المشرعات. هذا يضمن عدم وجود دنا ملوث من تفاعلات PCR السابقة في المختبر ، والتي يمكن أن تولد نتائج إيجابية خاطئة.
- تفاعل الپوليمريز المتسلسل المتشابك غير المتماثل حراريا (TAIL-PCR) : لعزل تسلسل غير معروف يحيط بتسلسل معروف. ضمن التسلسل المعروف ، يستخدم ذيل-تفاعل الپوليمريز المتسلسل زوجًا متداخلاً من المشرعات بدرجات حرارة التلدين المختلفة ؛ يستخدم المشرع المنحل لتضخيم الاتجاه الآخر من التسلسل غير المعروف.[68]
- تفاعل البوليمربز المتسلسل الهابط (تفاعل البوليمريز المتسلسل الخافض): أحد أشكال تفاعل الپوليمريز المتسلسل التي تهدف إلى تقليل الخلفية غير المحددة عن طريق خفض درجة حرارة التلدين تدريجيًا مع تقدم دورة تفاعل الپوليمريز المتسلسل. عادة ما تكون درجة حرارة التلدين في الدورات الأولية بضع درجات (3-5) ° C) فوق درجة الانصهار من المشرعات المستخدمة ، بينما في الدورات اللاحقة ، تكون درجات قليلة (3-5) ° C) تحت درجة انصهار المشرع . تعطي درجات الحرارة المرتفعة نوعية أكبر لربط المشرع ، وتسمح درجات الحرارة المنخفضة بتضخيم أكثر كفاءة من المنتجات المحددة التي تشكلت خلال الدورات الأولية.[69]
- السائر السريع العالمي : لسير الجينوم وبصمات الأصابع الوراثية باستخدام تفاعل الپوليمريز المتسلسل "ذي الجانبين" الأكثر تحديدًا من الطرق التقليدية "أحادية الجانب" (باستخدام مشرع واحد محدد للجين وآخر مشرع عام - مما قد يؤدي إلى "ضوضاء" فنية)[70] بحكم آلية تشتمل على تكوين بنية الوهقات. مشتقات مبسطة من UFW هي LaNe RAGE تفاعل البوليمريز المتسلسل متداخلة تعتمد على الوراثة للتضخيم السريع لنهايات الجينوم,[71]5RACE LaNe[72] و 3'RACE LaNe.[73]
التاريخ
تم اكتشاف الإنزيمات المقاومة للحرارة التي تعد مكونًا رئيسيًا في تفاعل البوليمريز المتسلسل في الستينيات كمنتج لشكل الحياة الميكروبية التي عاشت في المياه شديدة السخونة في فطر ماشروم في ينابيع يلوستون، المنتزه الوطني .[74]
وصفت ورقة علمية عام 1971 في مجلة علم الأحياء الجزيئية التي كتبها كييل كليبي وزملاؤه في مختبر هار غوبند خورانا. لأول مرة طريقة استخدام مقايسة إنزيمية لتكرار نموذج الدنا قصير مع مشرع في المختبر .[75] ومع ذلك ، فإن هذا المظهر المبكر لمبدأ تفاعل الپوليمريز المتسلسل الأساسي لم يحظ باهتمام كبير في ذلك الوقت ، ويُنسب اختراع تفاعل سلسلة البوليمريز في عام 1983 إلى كاري مولس .[76]
عندما طوّر موليس تفاعل الپوليمريز المتسلسل في عام 1983 ، كان يعمل في إميريفيلي (كاليفورنيا) ، كاليفورنيا لصالح شركة سيتوس ، وهي واحدة من أولى شركات التكنولوجيا الحيوية ، حيث كان مسؤولًا عن تجميع سلاسل قصيرة من الدنا. كتب موليس أنه تصور فكرة تفاعل البلمرة المتسلسل (PCR) أثناء تجوله على طول طريق المحيط الهادئ السريع في إحدى الليالي في سيارته.[77][78] كان يلعب في ذهنه بطريقة جديدة لتحليل التغييرات (الطفرات) في الحمض النووي عندما أدرك أنه اخترع بدلاً من ذلك طريقة لتضخيم أي منطقة من الحمض النووي من خلال دورات متكررة من الازدواجية مدفوعة ببوليمريز الحمض النووي. في مجلة ساينتفيك أمريكان ، لخص موليس الإجراء: "بدءًا من جزيء واحد من المادة الوراثية الدنا ، يمكن لـ تفاعل الپوليمريز المتسلسل توليد 100 مليار جزيء مشابه في فترة ما بعد الظهر. رد الفعل سهل التنفيذ. لا يتطلب الأمر أكثر من أنبوب اختبار وعدد قليل من الكواشف البسيطة ومصدر للحرارة.."[79] تم استخدام بصمة الحمض النووي لأول مرة في اختبار الأبوة في عام 1988 .[80]
مُنح موليز جائزة نوبل في الكيمياء في عام 1993 عن اختراعه ، بعد سبع سنوات من وضعه وزملاؤه في سيتوس لأول مرة اقتراحه للممارسة .[81] تم تكريم ورقة موليز العلمية لعام 1985 مع آر.كي. ساكي و إتش. إيه. إرليش ، "التضخيم الإنزيمي للتسلسلات الجينومية بيتا-غلوبين وتحليل موقع التقييد لتشخيص فقر الدم المنجلي" - اختراع تفاعل البلمرة المتسلسل (PCR) - من خلال اقتباس من جائزة الاختراق الكيميائي من قسم تاريخ الكيمياء للجمعية الكيميائية الأمريكية في عام 2017 .[82][83]
في جوهر طريقة تفاعل الپوليمريز المتسلسل هو استخدام بوليمريز الدنا المناسب القادر على تحمل درجات الحرارة العالية> 90 °C (194 °F) مطلوب لفصل شريطي الدنا في اللولب المزدوج للحمض النووي بعد كل دورة نسخ . لم تكن بوليميرازات الدنا المستخدمة في البداية في التجارب المعملية المسببة لـتفاعل الپوليمريز المتسلسل قادرة على تحمل درجات الحرارة المرتفعة.[1]لذلك كانت الإجراءات المبكرة لتكاثر الحمض النووي غير فعالة للغاية وتستغرق وقتًا طويلاً ، وتتطلب كميات كبيرة من بوليمريز الحمض النووي والمعالجة المستمرة طوال العملية .
اكتشاف پوليمريز المستحرة المائية عام 1976 - بوليمريز الدنا المنقى من البكتيريا المحبة للحرارة ، المستحرة المائية ، والتي تعيش بشكل طبيعي في بيئات ساخنة( 50 to 80 °C (122 to 176 °F) [13]مثل الينابيع الساخنة - مهدت الطريق لإدخال تحسينات كبيرة على طريقة تفاعل الپوليمريز المتسلسل. إن بوليمريز الدنا المعزول من المستحرة المائية مستقر عند درجات الحرارة العالية التي تظل نشطة حتى بعدإفساد الدنا ,[14] وبالتالي تجنب الحاجة إلى إضافة بوليمريز الدنا جديد بعد كل دورة .[2] وقد سمح ذلك بعملية تلقائية قائمة على المعالج الحراري لتضخيم الحمض النووي .
نزاعات براءة الاختراع
تقنية تفاعل الپوليمريز المتسلسل(PCR) حصلت على براءة اختراعها شركة سيتوس Cetus Corporation، حيث كان يعمل مليس حين اخترع التقنية في 1983. كما تمت تغطية إنزيم تاك الپوليمريز بواسطة براءات الاختراع. كانت هناك العديد من الدعاوى القضائية البارزة المتعلقة بهذه التقنية, بما فيها القضية الفاشلة التي أقامتها دوپونت. اشترت شركة المستحضرات الصيدلية هوفمان-لا روش حقوق براءات الاختراع في 1992 وتحتفظ حالياً بتلك البراءات التي مازالت سارية.
لا تزال معركة براءات الاختراع ذات الصلة حول إنزيم تاك الپوليمريز مستمرة في العديد من السلطات القضائية حول العالم بين روش و بروميجا. لقد امتدت الجدالات القانونية إلى ما بعد صلاحية براءات اختراع تفاعل الپوليمريز المتسلسل(PCR) و تاك الپوليمريز الأصلية ، والتي انتهت صلاحيتها في 28 مارس, 2005[84]
انظر أيضاً
المصادر
- ^ أ ب Saiki, R.; Scharf, S.; Faloona, F.; Mullis, K.; Horn, G.; Erlich, H.; Arnheim, N. (1985). "Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia". Science. 230 (4732): 1350–1354. Bibcode:1985Sci...230.1350S. doi:10.1126/science.2999980. PMID 2999980.
- ^ أ ب Saiki, R.; Gelfand, D.; Stoffel, S.; Scharf, S.; Higuchi, R.; Horn, G.; Mullis, K.; Erlich, H. (1988). "Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase". Science. 239 (4839): 487–491. Bibcode:1988Sci...239..487S. doi:10.1126/science.239.4839.487. PMID 2448875.
- ^ "Determining Annealing Temperatures for Polymerase Chain Reaction". The American Biology Teacher. 74 (4): 256–260. 2012. doi:10.1525/abt.2012.74.4.9.
- ^ أ ب ت ث ج ح Ninfa, Alexander; Ballou, David; Benore, Marilee (2009). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. United States: Wiley. pp. 408–410. ISBN 978-0470087664.
- ^ Cheng, S.; Fockler, C.; Barnes, W. M.; Higuchi, R. (1994). "Effective Amplification of Long Targets from Cloned Inserts and Human Genomic DNA". Proceedings of the National Academy of Sciences. 91 (12): 5695–5699. Bibcode:1994PNAS...91.5695C. doi:10.1073/pnas.91.12.5695. PMC 44063. PMID 8202550.
- ^ Carr AC, Moore SD (2012). Lucia A (ed.). "Robust quantification of polymerase chain reactions using global fitting". PLOS One. 7 (5): e37640. Bibcode:2012PLoSO...737640C. doi:10.1371/journal.pone.0037640. PMC 3365123. PMID 22701526.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Joseph Sambrook; David W. Russel (2001). Molecular Cloning: A Laboratory Manual (3rd ed.). Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press. ISBN 978-0-879-69576-7.
{{cite book}}: Unknown parameter|lastauthoramp=ignored (|name-list-style=suggested) (help) Chapter 8: In vitro Amplification of DNA by the Polymerase Chain Reaction - ^ "Polymerase Chain Reaction (PCR)". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "PCR". Genetic Science Learning Center, University of Utah.
- ^ Pavlov, A. R.; Pavlova, N. V.; Kozyavkin, S. A.; Slesarev, A. I. (2004). "Recent developments in the optimization of thermostable DNA polymerases for efficient applications☆". Trends in Biotechnology. 22 (5): 253–260. doi:10.1016/j.tibtech.2004.02.011. PMID 15109812.
- ^ Rychlik W, Spencer WJ, Rhoads RE (1990). "Optimization of the annealing temperature for DNA amplification in vitro". Nucleic Acids Res. 18 (21): 6409–6412. doi:10.1093/nar/18.21.6409. PMC 332522. PMID 2243783.
- ^ أ ب Sharkey, D. J.; Scalice, E. R.; Christy, K. G.; Atwood, S. M.; Daiss, J. L. (1994). "Antibodies as Thermolabile Switches: High Temperature Triggering for the Polymerase Chain Reaction". Bio/Technology. 12 (5): 506–509. doi:10.1038/nbt0594-506. PMID 7764710.
- ^ أ ب Chien A, Edgar DB, Trela JM (1976). "Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus". J. Bacteriol. 127 (3): 1550–1557. doi:10.1128/jb.127.3.1550-1557.1976. PMC 232952. PMID 8432.
- ^ أ ب Lawyer, F.; Stoffel, S.; Saiki, R.; Chang, S.; Landre, P.; Abramson, R.; Gelfand, D. (1993). "High-level expression, purification, and enzymatic characterization of full-length Thermus aquaticus DNA polymerase and a truncated form deficient in 5' to 3' exonuclease activity". PCR Methods and Applications. 2 (4): 275–287. doi:10.1101/gr.2.4.275. PMID 8324500.
- ^ أ ب ت ث Schochetman, Gerald; Ou, Chin-Yih; Jones, Wanda K. (1988). "Polymerase Chain Reaction". The Journal of Infectious Diseases. 158 (6): 1154–1157. doi:10.1093/infdis/158.6.1154. JSTOR 30137034. PMID 2461996.
- ^ Borman, Jon; Schuster, David; Li, Wu-bo; Jessee, Joel; Rashtchian, Ayoub (2000). "PCR from problematic templates" (PDF). Focus. 22 (1): 10.
- ^ Bogetto, Prachi and Waidne, Lisa (2000). "Helpful tips for PCR" (PDF). Focus. 22 (1): 12.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Sarkar, G.; Kapelner, S.; Sommer, S. (1990). "Formamide can dramatically improve the specificity of PCR". Nucleic Acids Research. 18 (24): 7465. doi:10.1093/nar/18.24.7465. PMC 332902. PMID 2259646.
- ^ "Electronic PCR". NCBI – National Center for Biotechnology Information. Retrieved 13 March 2012.
- ^ Pavlov AR, Pavlova NV, Kozyavkin SA, Slesarev AI (2006). "Thermostable DNA Polymerases for a Wide Spectrum of Applications: Comparison of a Robust Hybrid TopoTaq to other enzymes". In Kieleczawa J (ed.). DNA Sequencing II: Optimizing Preparation and Cleanup. Jones and Bartlett. pp. 241–257. ISBN 978-0-7637-3383-4.
- ^ Pombert JF, Sistek V, Boissinot M, Frenette M (2009). "Evolutionary relationships among salivarius streptococci as inferred from multilocus phylogenies based on 16S rRNA-encoding, recA, secA, and secY gene sequences". BMC Microbiol. 9: 232. doi:10.1186/1471-2180-9-232. PMC 2777182. PMID 19878555.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Chemical Synthesis, Sequencing, and Amplification of DNA (class notes on MBB/BIO 343)". Arizona State University. Archived from the original on 9 أكتوبر 1997. Retrieved 29 أكتوبر 2007.
- ^ Bustin, S. A.; Benes, V.; Garson, J. A.; Hellemans, J.; Huggett, J.; Kubista, M.; Mueller, R.; Nolan, T.; Pfaffl, M. W.; Shipley, G. L.; Vandesompele, J.; Wittwer, C. T. (2009). "The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments" (PDF). Clinical Chemistry. 55 (4): 611–622. doi:10.1373/clinchem.2008.112797. PMID 19246619.
- ^ Garibyan, Avashia (March 2013). "Polymerase Chain Reaction". Journal of Investigative Dermatology. 133 (3): 1–4. doi:10.1038/jid.2013.1. PMC 4102308. PMID 23399825.
- ^ Quill, E. (2008). "Medicine. Blood-matching goes genetic". Science. 319 (5869): 1478–9. doi:10.1126/science.319.5869.1478. PMID 18339916.
- ^ Tomar, Rukam (2010). Molecular Markers and Plant Biotechnology. Pitman Pura, New Delhi: New India Publishing Agency. p. 188. ISBN 978-93-80235-25-7.
- ^ أ ب Cai, H; Caswell JL; Prescott JF (March 2014). "Nonculture Molecular Techniques for Diagnosis of Bacterial Disease in Animals: A Diagnostic Laboratory Perspective". Veterinary Pathology. 51 (2): 341–350. doi:10.1177/0300985813511132. PMID 24569613.
- ^ Salis AD (2009). "Applications in Clinical Microbiology". Real-Time PCR: Current Technology and Applications. Caister Academic Press. ISBN 978-1-904455-39-4.
- ^ Kwok, S.; Mack, D. H.; Mullis, K. B.; Poiesz, B.; Ehrlich, G.; Blair, D.; Friedman-Kien, A.; Sninsky, J. J. (1987). "Identification of human immunodeficiency virus sequences by using in vitro enzymatic amplification and oligomer cleavage detection". Journal of Virology. 61 (5): 1690–4. doi:10.1128/jvi.61.5.1690-1694.1987. PMC 254157. PMID 2437321.
- ^ Cai, H; Caswell JL; Prescott JF (March 2014). "Nonculture Molecular Techniques for Diagnosis of Bacterial Disease in Animals: A Diagnostic Laboratory Perspective". Veterinary Pathology. 51 (2): 341–350. doi:10.1177/0300985813511132. PMID 24569613.
- ^ Finger, Horst; von Koenig, Carl Heinz Wirsing (1996). Baron, Samuel (ed.). Medical Microbiology (4th ed.). Galveston (TX): University of Texas Medical Branch at Galveston. ISBN 978-0963117212. PMID 21413270.
- ^ Yeh, Sylvia H.; Mink, ChrisAnna M. (2012). "Bordetella pertussis and Pertussis (Whooping Cough)". Netter's Infectious Diseases. pp. 11–14. doi:10.1016/B978-1-4377-0126-5.00003-3. ISBN 9781437701265.
{{cite book}}:|journal=ignored (help) - ^ Alonso, A (2004-01-28). "Real-time PCR designs to estimate nuclear and mitochondrial DNA copy number in forensic and ancient DNA studies". Forensic Science International. 139 (2–3): 141–149. doi:10.1016/j.forsciint.2003.10.008. PMID 15040907.
- ^ Kwok, S.; Mack, D. H.; Mullis, K. B.; Poiesz, B.; Ehrlich, G.; Blair, D.; Friedman-Kien, A.; Sninsky, J. J. (1987). "Identification of human immunodeficiency virus sequences by using in vitro enzymatic amplification and oligomer cleavage detection". Journal of Virology. 61 (5): 1690–4. doi:10.1128/jvi.61.5.1690-1694.1987. PMC 254157. PMID 2437321.
- ^ Cai, H; Caswell JL; Prescott JF (March 2014). "Nonculture Molecular Techniques for Diagnosis of Bacterial Disease in Animals: A Diagnostic Laboratory Perspective". Veterinary Pathology. 51 (2): 341–350. doi:10.1177/0300985813511132. PMID 24569613.
- ^ Finger, Horst; von Koenig, Carl Heinz Wirsing (1996). Baron, Samuel (ed.). Medical Microbiology (4th ed.). Galveston (TX): University of Texas Medical Branch at Galveston. ISBN 978-0963117212. PMID 21413270.
- ^ Yeh, Sylvia H.; Mink, ChrisAnna M. (2012). "Bordetella pertussis and Pertussis (Whooping Cough)". Netter's Infectious Diseases. pp. 11–14. doi:10.1016/B978-1-4377-0126-5.00003-3. ISBN 9781437701265.
{{cite book}}:|journal=ignored (help) - ^ Boehnke, M.; Arnheim, N.; Li, H.; Collins, F. S. (1989). "Fine-structure genetic mapping of human chromosomes using the polymerase chain reaction on single sperm: Experimental design considerations". American Journal of Human Genetics. 45 (1): 21–32. PMC 1683385. PMID 2568090.
- ^ Garibyan, Lilit; Avashia, Nidhi (2013-03-01). "Polymerase Chain Reaction". Journal of Investigative Dermatology. 133 (3): 1–4. doi:10.1038/jid.2013.1. PMC 4102308. PMID 23399825.
- ^ Garibyan L, Avashia N (2013). "Polymerase Chain Reaction". Journal of Investigative Dermatology. 133 (3): 1–4. doi:10.1038/jid.2013.1. PMC 4102308. PMID 23399825.
- ^ Zhou, Y H; Zhang, X P; Ebright, R H (1991-11-11). "Random mutagenesis of gene-sized DNA molecules by use of PCR with Taq DNA polymerase". Nucleic Acids Research. 19 (21): 6052. doi:10.1093/nar/19.21.6052. PMC 329070. PMID 1658751.
- ^ Newton CR, Graham A, Heptinstall LE, Powell SJ, Summers C, Kalsheker N, Smith JC, Markham AF (1989). "Analysis of any point mutation in DNA. The amplification refractory mutation system (ARMS)". Nucleic Acids Research. 17 (7): 2503–2516. doi:10.1093/nar/17.7.2503. PMC 317639. PMID 2785681.
- ^ Stemmer WP, Crameri A, Ha KD, Brennan TM, Heyneker HL (1995). "Single-step assembly of a gene and entire plasmid from large numbers of oligodeoxyribonucleotides". Gene. 164 (1): 49–53. doi:10.1016/0378-1119(95)00511-4. PMID 7590320.
- ^ Innis MA, Myambo KB, Gelfand DH, Brow MA (1988). "DNA sequencing with Thermus aquaticus DNA polymerase and direct sequencing of polymerase chain reaction-amplified DNA". Proc Natl Acad Sci USA. 85 (24): 9436–9440. Bibcode:1988PNAS...85.9436I. doi:10.1073/pnas.85.24.9436. PMC 282767. PMID 3200828.
- ^ Pierce KE, Wangh LJ (2007). Linear-after-the-exponential polymerase chain reaction and allied technologies Real-time detection strategies for rapid, reliable diagnosis from single cells. Methods in Molecular Medicine. Vol. 132. pp. 65–85. doi:10.1007/978-1-59745-298-4_7. ISBN 978-1-58829-578-1. PMID 17876077.
{{cite book}}: Unknown parameter|lastauthoramp=ignored (|name-list-style=suggested) (help) - ^ Krishnan, Madhavi; Ugaz, Victor; Burns, Mark (2002). "PCR in a Rayleigh-Benard convection cell". Science. 298 (5594): 793. doi:10.1126/science.298.5594.793. PMID 12399582.
- ^ Priye, Aashish; Hassan, Yassin; Ugaz, Victor (2013). "Microscale chaotic advection enables robust convective DNA replication". Analytical Chemistry. 85 (21): 10536–10541. doi:10.1021/ac402611s. PMID 24083802.
- ^ Schwartz JJ, Lee C, Shendure J (2012). "Accurate gene synthesis with tag-directed retrieval of sequence-verified DNA molecules". Nature Methods. 9 (9): 913–915. doi:10.1038/nmeth.2137. PMC 3433648. PMID 22886093.
- ^ Vincent M, Xu Y, Kong H (2004). "Helicase-dependent isothermal DNA amplification". EMBO Reports. 5 (8): 795–800. doi:10.1038/sj.embor.7400200. PMC 1249482. PMID 15247927.
- ^ Chou Q, Russell M, Birch DE, Raymond J, Bloch W (1992). "Prevention of pre-PCR mis-priming and primer dimerization improves low-copy-number amplifications". Nucleic Acids Research. 20 (7): 1717–1723. doi:10.1093/nar/20.7.1717. PMC 312262. PMID 1579465.
- ^ Kellogg, DE; Rybalkin, I; Chen, S; Mukhamedova, N; Vlasik, T; Siebert, PD; Chenchik, A (1994). "TaqStart Antibody: "hot start" PCR facilitated by a neutralizing monoclonal antibody directed against Taq DNA polymerase". BioTechniques. 16 (6): 1134–7. PMID 8074881.
- ^ San Millan RM, Martinez-Ballesteros I, Rementeria A, Garaizar J, Bikandi J (2013). "Online exercise for the design and simulation of PCR and PCR-RFLP experiments". BMC Research Notes. 6: 513. doi:10.1186/1756-0500-6-513. PMC 4029544. PMID 24314313.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Zietkiewicz, E.; Rafalski, A.; Labuda, D. (1994). "Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification". Genomics. 20 (2): 176–83. doi:10.1006/geno.1994.1151. PMID 8020964.
- ^ Ochman H, Gerber AS, Hartl DL (1988). "Genetic Applications of an Inverse Polymerase Chain Reaction". Genetics. 120 (3): 621–623. PMC 1203539. PMID 2852134.
- ^ Mueller PR, Wold B (1988). "In vivo footprinting of a muscle specific enhancer by ligation mediated PCR". Science. 246 (4931): 780–786. Bibcode:1989Sci...246..780M. doi:10.1126/science.2814500. PMID 2814500.
- ^ Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB (1996). "Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands". Proc Natl Acad Sci USA. 93 (13): 9821–9826. Bibcode:1996PNAS...93.9821H. doi:10.1073/pnas.93.18.9821. PMC 38513. PMID 8790415.
- ^ Isenbarger TA, Finney M, Ríos-Velázquez C, Handelsman J, Ruvkun G (2008). "Miniprimer PCR, a New Lens for Viewing the Microbial World". Applied and Environmental Microbiology. 74 (3): 840–9. doi:10.1128/AEM.01933-07. PMC 2227730. PMID 18083877.
- ^ Cenchao Shen; Wenjuan Yang; Qiaoli Ji; Hisaji Maki; Anjie Dong; Zhizhou Zhang (2009). "NanoPCR observation: different levels of DNA replication fidelity in nanoparticle-enhanced polymerase chain reactions". Nanotechnology. 20 (45): 455103. Bibcode:2009Nanot..20S5103S. doi:10.1088/0957-4484/20/45/455103. PMID 19822925.
- ^ Shen, Cenchao (2013). "An Overview of Nanoparticle-Assisted Polymerase Chain Reaction Technology". An Overview of Nanoparticle‐Assisted Polymerase Chain Reaction Technology. US: Wiley-Blackwell Publishing Ltd. pp. 97–106. doi:10.1002/9781118451915.ch5. ISBN 9781118451915.
- ^ Horton RM, Hunt HD, Ho SN, Pullen JK, Pease LR (1989). "Engineering hybrid genes without the use of restriction enzymes: gene splicing by overlap exten-sion". Gene. 77 (1): 61–68. doi:10.1016/0378-1119(89)90359-4. PMID 2744488.
- ^ Moller, Simon (2006). PCR: The Basics. US: Taylor & Francis Group. p. 144. ISBN 9780415355476.
- ^ David F, Turlotte E (1998). "Une méthode d'amplification génique isotherme" [An Isothermal Amplification Method]. Comptes Rendus de l'Académie des Sciences, Série III. 321 (11): 909–914. Bibcode:1998CRASG.321..909D. doi:10.1016/S0764-4469(99)80005-5. PMID 9879470.
- ^ Fabrice David (September–October 2002). "Utiliser les propriétés topologiques de l'ADN: une nouvelle arme contre les agents pathogènes" (PDF). Fusion. Archived from the original (PDF) on 2007-11-28.(in French)
- ^ Dobosy JR, Rose SD, Beltz KR, Rupp SM, Powers KM, Behlke MA, Walder JA (August 2011). "RNase H-dependent PCR (rhPCR): improved specificity and single nucleotide polymorphism detection using blocked cleavable primers". BMC Biotechnology. 11: 80. doi:10.1186/1472-6750-11-80. PMC 3224242. PMID 21831278.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Shyamala, V.; Ferro-Luzzi, Ames G. (1993). Single Specific Primer-Polymerase Chain Reaction (SSP-PCR) and Genome Walking. Methods in Molecular Biology. Vol. 15. pp. 339–48. doi:10.1385/0-89603-244-2:339. ISBN 978-0-89603-244-6. PMID 21400290.
- ^ Khan Z, Poetter K, Park DJ (2008). "Enhanced solid phase PCR: mechanisms to increase priming by solid support primers". Analytical Biochemistry. 375 (2): 391–393. doi:10.1016/j.ab.2008.01.021. PMID 18267099.
- ^ Raoult, D; G Aboudharam; E Crubezy; G Larrouy; B Ludes; M Drancourt (2000-11-07). "Molecular identification by "suicide PCR" of Yersinia pestis as the agent of medieval black death". Proc. Natl. Acad. Sci. U.S.A. 97 (23): 12800–12803. Bibcode:2000PNAS...9712800R. doi:10.1073/pnas.220225197. PMC 18844. PMID 11058154.
- ^ Y.G. Liu; R. F. Whittier (1995). "Thermal asymmetric interlaced PCR: automatable amplification and sequencing of insert end fragments from P1 and YAC clones for chromosome walking". Genomics. 25 (3): 674–81. doi:10.1016/0888-7543(95)80010-J. PMID 7759102.
{{cite journal}}: Unknown parameter|lastauthoramp=ignored (|name-list-style=suggested) (help) - ^ Don RH, Cox PT, Wainwright BJ, Baker K, Mattick JS (1991). "'Touchdown' PCR to circumvent spurious priming during gene amplification". Nucleic Acids Res. 19 (14): 4008. doi:10.1093/nar/19.14.4008. PMC 328507. PMID 1861999.
- ^ Myrick KV, Gelbart WM (2002). "Universal Fast Walking for direct and versatile determination of flanking sequence". Gene. 284 (1–2): 125–131. doi:10.1016/S0378-1119(02)00384-0. PMID 11891053.
- ^ "Full Text – LaNe RAGE: a new tool for genomic DNA flanking sequence determination".
- ^ Park DJ (2005). "A new 5' terminal murine GAPDH exon identified using 5'RACE LaNe". Molecular Biotechnology. 29 (1): 39–46. doi:10.1385/MB:29:1:39. PMID 15668518.
- ^ Park DJ (2004). "3'RACE LaNe: a simple and rapid fully nested PCR method to determine 3'-terminal cDNA sequence". BioTechniques. 36 (4): 586–588, 590. doi:10.2144/04364BM04. PMID 15088375.
- ^ "Key ingredient in coronavirus tests comes from Yellowstone's lakes". Science (in الإنجليزية). 2020-03-31. Retrieved 2020-05-13.
- ^ Kleppe K, Ohtsuka E, Kleppe R, Molineux I, Khorana HG (1971). "Studies on polynucleotides. XCVI. Repair replications of short synthetic DNA's as catalyzed by DNA polymerases". J. Mol. Biol. 56 (2): 341–361. doi:10.1016/0022-2836(71)90469-4. PMID 4927950.
- ^ Rabinow, Paul (1996). Making PCR: A Story of Biotechnology. Chicago: University of Chicago Press. ISBN 978-0-226-70146-2.
- ^ Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books. ISBN 978-0-679-44255-4.
- ^ Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books. ISBN 978-0-679-44255-4.
- ^ Mullis, Kary (1990). "The unusual origin of the polymerase chain reaction". Scientific American. 262 (4): 56–61, 64–5. Bibcode:1990SciAm.262d..56M. doi:10.1038/scientificamerican0490-56. PMID 2315679.
- ^ Patidar, Madhvika; Agrawal, Suraksha; Parveen, Farah; Khare, Parul (2015). "Molecular insights of saliva in solving paternity dispute". Journal of Forensic Dental Sciences. 7 (1): 76–79. doi:10.4103/0975-1475.150325. PMC 4330625. PMID 25709326.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Kary B. Mullis – Nobel Lecture: The Polymerase Chain Reaction".
- ^ "Citations for Chemical Breakthrough Awards 2017 Awardees". Division of the History of Chemistry. Retrieved 12 March 2018.
- ^ Saiki, R.; Scharf, S; Faloona, F; Mullis, K.; Horn, G.; Erlich, H.; Arnheim, N (1985). "Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia". Science. 230 (4732): 1350–1354. Bibcode:1985Sci...230.1350S. doi:10.1126/science.2999980. PMID 2999980.
- ^ Advice on How to Survive the Taq Wars ¶2: GEN Genetic Engineering News Biobusiness Channel: Article. May 1 2006 (Vol. 26, No. 9).
وصلات خارجية
| مراجع مكتبية عن تفاعل الپوليمريز المتسلسل |
- PCR Animation maxanim.com
- OpenPCR Open-source PCR thermalcycler project
- US Patent for PCR
- OpenWetWare
- What is PCR plateau effect? YouTube tutorial video
- GeneWarrior Online PCR Primer design tool
- History of the Polymerase Chain Reaction from the Smithsonian Institution Archives
- Computer exercise. Design of PCR and PCR-RFLP experiments
- CS1 maint: unflagged free DOI
- CS1 errors: unsupported parameter
- CS1 errors: periodical ignored
- Articles containing إنگليزية-language text
- Articles with hatnote templates targeting a nonexistent page
- بيولوجيا جزيئية
- Polymerase chain reaction
- Laboratory techniques
- DNA profiling techniques
- Amplifiers
- Hoffmann-La Roche
- تكنولوجيا حيوية
- Molecular biology techniques
- اختراعات أمريكية