أتپيز الهيدروجين پوتاسيوم
| أتپيز ، أتپيز الهيدرجين پوتاسيم ATPase, H+/K+ exchanging, alpha polypeptide | |||||||
|---|---|---|---|---|---|---|---|
| المعرفات | |||||||
| الرمز | ATP4A | ||||||
| NCBI gene | 495 | ||||||
| HGNC | 819 | ||||||
| OMIM | 137216 | ||||||
| RefSeq | NM_000704 | ||||||
| UniProt | P20648 | ||||||
| بيانات أخرى | |||||||
| EC number | 3.6.3.10 | ||||||
| Locus | Chr. 19 q13.1 | ||||||
| |||||||
| ATPase, H+/K+ exchanging, beta polypeptide | |||||||
|---|---|---|---|---|---|---|---|
| المعرفات | |||||||
| الرمز | ATP4B | ||||||
| NCBI gene | 496 | ||||||
| HGNC | 820 | ||||||
| OMIM | 137217 | ||||||
| RefSeq | NM_000705 | ||||||
| UniProt | P51164 | ||||||
| بيانات أخرى | |||||||
| EC number | 3.6.3.10 | ||||||
| Locus | Chr. 13 q34 | ||||||
| |||||||
أتپيز الهيدروجين پوتاسيوم الهضمي، ويعرف أيضاً بأتپيز H+/K+، هو انزيم يعمل على تحميض المعدة.[1]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الوظيفة الحيوية والموقع
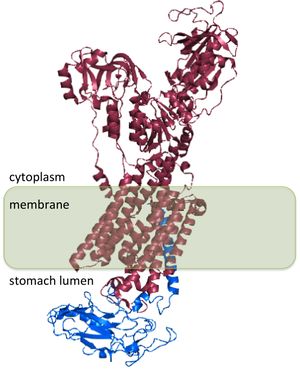
أتپيز الهيدروجين پوتاسيوم المعدي أو أتپيز H+/K+ هو مضخة پروتون المعدة. يعمل هذا الانزيم على تبديل الپوتاسيوم في تجويف الأنبوب المعوي بالهيدروجين السيتوپلازمي[2] هو الانزيم الرئيسي المسئول عن تحميض مكونات المعدة وتنشيط انزيم الپپسين المعدي[3] (انظر عصارة معدية).
يوجد انزيم أتپيز الهيدروجين پوتاسيوم في الخلايا الجدارية، وهي خلايا طلائية شديدة التخصص تقع في الخلايا الداخلية المبطنة للمعدة وتسمى بالغشاء المعدي. تمتلك الخلايا الجدارية نظام غشائي إفرازي موسع وانزيم أتپيز الهيدروجين پوتاسيوم هو المكون الپروتيني الرئيسي لهذه الأغشية. كما توجد كميات صغيرة من انزيم أتپيز الهيدروجين پوتاسيوم في اللب الكلوي.[2]
الجينات وتركيب الپروتين
أتپيز الهيدروجين پوتاسيوم هو پروتين مثنوي، وينتج عن طريق اثنين من الجينات. جين ATP4A[4] الذي يشفر الوحدة الفرعية ألفا من أتپيز الهيدروجين پوتاسيوم، وهو پروتين الحمض الأميني-~1000 الذي يحتوي على مواقع تحفيزية للانزيم ويشكل المسام التي يسمح من خلالها للأغشية الخلوية بنقل الأيونات. ترتبط أيونات الهيدروجين بالمواقع النشطة الموجهة على الوحدة الفرعية ألفا.[5] كما تمتلك الوحدة الفرعية ألفا موقع لإزالة الفوسفات (Asp385).[6] الجين ATP4B[7] يشفر الوحدة الفرعية بيتا من أتپيز الهيدروجين پوتاسيوم، وهي عبارة عن حمض أميني -~300 بنطاق تحفيزي طرفي-الحمض الأميني-36 إن.
تعمل الوحدة بيتا من أتپيز الهيدروجين پوتاسيوم على تثبيت الوحدة بيتا من أتپيز الهيدروجين پوتاسيوم وهي مطلوبة لعمل الانزيم. تمنع الوحدة الفرعية بيتا عملية الضخ من السير في الاتجاه المعاكس،[8] كما يبدو أنها تحتوي على إشارات تقوم بتوجيه الپروتين المثنوي إلى وجهات الغشاء داخل الهلية، بالرغم من أن بعض من هذه الإشارات تابعة للإشارات الموجودة في الوحدة الفرعية ألفا في أتپيز الهيدروجين پوتاسيوم.
تم تحديد بنية الأتپيز الهيدروجين پوتاسيوم في البشر، الكلاب، الخنازير، الفئران، والأرانب وهي متجانسة بنسبة 98% في جميع الأنواع.[2]
آلية ونشاط الإنزيم
العلاقة بالأمراض وتثبيطها
تثبيط ضخ الهيدروجين پوتاسيوم لتخفيض حموضة المعدة من أكثر الطرق شيوعاً لعلاج بعض الأمراض ومنها الارتجاع المعدي المريئي ومرض القرحة الهضمية.[9] تقليل حموضة المعدة يخفف من الأعراض لكنه لا يعالج السبب الحقيقي للارتجاع المعدي المريئي (استرخاء غير طبيعي للمصرة المريئية) أو مرض القرحة المعدية (الملوية البوابية ومضادات الالتهاب اللاستيرويدية).[10]
هناك ثلاث فئات من الأدوية المستخدمة لتثبيط أتپيز الهيدروجين پوتاسيوم. H2-receptor antagonists، مثل السيمتيدين (تاگمت)، يثبت المسار الإشاري الذي يؤدي إلى تنشيط أتپيز الهيدروجين پوتاسيوم. هذا النوع من المثبطات فعالاً في علاج القرح لكنه لا يمنع من تكونها، ويتطور تحمل المريض له خلال أسبوع واحد من العلاج، مما يؤدي إلى انخفاض التأثر إلى 50%.[11] Proton pump inhibitors were later developed, starting with timoprazole in 1975.[11] PPIs هي أدوية أولية منشطة حمياً والتي تثبط أتپيز الهيدروجين پوتاسيوم عن طريق الربط الملزم التساهمي للمضخات النشطة.[12] PPIs الحالية مثل الأومپرازول نصفها العمري قصير يصل إلى 90 دقيقة.[13] مناهضات الضخ الحمي أو حاصرات حمض الپوتاسيوم (PCABs) هي ثالث أنواع المثبطات التي تحصر الإفراز الحمضي بالارتباط بموقع الپوتاسيوم النشط.[11] توفر الـAPAs تثبيط أسرع من الـPPIs حيث أنها لا تتطلب نشاط حمضي. كان الرڤاپرازان أول APA يستخدم سريرياً في شرق ىسيا، وشهد تطورات منذ تبين في التجارب السريرية أنه يوفر تحكم أفضل في حموضة المعدة.[13]
كما قد يؤدي تعطيل ضخ الپروتون إلى مشكلات صحية. في دراسة على الفئران قام بها كريگ وزملائه،[14] تبين أن طفرة في الوحدة الفرعية ألف في المضخة قد تؤدي إلى فقد حمض المعدة والذي ينتج عنه مشكلات في امتصاص الحديد، مما يؤدي إلى نقص الحديد وفقر الدم. لم يرتبط استخدام PPIs بارتفاع مخاطر الإصابة بفقر الدم، ومن ثم يعتقد أن أتپيز الهيدروجين پوتاسيوم يساعد على امتصاص الحديد لكنه ليس مطلوب بالضرورة.[14]
الربط الحالي بين الخرف وPPIs تم توثيقه في ألمانيا وفي مقالات بحثية أشارت إلى كيفية تفاعل مشتقات البنزيميدازول، الأستيميزول واللانسوپرازول مع المجموعات الشاذة من پروتين تاو (التشابك الليفي العصبي).[15][16][17] تشمل النظريات الحالية الحصر الغير انتقائي لمضخات الصوديوم-الپوتاسيوم في المخ التي تسبب الاختلالات التناضحية والأورام في الخلايا. [رأي استشاري] التفاعل بين PPIs والأدوية الأخرى المؤثرة على ضخ الصوديوم-الپوتاسيوم، مثل الديجوكسين، الوارفارين وغيرها، تم توثيقه بشكل جيد.[18] ارتباط الذاكرة والخلايا النجمية والوحدات الفرعية ألفا 3 في مستقبل الأدينوسين الموجودة في مضخات الهيدروجين/الصوديوم-الپوتاسيوم قد يكون نقطة محورية في الخرف.[19][20][21] الاستخدام المزمن لـ PPIs قد يخل بتنظيم الوحدات الفرعية ألفا 3 مما يؤدي إلى المزيد من الضرر في الخلايا النجمية.[22]تصخر العظام بواسطة الجين TCIRG1 يرتبط ارتباطاً قوياً بالخرف الكهلي.[23][24]
انظر أيضاً
المصادر
- ^ Sakai, Hideki; Fujii, Takuto; Takeguchi, Noriaki (2016). "Chapter 13. Proton-Potassium (H+/K+) ATPases: Properties and Roles in Health and Diseases". In Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel (eds.). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. Vol. 16. Springer. pp. 459–483. doi:10.1007/978-4-319-21756-7_13.
- ^ أ ب ت Shin, J. M.; Munson, K.; Vagin, O.; Sachs, G. (2009). "The gastric HK-ATPase: structure, function and inhibition". Pflügers Archiv : European Journal of Physiology. 457 (3): 609–622. doi:10.1007/s00424-008-0495-4. PMC 3079481. PMID 18536934.
- ^ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2012). Biochemistry (7th ed.). New York: W.H. Freeman and Company.
- ^ ATP4A ATPase H+/K+ transporting alpha subunit
- ^ Chourasia, M.; Sastry, G. M.; Sastry. G. N. (2005). "Proton binding sites and conformational analysis of H+K+-ATPase". Biochemical and Biophysical Research Communications. 336 (3): 961–966. doi:10.1016/j.bbrc.2005.08.205.
- ^ Scheirlinckx, F.; Raussens, V.; Ruysschaert, J.-M.; Goormaghtigh, E. (2004). "Conformational changes in gastric H+/K+-ATPase monitored by difference Fourier-transform infrared spectroscopy and hydrogen/deuterium exchange". Biochemical Journal (Pt 1 ed.). 382: 121–129. doi:10.1042/BJ20040277. PMC 1133922. PMID 15096097.
- ^ ATP4B ATPase H+/K+ transporting beta subunit
- ^ Abe, K.; Tani, K.; Nishizawa, T.; Fujiyoshi, Y. (2009). "Inter-subunit interaction of gastric H+,K+-ATPase prevents reverse reaction of the transport cycle". The EMBO Journal. 28 (11): 1637–1643. doi:10.1038/emboj.2009.102. PMC 2693145. PMID 19387495.
- ^ Shin, J. M.; Vagin, O.; Munson, K.; Kidd, M.; Modlin, I. M.; Sachs, G. (2008). "Molecular mechanisms in therapy of acid-related diseases". Cellular and Molecular Life Sciences : CMLS. 65 (2): 264–281. doi:10.1007/s00018-007-7249-x. PMC 3081136. PMID 17928953.
- ^ Yeomans, N. D. (2011). "The ulcer sleuths: The search for the cause of peptic ulcers". Journal of Gastroenterology and Hepatology. 26: 35–41. doi:10.1111/j.1440-1746.2010.06537.x. PMID 21199512.
- ^ أ ب ت Sachs, G.; Shin, J. M.; Vagin, O.; Lambrecht, N.; Yakubov, I.; Munson, K. (2007). "The Gastric H,K ATPase as a Drug Target: Past, Present and Future". Journal of Clinical Gastroenterology. 41 (Suppl 2): S226–S242. doi:10.1097/MCG.0b013e31803233b7. PMC 2860960. PMID 17575528.
- ^ Shin J. M.; Sachs G. (2008). "Pharmacology of Proton Pump Inhibitors". Current Gastroenterology Reports. 10 (6): 528–534. doi:10.1007/s11894-008-0098-4. PMC 2855237. PMID 19006606.
- ^ أ ب Shin, J. M.; Sachs, G. (2009). "Long lasting inhibitors of the gastric H,K-ATPase". Expert Review of Clinical Pharmacology. 2 (5): 461–468. doi:10.1586/ecp.09.33. PMC 2995460. PMID 21132072.
- ^ أ ب Krieg L.; Milstein O.; Krebs, P.; Xia, Y.; Beutler B.; Du, X. (2011). "Mutation of the gastric hydrogen-potassium ATPase alpha subunit causes iron-deficiency anemia in mice". Blood. 118 (24): 6418–6425. doi:10.1182/blood-2011-04-350082. PMC 3236123. PMID 21976678.
- ^ Gomm W, von Holt K, Thomé F, Broich K, Maier W, Fink A, Doblhammer G, Haenisch B (2016). "Association of Proton Pump Inhibitors With Risk of Dementia: A Pharmacoepidemiological Claims Data Analysis". JAMA Neurol. 73 (4): 410–416. doi:10.1001/jamaneurol.2015.4791. PMID 26882076.
- ^ Rojo LE, Alzate-Morales J, Saavedra IN, Davies P, Maccioni RB (2010). "Selective interaction of lansoprazole and astemizole with tau polymers: potential new clinical use in diagnosis of Alzheimer's disease". J Alzheimers Dis. 19 (2): 573–89. doi:10.3233/JAD-2010-1262. PMC 2951486. PMID 20110603.
- ^ Fawaz MV, Brooks AF, Rodnick ME, Carpenter GM, Shao X, Desmond TJ, Sherman P, Quesada CA, Hockley BG, Kilbourn MR, Albin RL, Frey KA, Scott PJ (2014). "High affinity radiopharmaceuticals based upon lansoprazole for PET imaging of aggregated tau in Alzheimer's disease and progressive supranuclear palsy: synthesis, preclinical evaluation, and lead selection". ACS Chem Neurosci. 5 (8): 718–30. doi:10.1021/cn500103u. PMC 4140593. PMID 24896980. Epub 2014 Jun 16.
- ^ Trifirò G, Corrao S, Alacqua M, Moretti S, Tari M, Caputi AP, Arcoraci V (2006). "Interaction risk with proton pump inhibitors in general practice: significant disagreement between different drug-related information sources". Br J Clin Pharmacol. 62 (5): 582–90. doi:10.1111/j.1365-2125.2006.02687.x. PMC 1885178. PMID 16822281.
- ^ Björklund O, Shang M, Tonazzini I, Daré E, Fredholm BB (2008). "Adenosine A1 and A3 receptors protect astrocytes from hypoxic damage". Eur J Pharmacol. 596 (1–3): 6–13. doi:10.1016/j.ejphar.2008.08.002. PMID 18727925. Epub 2008 Aug 13.
- ^ Carmona MA, Murai KK, Wang L, Roberts AJ, Pasquale EB. "Glial ephrin-A3 regulates hippocampal dendritic spine morphology and glutamate transport". Proc Natl Acad Sci U S A. 106 (30): 12524–12529. doi:10.1073/pnas.0903328106. PMC 2718351. PMID 19592509.
- ^ Ben Haim L, Carrillo-de Sauvage MA, Ceyzériat K, Escartin C (2015). "Elusive roles for reactive astrocytes in neurodegenerative diseases". Front Cell Neurosci. 9: 278. doi:10.3389/fncel.2015.00278. PMC 4522610. PMID 26283915.
{{cite journal}}: CS1 maint: unflagged free DOI (link) eCollection 2015 - ^ Gessi S, Merighi S, Stefanelli A, Fazzi D, Varani K, Borea PA (2013). "A(1) and A(3) adenosine receptors inhibit LPS-induced hypoxia-inducible factor-1 accumulation in murine astrocytes". Pharmacol Res. 76: 157–70. doi:10.1016/j.phrs.2013.08.002. PMID 23969284. Epub 2013 Aug 19.
- ^ "TCIRG1". Genetics Home Reference.
- ^ Kaifu T, Nakahara J, Inui M, Mishima K, Momiyama T, Kaji M, Sugahara A, Koito H, Ujike-Asai A, Nakamura A, Kanazawa K, Tan-Takeuchi K, Iwasaki K, Yokoyama WM, Kudo A, Fujiwara M, Asou H, Takai T (2003). "Osteopetrosis and thalamic hypomyelinosis with synaptic degeneration in DAP12-deficient mice". J Clin Invest. 111 (3): 323–32. doi:10.1172/JCI16923. PMC 151867. PMID 12569157.
وصلات خارجية
- Yao X, Forte JG (2003). "Cell biology of acid secretion by the parietal cell". Annu. Rev. Physiol. 65: 103–31. doi:10.1146/annurev.physiol.65.072302.114200. PMID 12500969.
- Kühlbrandt W (April 2004). "Biology, structure and mechanism of P-type ATPases". Nat. Rev. Mol. Cell Biol. 5 (4): 282–95. doi:10.1038/nrm1354. PMID 15071553.
- Dunbar LA, Caplan MJ (August 2001). "Ion pumps in polarized cells: sorting and regulation of the Na+, K+- and H+, K+-ATPases". J. Biol. Chem. 276 (32): 29617–20. doi:10.1074/jbc.R100023200. PMID 11404365.
- Sachs G, Shin JM, Briving C, Wallmark B, Hersey S (1995). "The pharmacology of the gastric acid pump: the H+,K+ ATPase". Annu. Rev. Pharmacol. Toxicol. 35: 277–305. doi:10.1146/annurev.pa.35.040195.001425. PMID 7598495.
- MeSH Potassium+Hydrogen+ATPase