ڤانكوميسين
 | |
| البيانات السريرية | |
|---|---|
| فئة السلامة أثناء الحمل | |
| مسارات الدواء | IV, oral |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية |
|
| بيانات الحركية الدوائية | |
| التوافر الحيوي | Negligible (oral) |
| الأيض | Excreted unchanged |
| Elimination half-life | 4–11 hours (adults) 6-10 days (adults, impaired renal function) |
| الإخراج | Renal |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.014.338 |
| Chemical and physical data | |
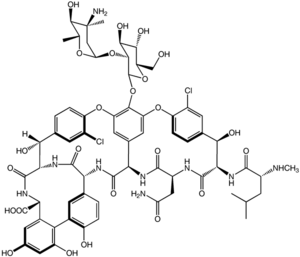
| التركيب | C66H75Cl2N9O24 |
| الكتلة المولية | 1449.3 g.mol-1 |
ڤانكوميسين، هو مضاد حيوي من مجموعة الگليكوپپتيد يستعمل للوقاية من ولعلاج الجراثيم إيجابية الگرام، وغالباً ما يكون هذا المضاد هو الورقة الأخيرة لعلاج العدوى الميكروبية حيث تفشل المضادات الأخرى. ولكن، نظرالإزدهار الميكروبات التي تقاوم الڤانكوميسين، فقد أستبدل في هذا السياق بمضادات مثل لينزوليد وداپتومايسين.
التاريخ
تم ڤانكوميسين تم فصله لأول مرة بواسطة إدموند كورنفيلد الذي يعمل في شركة إلاي لـِلي، من عينة من التربة في غابات بورنيو، وأطلق على الميكروب إسم أميسولاتوپسيس أورياناليس. [1] من أهم دواعى إستعمال ڤانكوميسين الستافيلوكوكوس المقاومة للپنسلين.[2][3]
التخليق الحيوي
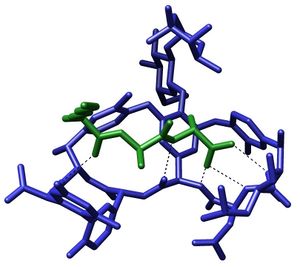
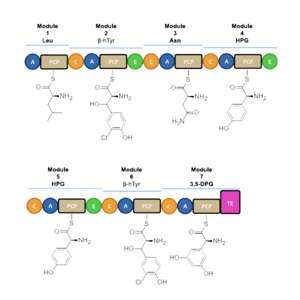
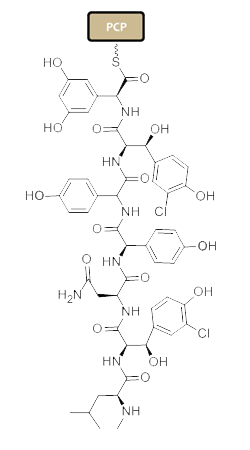
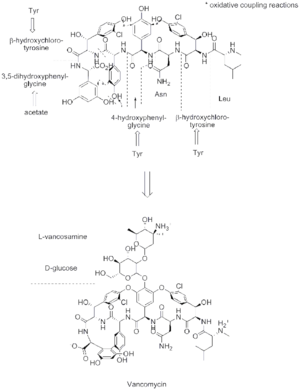
تخليق الپپتيد اللا ريبوسومي يحدث عبر الوحدات المتمايزة التي يمكنها تحميل وتفريغ الپروتين عن طريق أحد الأحماض الأمينية عبر تشكيل رابطة أميد في مواقع اتصال النطاقات النشطة.[4] تتألف كل وحدة من نطاق adenylation (A)، نطاق الپروتين الحامل للپپتيديل، ونطاق التركيز أو التمدد (C). في النطاق A، يتم تنشيط حمض أميني معين عن طريق تحويله إلى مركب انزيم أدينليت أمينوسيل مرتبط to a 4’phosphopantetheine cofactor by thioesterification [5] [6] بعد ذلك ينتقل المركب إلى نطاق الپروتين الحامل للپپتيديل مع طرد AMP. نطاق الپروتين الحامل للپپتيديل يستخدم 4’-phosphopantethein prosthetic group لتحميل سلسلة الپپتيد النامية وبادئاتها.[7] تنظيم الوحدات الضرورية للتخليق الحيوي للڤانكوميسين موضحة في الشكل-1. في التخليق الحيوي للڤانكوميسين، نطاقات التعديل الإضافية تكون موجودة، مثل نطاق epimerization (E)، والذي يستخدم في مصاوغة الحمض الأميني من كيمياء فراغية لأخرى، ونطاق thioesterase (TE) يستخدم كمحفظ للبلورة ويطلق الوحدة عن طريق thioesterase scission.
الكيمياء والفارماكولوجى
الإستعمالات السريرية
دواعى الإستعمال
التأثيرات الجانبية
إعتبارات الجرعة
الإستعمال عن طريق الفم / طريق الحقن الوريدى
عرض الرجل الأحمر
مراقبة الجرعات الدوائية
السمية
تسمم الكلي
تسمم العصب السمعي
التفاعل مع أدوية يسبب تسمم العصب السمعي
المقاومة للمضاد الحيوى
المقاومة الداخلية
المقاومة المكتسبة
المراجع
- ^ Levine DP (2006). "Vancomycin: a history". Clin Infect Dis. 42 (Suppl 1): S5-12. doi:10.1086/491709.
- ^ Moellering, RC Jr. (2006). "Vancomycin: A 50-Year Reassessment". Clin Infect Dis. 42: S3–S4. PMID 16323117.
- ^ Donald P. (2006). "Vancomycin: A History". Clin Infect Dis. 42: S5–S12. doi:10.1086/491709. PMID 16323120.
- ^ van Wageningen AM, Kirkpatrick PN, Williams DH; et al. (1998). "Sequencing and analysis of genes involved in the biosynthesis of a vancomycin group antibiotic". Chem. Biol. 5 (3): 155–62. PMID 9545426.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Schlumbohm W, Stein T, Ullrich C; et al. (1991). "An active serine is involved in covalent substrate [[amino acid]] binding at each reaction center of gramicidin S synthetase". J. Biol. Chem. 266 (34): 23135–41. PMID 1744112.
{{cite journal}}: Explicit use of et al. in:|author=(help); URL–wikilink conflict (help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Stein T, Vater J, Kruft V; et al. (1996). "The multiple carrier model of nonribosomal peptide biosynthesis at modular multienzymatic templates". J. Biol. Chem. 271 (26): 15428–35. PMID 8663196.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Kohli RM, Walsh CT, Burkart MD (2002). "Biomimetic synthesis and optimization of cyclic peptide antibiotics". Nature. 418 (6898): 658–61. doi:10.1038/nature00907. PMID 12167866.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link)
أنظر أيضا
- مقاومة الدواء
- مقاومة المضاد الحيوي
- مكورات عنقودية ذهبية مقاومة للمثيسيلين
- مكورات عنقودية ذهبية مقاومة للڤانكوميسين
- Vancomycin-resistant enterococcus
وصلات خارجية
- CS1 errors: unsupported parameter
- CS1 errors: URL–wikilink conflict
- Drugs with non-standard legal status
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Articles without EBI source
- Articles without KEGG source
- Articles without InChI source
- Articles without UNII source
- Articles containing unverified chemical infoboxes
- إلاي للي
- مضادات حيوية گليكوپپتيدية
- الأدوية الأساسية حسب منظمة الصحة العالمية