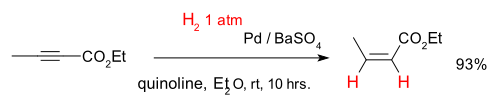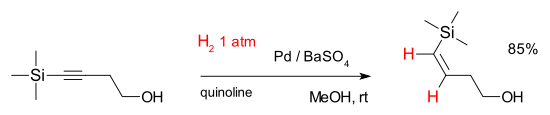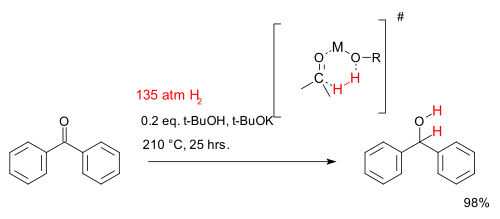هدرجة
| نوع العملية | Chemical |
|---|---|
| القطاع الصناعي | الصناعة الغذائية، الصناعة البتروكيماوية والصناعة الدوائية والصناعة الزراعية |
| التقنيات أو العملية الجزئية الرئيسة | مختلف المحفزات من الفلزات الانتقالية، تقنية الضغط العالي |
| المواد الأولية | Unsaturated substrates and hydrogen or hydrogen donors |
| المنتج | هيدروكربونات مشبعة ومشتقاتها |
| المخترع | پول ساباتييه |
| سنة الاختراع | 1897 |
الهدرجة هي عملية كيميائية تحدث عن طريق إضافة جزئ هيدروجين ، بهدف زيادة درجة تشبع المركب العضوي.
الهَدْرَجة عملية كيميائية يضاف فيها الهيدروجين إلى مادة ما. وتتم هَدْرَجةُ الزيوت والسوائل الدهنية غالبًا لتحسين نوعيتها. فعلى سبيل المثال، تتم هدرجة زيت الفول السوداني لتحويله إلى مادة صلبة ولتحسين رائحته ومذاقه. وتُعدّ عملية الهدرجة مهمه في تحضير مواد البترول. وتستخدم الهدرجة في تصنيع الزيت الخام من الفحم الحجري. وفي هذه العملية يتم خلط مسحوق الفحم الحجري مع قليل من الزيت، وتتم هدرجتها باستخدام كل من الحرارة والضغط.
ويطلق على المادة التي تحتوي جزيئاتها على بعض ذرات الهيدروجين، إلا أنها يمكن أن تقبل المزيد منها، بأنها غير مشبعة. فعلى سبيل المثال يُعدّ غاز الإثيلين (C2 H4)، مركبا غير مشَبّع. وعندما تتم هدرجة الإيثيلين فإنّ الرابطة المزدوجة (الرابطة الكيميائية) التي تربط بين ذرتين من الكربون تتفكك وينتج عن ذلك رابطة فردية وإضافة ذرتين من الهيدروجين إلى الجزيء. ويُسمى المركب الناتج غاز الإيثان (C2 H6). ويُعد الإيثان مركبًا مشبعـًا، ذلك لأن الجزيئات تحتوي على أكبر عدد ممكن من ذرات الهيدروجين.
والحفازات وهي مواد تزيد من سرعة التفاعلات الكيميائية ضرورية لجعل الهدرجه عملية اقتصادية. وفي عام 1912، تسلم الكيميائي الفرنسي پول ساباتييه جائزة نوبل في الكيمياء، لأنه اكتشف أن النيكل عنصر حفاز جيد في عملية الهدرجة. وتُستخدم عدة عناصر حفازة في الوقت الحاضر لعملية الهدرجه تشمل البلاتين والنيكل الراني (وهو خليط من الألومنيوم والنيكل ومعالج بالصودا الكاوية).
العملية
تتم الهدرجة بوجود ثلاث عناصر:
- مادة غير مشبعة.
- الهيدروجين (أو مصدر للهيدروجين) دائم.
- محفز.
المحفزات
الهدرجة الحفزية للألكينات تنتج الألكان المقابل. يتم التفاعل تحت الضغط في وجود محفز فلزي. ومن الحفازات الصناعية الشائعة الاستخدام البلاتين, النيكل, البلاديوم, وذلك للاستخدام في المعامل. وغالبا ما يستخدم نيكل راني, وهو سبيكة من النيكل والألومنيوم.
المعادلة القادمة توضح هدرجة الإثيلين للحصول على الإيثان:
CH2=CH2 + H2 → CH3-CH3.
ميكانيكية التفاعل
Because of its technological relevance, metal-catalyzed “activation” of H2, has been the subject of considerable study, focusing on the reaction mechanisms of by which metals mediate these reactions.[1] First of all isotope labeling using deuterium can be used to determine the regiochemistry of the addition:
- RCH=CH2 + D2 → RCHDCH2D
Essentially, the metal binds to both components to give an intermediate alkene-metal(H)2 complex. The general sequence of reactions is:
- binding of the hydrogen to give a dihydride complex ("oxidative addition"):
- LnM + H2 → LnMH2
- binding of alkene:
- LnM(η2H2) + CH2=CHR → Ln-1MH2(CH2=CHR) + L
- transfer of one hydrogen atom from the metal to carbon (migratory insertion)
- Ln-1MH2(CH2=CHR) → Ln-1M(H)(CH2-CH2R)
- transfer of the second hydrogen atom from the metal to the alkyl group with simultaneous dissociation of the alkane ("reductive elimination")
- Ln-1M(H)(CH2-CH2R) → Ln-1M + CH3-CH2R
Preceding the oxidative addition of H2 is the formation of a dihydrogen complex.
مصادر الهيدروجين
The obvious source of H2 is the gas itself, often under pressure. Hydrogen can also be transferred from hydrogen-donor molecules, such as hydrazine,[2][3] dihydronaphthalene, dihydroanthracene, isopropanol, and formic acid.[4][5] Transfer hydrogenation can be metal catalysed. Hydrogenation does proceed from some hydrogen donors without catalysts, examples being diimide and aluminium isopropoxide. Some reactions (e.g. reduction of thioketals) do not require the addition of hydrogen if a freshly prepared Raney Nickel catalyst is used; sufficient hydrogen is deposited on the catalyst as it is prepared. Recently flow hydrogenation systems have been developed that use hydrolysis of water as their source of hydrogen to produce the hydrogen on-demand.
درجات الحرارة
يتم التفاعل الكيميائي لعملية الهدرجة في مختلف درجات الحرارة ويعتمد الضغط على نوع المادة العضوية التي يتم هدرجتها. وعملية الهدرجة هي تفاعل قوي. في هدرجة الزيوت النباتية والأحماض الدهنية ، على سبيل المثال ، تصل درجة الحرارة إلى 25 كيلو سعر/المول ، لتوصل درجة حرارة الزيت إلى 1.6 - 1.7 درجة أيودية.
المدى
Alkynes can be selectively converted into alkenes in a so-called semihydrogenation, for instance with the compound Ethyl 2-Butynoate and catalyst palladium on barium sulfate and quinoline (which deactivates the catalyst enhancing chemoselectivity):[6]
or with 4-(trimethylsilyl)-3-butyn-1-ol:[7]
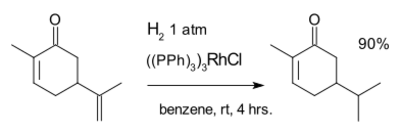
The next reaction featuring carvone is an example of homogeneous catalysis i.e. the محفز ولكنسون:[8]
Hydrogenation is sensitive to steric hindrance explaining the selectivity for reaction with the exocyclic double bond but not the internal double bond.
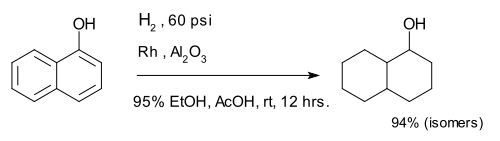
The compound 1-naphthol is completely reduced to a mixture of decalin-ol isomers.[9]
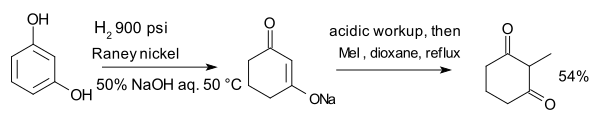
المركب resorcinol, hydrogenated with نيكل راني في وجود هيدروكسيد الصوديوم المائي يشكل enolate which is alkylated with methyl iodide to 2-methyl-1,3-cyclohexandione:[10]
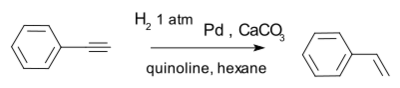
An effective catalyst is the Lindlar catalyst for example in the conversion of phenylacetylene to styrene.[11]
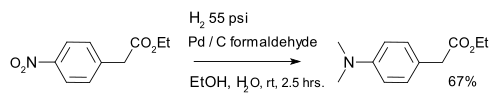
Hydrogenation is also used in organic reduction of nitro compounds, for instance aromatic nitro compounds in combination with palladium on carbon and formaldehyde:[12]
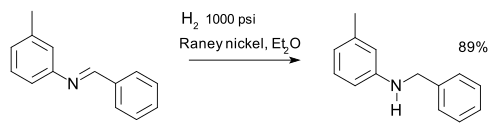
or the reduction of imines, for example in a synthesis of m-tolylbenzylamine:[13]
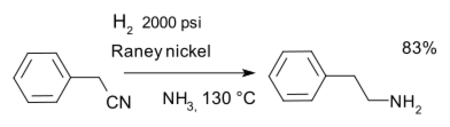
or the reduction of nitriles for instance in a synthesis of phenethylamine with Raney nickel and ammonia:[14]
في الصناعات الغذائية
| أنواع الدهون في الغذاء |
|---|
| انظر أيضاً |
تستخدم الهدرجة على نطاق واسع في عمليات الصناعات الغذائية ، حيث يتم معالجة الزيوت النباتية والدهون. وذلك بغرض تحويل الأحماض الدهنية الغير مشبعة إلى أحماض دهنية مشبعة.
وعملية إشباع الزيوت بالهيدروجين المقصود الرئيس منها هو إكساب تلك الزيوت النباتية الطبيعية قدرات فائقة غير طبيعية على مقاومة العوامل التي تُعجل في تأكسد الدهون وبالتالي فسادها، ما يعني أن مدة صلاحيتها ستتجاوز بمراحل عديدة جداً ما هو طبيعي منها. وتأثرها بالحرارة أو ضوء الشمس أو الهواء سيكون أيضاً أقل.
إن هدرجة الزيوت النباتية يجعل من السهل استخدامها في إعداد أطعمة تعيش لمدة أطول دون أن تفسد، وكذلك تُعطيها نكهة أفضل وشكلاً ذا بُنية غير قابلة للذبول. ولذا فإن الدهون التقابلية متركزة في المأكولات المقلية والـ «دونـَت» والحلويات من المعجنات والمعجنات المخبوزة والمقرمشات والبسكويت وغيرها كثير.
الآثار الصحية
 مقالة مفصلة: دهون تقابلية
مقالة مفصلة: دهون تقابلية
أسباب استخدام الزيوت المهدرجة
تستخدم الزيوت المهدرجة في الأطعمة لثلاثة أساب هي:
التكلفة: فالزيوت المهدرجة أرخص ثمناً من زيت الزيتون البكر وزيت جوز الهند الصحي، كما أنهما ليس لهما نفس المذاق ولا يحققان الطراوة المطلوبة.
العوامل التسويقية: لا تستطيع الزيوت النباتية الإحلال محل الزيوت المهدرجة في كل أنواع الطعام خاصة في المخبوزات، كما أن هناك عاملاً حقيقياً يرجع إلى "جهل بالمواد الموجودة في الطعام" فمعظمنا لا نقرأ لائحة المكونات، ومن يقرأها يجهل معناها، كما أن كلمة "خال من الكوليسترول" تعد كلمة سحرية، بعدها يشتري الشخص هذه المنتجات بلا تفكير وفي حقيقة الأمر هي ضارة وتحمل بداخلها أمراضاَ كثيرة. مدة الصلاحية: تبقى الأطعمة التي تحتوي على زيوت مهدرجة لمدة أطول على الرف ولا تحتاج إلى الثلاجات لحفظها، وتحتفظ بنكهتها لمدة طويلة، كما أنها لا تكلف كثيراً بالنسبة للشحن، فهي لا تحتاج إلى الثلاجات و تتحمل الظروف القاسية أحياناً دون أن تفسد، لذا تستخدمها المصانع أحياناً دون الحاجة إلى وجودها في الطعام.
المستوى المسموح بتناوله من هذه الأطعمة
تسمح بريطانيا بتناول كحد أقصى 4.4 جرام للنساء و 5.6 للرجال، ولكن هل تعلم أن وجبة من الدجاج المقلي والبطاطس تحتوي على 4 جرامات من الزيوت المهدرجة (وتعد وجبة واحدة في اليوم).
المخاطر الصحية
إن الأدلة العلمية الطبية تشير إلى أن تناول الدهون المتحولة يرفع من نسبة الكوليسترول الخفيف الضار بالجسم ارتفاعه، ويُقلل من نسبة الكوليسترول الثقيل المفيد للجسم ارتفاعه. ما يتسبب في إصابة الشرايين بمرض تصلب الشرايين وظهور ترسبات الكوليسترول السادة لها في أجزائها، الأمر الذي يُؤدي إلى أمراض شرايين القلب و السكتة الدماغية.
ومن الناحية الصحية فإنه لا يُعلم حتى اليوم أي فائدة من تناول هذا النوع من الدهون ، بل على العكس فإن كل المُؤشرات العلمية الطبية تتحدث عن مضارها على صحة الإنسان. ولذا يحرص أطباء القلب وغيرهم على النصيحة بتجنب تناولها وتناول الأطعمة المحتوية عليها أسوة بتحذيرهم من تناول الدهون المشبعة والكوليسترول. لكن الفارق في التحذير أن ثمة منافع للإنسان من تناول الدهون المشبعة والكوليسترول بكميات قليلة ، بخلاف الدهون المتحولة الدخيلة على حياة الإنسان وطعامه، والتي لا قيمة أو منفعة منها البته.
هدرجة الفحم
- Main article: Bergius process
التاريخ
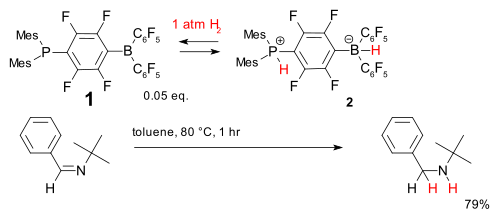
Metal-free hydrogenation
انظر أيضا
- Dehydrogenation
- Transfer hydrogenation
- Hydrogenolysis
- Hydrodesulfurization, Hydrotreater and Oil desulfurization
قراءات إضافية
- Jang ES, Jung MY, Min DB (2005). "Hydrogenation for Low Trans and High Conjugated Fatty Acids" (PDF). Comprehensive Reviews in Food Science and Food Safety. 1.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Fred A. Kummerow (2008). Cholesterol Won't Kill You, But Trans Fat Could. Trafford. ISBN 142513808.
{{cite book}}: Check|isbn=value: length (help)
المصادر
- ^ Kubas, G. J., "Metal Dihydrogen and σ-Bond Complexes", Kluwer Academic/Plenum Publishers: New York, 2001
- ^ Leggether, B. E.; Brown, R. K. Can. J. Chem. 1960, 38, 2363.
- ^ Kuhn, L. P. J. Am. Chem. Soc. 1951, 73, 1510.
- ^ Davies, R. R.; Hodgson, H. H. J. Chem. Soc. 1943, 281.
- ^ van Es, T.; Staskun, B. Org. Syn., Coll. Vol. 6, p.631 (1988); Vol. 51, p.20 (1971). (Article)
- ^ Organic Syntheses, Coll. Vol. 7, p.226 (1990); Vol. 64, p.108 (1986).http://orgsynth.org/orgsyn/pdfs/CV7P0226.pdf
- ^ Organic Syntheses, Coll. Vol. 8, p.609 (1993); Vol. 68, p.182 (1990). http://orgsynth.org/orgsyn/pdfs/CV8P0609.pdf
- ^ Organic Syntheses, Coll. Vol. 6, p.459 (1988); Vol. 53, p.63 (1973). http://orgsynth.org/orgsyn/pdfs/CV6P0459.pdf
- ^ Organic Syntheses, Coll. Vol. 6, p.371 (1988); Vol. 51, p.103 (1971). http://orgsynth.org/orgsyn/pdfs/CV6P0371.pdf
- ^ Organic Syntheses, Coll. Vol. 5, p.743 (1973); Vol. 41, p.56 (1961). http://orgsynth.org/orgsyn/pdfs/CV5P0567.pdf
- ^ Organic Syntheses, Coll. Vol. 5, p.880 (1973); Vol. 46, p.89 (1966). http://orgsynth.org/orgsyn/pdfs/CV5P0880.pdf
- ^ Organic Syntheses, Coll. Vol. 5, p.552 (1973); Vol. 47, p.69 (1967). http://orgsynth.org/orgsyn/pdfs/CV5P0552.pdf
- ^ Organic Syntheses, Coll. Vol. 3, p.827 (1955); Vol. 21, p.108 (1941). http://orgsynth.org/orgsyn/pdfs/CV3P0827.pdf
- ^ Organic Syntheses, Coll. Vol. 3, p.720 (1955); Vol. 23, p.71 (1943). http://orgsynth.org/orgsyn/pdfs/CV4P0603.pdf