الغدة الكظرية
| الغدة الكظرية Adrenal gland | |
|---|---|
 تقع الغدتان الكظريتان فوق الكليتين. | |
 | |
| Details | |
| Precursor | الأديم المتوسط والعرف العصبي |
| النظام | جهاز الغدد الصماء |
| الشريان | الشريان الكظري العلوي والسفلي |
| الوريد | الوريد الكظري |
| Nerve | الضفيرة البطنية والكلوية |
| لمف | العقد اللمفية حول الأبهر |
| Identifiers | |
| اللاتينية | Glandula suprarenalis |
| MeSH | D000311 |
| TA98 | A11.5.00.001 |
| TA2 | 3874 |
| FMA | 9604 |
| المصطلحات التشريحية | |
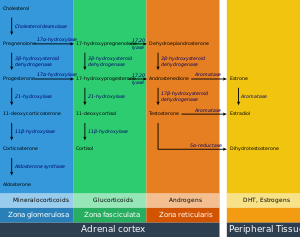
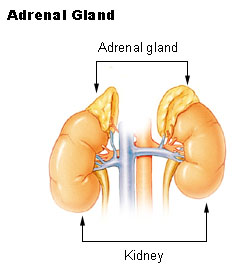
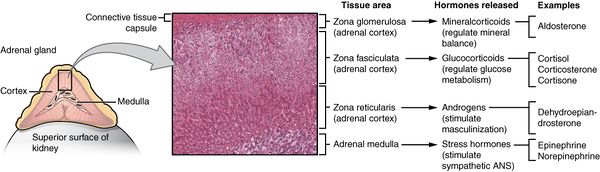
الغدد الكظرية (تُعرف أيضاً بالغدد الفوق كلوية suprarenal glands)، هي الغدتان الصماوتان التي تنتج مجموعة متنوعة من الهرمونات منها الأدرينالين والسترويدات مثل الألدوسترون والكوريتسول.[1][2] توجد الغدتان الكظريتان فوق الكلى. لكل غدة قشرة والتي تُنتج هرمونات سترويدية ولب. تنقسم قشرة الكظر إلى ثلاثة مناطق: المنطقة الكبيبية zona glomerulosa، المنطقة الحزمية zona fasciculata، والمنطقة الشبكية zona reticularis.[3]
تُنتج القشرة الكظرية ثلاث أنواع رئيسية من الهرمونات السترويدية: القشرانيات المعدنية mineralocorticoid، القشرانيات السكرية glucocorticoid، والأندروجينات androgen. القشرانيات المعدنية (مثل الأدلوسرتون) يُنتج في المنطقة الكبيبية ويساعد في تنظيم ضغط الدم والتوازن الكهربي. القشرانيات السكرية مثل الكوريتسول والكورتيكوسترون تُخلق في المنطقة الحزمية؛ ومن وظائفهما تنظيم الأيض وتثبيط الجهاز المناعي. المنطقة الداخلية من القشرة، المنطقة الشبكية، تنتج الأندروجينات التي تتحول إلى هرمونات جنسية وظيفية في الغدد التناسلية والأعضاء المستهدفة الأخرى.[4] يطلق على إنتاج الهرمونات السترويدية التخليق السترويدي، ويتضمن عدد من التفاعلات والعمليات والتي تحدث في الخلايا القشرية.[5] يُنتج لب الكظر الأدرينالين والنورأدرينالين الكاتيكولاميني، ووظيفتهما إنتاج الاستجابة السريعة عند تعرض الجسم للضغوط النفسية.[4]
يتسبب قصور الغدة الكظرية في عدد من أمراض الغدد الصماء. يؤدي فرط إنتاج الكورتيسول إلى متلازمة كوشينگ، بينما يرتبط نقص إنتاج بمرض أديسون. فرط تنسج الكظر الخلقي Congenital adrenal hyperplasia هو مرض وراثي ينتج عن خلل في آليات التحكم في الغدد الصماء.[4][6] قد تنشأ أنواع مختلفة من الأورام من النسيج الكظري وعادة ما يتم العثور عليها في التصوير الطبي عند البحث عن أمراض أخرى.[7]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التكوين
تقع الغدد الكظرية على جانبي الجسم في تجويف خلف الصفاق retroperitoneum، إلى الوسطي والجانبي|الوسط قليلاً من أعلى الكلى. في البشر، تكون الغدة الكظرية اليمنى هرمية الشكل، بينما تكون اليسرى شبه هلالية وأكبر نوعاً ما.[8] يقدر عرض الغددة الكظرية حوالي 3 سم، وطولها 5.0 سم، ويزيد سمكها عن 1.0 سم.[9] يتراوح وزن الغدتين الكظريتين معاً لدى الأشخاص البالغين من 7 إلى 10 گرام.[10] يميل لون الغدد الكظرية إلى الأصفر.[8]
الغدد الكظرية محاطة بكبسولة شحمية وتقع داخل اللفافة الكلوية، التي تحيط بالكلى أيضاً. يفصل حاجز ضعيف من الأنسجة الضامة الغدتين عن الكلى.[11] تقع الغدد الكظرية أسفل الحجاب الحاجز مباشرة، وتكون معلقة بساق الحجاب الحاجز عن طريق اللفافة الكلوية.
لكل غدة كظرية منطقتين مختلفتين، حيث تؤدي كل منها وظيفة مختلفة، القشرة الكظرية|القشرة الخارجية واللب الداخلي، وينتج كلاً منهما الهرمونات.[12]
القشرة الكظرية
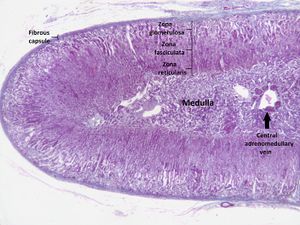
القشرة الكزرية هي الطبقة الخارجية من الغدة الكظرية. يوجد داخل القشرة ثلاث طبقات، تسمى "مناطق". عندما توضع تحت المجهر تبدو كل طبقة بمظهر مختلف، ولكل منها وظيفة مختلفة أيضاً.[13] القشرة الكظرية مخصصة لإنتاج الهرمونات؛ الألدوسترون، الكوريتسول والأندروجينات.[14]
المنطقة الكبيبية
تمثل المنطقة الكبيبية الطبققة الخارجية من القشرة الكظرية. وتقع فوق الكبسولة الشحمية مباشرة. تشكل الخلايا في هذه المنطقة مجموعات بيضاوية، يفصلها خيوط رفيعة من النسيج الضام من الكبسولة الشحمية في الغدة وتحمل شعيرات دموية عريضة.[15]
هذه المنطقة هي الموقع الرئيسي لإنتاج الألدوسترون، هرمون قشري معدني، عن طريق انزيم سينثاز الألدوسترون aldosterone synthase.[16][17] يلعب الألدوسرون دوراً هاماً في تنظيم ضغط الدم على المدى الطويل.[18]
المنطقة الحزمية
تقع المنطقة الحزمية بين المنطقة الكبيبية والمنطقة الشبكية. الخلايا في هذه المنطقة مسئولة عن إنتاج القشريات السكرية مثل الكوتيسول.[19] وهي أكبر الطبقات الثلاث المكونة للقشرة، وتمثل 80% تقريباً من حجم القشرة..[3] في المنطقة حزمية، تكون الخلايا مرتبة على شكل عواميد شعاعية متجهة نحو اللب. تحتوي الخلايا على القطيرات الشحمية، متقدرة وفيرة، وشبكة إندوبلازمية ملساء.[15]
المنطقة الشبكية
المنطقة الشبكية، وهي الطبقة الداخلية في القشرة، تقع فوق اللب مباشرة. تُنتج هذه المنطقة الأندروجينات، وخاصة ديهيدروإيپيأندروسترون dehydroepiandrosterone (DHEA)، كبريتات ديهيدروإيپيأندروسترون DHEA sulfate، و[[أندروستنديون|الأندروستنديون androstenedione (سلف التستوستيرون) في البشر.[19] تشكل خلاياها الصغيرة حبال وعناقيد غير منتظمة تفصل بينا الشعيرات الدموية والنسيج الضام. تحتوي الخلايا على كميات صغيرة نسبياً من السايتوبلازم والدهون، وفي بعض الأحيان تظهر صبغة ليپوفوسينية بنية اللون.[15]
لب الكظر
لب الكظر هو مركز الغدة الدرقية، ويكون محاط بالقشرة الكزرية. الخلايا الكرومافينية في اللب هي المصدر الرئيسي للجسم من الأدرينالين والنورأدرينالين الذي يُطلقه اللب. حوالي 20% من النورأدرينالين (النورإپينفرين) و80% من الأدرينالين (الإپينفرين) يُفرز هناك.[19]
يتحكم الجهاز العصبي الودي في اللب الكظري عن طريق الألياف السابقة للعقد ومنشأها الحبل الشوكي الصدري، من الفقرة T5–T11.[20] لأنه مدعوم من الألياف العصبية السابقة للعقد، يمكن اعتبار لب الكظر عقدة ودية متخصصة.[20] إلا أن لب الكظر، على عكس العقد الودية الأخرى، يفتقر إلى نقاط التشابك العصبي المتميزة وإطلاق الإفرازات في الدم بشكل مباشر.
إمدادات الدم
تتمتع الغدد الكظرية بأعلى معدلات إمدادات الدم بمقدار گرام لكل نسيج في أي عضو آخر: أكثر من 60 شريان صغير قد يدخل كل غدة.[21] الشرايين الثلاثة التي تمد كل غدة كظرية بالدم هي:[8]
- الشريان الكظري العلوي superior suprarenal artery، متفرع من الشريان الحجابي السفلي inferior phrenic arteries.
- الشريطان الكظري الأوسط middle suprarenal artery، فرع مباشر من الأبهر البطني abdominal aorta.
- الشريان الكظري السفلي inferior suprarenal artery، فرع من الشريان الكلوي renal artery.
تمد هذه الأوعية الدموية شبكة من الشرايين الصغيرة داخل كبسولة الغدد الكظرية. تدخل الخيوط الرقيقة لهذه الكبسولة الغدد، حاملة معها الدم.[8]
تتدفق الدماء الوريدية خارجة من الغدد عن طريق الأوردة الكظرية، وعادة ما يوجد وريد لكل غدة:[8]
- الوريد الكظري الأيمن right suprarenal vein يصب في الوريد الأجوف السفلي inferior vena cava.
- الوريد الكظري الأيسر left suprarenal vein ويصب في الوريد الكلوي الأيسر أو الوريد الأجوف العلوي inferior phrenic vein.
التغير
قد لا تتطور الغدد الكظرية على الإطلاق، أو قد تندمج في خط الوسط وراء الأبهر.[12] يرتبط هذا بعيوب خلقية أخرى، مثل فشل الكلى في التطور، أو الكلى المندمجة.[12] قد تتطور الكلى مع غياب جزئي أو كامل للقشرة، أو قد تتطور في موقع غير معتاد.[12]
الوظيفة
تُفرز الغدة الكظرية عدد من الهرمونات المختلفة والتي تُستقلب عن طريق الانزيمات سواء داخل الغدة أو في مناطق أخرى من الجسم. تساهم هذه الهرمونات في عدد من الوظائف الحيوية الأساسية.[23]
الكورتيكوستيرويدات
الكورتيكوستيرويدات Corticosteroid هي مجموعة هرمونات سترويدية تُنتج في قشرة الغدة الكظرية، ومنها اشتقت اسمها.[24] تُسمى الالكورتيكوستيرويدات تبعاً لوظيفتها:
- القشرانيات المعدنية Mineralocorticoids مثل الألدوسترون يُنظم توازن الأملاح المعدنية وحجم الدم.[25]
- القشرانيات السكرية Glucocorticoids مثل الكورتيسول يؤثر على معدلات أيض الپروتينات، الدهون، والسكريات ("الگلوكوز").[26]
- القشرانيات المعدنية
تُنتج الغدة الكظرية الألدوسترون، أحد هرمونات القشرانيات المعدنية، الذي يعتبر هرموناً هاماً لتنظيم توازن الأملاح المعدنية وحجم الدم. في الكلى، يعمل الألدوسترون على الأنابيب الملتوية البعيدة distal convoluted tubule والقنوات الجامعة عن طريق زيادة إعادة امتصاص الصوديوم وإفراز أيونات الپوتاسيوم والهيدروجين.[18] الألدوسترون مسئول عن إعادة امتصاص حوالي 2% من معدلات الترشح الكبيبي المرشحة.[27] احتباس الصوديوم هو أيضاً استجابة من القولون الصاعد والغدد العرقية لتحفيز مستقبلات الألدوسترون. الأنگيوتنسين 2 Angiotensin II والپوتاسيوم خارج الخلايا هما المنظمان الرئيسيان لإنتاج الألدوسترون.[19] كمية الصوديوم الموجودة في الدم تؤثر على الحجم خارج الخلية، الذي يؤثر بدوره على ضغط الدم. بالتالي، فإن تأثيرات الألدوسترون على الاحتفاظ بالصوديوم هامة لتنظيم ضغط الدم.[28]
- القشرانيات السكرية
الكوريتسول هو هرمون القشرنيات السكرية الرئيسي في البشر. في الأنواع التي لا يتكون في أجسادها كورتيسول، يقوم بدوره الكوريتكوسترون corticosterone. للقشرانيات السكرية تأثيرات كثيرة على الأيض. كما يشير اسمها، فإنها تزيد من مستوى دوران الگلوكوز. ينتج هذا عن زيادة في أيضاً الأحماض الأمينية من الپروتينات وتنشيط تخليق الالگلوكوز من هذه الأحماض الأمينية داخل الكبد. بالإضافة إلى ذلك، فإنها تزيد من مستويات الأحماض الأمينية الحرة، التي قد تستخدمها الخلايا كبديل للگلوكوز من أجل الحصول على الطاقة. كما تؤثر القشريات السكرية على تنظيم مستويات السكر في الدم، ويشمل ذلك تثبيط الجهاز المناعي وتأثير محتمل مضاد للالتهاب. يخفض الكورتيسول من قدرة بانيات العظام osteoblast على إنتاج الأنسجة العظمية الجديدة ويقلل من امتصاص الكالسيوم في القناة الهضمية.[28]
تفرز الغدة الكظرية مستوى قاعدي من الكورتيسول ولكن يمكنها أيضاً إنتاج دفعات من الهرمون استجابة للهرمون الموجه للقشرة الكظرية adrenocorticotropic hormone من الغدة النخامية الأمامية. خلال اليوم، لا يُطلق الكورتيسول بكميات متساوية - حيث أن تركيزاته في الدم تكون أعلى في الصباح الباكر والأدنى في المساء نتيجة الإيقاع اليوماوي لإفراز الهرمون الموجه للقشرة الكظرية.[28] الكورتيسون هو منتج غير نشط لعمل انزيم 11β-HSD الكورتيسول. التفاعل المحفظ عن طريق الانزيم 11β-HSD انعكاسي، مما يعني أنه يمكن أن تحويل الكورتيسون إلى كورتيسول، الهرمون النشط حيوياً.[28]
- التشكل
جميع الهرمونات الكورتيكوستيرويدية corticosteroid تتشارك الكورلسترول كسلف مشترك. لذلك، فإن الخطوة الأولى في تخليق السترويد هي تخليق الكولسترول. الخلايا المنتجة للهرمونات السترويدية يمكنها الحصول على الكولسترول بطريقتين. المصدر الرئيسي عن طريق الكولسترول الغذائي المنقول من خلال الدم على شكل إسترات الكولسترول ضمن الپروتينات الدهنية منخفضة الكثافة (LDL). تدخل الپروتينات الدهنية منخفضة الكثافة الخلايا عن طريق receptor-mediated endocytosis. المصدر الثاني للكولسترول هو تخليقه في الشبكة الإندپلازمية الخلوية. عند انخفاض مستويات LDL عند الحد الطبيعي يستخدم التخليق لتعويض الكولسترول الناقص.[4] في الجسيم الحال، تتحول إسترات الكولسترول إلى كولسترول حر، الذي يستخدم عندئذ لتخليق الكولسترول أو تخزينه في الخلية.[29]
يتضمن الجزء الأولي من تحويل الكولسترول إلى هرمونات سترويدية عدد من عائلة إنزيمات cytochrome P450 التي تقع في الغشاءا لداخلي للمتقدرة. يساعد [[الپروتين التنظيم الحاد السترويدي|الپروتين التنظيمي الحاد السترويدي steroidogenic acute regulatory protein على نقل الكولسترول من الغشاء الخارجي إلى الغشاء الداخلي وهي خطوة تحد من معدل تخليق السترويد.[29]
تختلف طبقات الغدة الكظرية من حيث الوظيفة، حيث تمتلك كل طبقة انزيمات مختلفة لإنتاج هرمونات مختلفة من السلف المشترك.[4]
- التنظيم
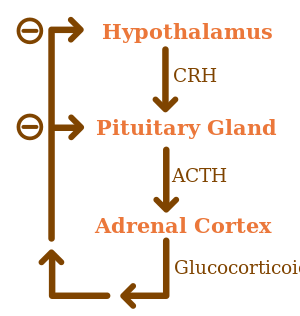
القشرانيات السكرية تكون تحت التأثير التنظيمي المحور الوطائي-النخامي-الكظري HPA axis. تخليق القشرانيات السكرية يحفزه الهرمون الموجه للقشرة الكظرية adrenocorticotropic hormone. بدوره، فإن إنتاج الهرمون الموجه للقشرة الكظرية يحفزه وجود corticotropin-releasing hormone (CRH)، الذي تطلقه عصبونات تحت المهاد. يعمل الهرمون المنشط للقشرة الكظرية على الخلايا الكظرية أولاً بزيادة مستويات StAR داخل الخلايا، ثم في جميع إنزيمات P450 السترويدية. المحور الوطائي-النخامي-الكظري هو مثال على نظام التغذية الارتجاعية السلبي، يعمل فيه الكورتيسول نفسه كمثبط مباشر لتخليق كلاً من CRH وACTH. كما يتفاعل المحور الوطائي-النخامي-الكظري مع الجهاز المناعي من خلال زيادة إفراز الهرمون المنشط للقشرة الكظرية في وجود جزيئات معينة من الاستجابة الالتهابية.[4]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الكاتيكولامينات
كاتيكولامينات، ويشار إليها بصفة رئيسية في الولايات المتحدة باسم بالإپينفرين والنورإپينفرين، الأدرينالين والنورأدرينالين، وهي مركبات قابلة للذوبان في الماء مكونه من مجموعة كاتكول ومجموعة أمين. الغدد الكظرية مسئولة عن معظم الأدرينالين الموجود في الجسم، وكمية صغيرة فقط من النورأدرينالين .[23] تُطلق هذه الهرمونات من اللب الكظري، الذي يحتوي على شبكة مكثفة من الأوعية الدموية. يعمل الأدرينالين والنورأدرينالين كمستقبلات أدرينالينية في الجسم، ومن تأثيراتها زيادة ضغط الدم وضربات القلب.[23] الأدرينالين والنورأدرينالين مسئولان عن استجابة الكر والفر، التي تتميز بسرعة التنفس وزيادة ضربات القلب، وارتفاع ضغط الدم، وتقلص الأوعية الدموية في أجزاء كثيرة من الجسم.[30]
- التشكيل
تُنتج الكاتيكولامينات في الخلايا الكرومافينية داخل لب الغدة الكظرية، من التايروسين، الحمض الأميني الغير أساسي المستمد من الطعام أو المُنتج من الفنايلألانين في الكبد. انزيم هيدروكسيلاز التايروسين يحول التايروسين إلى L-DOPA في أولى مراحل تخليق الكاتيكولامينات. بعد ذلك يتحول L-DOPA إلى دوپامين قبل أن يمكنه التحول إلى نورأدرينالين. في العصارة الخلوية، يتحول النورأدرينالين إلى إپينفرين عن طريق إنزيم phenylethanolamine N-methyltransferase (PNMT) ويُخزن في الحبيبات. القشريات السكرية المنتجة في القشرة الكظرية تحفز تخليق الكاتيكولامينات عن طريق زيادة مستويات هيدروكسيلاز التايروسين وPNMT.[4][13]
إنطلاق الكاتيكولامينات يحفزه تنشيط الجهاز العصبي الودي. الأعصاب الحشوية Splanchnic nerves في الجهاز العصبي الودي تقوي لب الغدة الكظرية. عندما تنشط، تحفز إطلاق الكاتيكولامينات من مخازن الحبيبات بتنشيط فتح قنوات الكالسيوم في الغشاء الخلوي.[31]
الأندروجينات
تُنتج الخلايا الموجودة في المنطقة القشرية zona reticularis في الغدد الظرية إنتاج الهرمونات الجنسية الذكرية، أو الأندروجينات، وأهمها ديهيدروإيپيأندروسترون dehydroepiandrosterone (DHEA). بصفة عامة، ليس لهذه الهرمونات تأثير على أجسام الذكور، ويتم تحويلها إلى الإستروجينات الأكثر فعالية (الهرمونات الجنسية الأنثوية) في الغدد التناسلية، فتعمل بهذه الطريقة كمركب وسطي أيضي.[32]
التعبير الجيني والپروتيني
يتضمن الجينوم البشري حوالي 20.000 جين لترميز الپروتين و70% منها- جينات معبر عنها- في الغدد الكظرية لدى البالغين الطبيعيين.[33][34] 250 جين منهم فقط معبر عنهم بشكل أكثر تحديداً في الغدد الكظرية مقارنة بالأعضاء والأنسجة الأخرى. الجينات المحددة الكظرية ذات مستويات التعبير الأعلى تشمل بعض من عائلة الانزيمات الفرعية cytochrome P450. الپروتينات المقابلة معبر عنها في الأقسام المختلفة من الغدة الكظرية، مثل CYP11A1، HSD3B2 وFDX1 تساهم في تخليق الهرمونات السترويدية ويُعبر عنها في الطبقات الخلوية القشرية، يشارك hydroxylase|DBH]] في تخليق الأدرينالين والنورأدرينالين ويُعبر عنه في اللب.[35]
التطور
تتكون الغدد الكظرية من نوعين من الأنسجة متغيري المنشأ. في الوسط يوجد اللب الكظري، الذي يُنتج الأدرينالين والنورأدرينالين ويطلقهما في مجرى الدم، كجزء من الجهاز العصبي الودي. تحيط القشرة الكظرية باللب، والتي تُنتج مجموعة متنوعة من الهرمونات السترويدية. تأتي هذه الأنسجة من أسلاف جنينية وتتمتع بمسارات تطور أبوي متمايز. قشرة الغدة الدرقية مشتقة من الأديم المتوسط، بينما اللب مشتق من القشرة العصبية، التي يرجع منشأها إلى الأديم الظاهر.
الغدد الكظرية في حديثي الولادة تكون أكبر حجماً قياساً لحجم الجسم عنها لدى البالغين.[36] على سبيل المثال، في سن الثلاثة أشهر تكون الغدد أكبر خمسة أضعاف من حجم الكلى. ينخفض حجم الغدد بعد الميلاد، ويرجع السبب الرئيسي في ذلك إلى انكماش القشرة. القشرة، التي تختفي بالكامل في العام الأول، تتطور مرة أخرى ما بين السنة الرابعة والخامسة. يصل وزن الغدد عند الميلاد إلى 1 گرام[12] ويتطور الوزن لدى البالغين ليصبح 5 لكل غدة.[28] في الجنين يمكن اكتشاف الغدد لأول مرة بعد الأسبوع السادس من التطور.[12]
القشرة
أنسجة القشرة الكظرية مستمدة من الأديم الأوسط المتوسط. تظهر لأول مرة بعد 33 يوم من الإخصاب، وتظهر القدرة على إنتاج الهرمونات السترويدية في الأسبوع الثامن وتواصل نموها بشكل سريع خلال الأشهر الثلاث الأولى من الحمل. تختلف قشرة الغدة الكظرية الجنينية عن نظيرتها لدى البالغين، حيث تتكون من منطقتين متميزتين: المنطقة "الجنينية" الداخلية، والتي تقوم بمعظم الأنشطة المنتجة للهرمونات، والمنطقة "النهائية" الخارجية، وتتواجد في مرحلة التكاثر الخلوي. تُنتج المنطقة الجنينية كميات ضخمة من الأندروجين الكظري (الهرمونات الجنسية الذكرية) التي تستخدمها المشيمة لتخليق الإستروجين حيوياً.[37] يخضع التطور القشري للغدة الكظرية بشكل كبير للهرمون المنشط للقشرة الكظرية ACTH، الهرمون الذي تنتجه الغدة النخامية الذي ينشط تخليق الكورتيسول.[38] أثناء midgestation، تشكل المنطقة الجنينية معظم حجم القشرة وتُنتج 100-200 مگ/يومياً من DHEA-S، الإندروجين، وسلف الإندروجينات والإستروجينات (الهرمونات الجنسية الأنثوية).[39] الهرومات الكظرية، وخاصة القشرانيات السكرية glucocorticoid، تعتبر أساسية لتطور الأعضاء في مرحلة ما قبل الولادة، وخاصة لنضج الرئتين. ينخفض حجم الغدة الكظرية بعد الميلاد بسبب الاختفاء السريع للمنطقة الجنينية، ومع انخفاض مقابل في إمتصاص الأندروجين.[37]
عنفوان الكظر
خلال سنوات الطفولة المبكرة يُخلق الأندروجين ويظل إمتصاصه منخفضاً، لكن قبل البلوغ بعدة سنوات (من 6-8 سنوات) تحدث تغيرات في الجوانب التشريحية والوظيفية لإنتاج الأندروجين القشري والتي تؤدي إلى زيادة إمتصاص DHEA وDHEA-S السترويدية. تعتبر هذه التغيرات جزءاً من عملية تسمى بعنفوان الكظر adrenarche، التي لم توصف إلا في البشر وبعض الرئيسيات الأخرى. في عنفوان الكظر لا يُفرز ACTH أو الگونادوتروپينات وترتبط بالسماكة التدريجية لطبقة المنطقة القشرية لقشرة الكظر. وظيفياً، يوفر عنفوان الكظر مصدراً للأندروجينات اللازمة لتطور شعر الإبط والعانة قبل بداية البلوغ.[40][41]
لب الكظر
لب الكظر مشتق من خلايا القشرة العصبية، المشتقة بدورها من طبقة الأديم الأوسط من الجنين. تهاجر هذه الخلايا من موضعها الأولي وتتجمع في محيط الأبهر الظاهري، الوعاء الدموي البدائي، الذي ينشط الاختلافات بين الخلايا عبر إطلاق الپروتينات المعروفة باسم BMPs. بعد ذلك تبدأ هذه الخلايا في هجرتها الثانية من الأبهر الظاهري إلى الأعضاء الأخرى في الجهاز العصبي الودي.[42] خلايا اللب الظاهري تسمى بالخلايا الكرومافينية لأنها تحتوي على حبيبات ملطخة بأملاح الكروم، الصفة التي لا تتواجد في جميع الأعضاء الودية. تُنتج الهرومات القشرية السكرية Glucocorticoid داخل القشرة الكظرية التي يعتقد أنها كانت في وقت ما مسئولة عن تمايز الخلايا الكرومافينية. تشير الأبحاث الحديثة إلى أن الپروتين BMP-4 الذي يُمتص في الأنسجة الكظرية هو المسئول الرئيسي عن هذا، وأن هرمونات القشرة السكرية تلعب دوراً فقط في التطور اللاحق للخلايا.[43]
الأهمية السريرية
قد تتعطل الوظيفة الطبيعية للغدة الكظرية بسبب أمراض مثل الالتهابات والأورام والاضطرابات الوراثية و[[مرض مناعي|الأمراض المناعيةي]، أو كأثر جانبي للعلاج الدوائي. تؤثر اضطرابات الغدة الكظرية هذه بسواء بشكل مباشر (في الأمراض المعدية أو المناعية) أو كنتيجة لقصور تنظيم إنتاج الهرمونات (في بعض أنواع متلازمة كوشينگ) مما يؤدي إلى زيادة أو قصور الهرمونات الكظرية والأعراض المتعلقة بها.
فرط القشرانيات السكرية
متلازمة كوشينگ
تعتبر متلازمة كوشينگ Cushing's syndrome إشارة على فرط القشرانيات السكرية. وقد تكون نتيجة للعلاج طويل المدى بالقشرانيات السكرية أو بسبب مرض ضمني يؤدي إلى حدوث تغيرات في المحور الوطائي-النخامي-الكظري أو إنتاج الكورتيسول. ويمكن تصنيف الأسباب إلى نوعين، أسباب متعلقة بالهرمون الموجه للقشرة الكظرية أو أسباب غير متعلقة بالهرمون الموجه للقشرة الكظرية. ومن أكثر الأسباب شيوعاً لمتلازمة كوشينگ داخلية المنشأ ورم الغدة النخامية الذي يتسبب في فرط إنتاج الهرمون الموجه للقشرة الكظرية. يُنتج المرض مجموعة متنوعة من الأعراض والعلامات التي تشمل البدانة، السكري، الاكتئاب، وأكثرها وضوحاً، علامات تمدد الجلد، بسبب ترققه التدريجي.[4][6]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الألدوسترونية الأولية
عندما تُنتج المنطقة الكبيبية كميات كبيرة من الألدوسترون، ينتج عن ذلك ما يعرف بالألدوسترونية الأولية primary aldosteronism. وتنتج هذه الحالة بسبب فرط التنسج hyperplasia، زيادة في نمو أنسجة الغدد، أو ظهور الأورام الغدية (حالة تسمى متلازمة كون). تسبب الألدوسترونية الأولية في ارتفاع ضغط الدم واخلال التوازن الكهرلي، زيادة استنفاد الپوتاسيوم واحتباس الصوديوم.[6]
قصور الغدة الكظرية
قصور الغدة الكظرية (قصور إنتاج القشرانيات السكرية) يحدث في حوالي 5 من كل 10.000 شخص من إجمالي السكان.[6] الأمراض المصنفة "كقصور كظري رئيسي" (تشمل مرض أديسون والأسباب الوراثية) تؤثر بشكل مباشر على القشرة الكظرية. إذا كانت المشكلة تؤثر على المحور الوطائي-النخامي-الكظري خارج الغدة، تسمى حينئذ "القصور الكظري الثانوي".
مرض أديسون
يشير مرض أديسون إلى القصور الكظري الرئيسي، وهو عبارة عن قصور الغدة الدرقية في إنتاج القشرانيات السكرية أو القشرانيات المعدنية. في العالم الغربي، يعتبر مرض أديسون من أكثر أمراض المناعة الذاتية شيوعاً، وفي يُنتج الجسم أجسام مضادة لخلايا القشرة الكظرية. في أنحاء العالم، تعتبر العدوى هي السبب الأكثر تواتراً، خاصة السل. ومن أهم مظاهر مرض أديسون فرط تصبغ الجلد hyperpigmentation، وأعراض أخرى غير محددة مثل الإرهاق.[4]
المضاعفات الناتجة عن عدم علاج مرض أديسون وأنواع أخرى من قصور الغدة الكظرية الأساسية هي النوبة الكظرية adrenal crisis، حالة طوارئ طبية يحدث فيها انخفاض لمستوى القشرانيات السكرية والقشرانيات المعدنية نتيجة نقص حديد الجسم وأعراض مثل القيء والحمى. قد تتطور النوبة الكظرية فتؤدي إلى الذهول stupor والغيبوبة.[4] ويشمل علاج الأزمة الكظرية حقن الهيدروكورتيزون hydrocortisone.[44]
الأورام الكظرية
عادة ما تكتشف الأورام الكظرية عرضياً، كأورام غير متوقعة تُكتشف عرضياً أثناء التصوير الطبي. تظهر في حوالي 3.4% من حالات التصوير الطبقي المحوسب،[7] وتكون في معظم الحالات أورام غدية حميدة.[45] سرطانات القشرة الكظرية Adrenal carcinoma نادرة للغاية، حيث تحدث بمعدل 1 لكل مليون شخص سنوياً.[4]
أورام القواتم Pheochromocytomas هي أورام القشرة الكظرية التي تنشأ من الخلايا الكرومافينية. قد يظهر المرض مجموعة متنوعة من الأعراض الغير محددة، والتي تشمل الصداع، التعرق، القلق، والخفقان. الجراحة، خاصة التنظير الكظري، هو العلاج الأكثر شيوعاً لأورام القواتم الصغيرة.[46]
التاريخ
بارتولميو أوستاتشي Bartolomeo Eustachi، عالم التشريح الإيطالي، كان أول من وصف الغدد الكظرية عام 1563-4.[47][48] ومع ذلك، فإن هذه المنشورات كانت جزءاً من المكتبة الپاپوية ولم تلفت انتباه العامة، على عكس مع حدث مع رسومات كاسپار بارتولين الأكبر عام 1611.[48]
سُميت الغدد الكظرية بهذا الاسم بسبب موقعها القريب من الكلى. مصطلح "الكظر" adrenal مشتق من ad- (باللاتينية، "قرب") وrenes (باللاتينية، "الكلى").[49] على نفس المنول، مصطلح "الفوق كلوية"، الذي صاغه جان ريولان الأصغر عام 1629، مشتق من اللاتينية supra (لاتينية: "فوق") وrenes (لاتينية: الكلى). الطبيعة الفوق كلوية للغدة لم تكن مقبولة فعلياً حتى القرن 19، عندما أوضح علماء التشريح الطبيعة اللامثالية للغدد ودورها السري المحتمل - قبل هذا، كان هناك بعض الجدل حول ما إذا كانت الغدد بالفعل فوق الكلى أو جزء من الكلية.[48]
ظهر عام 1885 واحداً أكثر الأعمال أهمية حول الغدد الكظرية، حول التأثيرات البنيوية والموضعية لمرض الكبسولة الفوق كلوية On the Constitutional and Local Effects of Disease of the Suprarenal Capsule، للطبيب الإنگليزي توماس أديسون. في هذا البحث، وصف أديسون ما أطلق عليه الطبيب الفرنسي جورج تروسو لاحقاً اسم مرض أديسون، المسمى الذي لا زال مستخدماً حتى اليوم لحالة قصور الغدة الكظرية والأعراض السريرية المرتبطة بها.[50] عام 1894، درس الفسيولوجي الإنگليزي جورج أوليڤر وإدوارد شافر حركة عمل المستخلصات الكظرية ورصدا آثارها الرافعة للضغط. بعد قرون عقد علماء مختلفون تجارب على مستخلصات من القشرة الكظرية لعلاج مرض أديسون.[47] فاز إدوارد كندال وفيليپ هنش وتاديوس رايخشتاين على جائزة نوبل في الفسيولوجيا أو الطب 1950 لاكتشافتهم المتعلقة ببنية وتأثيرات الهرمونات الكظرية.[51]
انظر أيضاً
المصادر
- ^ Santulli G. MD (2015). Adrenal Glands: From Pathophysiology to Clinical Evidence. Nova Science Publishers, New York, NY. ISBN 978-1-63483-570-1.
- ^ "Adrenal gland". Medline Plus/Merriam-Webster Dictionary. Retrieved 11 February 2015.
- ^ أ ب Ross M, Pawlina W (2011). Histology: A Text and Atlas (6th ed.). Lippincott Williams & Wilkins. pp. 708, 780. ISBN 978-0-7817-7200-6.
- ^ أ ب ت ث ج ح خ د ذ ر ز Melmed, S; Polonsky, KS; Larsen, PR; Kronenberg, HM (2011). Williams Textbook of Endocrinology (12th ed.). Saunders. ISBN 978-1437703245.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةmiller auchus - ^ أ ب ت ث Longo, D; Fauci, A; Kasper, D; Hauser, S; Jameson, J; Loscalzo, J (2012). Harrison's Principles of Internal Medicine (18th ed.). New York: McGraw-Hill. ISBN 978-0071748896.
- ^ أ ب Nieman, LK (2010). "Approach to the patient with an adrenal incidentaloma". The Journal of Clinical Endocrinology and Metabolism. 95 (9): 4106–13. doi:10.1210/jc.2010-0457. PMC 2936073. PMID 20823463.
- ^ أ ب ت ث ج Thomas, edited by Paul; Molecular, School of; Australia, Biomedical Science, University of Adelaide, Adelaide, South Australia (2013). Endocrine Gland Development and Disease. Burlington: Elsevier Science. p. 241. ISBN 9780123914545.
{{cite book}}:|first1=has generic name (help)CS1 maint: multiple names: authors list (link) - ^ Antonio Carlos A. Westphalen and Bonnie N. Joe (2006). "CT and MRI of Adrenal Masses". Appl Radiol. 35 (8): 10–26.
- ^ O'Hare, A. Munro Neville, Michael J. (1982). The Human Adrenal Cortex Pathology and Biology – An Integrated Approach. Springer London. pp. Chapter 4: Structure of the adult cortex. ISBN 9781447113171.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Moore KL, Dalley AF, Agur AM (2013). Clinically Oriented Anatomy, 7th ed. Lippincott Williams & Wilkins. pp. 294, 298. ISBN 978-1-4511-8447-1.
- ^ أ ب ت ث ج ح Kay, Saundra. "Adrenal Glands". Medscape. Retrieved 1 August 2015.
- ^ أ ب Whitehead, Saffron A.; Nussey, Stephen (2001). Endocrinology: an integrated approach. Oxford: BIOS. p. 122. ISBN 978-1-85996-252-7.
- ^ Jefferies, William McK (2004). Safe uses of cortisol. Springfield, Ill: Charles C. Thomas. ISBN 978-0-398-07500-2.
- ^ أ ب ت Young B, Woodford P, O'Dowd G (2013). Wheater's Functional Histology: A Text and Colour Atlas (6th ed.). Elsevier. p. 329. ISBN 978-0702047473.
- ^ Curnow KM, Tusie-Luna MT, Pascoe L, Natarajan R, Gu JL, Nadler JL, White PC (October 1991). "The product of the CYP11B2 gene is required for aldosterone biosynthesis in the human adrenal cortex" (PDF). Mol. Endocrinol. 5 (10): 1513–1522. doi:10.1210/mend-5-10-1513. PMID 1775135.
- ^ Zhou M, Gomez-Sanchez CE (July 1993). "Cloning and expression of a rat cytochrome P-450 11 beta-hydroxylase/aldosterone synthase (CYP11B2) cDNA variant". Biochem Biophys Res Commun. 194 (1): 112–117. doi:10.1006/bbrc.1993.1792. PMID 8333830.
- ^ أ ب Marieb, EN; Hoehn, K (2012). Human anatomy & physiology (9th ed.). Pearson. p. 629. ISBN 978-0321743268.
- ^ أ ب ت ث Dunn R. B.; Kudrath W.; Passo S.S.; Wilson L.B. (2011). "10". Kaplan USMLE Step 1 Physiology Lecture Notes. pp. 263–289.
- ^ أ ب Sapru, Hreday N.; Siegel, Allan (2007). Essential Neuroscience. Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-9121-2.
- ^ Mirilas P, Skandalakis JE, Colborn GL, Weidman TA, Foster RS, Kingsnorth A, Skandalakis LJ, Skandalakis PN (2004). Surgical Anatomy: The Embryologic And Anatomic Basis Of Modern Surgery. McGraw-Hill Professional Publishing. ISBN 978-960-399-074-1.
- ^ "OpenStax CNX". cnx.org. Retrieved 2015-08-01.
- ^ أ ب ت Britton, the editors Nicki R. Colledge, Brian R. Walker, Stuart H. Ralston ; illustrated by Robert (2010). Davidson's principles and practice of medicine (21st ed.). Edinburgh: Churchill Livingstone/Elsevier. pp. 768–778. ISBN 978-0-7020-3085-7.
{{cite book}}:|first=has generic name (help)CS1 maint: multiple names: authors list (link) - ^ "Corticosteroid". TheFreeDictionary. Retrieved 23 September 2015.
- ^ Marieb Human Anatomy & Physiology 9th edition, chapter:16, page:629, question number:14
- ^ "Corticosteroid". TheFreeDictionary. Retrieved 23 September 2015.
- ^ Sherwood, Lauralee (2001). Human physiology: from cells to systems. Pacific Grove, CA: Brooks/Cole. ISBN 978-0-534-56826-9. OCLC 43702042.
- ^ أ ب ت ث ج Boron, WF.; Boulapep, EL. (2012). Medical Physiology (2nd ed.). Philadelphia: Saunders. ISBN 978-1437717532.
- ^ أ ب Miller, WL; Bose, HS (2011). "Early steps in steroidogenesis: intracellular cholesterol trafficking". Journal of Lipid Research. 52 (12): 2111–2135. doi:10.1194/jlr.R016675. PMC 3283258. PMID 21976778.
- ^ Henry Gleitman, Alan J. Fridlund and Daniel Reisberg (2004). Psychology (6 ed.). W. W. Norton & Company. ISBN 978-0-393-97767-7.
- ^ García, AG; García de Diego, AM; Gandía, L; Borges, R; García Sancho, J (2006). "Calcium signaling and exocytosis in adrenal chromaffin cells". Physiological Reviews. 86 (4): 1093–1131. doi:10.1152/physrev.00039.2005. PMID 17015485.
- ^ Hall JE, Guyton AC (2010). Guyton and Hall Textbook of Medical Physiology, 12th edition. Saunders. ISBN 978-1416045748.
- ^ "The human proteome in adrenal gland – The Human Protein Atlas". www.proteinatlas.org. Retrieved 2017-09-21.
- ^ Uhlén, Mathias; Fagerberg, Linn; Hallström, Björn M.; Lindskog, Cecilia; Oksvold, Per; Mardinoglu, Adil; Sivertsson, Åsa; Kampf, Caroline; Sjöstedt, Evelina (2015-01-23). "Tissue-based map of the human proteome". Science (in الإنجليزية). 347 (6220): 1260419. doi:10.1126/science.1260419. ISSN 0036-8075. PMID 25613900.
- ^ Bergman, Julia; Botling, Johan; Fagerberg, Linn; Hallström, Björn M.; Djureinovic, Dijana; Uhlén, Mathias; Pontén, Fredrik (2017-02-01). "The Human Adrenal Gland Proteome Defined by Transcriptomics and Antibody-Based Profiling". Endocrinology. 158 (2): 239–251. doi:10.1210/en.2016-1758. ISSN 0013-7227. PMID 27901589.
- ^ Barwick, T.D.; Malhotra, A.; Webb, J.A.W.; Savage, M.O.; Reznek, R.H. (September 2005). "Embryology of the adrenal glands and its relevance to diagnostic imaging". Clinical Radiology. 60 (9): 953–959. doi:10.1016/j.crad.2005.04.006. PMID 16124976.
- ^ أ ب Ishimoto H, Jaffe RB (2011). "Development and Function of the Human Fetal Adrenal Cortex: A Key Component in the Feto-Placental Unit". Endocrine Reviews. 32 (3): 317–355. doi:10.1210/er.2010-0001. PMC 3365797. PMID 21051591.
- ^ Hoeflich A, Bielohuby M (2009). "Mechanisms of adrenal gland growth: signal integration by extracellular signal regulated kinases1/2". Journal of Molecular Endocrinology. 42 (3): 191–203. doi:10.1677/JME-08-0160. PMID 19052254.
- ^ Mesiano S, Jaffe RB (1997). "Developmental and Functional Biology of the Primate Fetal Adrenal Cortex". Endocrine Reviews. 18 (3): 378–403. doi:10.1210/edrv.18.3.0304. PMID 9183569.
- ^ Hornsby, PJ (2012). "Adrenarche: a cell biological perspective". The Journal of Endocrinology. 214 (2): 113–119. doi:10.1530/JOE-12-0022. PMID 22573830.
- ^ Rege, J; Rainey, WE (2012). "The steroid metabolome of adrenarche". The Journal of Endocrinology. 214 (2): 133–143. doi:10.1530/JOE-12-0183. PMC 4041616. PMID 22715193.
- ^ Huber K (2006). "The sympathoadrenal cell lineage: Specification, diversification, and new perspectives". Developmental Biology. 298 (2): 335–343. doi:10.1016/j.ydbio.2006.07.010. PMID 16928368.
- ^ Unsicker K, Huber K, Schober A, Kalcheim C (2013). "Resolved and open issues in chromaffin cell development". Mechanisms of Development. 130 (6–8): 324–329. doi:10.1016/j.mod.2012.11.004. PMID 23220335.
- ^ Hydrocortisone Emergency Factsheet for Ambulance Personnel The Pituitary Foundation
- ^ Mantero, F; Terzolo, M; Arnaldi, G; Osella, G; Masini, AM; Alì, A; Giovagnetti, M; Opocher, G; Angeli, A (2000). "A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology". The Journal of Clinical Endocrinology and Metabolism. 85 (2): 637–644. doi:10.1210/jcem.85.2.6372. PMID 10690869.
- ^ Martucci, VL; Pacak, K (2014). "Pheochromocytoma and paraganglioma: diagnosis, genetics, management, and treatment". Current Problems in Cancer. 38 (1): 7–41. doi:10.1016/j.currproblcancer.2014.01.001. PMC 3992879. PMID 24636754.
- ^ أ ب Schmidt, JE (1959). Medical Discoveries: Who and When. Thomas. pp. 9–10.
- ^ أ ب ت O'Hare, A. Munro Neville, Michael J. (2012). The Human Adrenal Cortex Pathology and Biology – An Integrated Approach. London: Springer London. pp. Chapter 2: Historical Aspects. ISBN 978-1447113171.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ "What Are The Adrenal Glands?". About.com. Retrieved 18 September 2013.
- ^ Pearce, JM (2004). "Thomas Addison (1793–1860)". Journal of the Royal Society of Medicine. 97 (6): 297–300. doi:10.1258/jrsm.97.6.297. PMC 1079500. PMID 15173338.
- ^ "The Nobel Prize in Physiology or Medicine 1950". Nobel Foundation. Retrieved 10 February 2015.
وصلات خارجية
- Adrenal gland at the Human Protein Atlas
- قالب:MedlinePlusEncyclopedia
- Adrenal gland histology
- Virtual Slidebox at Univ. Iowa Slide 272
- Anatomy Atlases - Microscopic Anatomy, plate 15.292 – "Adrenal Gland"
- Histology at BU 14501loa
- SUNY Labs 40:03-0105 – "Posterior Abdominal Wall: The Retroperitoneal Fat and Suprarenal Glands"
- Adrenal Gland, from Colorado State University
- Cross section at UV pembody/body8a