گلوكاگون
| عدِّل |
گلوكاگون بالإنجليزية Glucagon، هو عبارة عن هورمون پيپتيدي، يُفرز من خلايا ألفا الموجودة في البنكرياس.
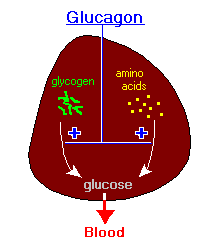
ينتمي الگلوكاگون إلى عائلة السكرينينات ويعمل على رفع مستويات سكر الگلوكوز، والأحماض الدهنية في الدم.
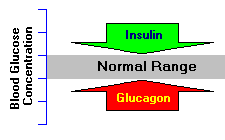
وبذلك فهو يعتبر هورمون التقويض (الهدم) الرئيس في الجسم، على عكس الإنسولين المعاكس لعمل الگلوكاگون (الذي يعمل على خفض مستويات السكر في الدم، والذي يعد هورمون البناء الرئيس.
كما يُستخدم الگلوكاگون كدواء لعلاج العديد من الحالات الطبية.
يتم إنتاج الگلوكاگون من الپيپتيد پروگلوكاگون المشفر بالجين GCG.
يطلق البنكرياس الگلوكاگون كرد فعل على انخفاض مستوى السكر في الدم بفعل الإنسولين. فيعمل على تحفيز الكبد على تحلل الگلايكوجين إلى گلوكوز وإطلاقه إلى مجرى الدم، وبذلك يعمل على رفع مستوى السكر في الدم المؤدي إلى تحفيز إطلاق الإنسولين.
يعمل الإنسولين على تحفيز خلايا الجسم على استخدام الگلوكوز الموجود في مجرى الدم، وبذلك يشكل هو والگلوكاكون جزءً من نظام رد الفعل المحافظ على توازن كميات السكر في الدم.
يعد الگلوكاگون هوروموناً مستهلكاً للطاقة، كما يرتفع تركيزه في الدم تحت حالات الإجهاد والتوتر.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
لمحة تأريخية
في العام 1920، قام كيمبول ومورلين بدراسة عصارة الپنكرياس. وأدت دراستهما إلى اكتشاف مادة إضافية مرتبطة بارتفاع مستوى السكر في الدم، هذه المادة هي ما سيعرف لاحقاً بالگلوكاگون.
وقاما بوصف الگلوكاگون في العام 1923، وأطلقا عليه اسم مضاد الگلوكوز أولاً، ثم الگلوكاگون.
إلا أن تسلسل الأحماض الأمينية للگلوكاگون، تم وصفه لاحقاً في العام 1950.
أما وظائف الگلوكاگون وآلية عمله، والأمراض المرتبطة بخلل إفرازه، فلم يتم وصفها وفهمها حتى العام 1970، بعد تطور المقايسة المناعية الشعاعية.
التركيب
الگلوكاگون عبارة عن پوليپيپتيد مؤلف من تسلسل 29 حمضاً أمينياً، كتلته الجزيئية 3485 دالتون، وهو لايذوب في الدهن وإنما في الماء.
ينتج الگلوكاگون من الپروگلوكاگون عن طريق إنزيم محوّل الپروپروتين 2 الموجود في خلايا ألفا في الپنكرياس.
وفي الأمعاء يتحول الپروگلوكاگون بفعل (خلايا L) إلى: گليسنتين، الپيپتيد الشبيه بالگلوكاگون - ١، الپيپتيد الشبيه بالگلوكاگون - ٢، وlP-2. وجميعها تعمل على تعزيز النمو في الأمعاء.
إفراز الهورمون
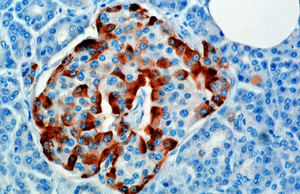
يتم تكوين وإفراز الگلوكاگون في خلايا ألفا الموجودة ضمن الجزء ذي الإفراز الداخلي من غدة البنكرياس (جزيرات لانگرهانس).
ويتم تنظيم (كبح) إفراز الگلوكاگون بوساطة هورمون الأميلين، وهو عبارة عن هورمون پيپتيدي يُفرز من خلايا بيتا في البنكرياس بشكل متزامن مع إفراز الإنسولين من ذات الخلايا.
ومع انخفاض مستويات السكر (الگلوكوز) في الدم، وما يرافقه من انخفاض في مستوى الأميلين الكابح للگلوكاگون، فإن ذلك يسمح بإفراز الگلوكاگون من خلايا ألفا.
في القوارض، تقع خلايا ألفا في الحافة الخارجية من الجُزيرة. أما في الإنسان، فأن تركيب الجُزيرة أقل انعزالاً، وأن خلايا ألفا منتشرة ضمن الجُزيرة بالقرب من خلايا بيتا.
وإضافة إلى خلايا ألفا في البنكرياس، فإن الگلوكاگون يُفرز من ذات الخلايا (خلايا ألفا) في المعدة. فقد أوضحت العديد من الدراسات الحديثة، بأن الگلوكاگون لايفرز فقط في البنكرياس، وإنما يتم تخليقه في أماكن أخرى غير البنكرياس. وتعد القناة الهضمية الموضع الرئيسي لتصنيع الگلوكاگون غير البنكرياسي.
الوظيفة
بشكل عام يعمل الگلوكاگون على رفع مستويات السكر في الدم، عن طريق تحفيز عمليتي استحداث الگلوكوز وتحلل الگلايكوجين.
إضافة إلى ذلك، فهو يعمل على تقليل تصنيع الأحماض الدهنية في النسيج الدهني والكبد، ويحفز عملية تحلل الدهون في الأنسجة مطلقة أحماضاً دهنية إلى مجرى الدم، والتي يتم استهلاكها من قبل العضلات الهيكلية لتوليد الطاقة.
يتم تخزين الگلوكوز في الكبد بشكل گلايكوجين متعدد السكاريد. ويوجد على سطح خلايا الكبد مستقبلات الگلوكاگون، التي بمجرد ارتباط الگلوكاگون بها، تعمل خلايا الكبد على إعادة تحويل الگلايكوجين إلى جزيئات گلوكوز أحادية تنطلق إلى مجرى الدم بعملية تدعى تحلل الگلايكوجين.
وبمجرد نفاذ مخازن الگلايكوجين في الكبد، يعمل الگلوكاگون على تشجيع الكبد والكلى على تخليق الگلوكوز بعملية تدعى استحداث الگلوكوز.
كما يعمل الگلوكاگون على تنظيم معدل إنتاج الگلوكوز من خلال عملية تحلل الدهون. فالگلوكاگون هو المسؤول عن عملية تحلل الدهون في حالات غياب الإنسولين كما في حالة النوع الأول من داء السكري.
ويعتمد انتاج الگلوكاگون على الجهاز العصبي المركزي، عبر مسار غير مفهوم بعد. وفي الحيونات اللافقرية تؤثر عملية استئصال ساق العين على إنتاج الگلوكاگون، فاستئصالها في سلطعون النهر يؤدي إلى حالة فرط سكر الدم.
آلية العمل
يرتبط الگلوكاگون بمستقبلات الگلوكاگون (من نوع المستقبلات المقترنة بالبروتين ج) الموجودة على الغشاء البلازمي.
ويؤدي ارتباط الگلوكاگون بالمستقبل إلى تنشيط الپروتين ج، وبالتالي تنشيط إنزيم محلقة الأدينيلات، المؤدي إلى تحويل الأدينوسين ثلاثي الفوسفات (ATP) إلى أحادي فوسفات الأدينوسين الحلقي (cAMP).
ويعمل أحادي فوسفات الأدينوسين الحلقي (cAMP) على تنشيط إنزيم كيناز البروتين، والذي بدوره يعمل على تنشيط أو تثبيط الإنزيمات الرئيسة في عملية تخليق وإفراز الگلوكاگون بعملية الفسفرة.
التنظيم
يتم تحفيز إفراز الگلوكاگون بوساطة:
- انخفاض مستوى السكر في الدم.
- الأدرينالين (عبر مستقبلات بيتا ٢، ألفا ٢ وألفا ١ الأدرينالينية).
- الآرجنين.
- الألانين.
- الأسيتايل كولين.
- الكوليسيستوكاينين.
- الپولي پيپتيد المثبط المِعدي.
بينما يتم تثبيط إفراز الگلوكاگون عن طريق:
- السوماتوستاتين.
- الأميلين.
- الإنسولين.
- زيادة الأحماض الدهنية الحرة، والأحماض الكيتونية في مجرى الدم.
- زيادة إفراز اليوريا في الجسم.
- الپيپتيد الشبيه بالگلوكاگون - ١.
انظر أيضا
مرئيات
المصادر
قراءات إضافية
- Kieffer TJ, Habener JF (2000). "The glucagon-like peptides". Endocr. Rev. 20 (6): 876–913. doi:10.1210/er.20.6.876. PMID 10605628.
- Drucker DJ (2003). "Glucagon-like peptides: regulators of cell proliferation, differentiation, and apoptosis". Mol. Endocrinol. 17 (2): 161–71. doi:10.1210/me.2002-0306. PMID 12554744.
- Jeppesen PB (2004). "Clinical significance of GLP-2 in short-bowel syndrome". J. Nutr. 133 (11): 3721–4. PMID 14608103.
- Brubaker PL, Anini Y (2004). "Direct and indirect mechanisms regulating secretion of glucagon-like peptide-1 and glucagon-like peptide-2". Can. J. Physiol. Pharmacol. 81 (11): 1005–12. doi:10.1139/y03-107. PMID 14719035.
- Baggio LL, Drucker DJ (2005). "Clinical endocrinology and metabolism. Glucagon-like peptide-1 and glucagon-like peptide-2". Best Pract. Res. Clin. Endocrinol. Metab. 18 (4): 531–54. doi:10.1016/j.beem.2004.08.001. PMID 15533774.
- Holz GG, Chepurny OG (2006). "Diabetes Outfoxed by GLP-1?". Sci. STKE. 2005 (268): pe2. doi:10.1126/stke.2682005pe2. PMC 2909599. PMID 15671479.
- Dunning BE, Foley JE, Ahrén B (2006). "Alpha cell function in health and disease: influence of glucagon-like peptide-1". Diabetologia. 48 (9): 1700–13. doi:10.1007/s00125-005-1878-0. PMID 16132964.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Gautier JF, Fetita S, Sobngwi E, Salaün-Martin C (2005). "Biological actions of the incretins GIP and GLP-1 and therapeutic perspectives in patients with type 2 diabetes". Diabetes Metab. 31 (3 Pt 1): 233–42. doi:10.1016/S1262-3636(07)70190-8. PMID 16142014.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - De León DD, Crutchlow MF, Ham JY, Stoffers DA (2006). "Role of glucagon-like peptide-1 in the pathogenesis and treatment of diabetes mellitus". Int. J. Biochem. Cell Biol. 38 (5–6): 845–59. doi:10.1016/j.biocel.2005.07.011. PMID 16202636.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Beglinger C, Degen L (2007). "Gastrointestinal satiety signals in humans--physiologic roles for GLP-1 and PYY?". Physiol. Behav. 89 (4): 460–4. doi:10.1016/j.physbeh.2006.05.048. PMID 16828127.
- Stephens JW, Bain SC (2007). "Safety and adverse effects associated with GLP-1 analogues". Expert opinion on drug safety. 6 (4): 417–22. doi:10.1517/14740338.6.4.417. PMID 17688385.
- Orskov C, Bersani M, Johnsen AH; et al. (1989). "Complete sequences of glucagon-like peptide-1 from human and pig small intestine". J. Biol. Chem. 264 (22): 12826–9. PMID 2753890.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - Drucker DJ, Asa S (1988). "Glucagon gene expression in vertebrate brain". J. Biol. Chem. 263 (27): 13475–8. PMID 2901414.
- Novak U, Wilks A, Buell G, McEwen S (1987). "Identical mRNA for preproglucagon in pancreas and gut". Eur. J. Biochem. 164 (3): 553–8. doi:10.1111/j.1432-1033.1987.tb11162.x. PMID 3569278.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - White JW, Saunders GF (1986). "Structure of the human glucagon gene". Nucleic Acids Res. 14 (12): 4719–30. doi:10.1093/nar/14.12.4719. PMC 311486. PMID 3725587.
- Schroeder WT, Lopez LC, Harper ME, Saunders GF (1984). "Localization of the human glucagon gene (GCG) to chromosome segment 2q36----37". Cytogenet. Cell Genet. 38 (1): 76–9. doi:10.1159/000132034. PMID 6546710.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Bell GI, Sanchez-Pescador R, Laybourn PJ, Najarian RC (1983). "Exon duplication and divergence in the human preproglucagon gene". Nature. 304 (5924): 368–71. doi:10.1038/304368a0. PMID 6877358.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Kärgel HJ, Dettmer R, Etzold G; et al. (1982). "Action of rat liver cathepsin L on glucagon". Acta Biol. Med. Ger. 40 (9): 1139–43. PMID 7340337.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - Wayman GA, Impey S, Wu Z; et al. (1994). "Synergistic activation of the type I adenylyl cyclase by Ca2+ and Gs-coupled receptors in vivo". J. Biol. Chem. 269 (41): 25400–5. PMID 7929237.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - Unson CG, Macdonald D, Merrifield RB (1993). "The role of histidine-1 in glucagon action". Arch. Biochem. Biophys. 300 (2): 747–50. doi:10.1006/abbi.1993.1103. PMID 8382034.
{{cite journal}}: CS1 maint: multiple names: authors list (link)