أيون
الايون بالإنجليزيةIon ، عبارة عن ذرة او مجموعة ذرات غير متعادلة من ناحية كهربائية، اي انها اكتسبت شحنة كهربائية بعد تفاعل كيميائي (اخذت او اعطت الكترونات لذرة او مجموعة ذرات اخرى) ويوجد ايضًا ايون على شكل مجموعة من الذرات وتسمى هذه المجموعة مجموعة ايونية، والايون نوعان:
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ والاكتشاف
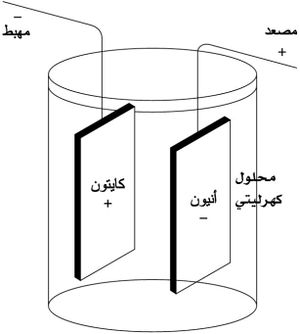
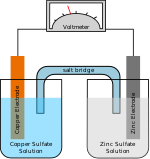
يعود الفضل إلى الكيميائي السويدي س.أ. أرِنيوس S.A.Arrhenius عام 1884، في إدخال مفهوم الأيون أو الشاردة. فقد بَّين أن إذابة ملح في الماء، أو تمديد الحموض والأسس بالماء، يحولها إلى أيونات، بحيث يمكنها أن تتحرك في وعاء فولطا كالمبيَّن في الشكل (1)، وبحيث تتجه الكاتيونات نحو المهبط والأنيونات نحو المصعد وهو مبدأ الكيمياء الكهربائيةelectrochemistry.[1]
أيون موجب (كاتيون)
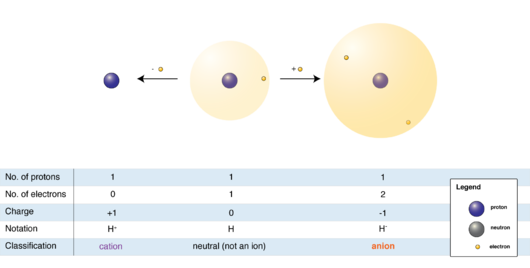
وهو ذرة غير متعادلة كهربائيًا عدد البروتونات فيها اكبر من عدد الالكترونات اي ان الشحنة الموجبة في الذرة اعلى من الشحنة السالبة.يتكون الايون الموجب عن طريق خسارة الذرة للالكترونات (مقدار الشحنة الموجبةالتي تاخذها الذرة يتعلق بعدد الالكترونات التي تخسرها الذرة). فمثلاً اذا خسرت الذرة الكترونًا واحدًا بعد ان كانت حيادية(عدد الالكترونات = عدد البروتونات) فعدد البروتونات يصبح فيها اكبر من عدد الالكترونات بوحدة واحدة اي ان الذرة تشحن بشحنة موجبة(1+).
أيون سالب (انيون)
وهو ذرة غير متعادلة كهربائيًا عدد الالكترونات فيها اكبر من عدد البروتونات، اي ان الشحنة السالبة في الذرة اكبر من الشحنة الموجبة. مقدار الشحنة السالبة للذرة يتعلق بعدد الالكترونات التي تكتسبها الذرة، فمثلاً اذا اكتسبت الذرة الكترون واحد، فعدد الالكترونات يصبح فيها اكبر بوحدة واحدة من عدد البروتونات وبما ان شحنة الالكترون سالبة، اذن تشحن الذرة بشحنة(1-).
كيمياء
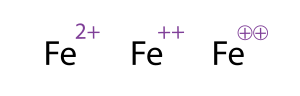
تشكل الأيونات متعددة الذرات والجزيئية
تقاس الطاقة اللازمة لتأيين ذرة غاز معتدلة بطرائق عديدة، وهي طاقة مميزة للغاز، وهي تراوح بين بضعة أجزاء من الإلكترون فولط، كما هو الحال في المعادن القلوية (Li, Na, K, Rb, Cs, Fr) و25 إلكترون فولط لذرة الهليوم. إن حرف الأيونات الموجبة في حقول كهربائية وأخرى مغنطيسية، يمكن من قياس النسبة بين شحنة الأيون q وكتلته M. وهذا هو مبدأ عمل المطياف الكتلوي.
كما يمكن تمييز الأيونات باستخدام طرائق التحليل الطيفي الضوئي؛ فالخطوط الطيفية الصادرة عن أيونات غاز ما، والتي تحدث لدى إثارتها في أنبوب انفراغ كهربائي، مميزة للغاز المدروس، وهي تختلف باختلاف عدد الإلكترونات التي تم انتزاعها من ذرات الغاز المعتدلة.
تؤدي الأيونات كذلك دوراً مهماً في الحالة الصلبة للمادة؛ إذ إنَّ معظم الأملاح توجد على هيئة بلورات؛ بمعنى أن ذراتها تصطف بشكل منتظم بحيث يجاور الأيونُ الموجبُ أيوناً سالباً وهكذا.
إنَّ الطاقة الكهراكدة لتآثر الأيونات بعضها مع بعض في البلورات الأيونية يفسر سبب تماسكها. كما أن انزياحات الأيونات عن مواضعها في تلك البلورات، وهي انزياحات ضئيلة ـ يجعلها غير ناقلة للكهرباء. وفي بعض الحالات، كما هو الحال في الكوارتز، تقود هذه الانزياحات إلى ظاهرة الكهرباء الضغطية (الكهرباء الإجهادية) Piezoelectr.
تواجده

لا يقتصر وجود الأيونات أو الشوارد على السوائل، بل يتعداها إلى الأجسام الصلبة والغازات.
إذ يمكن لذرات الغاز أو جزيئاته أن تفقد إلكتروناً أو أكثر بإحدى الطرق الآتية:
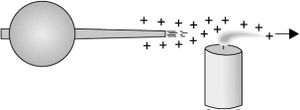
1ـ إن وجود حقل كهربائي شديد في نهاية رأس مؤنَّف، مغذىً بجهد كهربائي عال، يؤين الهواء المجاور له؛ مما يجعل الرأس المؤنف يدفع الأيونات المماثلة له في الشحنة بعيداً عنه، كما هو واضح في الشكل (2). وهذا هو المبدأ الذي تعمل عليه وسيلة الحماية من الصواعق [ر: الصاعقة]، وهو المبدأ الذي يعتمد عليه عمل مسرع فان دي غراف van de graaff.
2ـ إن مرور جسيمات عالية الطاقة في غاز يؤين ذراته. ويمكن أن تكون هذه الجسيمات إلكترونات مولدة في أنبوب أشعة مهبطي، أو أن تكون إشعاعات α أو β أو γ صادرة عن مادة مشعة. إن تشكل هذه الأيونات في عداد غايغر - موللر، وما يتبعه من انفراغ فيه، يمهد الطريق لعد الأيونات إلكترونياً، كما أن تكاثف قطيرات الماء في حجرة ويلسن حول الأيونات يجعل مسارات الجسيمات التي ولَّدتها مرئية.
تتحول جميع ذرات العناصر وهي بالحالة الغازية، بما في ذلك ذرات الغازات الخاملة، إلى كاتيونات غازية بالانفراغ الكهربائي تحت ضغط منخفض. وتشكل بعض الذرات أنيونات غازية شحنتها -1. وتشكل الجزيئات أيضاً أيونات بفعل الانفراغ الكهربائي. فبالانفراغ الكهربائي في أنبوب مملوء بغاز الميتان CH4، تتشكَّل أيونات جزيئيَّة غازية مثل CH2+ CH1+ CH4+ CH3+ وأيونات ذرية مثل H+ ،C3+ ،C++ ، C.
ولبعض الذرات الغازية قدرة على ضم إلكترون إضافي مشكلة أيوناً سالباً مثل I- أو خسارة إلكترون مشكلة أيوناً موجباً مثل I+. وهنالك ذرات كثيرة لها ميل شديد لضم إلكترونات لها، أو لها ميل شديد للتخلي عن إلكترونات مما يجعل الأيونات السالبة أو الموجبة، المتشكلة شديدة الثبات حيث توجد في معظم مركبات هذه العناصر.
وأيون I- هو الأيون الوحيد الثابت في مركبات اليود. يطلق على هذا الأيون اسم «يوديد» وهو موجود في ضروب اليوديد التي تشكلها المعادن النشيطة كيمياوياً (الفعّالة). كما تشكل باقي الهالوجينات أنيونات وحيدة الشحنة مثل أيون الفلوريد F- وأيون الكلوريد Cl- وأيون البروميد Br-.
تميل الذرات المعتدلة للمعادن القلوية أن تتخلى عن الكتروناتها الخارجية، إذ تحوي الذرة المعتدلة إلكتروناً في الطبقة الخارجية ضعيف الارتباط، بحيث تتخلى الذرة عن هذا الإلكترون الضعيف الارتباط بوجود الهالوجين ذي الميل الشديد لضم إلكترون، فيخسر المعدن إلكترونه مشكّلاً أيوناً موجباً ذا شحنة قدرها +1. وهذه الكاتيونات التي توجد في جميع مركبات المعادن القلوية تقريباً هي: أيون الليثيوم Li+، وأيون الصوديوم Na+، وأيون البوتاسيوم K+، وأيون الروبيديوم Rb+، وأيون السيزيوم Cs+.
المعادن القلوية (وهي عناصر الفصيلة I من الجدول الدوري) أيوناتها ذات شحنة موجبة قدرها +1، لأنّ ذراتها تحوي إلكتروناً واحداً إضافة إلى بنية غاز خامل، ويمكن التخلي عن هذا الإلكترون بسهولة. وتشكل الهالوجينات، في الفصيلة VII من الجدول الدوري أيونات سالبة أحادية الشحنة، لأن ذرة العنصر فيها سبعة الكترونات في طبقتها الخارجية أي تحوي إلكتروناً واحداً أقل من ذرة غاز خامل ولذا ترتبط مع إلكترون بسهولة.
وبصورة مشابهة، فإن ذرات عناصر الفصيلة II من الجدول الدوري تخسر إلكترونين وتتشكل أيونات (Be++,Mg++ ,Ca++,Sr++, Ba++,Ra++) لها بنية غاز خامل.
وتشكل عناصر الفصيلة III أيونات ثلاثية الشحنة الموجبة، وعناصر المجموعة VI أيونات ثنائية الشحنة السالبة.
تتكوّن المركبات الأيونية بين المعادن الفعّالة، في الفصائل III, II, I واللامعادن ذات الكهرسلبية العالية، في الزاوية العليا إلى يمين الجدول الدوري.
إضافة إلى ذلك تتكون مركبات أيونية حاوية كاتيونات معادن فعّالة مع أنيونات الحموض، خاصة الحموض الأكسجينية. والحموض الأكسجينية الرئيسة هي: حمض الكربون H2CO3 وأيونه السالب هو الكربونات CO3-- وحمض السيليكون H4SiO4 وأيونه السالب هو السيليكات SiO44-، وحمض الآزوت HNO3 وأيونه السالب النترات NO3-، وحمض الفوسفور H3PO4 وأيونه السالب الفوسفات PO43-، وحمض الكبريت H2SO4 وأيونة السالب الكبريتات SO4-- وحمض الكبريت (IV) وأيونه السالب الكبريتيت SO3--، وحمض فوق الكلور HClO4 وأيونه السالب فوق الكلورات ClO4-، وحمض الكلور HClO3 وأيونه السالب الكلورات ClO3-.
3 ـ إن مرور الأشعة فوق البنفسجية في غاز يؤين ذراته، وتسمى ظاهرة التأيين هذه باسم التأيين الضوئي photoionization، وهي ظاهرة تحدث في الغلاف الجوي الخارجي على ارتفاع بضع مئات من الكيلومترات فوق سطح الأرض، في منطقة تسمى الغلاف الأيوني Ionosphere. حيث يكون الهواء هناك مخلخلاً، ويتأين بشدة بفعل الأشعة فوق البنفسجية القادمة من الشمس.
قائمة الأيونات الشائعة
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
الهامش
- ^ أحمد حصري، هيام بيرقدار. "الشاردة". الموسوعة العربية. Retrieved 2012-04-14.
وصلات خارجية
- Department of Education, Newfoundland and Labrador-Canada "Periodic Chart of IonsPDF (70.9 KiB)". A Periodic table reporting ionic charges for every chemical element.