علم المناعة السرطاني
علم المناعة السرطاني Cancer immunology هو فرع متداخل التخصصات في علم الأحياء يختص بفهم دور الجهاز المناعي في تطور السرطان؛ أهم تطبيق معروف لهذا العلم هو المعالجة المناعية للسرطان، التي تستخدم الجهاز المناعي كعلاج للسرطان. تعتمد المراقبة المناعية والتحرير المناعي للسرطان على الحماية من تطور الأورام في أنظمة الحيوانات و (2) تحديد أهداف التعرف المناعي على سرطان الإنسان.
التعريف
علم المناعة السرطاني هو فرع متعدد التخصصات في علم الأحياء يهتم بدور الجهاز المناعي في تقدم السرطان وتطوره ؛ أهم تطبيق معروف هو المعالجة المناعية للسرطان، حيث تستخدم الجهاز المناعي لعلاج السرطان.[1][2] المراقبة المناعية للسرطان هي نظرية صاغها بيرنت وتوماس في عام 1957، واقترحا أن الخلايا اللمفاوية تعمل كحراس في التعرف والقضاء على الخلايا الناشئة،و الوليدة المتحولة باستمرار.[3][4] يبدو أن المراقبة المناعية للسرطان هي عملية مهمة لحماية المضيف حيث تقلل معدلات الإصابة بالسرطان من خلال تثبيط التسرطن والحفاظ على الاستتباب الخلوي المنتظم.[5] كما تم اقتراح أن المراقبة المناعية تعمل بشكل أساسي كعنصر من مكونات عملية أكثر عمومية للتعديل المناعي للسرطان.[3]
مستضدات الورم
قد تعبر الأورام عن مستضدات الورم التي يتعرف عليها الجهاز المناعي وقد تؤدي إلى استجابة مناعية.[6] مستضدات الورم هذه هي إما TSA (مستضد خاص بالورم) أو TAA (مستضد مرتبط بالورم).[7]
خاص بالورم
المستضدات الخاصة بالورم (TSA) هي مستضدات تحدث فقط في الخلايا السرطانية.[7] يمكن أن تكون المستضدات الخاصة بالورم من نواتج ڤيروسات الأورام مثل پروتينات E6 و E7 من ڤيروس الورم الحليمي البشري، والتي تحدث في سرطان عنق الرحم، أو پروتين EBNA-1 من ڤيروس إپستاين-بار، الذي يحدث في خلايا لمفومة بيركت.[8][9] مثال آخر على المستضدات الخاصة بالورم هي نواتج غير طبيعية من الجينات المسرطنة الطافرة (على سبيل المثال پروتين راس ) ومضادات الجينات الورمية (مثل بي53 ).[10]
المستضدات المرتبطة بالورم
توجد المستضدات المرتبطة بالورم (TAA) في الخلايا السليمة، ولكنها تحدث أيضًا لسبب ما في خلايا الورم.[7] ومع ذلك، فهي تختلف في الكمية أو المكان أو الفترة الزمنية للتعبير.[11] [12] المستضدات الورمية الجنينية هي مستضدات مرتبطة بالورم يتم التعبير عنها بواسطة الخلايا الجنينية والورمية.[13]أمثلة على المستضدات الورمية الجنينية هو ألفا فيتو پروتين (α-fetoprotein)، الذي ينتجه سرطان الخلايا الكبدية، أو CEA (مستضد سرطاني مضغي)، والذي يحدث في سرطان المبيض والقولون.[14][15] المزيد من المستضدات المرتبطة بالورم هم HER2/neu، EGFR or MAGE-1.[16][17][18]
التحرير المناعي
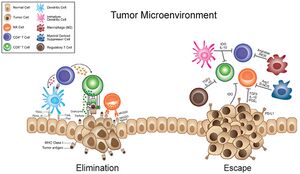
إن التحرير المناعي للسرطان هو عملية يتفاعل فيها الجهاز المناعي مع الخلايا الورمية. ويتكون من ثلاث مراحل: الاقصاء والتوازن والهروب. غالبًا ما يشار إلى هذه المراحل باسم "المراحل الثلاث" للتحرير المناعي للسرطان. كلا الجهاز المناعي المتكيف والفطري يشاركان في التحرير المناعي.[19]
في مرحلة الإقصاء، تؤدي الاستجابة المناعية إلى تدمير خلايا الورم وبالتالي تثبيط الورم. ومع ذلك، فإن بعض الخلايا الورمية قد تكتسب المزيد من الطفرات وتغير خصائصها وتتفادى جهاز المناعة. قد تدخل هذه الخلايا في مرحلة التوازن، حيث لا يتعرف الجهاز المناعي على جميع خلايا الورم، ولكن في نفس الوقت لا ينمو الورم. قد تؤدي هذه الحالة إلى مرحلة الهروب، حيث يكتسب الورم السيطرة على جهاز المناعة، ويبدأ في النمو ويؤسس بيئة مثبطة للمناعة.[20]
نتيجة للتحرير المناعي، تكتسب مستنسخات خلايا الورم الأقل استجابة للجهاز المناعي السيطرة في الورم بمرور الوقت، حيث يتم التخلص من الخلايا التي تم التعرف عليها. يمكن اعتبار هذه العملية شبيهة بالتطور الدارويني، حيث تعيش الخلايا التي تحتوي على طليعة الجين الورمي أو طفرات مثبطة للمناعة لتمرير طفراتها إلى الخلايا الوليدة، والتي قد تتحور هي نفسها وتخضع لمزيد من الضغط الانتقائي. ينتج عن هذا أن الورم يتكون من خلايا ذات استمناع منخفض ولا يمكن القضاء عليها بصعوبة.[20] وقد ثبت حدوث هذه الظاهرة كنتيجة للعلاج المناعي لمرضى السرطان.[21]
آليات مراوغة الورم
- تعد الخلايا التائية السامة للخلايا CD8+ عنصرًا أساسيًا في المناعة المضادة للورم. تتعرف مستقبلات الخلايا التائية الخاصة بها على المستضدات التي يقدمها معقد التوافق النسيجي الكبير الفئة الأولى وعندما يكونوا مرتبطين، تحفز الخلية التائية السامة نشاطها السام للخلايا. معقد التوافق النسيجي الكبير I موجود على سطح جميع الخلايا المنواة. ومع ذلك، فإن بعض الخلايا السرطانية تقلل من تعبير معقد التوافق النسيجي الكبير I الخاص بها وتتجنب اكتشافها بواسطة الخلايا التائية السامة للخلايا.[22][23] يمكن القيام بذلك عن طريق طفرة في جين معقد التوافق النسيجي الكبير I أو عن طريق خفض الحساسية لإنترفيرون- گاما (الذي يؤثر على التعبير السطحي لمعقد التوافق النسيجي الكبير I).[22][24] تحتوي الخلايا الورمية أيضًا على عيوب في مسار عرض المستضد، مما يؤدي إلى تقليل التنظيم لعروض مستضد الورم. توجد العيوب على سبيل المثال في الناقل المرتبط بمعالجة المستضد (TAP) أو تاباسين.[25] من ناحية أخرى، فإن الفقدان الكامل لمعقد التوافق النسيجي الكبير I هو محفز للخلايا القاتلة الطبيعية.[26]وبالتالي تحافظ الخلايا الورمية على تعبير منخفض لمعقد التوافق النسيجي الكبير 1.[22]
- هناك طريقة أخرى للهروب من الخلايا التائية السامة للخلايا وهي توقف التعبير عن الجزيئات الضرورية للتحفيز المشترك للخلايا التائية السامة للخلايا، مثل CD80 أو CD86.[27][28]
- تعبر الخلايا الورمية عن جزيئات للحث على الاستموات أو لتثبيط الخلايا اللمفاوية التائية :
- اكتسبت الخلايا الورمية مقاومة للآليات المستفعلة من الخلية القاتلة الطبيعية و الخلية التائية السامة للخلايا +CD8:
- عن طريق فقدان التعبير الجيني أو تثبيط جزيئات مسار إشارة الاستموات: APAF1، كاسباس 8،Bcl-2 المرتبط بپروتين (bax) (X) و Bcl-2 القاتل المضاد المتماثل (باك).[بحاجة لمصدر]
- عن طريق تحفيز التعبير أو الإفراط في التعبير عن الجزيئات المضادة للخلايا: Bcl-2 أو مثبط پروتين الاستموات أو مثبط پروتين الاستموات المرتبط بالصبغي X.[31][32]
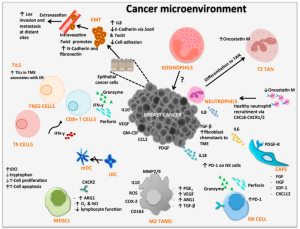
البيئة المكروية للورم
- يؤدي إنتاج عامل النمو المحول بيتا بواسطة الخلايا الورمية والخلايا الأخرى (مثل الخلية الكابتة المشتقة من النخاع الشوكي) إلى تحويل خلية تائية +CD4 إلى خلية تائية تنظيمية قمعية(Treg)[33] عن طريق الاعتماد علي الاتصال أو تحفيز مستقل. في الأنسجة السليمة، تعتبر الخلايا التائية التنظيمية الوظيفية ضرورية للحفاظ على تحمل الذات. ومع ذلك، في الورم، تشكل الخلايا التائية التنظيمية بيئة مكروية مثبطة للمناعة.[34]
- تنتج الخلايا الورمية السيتوكينات الخاصة (مثل عامل تحفيز المستعمرة ) لإنتاج خلية مثبطة مشتقة من النخاع الشوكي. هذه الخلايا عبارة عن مجموعة غير متجانسة من أنواع الخلايا بما في ذلك سلائف الخلية المتغصنة والخلية الوحيدة و الخلية العدلة. الخلية المثبطة المشتقة من النخاع الشوكي لها تأثيرات قمعية على الخلايا اللمفاوية التائية والخلايا المتغصنة وخلايا الدم البيضاء. أنها تنتج عامل النمو المحول بيتا مثبط للمناعة و إنترلوكين-10.[35][26]
- منتج آخر لعامل النمو المحول بيتا مثبط و إنترلوكين-10 هي خلايا الدم البيضاء المرتبطة بالورم، هذه الخلايا الدم البيضاء لها في الغالب نمط ظاهري من الخلية الدم البيضاء M2 المنشطة بشكل بديل. يتم تعزيز تنشيطها بواسطة سيتوكينات الخلية التائية من النوع 2 (مثل إنترلوكين-4 و إنترلوكين-13 ). وتتمثل آثارها الرئيسية في قمع المناعة وتعزيز نمو الورم وتولد الأوعية.[36]
- تحتوي الخلايا الورمية على فئة معقد التوافق النسيجي الكبير غير الكلاسيكي I على سطحها، على سبيل المثال HLA-G. HLA-G هو محفز للخلايا التائية التنظيمية، الخلية المثبطة المشتقة من النخاع الشوكي، يستقطب خلايا الدم البيضاء إلى M2 المنشطة بشكل بديل وله تأثيرات أخرى مثبطة للمناعة على الخلايا المناعية.[37]
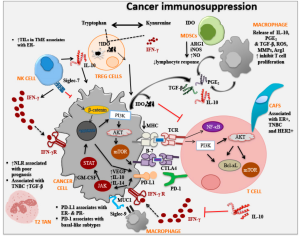
طرق التنظيم المناعي
الجهاز المناعي هو اللاعب الرئيسي في مكافحة السرطان. كما هو موضح أعلاه في آليات مراوغة الورم، فإن الخلايا الورمية تنظم الاستجابة المناعية في صفها. من الممكن تحسين الاستجابة المناعية من أجل تعزيز المناعة ضد الخلايا الورمية.
- تسمى الأجسام المضادة وحيدة النسيلة الضد لپروتين مرتبط بالخلايا اللمفاوية التائية السامة 4 والضد لپروتين الاستموات-1 مثبطات نقطة التفتيش المناعية :
- الپروتين المرتبط بالخلايا اللمفاوية التائية السامة 4 هو مستقبل منظم على غشاء الخلايا اللمفاوية التائية المنشطة، يؤدي تفاعل الپروتين المرتبط بالخلايا اللمفاوية التائية السامة 4 و CD80 / 86 إلى إيقاف الخلايا اللمفاوية التائية. عن طريق منع هذا التفاعل مع الجسم المضاد وحيد النسيلة الضد للپروتين المرتبط بالخلايا اللمفاوية التائية السامة 4 يمكننا زيادة الاستجابة المناعية. مثال على الدواء المعتمد هو إيپيليموماب.
- پروتين الاستموات-1 هو أيضًا مستقبل منظم على سطح الخلايا اللمفاوية التائية بعد التنشيط. يؤدي تفاعل پروتين الاستموات-1 مع لجين 1- پروتين الاستموات إلى إيقاف التشغيل أو الاستموات. لجين 1- پروتين الاستموات هي جزيئات يمكن أن تنتجها الخلايا الورمية. يعمل الجسم المضاد أحادي النسيلة المضاد لپروتين الاستموات-1 على منع هذا التفاعل مما يؤدي إلى تحسين الاستجابة المناعية في الخلايا الليمفاوية التائية +CD8. مثال على دواء السرطان المعتمد نيڤولوماب.[38]
- مستقبل المستضد الوهمي في الخلية التائية
- مستقبلات المستضد الوهمي هذه عبارة عن مستقبلات معدلة وراثيًا مع مواقع ارتباط خاصة بالورم خارج الخلية ومجال إشارة داخل النخاع يمكّن من تنشيط الخلايا اللمفاوية التائية.[39]
- لقاح السرطان
- يمكن أن يتكون اللقاح من خلايا ورمية ميتة، أو مستضدات أورام مأشوبة، أو خلايا متغصنة محتضنة مع مستضدات الورم ( لقاح السرطان القائم على الخلايا المتغصنة ) [40]
العلاقة بالعلاج الكيماوي
عُبيد وآخرون.[41] تقصوا عن كيف يجب أن يصبح حث موت الخلايا السرطانية المناعية أولوية في العلاج الكيميائي للسرطان. ورأى أن الجهاز المناعي سيكون قادرًا على لعب عاملاً من خلال "تأثير المتفرج" في القضاء على الخلايا السرطانية المقاومة للعلاج الكيميائي.[42][43][44][2] ومع ذلك، لا تزال هناك حاجة إلى إجراء بحث مكثف حول كيفية تحفيز الاستجابة المناعية ضد الخلايا السرطانية المحتضرة.[2][45]
افترض المتخصصون في هذا المجال أن "الاستموات يكون ضعيفًا مناعياً بينما موت الخلايا النخرية هو حقًا مناعي’.[46][47][48] ربما يرجع ذلك إلى أن الخلايا السرطانية التي يتم استئصالها عبر مسار موت الخلايا النخرية تحفز استجابة مناعية عن طريق تحفيز الخلايا المتغصنة لتنضج، بسبب تحفيز الاستجابة الالتهابية.[49][50] من ناحية أخرى، يرتبط الاستموات بتغييرات طفيفة داخل غشاء البلازما مما يجعل الخلايا المحتضرة جذابة للخلايا البلعمية.[51] ومع ذلك، فقد أظهرت العديد من الدراسات التي أجريت على الحيوانات تفوق التطعيم بالخلايا الميتة، مقارنة بالخلايا النخرية، في استنباط استجابات مناعية مضادة للورم.[52][53][54][55][56]
وبناءاً عليه عُبيد وآخرون.[41] اقترحوا أن الطريقة التي تموت بها الخلايا السرطانية أثناء العلاج الكيميائي أمر حيوي. أنثراسيكلينات تنتج بيئة مناعية مفيدة. أفاد الباحثون أنه عند قتل الخلايا السرطانية بهذا العامل، يتم تشجيع امتصاص الخلايا المتغصنة وعرضها بواسطة مستضد، مما يسمح باستجابة الخلايا التائية التي يمكن أن تقلص الأورام. لذلك، فإن تنشيط الخلايا التائية القاتلة للورم أمر بالغ الأهمية لنجاح العلاج المناعي.[2][57]
ومع ذلك، فإن مرضى السرطان المتقدمين الذين يعانون من تثبيط مناعي قد تركوا الباحثين في معضلة حول كيفية تنشيط الخلايا التائية الخاصة بهم. الطريقة التي تتفاعل بها الخلايا المتغصنة المضيفة وامتصاص مستضدات الورم لتقديمها إلى خلايا التائية +CD4 و+CD8 هي مفتاح نجاح العلاج.[2][58]
انظر أيضاً
المراجع
- ^ Miller JF, Sadelain M (April 2015). "The journey from discoveries in fundamental immunology to cancer immunotherapy". Cancer Cell. 27 (4): 439–49. doi:10.1016/j.ccell.2015.03.007. PMID 25858803.
- ^ أ ب ت ث ج Syn NL, Teng MW, Mok TS, Soo RA (December 2017). "De-novo and acquired resistance to immune checkpoint targeting". The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ أ ب Dunn GP, Bruce AT, Ikeda H, Old LJ, Schreiber RD (November 2002). "Cancer immunoediting: from immunosurveillance to tumor escape". Nature Immunology. 3 (11): 991–8. doi:10.1038/ni1102-991. PMID 12407406. S2CID 3355084.
- ^ Burnet M (April 1957). "Cancer; a biological approach. I. The processes of control". British Medical Journal. 1 (5022): 779–86. doi:10.1136/bmj.1.3356.779. JSTOR 25382096. PMC 1973174. PMID 13404306.
- ^ Kim R, Emi M, Tanabe K (May 2007). "Cancer immunoediting from immune surveillance to immune escape". Immunology. 121 (1): 1–14. doi:10.1111/j.1365-2567.2007.02587.x. PMC 2265921. PMID 17386080.
- ^ Pandolfi F, Cianci R, Pagliari D, Casciano F, Bagalà C, Astone A, et al. (2011). "The immune response to tumors as a tool toward immunotherapy". Clinical & Developmental Immunology. 2011: 894704. doi:10.1155/2011/894704. PMC 3235449. PMID 22190975.
- ^ أ ب ت Storkus WJ, Finn OJ, DeLeo A, Zarour HM (2003). "Categories of Tumor Antigens". In Kufe DW, Pollock RE, Weichselbaum RR, Bast Jr RC, Gansler TS, Holland JF, Frei III E (eds.). Holland-Frei Cancer Medicine (6th ed.).
- ^ Ramos CA, Narala N, Vyas GM, Leen AM, Gerdemann U, Sturgis EM, Anderson ML, Savoldo B, Heslop HE, Brenner MK, Rooney CM (January 2013). "Human papillomavirus type 16 E6/E7-specific cytotoxic T lymphocytes for adoptive immunotherapy of HPV-associated malignancies". Journal of Immunotherapy. 36 (1): 66–76. doi:10.1097/CJI.0b013e318279652e. PMC 3521877. PMID 23211628.
- ^ Kelly GL, Stylianou J, Rasaiyaah J, Wei W, Thomas W, Croom-Carter D, Kohler C, Spang R, Woodman C, Kellam P, Rickinson AB, Bell AI (March 2013). "Different patterns of Epstein-Barr virus latency in endemic Burkitt lymphoma (BL) lead to distinct variants within the BL-associated gene expression signature". Journal of Virology. 87 (5): 2882–94. doi:10.1128/JVI.03003-12. PMC 3571367. PMID 23269792.
- ^ Disis ML, Cheever MA (October 1996). "Oncogenic proteins as tumor antigens". Current Opinion in Immunology. 8 (5): 637–42. doi:10.1016/s0952-7915(96)80079-3. PMID 8902388.
- ^ Finn OJ (May 2017). "Human Tumor Antigens Yesterday, Today, and Tomorrow". Cancer Immunology Research. 5 (5): 347–354. doi:10.1158/2326-6066.CIR-17-0112. PMC 5490447. PMID 28465452.
- ^ "Human Tumor Antigens Yesterday, Today, and Tomorrow". Cancer Immunology Research. 5 (5): 347–354. May 2017. doi:10.1158/2326-6066.CIR-17-0112. PMID 28465452.
{{cite journal}}: Unknown parameter|PMCID=ignored (|pmc=suggested) (help) - ^ Orell SR, Dowling KD (November 1983). "Oncofetal antigens as tumor markers in the cytologic diagnosis of effusions". Acta Cytologica. 27 (6): 625–9. PMID 6196931.
- ^ Hsieh MY, Lu SN, Wang LY, Liu TY, Su WP, Lin ZY, Chuang WL, Chen SC, Chang WY (November 1992). "Alpha-fetoprotein in patients with hepatocellular carcinoma after transcatheter arterial embolization". Journal of Gastroenterology and Hepatology. 7 (6): 614–7. doi:10.1111/j.1440-1746.1992.tb01495.x. PMID 1283085. S2CID 7112149.
- ^ Khoo SK, MacKay EV (October 1976). "Carcinoembryonic antigen (CEA) in ovarian cancer: factors influencing its incidence and changes which occur in response to cytotoxic drugs". British Journal of Obstetrics and Gynaecology. 83 (10): 753–9. doi:10.1111/j.1471-0528.1976.tb00739.x. PMID 990213. S2CID 6945964.
- ^ Wang B, Zaidi N, He LZ, Zhang L, Kuroiwa JM, Keler T, Steinman RM (March 2012). "Targeting of the non-mutated tumor antigen HER2/neu to mature dendritic cells induces an integrated immune response that protects against breast cancer in mice". Breast Cancer Research. 14 (2): R39. doi:10.1186/bcr3135. PMC 3446373. PMID 22397502.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Li G, Wong AJ (September 2008). "EGF receptor variant III as a target antigen for tumor immunotherapy". Expert Review of Vaccines. 7 (7): 977–85. doi:10.1586/14760584.7.7.977. PMID 18767947. S2CID 207196758.
- ^ Weon JL, Potts PR (December 2015). "The MAGE protein family and cancer". Current Opinion in Cell Biology. 37: 1–8. doi:10.1016/j.ceb.2015.08.002. PMC 4688208. PMID 26342994.
- ^ Dunn GP, Old LJ, Schreiber RD (2004-03-19). "The three Es of cancer immunoediting". Annual Review of Immunology. 22 (1): 329–60. CiteSeerX 10.1.1.459.1918. doi:10.1146/annurev.immunol.22.012703.104803. PMID 15032581.
- ^ أ ب Mittal D, Gubin MM, Schreiber RD, Smyth MJ (April 2014). "New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape". Current Opinion in Immunology. 27: 16–25. doi:10.1016/j.coi.2014.01.004. PMC 4388310. PMID 24531241.
- ^ von Boehmer L, Mattle M, Bode P, Landshammer A, Schäfer C, Nuber N, Ritter G, Old L, Moch H, Schäfer N, Jäger E, Knuth A, van den Broek M (2013-07-15). "NY-ESO-1-specific immunological pressure and escape in a patient with metastatic melanoma". Cancer Immunity. 13: 12. PMC 3718732. PMID 23882157.
- ^ أ ب ت Daniyan AF, Brentjens RJ (June 2017). "Immunotherapy: Hiding in plain sight: immune escape in the era of targeted T-cell-based immunotherapies". Nature Reviews. Clinical Oncology. 14 (6): 333–334. doi:10.1038/nrclinonc.2017.49. PMC 5536112. PMID 28397826.
- ^ Cai L, Michelakos T, Yamada T, Fan S, Wang X, Schwab JH, et al. (June 2018). "Defective HLA class I antigen processing machinery in cancer". Cancer Immunology, Immunotherapy. 67 (6): 999–1009. doi:10.1007/s00262-018-2131-2. PMID 29487978. S2CID 3580894.
- ^ Mojic M, Takeda K, Hayakawa Y (December 2017). "The Dark Side of IFN-γ: Its Role in Promoting Cancer Immunoevasion". International Journal of Molecular Sciences. 19 (1): 89. doi:10.3390/ijms19010089. PMC 5796039. PMID 29283429.
- ^ Vinay DS, Ryan EP, Pawelec G, Talib WH, Stagg J, Elkord E, et al. (December 2015). "Immune evasion in cancer: Mechanistic basis and therapeutic strategies". Seminars in Cancer Biology. A broad-spectrum integrative design for cancer prevention and therapy. 35 Suppl: S185–S198. doi:10.1016/j.semcancer.2015.03.004. PMID 25818339.
- ^ أ ب Wagner M, Koyasu S (May 2019). "Cancer Immunoediting by Innate Lymphoid Cells". Trends in Immunology. 40 (5): 415–430. doi:10.1016/j.it.2019.03.004. PMID 30992189. S2CID 119093972.
- ^ Tirapu I, Huarte E, Guiducci C, Arina A, Zaratiegui M, Murillo O, Gonzalez A, Berasain C, Berraondo P, Fortes P, Prieto J, Colombo MP, Chen L, Melero I (February 2006). "Low surface expression of B7-1 (CD80) is an immunoescape mechanism of colon carcinoma". Cancer Research. 66 (4): 2442–50. doi:10.1158/0008-5472.CAN-05-1681. PMID 16489051.
- ^ Pettit SJ, Ali S, O'Flaherty E, Griffiths TR, Neal DE, Kirby JA (April 1999). "Bladder cancer immunogenicity: expression of CD80 and CD86 is insufficient to allow primary CD4+ T cell activation in vitro". Clinical and Experimental Immunology. 116 (1): 48–56. doi:10.1046/j.1365-2249.1999.00857.x. PMC 1905215. PMID 10209504.
- ^ Peter ME, Hadji A, Murmann AE, Brockway S, Putzbach W, Pattanayak A, Ceppi P (April 2015). "The role of CD95 and CD95 ligand in cancer". Cell Death and Differentiation. 22 (4): 549–59. doi:10.1038/cdd.2015.3. PMC 4356349. PMID 25656654.
- ^ Buchbinder EI, Desai A (February 2016). "CTLA-4 and PD-1 Pathways: Similarities, Differences, and Implications of Their Inhibition". American Journal of Clinical Oncology. 39 (1): 98–106. doi:10.1097/COC.0000000000000239. PMC 4892769. PMID 26558876.
- ^ Frenzel A, Grespi F, Chmelewskij W, Villunger A (April 2009). "Bcl2 family proteins in carcinogenesis and the treatment of cancer". Apoptosis. 14 (4): 584–96. doi:10.1007/s10495-008-0300-z. PMC 3272401. PMID 19156528.
- ^ Obexer P, Ausserlechner MJ (2014-07-28). "X-linked inhibitor of apoptosis protein - a critical death resistance regulator and therapeutic target for personalized cancer therapy". Frontiers in Oncology. 4: 197. doi:10.3389/fonc.2014.00197. PMC 4112792. PMID 25120954.
- ^ Polanczyk MJ, Walker E, Haley D, Guerrouahen BS, Akporiaye ET (July 2019). "+ T cells". Journal of Translational Medicine. 17 (1): 219. doi:10.1186/s12967-019-1967-3. PMC 6617864. PMID 31288845.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Ha TY (December 2009). "The role of regulatory T cells in cancer". Immune Network (in الإنجليزية). 9 (6): 209–35. doi:10.4110/in.2009.9.6.209. PMC 2816955. PMID 20157609.
- ^ Mantovani A (December 2010). "The growing diversity and spectrum of action of myeloid-derived suppressor cells". European Journal of Immunology. 40 (12): 3317–20. doi:10.1002/eji.201041170. PMID 21110315.
- ^ Quaranta V, Schmid MC (July 2019). "Macrophage-Mediated Subversion of Anti-Tumour Immunity". Cells. 8 (7): 747. doi:10.3390/cells8070747. PMC 6678757. PMID 31331034.
- ^ Lin A, Yan WH (2018). "Heterogeneity of HLA-G Expression in Cancers: Facing the Challenges". Frontiers in Immunology (in الإنجليزية). 9: 2164. doi:10.3389/fimmu.2018.02164. PMC 6170620. PMID 30319626.
- ^ Brunner-Weinzierl MC, Rudd CE (2018-11-27). "CTLA-4 and PD-1 Control of T-Cell Motility and Migration: Implications for Tumor Immunotherapy". Frontiers in Immunology. 9: 2737. doi:10.3389/fimmu.2018.02737. PMC 6277866. PMID 30542345.
- ^ Feins S, Kong W, Williams EF, Milone MC, Fraietta JA (May 2019). "An introduction to chimeric antigen receptor (CAR) T-cell immunotherapy for human cancer". American Journal of Hematology. 94 (S1): S3–S9. doi:10.1002/ajh.25418. PMID 30680780.
- ^ Abbas AK (2018). Cellular and molecular immunology. Elsevier. p. 409. ISBN 978-0-323-47978-3.
- ^ أ ب Obeid M, Tesniere A, Ghiringhelli F, Fimia GM, Apetoh L, Perfettini JL, Castedo M, Mignot G, Panaretakis T, Casares N, Métivier D, Larochette N, van Endert P, Ciccosanti F, Piacentini M, Zitvogel L, Kroemer G (Jan 2007). "Calreticulin exposure dictates the immunogenicity of cancer cell death". Nature Medicine. 13 (1): 54–61. doi:10.1038/nm1523. PMID 17187072. S2CID 12641252.
- ^ Steinman RM, Mellman I (Jul 2004). "Immunotherapy: bewitched, bothered, and bewildered no more". Science. 305 (5681): 197–200. Bibcode:2004Sci...305..197S. doi:10.1126/science.1099688. PMID 15247468. S2CID 5169245.
- ^ Lake RA, van der Most RG (Jun 2006). "A better way for a cancer cell to die". The New England Journal of Medicine. 354 (23): 2503–4. doi:10.1056/NEJMcibr061443. PMID 16760453.
- ^ Zitvogel L, Tesniere A, Kroemer G (Oct 2006). "Cancer despite immunosurveillance: immunoselection and immunosubversion". Nature Reviews. Immunology. 6 (10): 715–27. doi:10.1038/nri1936. PMID 16977338.
- ^ Zitvogel L, Casares N, Péquignot MO, Chaput N, Albert ML, Kroemer G (2004). Immune response against dying tumor cells. Advances in Immunology. Vol. 84. pp. 131–79. doi:10.1016/S0065-2776(04)84004-5. ISBN 978-0-12-022484-5. PMID 15246252.
- ^ Bellamy CO, Malcomson RD, Harrison DJ, Wyllie AH (Feb 1995). "Cell death in health and disease: the biology and regulation of apoptosis". Seminars in Cancer Biology. 6 (1): 3–16. doi:10.1006/scbi.1995.0002. PMID 7548839.
- ^ Thompson CB (Mar 1995). "Apoptosis in the pathogenesis and treatment of disease". Science. 267 (5203): 1456–62. Bibcode:1995Sci...267.1456T. doi:10.1126/science.7878464. PMID 7878464. S2CID 12991980.
- ^ Igney FH, Krammer PH (Apr 2002). "Death and anti-death: tumour resistance to apoptosis". Nature Reviews. Cancer. 2 (4): 277–88. doi:10.1038/nrc776. PMID 12001989. S2CID 205470264.
- ^ Steinman RM, Turley S, Mellman I, Inaba K (Feb 2000). "The induction of tolerance by dendritic cells that have captured apoptotic cells". The Journal of Experimental Medicine. 191 (3): 411–6. doi:10.1084/jem.191.3.411. PMC 2195815. PMID 10662786.
- ^ Liu K, Iyoda T, Saternus M, Kimura Y, Inaba K, Steinman RM (Oct 2002). "Immune tolerance after delivery of dying cells to dendritic cells in situ". The Journal of Experimental Medicine. 196 (8): 1091–7. doi:10.1084/jem.20021215. PMC 2194037. PMID 12391020.
- ^ Kroemer G, El-Deiry WS, Golstein P, Peter ME, Vaux D, Vandenabeele P, Zhivotovsky B, Blagosklonny MV, Malorni W, Knight RA, Piacentini M, Nagata S, Melino G (Nov 2005). "Classification of cell death: recommendations of the Nomenclature Committee on Cell Death". Cell Death and Differentiation. 12 Suppl 2: 1463–7. doi:10.1038/sj.cdd.4401724. PMC 2744427. PMID 16247491.
- ^ Buckwalter MR, Srivastava PK (2013). "Mechanism of dichotomy between CD8+ responses elicited by apoptotic and necrotic cells". Cancer Immunity. 13: 2. PMC 3559190. PMID 23390373.
- ^ Gamrekelashvili J, Ormandy LA, Heimesaat MM, Kirschning CJ, Manns MP, Korangy F, Greten TF (Oct 2012). "Primary sterile necrotic cells fail to cross-prime CD8(+) T cells". Oncoimmunology. 1 (7): 1017–1026. doi:10.4161/onci.21098. PMC 3494616. PMID 23170250.
- ^ Janssen E, Tabeta K, Barnes MJ, Rutschmann S, McBride S, Bahjat KS, Schoenberger SP, Theofilopoulos AN, Beutler B, Hoebe K (Jun 2006). "Efficient T cell activation via a Toll-Interleukin 1 Receptor-independent pathway". Immunity. 24 (6): 787–99. doi:10.1016/j.immuni.2006.03.024. PMID 16782034.
- ^ Ronchetti A, Rovere P, Iezzi G, Galati G, Heltai S, Protti MP, Garancini MP, Manfredi AA, Rugarli C, Bellone M (Jul 1999). "Immunogenicity of apoptotic cells in vivo: role of antigen load, antigen-presenting cells, and cytokines". Journal of Immunology. 163 (1): 130–6. PMID 10384108.
- ^ Scheffer SR, Nave H, Korangy F, Schlote K, Pabst R, Jaffee EM, Manns MP, Greten TF (Jan 2003). "Apoptotic, but not necrotic, tumor cell vaccines induce a potent immune response in vivo". International Journal of Cancer. 103 (2): 205–11. doi:10.1002/ijc.10777. PMID 12455034.
- ^ Storkus WJ, Falo LD (Jan 2007). "A 'good death' for tumor immunology". Nature Medicine. 13 (1): 28–30. doi:10.1038/nm0107-28. PMID 17206130. S2CID 28596435.
- ^ Dunn GP, Koebel CM, Schreiber RD (Nov 2006). "Interferons, immunity and cancer immunoediting". Nature Reviews. Immunology. 6 (11): 836–48. doi:10.1038/nri1961. PMID 17063185. S2CID 223082.