حالة انتقالية
الإصطدام بين جزيئات المتفاعلات يمكن أن يؤدي إلى تفاعل ناجح.وتعتمد النواتج على عوامل مثل طاقة الحركة النسبية, توجهات الجزيئات, والطاقة الداخلية للجزيئات. وحتى لو أن هذا التصادم للمتفاعلات أدى لتكون معقد منشط لا تتحد هذه المتفاعلات لتكوين النواتج، وبدلا من ذلك يتفكك المعقد إلى المتفاعلات مرة أخرى.
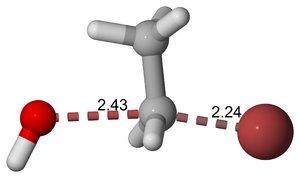
وكمثال، فالحالة الانتقالية المعروضة أدناه تحدث أثناء التفاعل SN2 للبروموإثان مع أنيون هيدروكسيل.
التعريف القديم
الحالة الإنتقالية لتفعال هو شكل معين يحدد إتجاه التفاعل. ويتم تعريفها على أنها الحالة المناظرة لأعلى طاقة خلال إتجاه التفاعل. وعند هذه النقطة, بفرض وجود تفاعل عكسي تام, فإن المتفاعلات ستصطدم دائما لتكوين النواتج.
تاريخ الحالة الإنتقالية
مصطلح الحالة الإنتقالية هام للغاية في عديد من نظريات المعدلات التى يحدث بها تفاعل كيميائي. وتبدأ هذه النظريات بنظرية الحالة الإنتقالية, والتى تم إقتراحها لأول مرة عام 1935 والتى كانت السبب لوجود المفاهيم الأساسية في الكيمياء الحركية ولازالت تستخدم حتى الآن.
المشاكل التى تلاحظ أثناء الحالة الإنتقالية
حسب قواعد ميكيانيكا الكم, لا يمكن تحديد الحالة الإنتقالية, أو ملاحظتها. لأن نشبة التوزيع عند هذه النقطة يكون صفر. وعموماً، فإن تقنيات المطياف الجيدة يمكن أن تقترب من الحالة الإنتقالية قدر المستطاع. كما أن إختراع مطيافية الآشعة تحت الحمراء الفمتو-كيميائية كان من أجل الوصول للحالة الإنتقالية، ويمكن تصور البناء الجزيئي عند نقطة في غاية القرب من الحالة الإنتقالية. وذلك بالرغم من أنه خلال إتجاه التفاعل تكون الوسائط النشيطة موجودة ولا تكون أقل في الطاقة من الحالة الإنتقالية مما يجعل من الصعب للتفريق بينهما.
فرض هاموند-ليفلر
فرض هاموند-ليفلر Hammond–Leffler postulate هو إفتراض بأن الحالات التى تكون فيها الحالة الإنتقالية قريبة من الوصول للنواتج أو للمتفاعلات الأولية, تعتمد على أيهما له إنثالبي أكبر.
التطبيق على تحفيز الإنزيمات
أحد الطرق التى يتم بها حفز الإنزيمات هى تثبيت الحالة الإنتقالية عن طريق التحليل الكهربي. وذلك يقلل طاقة الحالة الإنتقالية, ويسمح بإنتشار أكبر للمواد البادئة للتفاعل للحصول على الطاقة اللازمة للتغلب على الطاقة الإنتقالية والوصول للنواتج.
انظر أيضاً
- نظرية الحالة الانتقالية
- Transition state analogs, chemical compounds mimicking the substrate's transition state and act as enzyme inhibitors
الهامش
المراجع
سولومونس, تي. دبليو. جراهام ، فريل, كريج بي. (2004) – "الكيمياء العضوي" (الطبعة الثامنة). شركة جون ويلي وأولاده. ISBN 0-471-41799-8
المصادر
- ويكيبيديا الإنجليزية.
