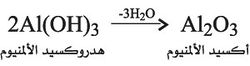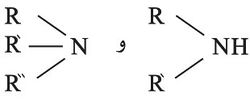قاعدة (كيمياء)
For the term in مورثات، انظر قاعدة (مورثات)
الأسس أو القواعد bases ، مركبات كيميائية تتميز بعدد من الخواص المشتركة ومنها: الطعم الذي يشبه طعم الغِسْلَة؛ والتأثير في محاليل الكواشف الملونة، فهي تلون عباد الشمس باللون الأزرق، والهليانتين باللون الأصفر، والفنول فتالئين باللون الأحمر البنفسجي أو الوردي، وتؤثر الأسس في الحموض مطلقةً حرارة ومكونةً ملحاً وماء، وتؤثر في بعض المعادن مكونةً ملحاً ومطلقة الهيدروجين.[1]
تعاريف
من الأجسام التي تبدي درجات شتى من هذه الخواص هناك: الأسس القلوية كالصود NaOH والبوتاس KOH الوحيدي الأساس، والأسس القلوية الترابية كالكلس Ca(OH)3، والباريت Ba(OH)2 الثنائيي الأساس.
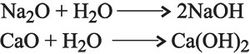
ويمكن عد الأسس نتاجَ انحلال أكاسيد المعادن القلوية في الماء كأكسيد الصوديوم Na2O، وانحلال أكاسيد المعادن القلوية الترابية في الماء كأكسيد الكلسيوم CaO:
كما يطلق على الأسس المذكورة ـ نتيجة لصيغتها ـ اسم هدروكسيدات المعادن الموافقة؛ فكل معدن يوافق من حيث المبدأ هدروكسيداً أو أكثر، إلا أن هذه الهدروكسيدات غالباً ما تكون قليلة الانحلال مما يحول دون التمكن من فحص خواصها في المحاليل، ومع ذلك تنسب إليها وظيفة أساسية لأنها تتفاعل مع الحموض معطية ملحاً وماء كهدروكسيد الألمنيوم الثلاثي الأساس:
ويوافق الأسسَ عند فقدها للماء أكسيد يدعى أكسيداً أساسياً للمعدن:
ومن الأسس أيضاً غاز النشادر NH3 والأمينات العضوية مثل RNH2،
ففي حالة النشادر أدت التشابهات الكثيرة بين أملاح الأمونيوم والأملاح القلوية إلى قبول وجود الأساس NH4OH في المحاليل المائية لغاز النشادر، إلا أن هذا الجسم لم يعزل، وقد ثبت في الوقت الحاضر عدم وجود جزيء كهذا.
الخصائص
جاءت نظرية الشوارد (الأيونات) لأرنيوس Arrhenius فعزت خواص الأسس في محاليلها المائية إلى شوارد الهدروكسيل التي تصدرها بالتفكك الأيوني (الشاردي) ionization. ويكون الأساس قوياً (مثل NaOH ) إذا كان التشرد (التأين) كلياً:
ويكون الأساس ضعيفاً إذا كان التشرد جزئياً:
ويتميز الأساس في هذه الحالة الأخيرة بثابتة أساسية (كاف الأساس ):
حيث [B+] و[OH-] و[BOH] هي التركيزات الجزيئية الحجمية لمحاليل هذه الشوارد والجزيئات غير المتشردة. وتعرّف هذه الثابتة بأسلوب مماثل لتعريف ثابتة حموضة الحمض (كاف الحمض KA).
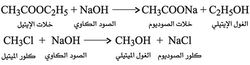
ومن خواص الأسس القوية تصبينها للإسترات ولهاليدات الألكيل بتفاعل كلي حسن السرعة:
إلا أن مفهوم أرّنيوس قد أُهمل في الوقت الحاضر بعد أن حلت محله نظرية برونستد Bronsted الأكثر إرضاء وعمومية.
فبحسب برونستد يُعَدُّ أساساً كلُّ جسم أو جزيء أو أيون قادر على تثبيت بروتون. فالمحاليل المائية للصود والبوتاس وغيرهما تحوي الأساس OH- الذي يتحد بالبروتون لإعطاء H2O:
ويُعَدُّ غاز النشادر NH3 أساساً لأنه يلتقط بروتوناً لإعطاء شاردة الأمونيوم لذلك لم يعد من الضروري افتراض وجود NH4OH لتفسير الخواص الأساسية للمحاليل المائية لغاز النشادر.
القواعد و pH
وتعد المحاليل المائية للأسس الكتروليتات electrolytes، ولها عموماً باهاء pH (رقم هدروجيني) أعلى من 7.
تحييد الأحماض
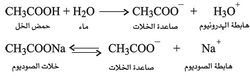
وعموماً تعد الصواعد (الأنيونات) anions المتكونة بفعل الحموض الضعيفة في الماء أو بتشرد أملاح الحموض الضعيفة هي نفسها أسساً ضعيفة، كشاردة الخلات CH3COO-، ونتيجة لذلك ازداد عدد الأسس ازدياداً كبيراً.
هذا مع العلم أن مفهوم لويس Lewis للتفاعل حمض + أساس هو أكثر عمومية من مفهوم برونستد.
Alkalinity of non-hydroxides
قواعد قوية
قواعد فائقة
القواعد كحافز
انظر أيضا
- Acids
- Acid-base reactions
- Base-richness (used in ecology, referring to environments)
- Conjugate base
- Titration
مراجع للإستزادة
- صلاح يحياوي، الكيمياء العامة (منشورات جامعة دمشق، 1968).
- KENNETH L. HENOLD & FRANK WALMSLY, Chemical Principles, Properties, and Reaction (Addison-Wesley 1984).
المصادر
- ^ صلاح يحياوي. "الأسس". الموسوعة العربية. Retrieved 2012-09-01.