أخبار:أمريكا (FDA) توافق على طرح عقار "لكمبي" لعلاج الألزايمر
- إدارة الغذاء والدواء الأمريكية تمنح الموافقة القياسية لعقار الزايمر من إيساي وبيوجين.
في 7 يوليو 2023، حققت لكمبي، التعاون بين إيساي وبيوجين، موافقة قياسية مرموقة من إدارة الغذاء والدواء الأمريكية، وهو أول علاج لمرض الزهايمر يتحقق هذا الهدف، مما يفتح الطريق أمام توسيع تغطية التأمين للدواء.[2]
يُعتبر قرار إدارة الغذاء والدواء هذا إنجازاً جديداً لمرض قاتل يعاني منه الصناعيون منذ عقود. أظهرت بيانات التجارب أن العلاج يبطئ تقدم مرض تلف الدماغ بنسبة 27٪ للمرضى في مراحل الزهايمر المبكرة.
كما وضعت إدارة الغذاء والدواء الأمريكية تحذير هام بأقوى تحذيرات السلامة على عبوة ليكمبي، لإشارة إلى خطر تورم الدماغ الخطير المحتمل لعقاقير الزهايمر في نفس الفئة. ليكمبي هو أحد أجسام المضادات المصممة لإزالة ترسبات البروتين اللزجة المعروفة باسم الأميلويد بيتا من أدمغة مرضى الزهايمر.
"نعتقد اليوم أنه انتصار لمجتمع مرض الزهايمر، بعد سنوات عديدة من العمل الشاق من قبل العديد من العلماء والأطباء ومشاركي التجارب السريرية وشركاء الرعاية"، صرح إيفان تشونغ، الرئيس التنفيذي لإيساي في الولايات المتحدة، في مقابلة.
حصل ليكمبي على موافقة "مسرعة" من إدارة الغذاء والدواء الأمريكية في يناير بناءً على قدرته على إزالة بروتين الأميلويد، ولكن خطة الرعاية الصحية للمسنين البالغين من 65 عاماً وأكثر في الحكومة الأمريكية (ميديكير) قامت بتقييد تغطية الدواء للمرضى فقط في التجربة السريرية.
تعني الموافقة القياسية أنه سيتم الآن تغطية ليكمبي، على الرغم من أن مراكز ميديكير للخدمات (CMS) تربط التعويض بمشاركة المرضى في قاعدة بيانات وكالة الصحة، المعروفة بالسجل. نظراً لأن الزهايمر هو مرض يتعلق بالشيخوخة، فإن معظم المرضى في الولايات المتحدة مؤمنون عن طريق ميديكير.
وقالت مديرة CMS، شيكيتا بروكس-لاسوري، في بيان: "بقرار إدارة الغذاء والدواء، ستغطي CMS هذا الدواء على نطاق واسع مع استمرار تجميع البيانات التي ستساعدنا في فهم كيفية عمل الدواء". وسعر ليكمبي، الذي يُعطى بالوريد، قائم في الولايات المتحدة قدره 26,500 دولار في السنة.
قال الدكتور بابك توسي، الباحث الرئيسي لتجارب ليكمبي في مستشفى كليفلاند كلينيك: "أتوقع أن يكون هناك الكثير من الاهتمام بالعلاج، ولكنني أقدر أن 1 من بين كل 10 مرضى فقط سيكون مؤهلاً للحصول على الدواء".
وأضاف توسي أن ليكمبي "ليس علاجاً نهائياً"، ولن يعيد الزمن للوراء في المرض، بل سيبطئ فقط التقدم. وقال: "هذا مجرد قطعة من اللغز".
التسمية الجديدة لـ ليكمبي تشرح ضرورة مراقبة المرضى لاحتمال حدوث تورم الدماغ والنزيف الخطير المرتبط بالأجسام المضادة للأميلويد. تشير التسمية إلى أن هناك خطراً أعلى في المرضى الذين يحملون نسختين من الجين APOE4 المرتبط بمرض الزايمر، وعلى الرغم من أن الفحص الجيني موصى به بشدة، إلا أنه ليس مطلوباً.
تتضمن التسمية الجديدة للدواء بيانات تُظهر أن استخدام بعض مضادات التخثر مع ليكمبي قد يرتبط بخطر نزيف الدماغ.
قال الدكتور إريك موسيك، أخصائي أمراض الأعصاب في جامعة واشنطن في مستشفى بارنز-جيويش: "يبدو أن التحذير المربع مناسباً، حيث يجب النظر في المخاطر بعناية ومناقشتها مع المرضى".
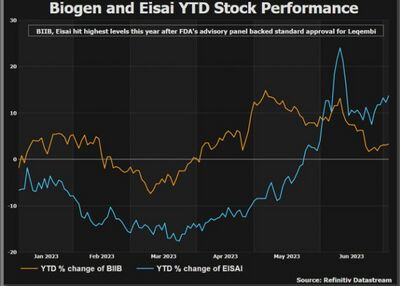
تراجعت أسهم إيساي بنسبة حوالي 5% في تداولات طوكيو، على الرغم من أنها ارتفعت بنحو 50% على مدى العام الماضي.
أشار محللون في جيفيريس إلى أن قرار إدارة الغذاء والدواء الأمريكية غير المتوقع بوضع التحذير على العبوة قد يسهم في تباطؤ نمو المبيعات للدواء، مشيرين إلى أن توصية الفحص الجيني ستزيد من تكاليف المرضى المحتملين.
ومع ذلك، صرح الرئيس التنفيذي لشركة إيساي هاروو نايتو للصحفيين في طوكيو بأنه يعتقد أن التأمين الصحي الأمريكي سيغطي على الأرجح العملية العلاجية بأكملها، بما في ذلك الفحص الجيني، في المستقبل القريب. وقال إن الدواء على الطريق الصحيح للحصول على الموافقة في اليابان بحلول نهاية سبتمبر.
سينطبق التحذير الأمني أيضاً على دونانيماب، الدواء التجريبي لشركة إلي ليلي وكو الذي أظهر في تجربة في المرحلة المتأخرة أنه يبطئ التدهور الإدراكي بنسبة 35٪، وفقاً لبيان صحفي صدر في مايو. من المتوقع الحصول على نتائج كاملة من تلك الدراسة في وقت لاحق هذا الشهر.
قال تشونغ إن إيساي يقوم بتوسيع جهوده للتحضير لاستخدام ليكمبي في المراكز الصحية، لكنه رفض التعليق على عدد المرضى الذين تم علاجهم بالدواء حتى الآن. كما قالت جوان بيك، رئيسة والرئيس التنفيذي لجمعية الزهايمر: "يستحق الأشخاص الذين يعيشون مع هذا المرض القاتل الفرصة لمناقشة واختيار العلاج المعتمد من إدارة الغذاء والدواء بالتشاور مع أطبائهم وعائلاتهم".
وقد أوصت لجنة من المستشارين الخارجيين لإدارة الغذاء والدواء مؤخراً بالموافقة التقليدية على الدواء بعد أن خلص تقرير من موظفي الوكالة إلى أنه يقدم فائدة معنوية للمرضى وأن المخاوف الأمنية يمكن أن يتم التعامل معها بشكل مناسب.
وفقًا لجمعية الزهايمر، يعاني أكثر من 6 ملايين أمريكي من مرض الزايمر. تقدر إيساي أن تستخدم أدوية خفض الأميلويد في حوالي 100,000 مريض أمريكي خلال السنوات الثلاث الأولى لتوفر ليكمبي في السوق.
أدوهيلم هو أول عقار لعلاج مرض الزهايمر الذي تمت الموافقة عليه من قبل إدارة الغذاء والدواء الأمريكية، وتم تطويره أيضاً بواسطة شركة إيساي وبيوجين، ولكن قيود تغطية ميديكير قد قيدت استخدامه بشدة. بالإضافة إلى الولايات المتحدة واليابان، تسعى إيساي أيضاً للحصول على موافقة ليكمبي في الاتحاد الأوروبي والصين وكندا وبريطانيا العظمى وكوريا الجنوبية. في الصين، مثل اليابان، تم تخصيص تقديم الطلب للمراجعة الأولوية.
مرئيات
| تعرف على عقار لكمبي الجديد لعلاج مرض ألزايمر، 6 يوليو 2023. |
انظر أيضاً
المصادر
- ^ Eisai/Handout via REUTERS/File Photo
- ^ By Deena Beasley and Julie Steenhuysen (2023-07-09). "US FDA grants standard approval of Eisai/Biogen Alzheimer's drug". رويترز.