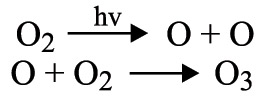اوزون
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Trioxygen
| |||
| Identifiers | |||
| رقم CAS | |||
| ECHA InfoCard | 100.030.051 | ||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | O3 | ||
| كتلة مولية | 47.998 g·mol−1 | ||
| المظهر | غاز ملون مائل إلى الزرقة | ||
| الكثافة | 2.144 g·L−1 (0 °C), غاز | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 0.105 g·100mL−1 (0 °C) | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
+142.3 kJ·mol−1 | ||
| Standard molar entropy S |
237.7 J·K−1.mol−1 | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
not listed | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
الاوزون بالإنجليزية Ozone، هو غاز شفاف يتكون من ثلاث ذرات من الأكسجين صيغته الكيميائية O3،ونسبته في الغلاف الجوى ضئيلة قد لا تتجاوزفى بعض الأحيان واحد في المليون وهو غاز سام، لكنه يتكون بعيدا عن سطح الأرض حتى لايستنشقه الانسان أوالحيوان.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التواجد
 مقالة مفصلة: وقت صلاة الصبح يمتلأ الجو بأعلى نسبة من غاز الأوزون
مقالة مفصلة: وقت صلاة الصبح يمتلأ الجو بأعلى نسبة من غاز الأوزون
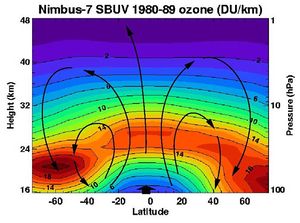
يوجد الأوزون طبيعياً في طبقة الستراتوسفير ويرجع وجودة إلى سلسلة من التفاعلات بين الأكسجين الجزئى و الذرى ولايبقى الأوزون المتكون لفترة وجيزه ثم يتفكك بفعل ضوء الشمس إلى أكسجين جزئى ثم يتكون وفى النهاية نحصل على شكل يبقى دائماً على طبقة من الأوزون في منطقة الستراتوسفير متوازنة وهذا التوازون يعتمد على سرعة تكوينه وسرعة تفكك الأوزون وعندما يحدث تداخل لبعض المواد مع هذة السرعة نحصل على خلل إما في زيادة تركيز الأوزون أو بالعكس إزالة الاوزون من الستراتوسفير .
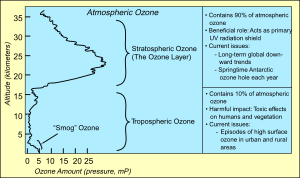
الأوزون شكل من الأكسجين الموجود بكميات قليلة في طبقات الجو المحيطة بالأرض. ويُعدّ وجود الأوزون في الطبقة العليا من الجو عاملاً رئيسيًا للحفاظ على الحياة على الأرض. أما وجود الأوزون في الطبقة السفلى من الجو فيؤدي إلى تلوث الهواء. ويستخدم الأوزون في بعض الصناعات، كتنقية المياه والتبييض.
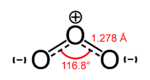
تحتوي جزيئات الأكسجين العادية على ذرتين من الأكسجين، أما جزيئات الأوزون فإنها تحتوي على ثلاث ذرات من الأكسجين.
يتكون الأوزون طبيعيًا عن طريق التفاعلات الضوئية الكيميائية والتفريغ الكهربائي. يتكون الأوزون عن طريق التفاعل الضوئي الكيميائي عندما يرتطم إشعاع شمس ذو قوة عالية بالأكسجين العادي في الطبقة العليا من جو الأرض، ويحول بعضًا منه إلى أوزون.
وكذلك تقوم تفاعلات التفريغ الكهربائي بما فيها البرق والشرارات الكهربائية الصادرة من المحركات بتحويل بعض الأكسجين إلى أوزون. وبالإمكان إنتاج الأوزون صناعيًا عن طريق التفريغات الكهربائية في آلة تسمى مولد الأوزون.
يوجد معظم الأوزون في الطبقات العليا من الجو، وتوجد أعلى نسبة تركيز على ارتفاع يتراوح مابين 15 و30 كم عن سطح الأرض ويعتمد ذلك على خط العرض. ويمثل هذا التركيز عشرة أجزاء في المليون بالحجم - أي عشرة أجزاء أوزون لكل مليون جزء من الهواء. تعمل طبقة الأوزون في الطبقة العليا من الجو كحجاب واقٍ للأرض من 95% إلى 99% من أشعة الشمس فوق البنفسجية التي تعتبر سببًا يؤدي لسرطان الجلد، إذا ماتعرض لها الإنسان بكثرة.
أعرب بعض العلماء في أواسط السبعينيات من القرن العشرين عن قلقهم من أن المركبات الكيميائية المسماة الكلوروفلوروكربون (ك ف ك) هي المسؤولة عن خرق طبقة الأوزون الواقية للأرض.
وكانت مركبات (ك ف ك) تستعمل بكثرة في ذلك الوقت كمادة دافعة في علب رش الهباء الجوي. عندما ينبعث هذا المركب من العلبة يصعد ببطء في الهواء وعندما يصل إلى طبقات الجو العليا تقوم أشعة الشمس فوق البنفسجية بتفتيت هذا المركب إلى أجزاء يتفاعل بعضها مع الأوزون الموجود في تلك الطبقة، وبذلك يقلل من كمية الأوزون.
ولكن العلماء سرعان ما اكتشفوا أن انخفاض نسبة الأوزون الموجود في طبقات الجو العليا يعتمد على خط العرض، إذ يكون الانخفاض أشد في المناطق الواقعة على القطب الجنوبي (أنتارتيكا)، حيث يكوّن ¸ثقبًا·. وأصدر علماء من المركز البريطاني لدراسة القطب الجنوبي في عام 1985م، أول تقرير عن وجود ثقب في طبقة الأوزون فوق خليج هالي. وفي عام 1986م قامت كل من الهيئة الوطنية لإدارة أبحاث الملاحة الجوية والفضاء الأمريكية (NASA)، والمنظمة العالمية للأرصاد الجوية، وبرنامج الأمم المتحدة للبيئة (UNEP)، بتأسيس هيئة معدل الأوزون لدراسة نفاد كمية الأوزون في الجو.
وقد جمع بعض أعضاء هذه الهيئة معلومات من خلال الأقمار الصناعية ومن معدات على الأرض، ونشروا استنتاجاتهم في مارس من عام 1988م. وقد أكدت انخفاض نسبة الأوزون فوق منطقة القطب الجنوبي. واستنتج أعضاء هذه الهيئة أيضًا أنّ نسبة الأوزون في مناطق القطب الشمالي منخفضة، ولكن ليست إلى تلك الدرجة التي تؤدي إلى تكوين ثقب كما هو الحال في منطقة القطب الجنوبي.
وفي أوروبا وضعت كل من ألمانيا وفرنسا خططًا للبحث تسمى مشروع كيمياء الأوزون في الغلاف الزمهريري القطبي، وكان غرض هذا المشروع هو دراسة نضوب كمية الأوزون في المناطق الشمالية.
وفي عام 1987م وقعت إحدى وثلاثون دولة إتفاقية مونتريال التي تقضي بالحد من إنتاج مركبات (ك ف ك). وقد تم تنفيذ هذه الاتفاقية في الأول من يناير عام 1989م. وفي إعادة لتقييم اتفاقية مونتريال في عام 1990م، اتضح أن إنتاج مركبات (ك ف ك) انخفض في جميع أنحاء العالم، ولكنه اتضح أيضًا أن المركبات التي أنتجت كبديل لمركبات (ك ف ك) ضارة أيضًا بطبقة الأوزون.
ودعت اتفاقية مونتريال المجددة في عام 1990م بالإيقاف الكلي لإنتاج مركبات (ك ف ك) في نهاية القرن الحالي.
ولكن الجو سيبقى ملوثًا بمركبات (ك ف ك) لعدة سنوات حتى بعد إيقاف إنتاج هذه المركبات؛ وذلك لأن كمية كبيرة منها تتسرَّب إلى الجو من المكيفات الهوائية والثلاجات. كما أن العلماء يتوقعون أن يزداد تآكل طبقة الأوزون أكثر في السنوات القادمة، لأن مركبات (ك ف ك) تعمر طويلاً. وهذا سيؤدِّي إلى زيادة كمية الأشعة فوق البنفسجية التي تصل إلى الأرض، وبخاصة في مناطق جنوب أستراليا ونيوزيلندا.
يعتبر معظم الأوزون الموجود في طبقات الجو السفلى مسببًا لتلوث الهواء، إذ إنه يتكون نتيجة للتفاعلات الكيميائية بين أشعة الشمس والمواد المسببة للتلوث الموجودة في الجو. والأوزون الناتج عن هذا التفاعل عبارة عن مركب دخاني ضوئي كيميائي. انظر: الضباب الدخاني. ويستطيع هذا النوع من الأوزون أن يتلف مباشرة مواد المطاط والبلاستيك والنبات وأنسجة الحيوانات. وقد يتعرَّض هذا الأوزون إلى المزيد من التفاعلات الكيميائية التي تولد مواد كيميائية أخرى ضارة. والتعرّض إلى نسب معينة من هذا الأوزون يسبب صداعًا وحرقة في العينين، وتهيجًا في مجرى التنفس عند العديد من الأفراد.
والصيغة الكيميائية للأوزون هي O3 ويبلغ وزنه الجزيئي 47,998. أما الأوزون الخام فهو غاز أزرق باهت.
عُرف الأوزون لأول مرة عن طريق رائحته الحادة المزعجة التي غالبًا ما تلاحظ قرب المفاتيح الكهربائية والآلات.
وقد اكتشف عالم الكيمياء الألماني كريستيان فريدريك شونباين الأوزون في عام 1840م.
استخداماته
يُكشف عن الأوزون في مزيج غازي بالتفاعل الآتي:
يتكوَّن الأوزون في العمليات التي يرافقها انطلاق الأوكسجين الذري، وفي الصناعة يُحصَل عليه من الهواء ومن الأوكسجين بالانفراغ الكهربائي في درجات منخفضة من الحرارة.[1]
تتيح خاصيات الأوزون الشديدة الأكسدة استعماله في تحضير كثير من المركبات العضوية وفي تبييض الورق والزبدة.
يقتل الأوزون الأحياء الدقيقة، لذلك يستعمل في تنقية مياه الشرب والهواء. وهو سام جداً (تزيد سميته على سمية CO)، ويساوي التركيز الحدّي المسموح به للأوزون في الهواء 10-5 %.
الخصائص الفيزيائية
التركيب
هو غاز أزرق اللون شديد الانفجار ذو رائحة واخزة مميزة، كثافته بالنسبة للهواء 62.1، ودرجة غليانه -122ْس، يكوِّن في الدرجات التي هي أخفض من درجة غليانه سائلاً أزرق داكناً تبلغ كثافته 71.1 غ/سم3 . وفي الدرجة -183ْس يكون الأوزون ذا مغنطيسية عكسية في الحالة الغازية وذا مغنطيسية طردية ضعيفة في الحالة السائلة. ينحل الأوزون في الماء بنسبة 0.394غ/سم3 في الدرجة 0ْس، أي أكثر بخمس عشرة مرة من انحلال الأكسجين.
الكيمياء
يتكون الأوزون بالتفاعل العكوس:
ويتفكك جزيء الأوزون تلقائياً إلى الأكسجين ناشراً الحرارة، ويتفكك في التركيزات العالية منفجراً. أما في التركيزات البسيطة العادية، وفي حال عدم وجود شوائب غريبة، فيتفكك ببطء. ويتسارع تفكك الأوزون بشدة بتسخينه أو بملامسته لشيء من المركبات العضوية أو لبعض المعادن أو أكاسيدها. وتؤثر المقادير البسيطة من حمض الآزوت HNO3 في استقرار الأوزون.
وهو لا يتفكك إذا كان محفوظاً في الدرجة -78ْس في أوعية زجاجية أو لدائنية أو أوعية مصنوعة من معادن صرفة.
والأوزون هو أحد المؤكسِدات القوية (أقوى من الأكسجين العادي)، يؤكسد جميع المعادن (ما عدا الذهب والبلاتين وما يماثلهما) ومعظم العناصر الأخرى. ويعطي أوزونيدات مع بعض المركبات العضوية واللاعضوية.
تأثير الأوزون على الحياه
وجود الأوزون في الغلاف الجوى يعمل كرداء كونى يقوم بعملية تنظيف أوتعقيم البيئة بالإضافة إلى حماية الإرض من الأشعة فوق البنفسجية التى تصلنا من الشمس والتى يتولى الأوزون إمتصاص أكثرمن 99% منها وبذلك يحمى أشكال الحياة المعروفه على سطح الأرض .
يشعر بعض الناس بتأثير الأوزون عندما يوجد في الهواء بتركيز 0.001 جزء من المليون. وعندما يصبح بتركيز يراوح بين 0.5 و0.1 جزء من المليون يضطرب لديهم تنسيق تقلصات عضلات العين، وتنخفض حدة الرؤية. وتظهر وذمة رئوية عند الذين يتم تعريضهم تجريبياً لتركيز أقل من جزء واحد من المليون.
وتذكر وكالة حماية البيئة الأمريكية أن تركيز 0.15 جزءاً من المليون يسبب ضيقاً في الصدر وتخريشاً للجهاز التنفسي وانخفاضاً في وظيفة التنفس. ويسبب 0.17 جزءاً من المليون تفاقم حالات الربو والتهاب القصبات الحاد، وفي تركيز 0.18 جزءاً من المليون تنخفض مقاومة الأفراد للإصابة الجرثومية. أما تركيز 0.12 جزءاً من المليون فيعد الحد الأعلى للسلامة المسموح بها.
أما في الصناعة فيُسمح بالتعرض مدة 8 ساعات من العمل لتركيز مقداره 0.5 جزءاً من المليون، علماً أن تركيزات الأوزون في بعض الصناعات قد تصل أحياناً إلى جزء واحد من المليون، ويمكن أن يحصل هذا التركيز في حالات تلوث الهواء تلوثاً شديداً في بعض الأماكن، مثل مدينة لوس أنجلس في الولايات المتحدة الأمريكية, ويزداد تركيز الأوزون في الارتفاعات العالية، كما يحصل في الطائرات التي تحلق على ارتفاع يزيد على 9 كيلو مترات. وعلى ارتفاع 25- 30كم يصل التركيز إلى 12 جزءاً من المليون، وهو الحد الذي يموت عنده الإنسان.
ولما كان الأوزون مادة مؤكسدة شديدة الفعالية، كان تركيزه يسبب تلف المحاصيل الزراعية والنباتات، ويسبب التخرب المبكر للمطاط والأنسجة، فتظهر على الأوراق قشور رقيقة حمراء، ويسبب ابيضاض النباتات ويثبط نموها ويؤدي إلى شيخوختها المبكرة.
ولما كان الأوزون يسبب تناثر المعلقات الخفيفة فقد أسهم، مع المواد المؤكسدة الأخرى، في خفض الرؤية.
التحضير
يحضر الأوزون عادة في الظروف الكيميائية المناسبة 2التي لا يتفاعل فيها الأكسجين.[2] الأوزون المستخدم صناعيا يقاس بالجرام/نانومتر المكعب. ويحضر بإدماج من 1-5 وزن مئوي في الهواء إلى من 6-14 من الأكسجين.
العلاج بالأوزون
انظر
 مقالة مفصلة: العلاج بالأوزون
مقالة مفصلة: العلاج بالأوزون
القياسات التي أجريت على الأوزون
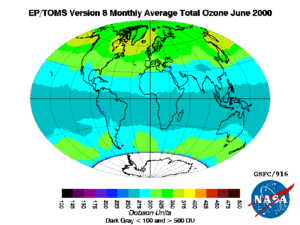
أجري منذ أواخر السبعينات من القرن العشرين نوعان من القياسات الخاصة بطبقة الأوزون. ففي القياس الأول تؤكد قياسات الأقمار الصناعية، على ما يبدو، النظرية القائلة إن طبقة الأوزون تتعرض لاستنزاف تدريجي. وتشير هذه القياسات إلى أن تركيز الأوزون قد انخفض عدة أجزاء في المئة منذ عام 1979، ووصلت نسبة الانخفاض إلى 18 في المئة في المناطق المتوسطة من نصف الكرة الجنوبي.
وفي القياس الثاني الذي تم في شهري أيلول وتشرين الأول من سنوات هذه المدة كلها تقريباً، بَيَّنت القياسات فوق القطب الجنوبي أن استنزاف الأوزون كان أكثر إثارة، وهو ما أصبح يعرف باسم ثقب الأوزون. ومع أن الثقب يمتلئ في الصيف فهو يعود كل سنة أكثر عمقاً من السابق. وقد كان متوسط تركيز الأوزون فوق القطب الجنوبي في تشرين الأول من عام 1985 أقل بنحو 40 في المئة مما كان عليه في تشرين الأول من عام 1979. وليس هناك إجماع على سبب هذه الظاهرة القطبية الجنوبية، كما أنه لا يوجد اتفاق على العلاقة بين ثقب القطب الجنوبي والاستنزاف العالمي للأوزون.
نضوب الأوزون والثقب الأوزوني وأسباب هذا النضوب
إن العوامل المؤثرة في مصير الغازات وتأثيراتها المتبادلة بينها وبين الكرة الحية biosphere معقدة وغير مفهومة جيداً. فالتفاعلات الكيمياوية التي يقوم بها مثلاً غاز ما في الكرة الحية تتوقف على مزيج الغازات والجسيمات القريبة منه، وعلى درجة الحرارة وشدة الشمس واختلاف أنواع الغيوم، وأنماط جريان الهواء التي تحرك الكيمياويات أفقياً وعمودياً. وتؤثر التفاعلات كذلك في طول المدة الزمنية التي يبقى فيها الغاز في الجو، وفيما إذا كان للغاز نفسه أو النواتج النهائية من تفاعله تأثير شامل (عالمي)، أو أن تأثيراتها البيئية لا تتجاوز حدود المنطقة التي توجد فيها.
ويعد بعض الباحثين الثقب الأوزوني إنذاراً بكارثة عالمية وشيكة الوقوع. ويعزى نضوب الأوزون الستراتوسفيري أساساً إلى مركبات الكلوروفلوروكربون Chlorofluorocarbon الصناعية، وهي مركبات تحوي الكلور والفلور والكربون، وتحوي الهيدروجين أحياناً، ولاسيما المركب (CF2Cl2) CF - 12(CFCl3)CFC -11. وقد ازدادت انبعاثات هذه الكيمياويات المتولدة عن النشاط البشري وتركيزاتها بسرعة منذ عدة عقود، أي في الوقت الذي راج فيه استعمالها مبرّداتٍ أو حُلاَلاَتٍ هوائية (دواسر الحُلاَلاَت أو الرذيذات) aerosol propellants ومذيباتٍ وعواملَ نفخٍ لتكوين الرغوة. ومما عزَّز من رواج هذه الكيمياويات تمتعها بخاصة بدت جيدة في باديء الأمر وهي خمولها في الطبقة المنخفضة من الجو، فهي لذلك ليس لها فعل سُمِّيٌ مباشر في الكائنات الحية. ولا تتجاوز نسبة هذه المركبات مجتمعة في الجو جزءاً واحداً في البليون تقريباً. وتتحلل هذه المركبات بوساطة الأشعة فوق البنفسجية في الستراتوسفير فيتحرر الكلور الذي يحفز عملية تحليل الأوزون إلى أكسجين جزيئي O2:
ثم يتفاعل أحادي أكسيد الكلور مع ذرات من الأكسجين (تتكوّن نتيجة التفكك الضوئي لجزيء آخر من الأوزون)، وينطلق الكلور الذي يعيد الدورة من جديد.
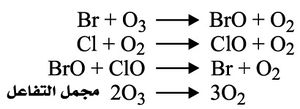
أما البروم Br2 فيتكوَّن في الستراتوسفير من مصدرين رئيسيين ينجمان عن فعاليات الإنسان وهما بروميد الميثيل والهالونات. والهالون هو الاسم التجاري لمتبلمر تترافلورو الأثيلين. ولبروميد الميثيل مصدران: مصدر طبيعي ومصدر بشري، أما الهالونات فلها مصدر بشري فقط. ويبلغ إجمالي الوفرة الجوية للبروم نحو 15-20 جزءاً لكل ترليون جزء حجماً. والهالونات، بصفتها مواد كيمياوية «مهلجنة» (تحوي في تركيبها هالوجيناً. والهالوجينات هي الفلور والكلور والبروم واليود) ذات عمر طويل نسبياً (مستقرة)، فإنها تتفكك بتأثير الضوء في طبقة الستراتوسفير من الغلاف الجوي، فينبعث منها بروم ذو قدرة تحفيزية عالية في تدمير طبقة الأوزون. فالبروم عامل مدمر للأوزون، وقدرته على استنزافه أكبر من قدرة الكلور بنحو 10- 100 مرة.
والتفاعلات المتعلقة بالبروم هي المسؤولة عن التدمير الكيمياوي لطبقة الأوزون بنسبة 25% فوق القطب الجنوبي للأرض، وبنسبة 50% فوق القطب الشمالي.
وسلسلة التفاعلات التحفيزية للبروم هي كالآتي:
وتُرجِع نظرية أخرى السبب في ثقب الأوزون بالقطب الجنوبي واستنزاف الأوزون العالمي إلى أكاسيد الآزوت (النتروجين). فدورة الكلور التحفيزية لا تتم عادة من دون قيود ومداخلات. فهناك نوعان رئيسيان من التفاعلات يُعتَقَد أنهما يتدخلان في عملية تحطيم الأوزون، على الأقل عند الارتفاعات المتوسطة. ففي إحدى الحالات يتفاعل أكسيد الكلور ClO مع أكسيد الآزوت NO، وتنتقل ذرة الأكسجين في أكسيد الكلور إلى أكسيد الآزوت NO منتجة ذرة كلور حرة وثنائي أكسيد الآزوت NO2. وعندما يمتص ثنائي أكسيد الآزوت الضوء المرئي، فإنه يحرر ذرة أكسجين تكون جاهزة لكي تعيد توليد الأوزون:
وتكون النتيجة عدم حدوث تغير في مستوى الأوزون.
وفي حالة ثانية أكثر أهمية يؤدي اتحاد ذرة الكلور أو جذر أحادي أكسيد الكلور بجزيء آخر إلى ناتج مستقر يقوم مؤقتاً بدور «مستودع» للكلور. وعند ارتباط الكلور على هذا النحو (كما هي الحال في معظم الوقت بالجو العادي)، فإنه لا يتيسر له مهاجمة الأوزون. وهناك مستودعان مهمان هما نترات الكلور ClONO2 المكونة من اتحاد أحادي أكسيد الكلور بثنائي أكسيد الآزوت NO2، وحمض كلور الماء HCl الذي يتكون من تفاعل ذرة الكلور مع الميثان CH4. وفي نهاية المطاف فإن هذين المستودعين يمتصان فوتوناً أو يتفاعلان مع مواد كيمياوية أخرى، ويتفككان فيتحرر الكلور ليستأنف تحفيزه في تحطيم الأوزون.
تعزِّز درجات الحرارة المنخفضة، خاصة في القارة القطبية الجنوبية، وبدرجة أقل في القطب الشمالي، دورات الكلور التحفيزية، وذلك بإزالة أكاسيد الآزوت التي تعيق هذه الدورات (مع أن غازات NOx يمكنها أن تخرب الأوزون، إذ يعزز وجودها في الستراتوسفير غالباً عملية تخريب الأوزون المحفِّزَة بالكلور. والتناقض هنا ظاهري). إذ تتجمد غازات NOx مع الماء مشكلة جسيمات تعرف باسم الغيوم الستراتوسفيرية القطبية. وتسهّل الجسيمات الغيمية عملياً حدوث التفاعلات السابقة الذكر التي تؤدي إلى انطلاق الكلور من مركبات لا تتفاعل هي نفسها مع الأوزون مثل HCl و ClNO3.
إن تركيزات أكاسيد الآزوت في الجزء السفلي من الستراتوسفير ترتفع وتنخفض مع دورة الإحدى عشرة سنة للنشاط الشمسي. وقُبيل الذروة الشمسية (تصبح حرارة الشمس في ذروتها عندما يكون الكلف الشمسي Sunspot في مستواه الأدنى، وهذا يحدث دورياً كل 11 سنة) تنتقل كميات كبيرة من مركبات الآزوت التي تتولد في الجزء العلوي من الستراتوسفير إلى الجزء السفلي منه بفعل دوامة القطب الجنوبي، وهي نوع من الريح الدائرية التي تستقر فوق القطب الجنوبي في الشتاء القطبي الطويل. وتتسبب شمس الربيع في التحليل الضوئي لبعض المركبات لتنتج أول أكسيد الآزوت NO وثنائي أكسيد الآزوت NO2 المبددين للأوزون، وتنتشر أكاسيد الآزوت في الستراتوسفير، مبددة الأوزون فوق أجزاء أخرى من الكرة الأرضية. ومع أن هذه النظرية لا تبرئ مركبات كلوروفلورو الكربون بحال من الأحوال، فإنها ترى أن معظم استنزاف الأوزون الذي رُوقب حتى اليوم، يحدث دورياً لأسباب طبيعية.
وما يزال باحثون آخرون يعتقدون أن الثقب القطبي الجنوبي من جهة، والنقص في ثخانة طبقة الأوزون العالمية من جهة أخرى، هما ظاهرتان منفصلتان تماماً، وأن الثقب لم يتكون بفعل المواد الكيمياوية بل بفعل الرياح. إذ لوحظ أن الكمية الكلّية للأوزون الجوي في اتجاه القطب وفي مدى 44 درجة جنوب خط الاستواء تكاد تبقى ثابتة عندما يتكون الثقب القطبي كل ربيع. والتفسير المحتمل لهذا هو أن تيارات الهواء الصاعدة تدفع الهواء الغني بالأوزون الموجود في الجزء السفلي من الستراتوسفير بعيداً عن القطب، ويحل محله هواء من خطوط العرض الدنيا يفتقر إلى الأوزون. ويجتمع الهواء الغني بالأوزون على هيئة حلقة عند خطوط العرض دون القطبية حيث يقاس حقاً نسبة عالية من تركيز الأوزون. وهكذا فإن الثقب يتعمق من سنة إلى أخرى لأن الاندفاع نحو الأعلى يزداد لأسباب غير واضحة حتى اليوم.
وقد حصل باحثون آخرون ضمن بعثة توجهت حديثاً إلى القطب الجنوبي على دليل أولي يناقض نظريتي الدورة الشمسية ونظرية الريح كلتيهما. وما يزال الجدل قائماً بين أنصار كل من هذه النظريات، وقد يحتاج الأمر إلى عدة سنوات قبل الوصول إلى تفسير واحد لظاهرة الثقب الأوزوني ولظاهرة استنزاف الأوزون.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
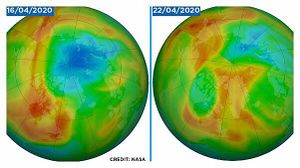
انغلاق أكبر ثقب بالأوزون على الإطلاق فوق القطب الشمالي
أعلنت خدمة كوبرنيكوس لرصد الغلاف الجوى أن أكبر ثقب لوحظ فى طبقة الأوزون فوق القطب الشمالى قد أغلق، إذ اكتشف العلماء علامات تشكله في أواخر مارس، ويعتقد أنه كان نتيجة درجات الحرارة المنخفضة في القطب الشمالي.
وتحمى طبقة الأوزون الأرض من معظم أشعة الشمس فوق البنفسجية، التى تعد سببا رئيسيا لسرطان الجلد، وكان من الممكن أن يشكل هذا الثقب تهديدًا مباشرًا للبشر لو انتقل جنوبًا إلى مناطق مأهولة بالسكان، لكن يوم الخميس (23 أبريل)، أعلنت كوبرنيكوس - برنامج الاتحاد الأوروبى لمراقبة الأرض - أن الثقب قد تم إغلاقه الآن.
ولا علاقة للإغلاق بالحد من التلوث الناجم عن عمليات الإغلاق بجزء كبير من العالم بسبب COVID-19.، بدلاً من ذلك، يعود الأمر إلى الدوامة القطبية، والتيارات العالية الارتفاع التى تجلب عادةً الهواء البارد إلى المناطق القطبية، مما أعطى منطقة القطب الشمالى موجة حرارية نسبية، مع درجات حرارة تصل إلى 20 درجة مئوية أعلى من المعتاد فى هذا الوقت من العام.
وقال عالم كوبرنيكوس Antje Inness "من غير المعتاد أن يحدث مثل هذا الاستنفاد القوى للأوزون فى نصف الكرة الشمالى، لكن الدوامة القطبية لهذا العام كانت قوية ومستمرة بشكل استثنائى، وكانت درجات الحرارة منخفضة بما يكفى للسماح بتكوين السحب الستراتوسفيرية لعدة أشهر.
ويوجد ثقب الأوزون الأكثر شهرة فوق القطب الجنوبى ويحدث خلال الربيع الأسترالى (من يوليو إلى سبتمبر) عندما يكون الستراتوسفير أكثر برودة بشكل طبيعي، بشكل عام ، لا تحدث ظروف تدمير الأوزون على هذا النطاق فى القطب الشمالى، لكن هذا العام، تسببت الدوامة القطبية القوية والمستقرة فى تركيز المزيد من المواد الكيميائية المستنفدة للأوزون أكثر من المعتاد، والتى أضافت إلى البرد القارس خلقت الظروف لهذا الثقب غير المسبوق.
وكانت المرة الأولى التى لوحظ فيها ثقب للأوزون فى القطب الشمالى فى عام 2011، لكنه كان أصغر وكان خلال شهر يناير.[3]
انظر أيضا
وصلات خارجية
- International Ozone Association
- European Environment Agency's near real-time ozone map (ozoneweb)
- NASA's Ozone Resource Page
- Paul Crutzen Interview Freeview video of Paul Crutzen Nobel Laureate for his work on decomposition of ozone talking to Harry Kroto Nobel Laureate by the Vega Science Trust.
- NASA's Earth Observatory article on Ozone
- International Day for the Preservation of the Ozone Layer
- International Chemical Safety Card 0068
- NIOSH Pocket Guide to Chemical Hazards
- National Institute of Environmental Health Sciences, Ozone Information
- Ground-level Ozone Air Pollution
- NASA Study Links "Smog" to Arctic Warming — NASA Goddard Institute for Space Studies (GISS) study shows the warming effect of ozone in the Arctic during winter and spring.
- EPA Assessment of Effectiveness and Health Consequences of Ozone Generators that are Sold as Air Cleaners
- Pesticides Database; Ozone
المصادر
- ^ هيام بيرقدار، حسن حلمي خاروف. "الأوزون". الموسوعة العربية. Retrieved 2012-03-01.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةbrown - ^ "انغلاق أكبر ثقب بالأوزون على الإطلاق فوق القطب الشمالي".
- Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Series in Plasma Physics: Non-Equilibrium Air Plasmas at Atmospheric Pressure. Edited by K.H. Becker, U. Kogelschatz, K.H. Schoenbach, R.J. Barker; Bristol and Philadelphia: Institute of Physics Publishing Ltd; ISBN 0-7503-0962-8; 2005
مراجع للإستزادة
- مجلة العلوم، المجلد4، العدد3، مارس/آذار 1988، الكويت.
- مجلة العلوم، المجلد7، العدد3، مارس/آذار 1990، الكويت.
- حماية الأوزون (مجلة)، الأعداد 4، 7، 8، 11، 1993.
- معهد مراقبة البيئة العالمية Worldwatch