تطوير دواء كوڤيد-19
| جزء من سلسلة عن |
| جائحة ڤيروس كورونا 2019-2020 |
|---|
|
|
|
تطوير دواء كوڤيد-19 COVID-19 drug development، هي عملية البحث لتطوير دواء كوڤيد -19 COVID-19 ، هي عملية البحث لتطوير لقاح وقائي أو دواء علاجي من شأنه أن يخفف من شدة مرض ڤيروس كورونا 2019 (COVID-19). على الصعيد الدولي اعتبارًا من مارس 2020 ، شاركت حوالي 100 شركة أدوية وشركات التكنولوجيا الحيوية ومجموعات البحث الجامعي والمنظمات الصحية في مراحل تطوير اللقاحات أو الأدوية.[1][2][3][4][5] قامت منظمة الصحة العالمية ,[6] والوكالة الأوروبية للأدوية (EMA) ,[7] وإدارة الغذاء والدواء الأمريكية,[8] والحكومة الصينية وشركات تصنيع الأدوية[9][10] بالتنسيق مع الباحثين الأكاديميين وقطاع الصناعة لتسريع تطوير اللقاحات والأدوية المضادة للفيروسات و علاجات الأجسام المضادة وحيدة النسيلة.[11][12][13][14]
بحلول مارس 2020 ، بدأ التحالف من أجل ابتكارات التأهب للأوبئة (CEPI) صندوقًا دوليًا لتطوير لقاح COVID-19 ، بهدف جمع 2 مليار دولار أمريكي لأبحاث وتطوير اللقاحات,[15] والتزم باستثمارات 100 مليون دولار أمريكي في تطوير اللقاحات عبر عدة بلدان.[16] في أوائل شهر مارس ، أعلنت الحكومة الكندية government قالب:CAD في تمويل 96 مشروعًا بحثيًا حول الإجراءات المضادة الطبية ضد COVID-19 بما في ذلك العديد من المرشحين للقاحات في الجامعات الكندية ,[17][18] مع خطط لإنشاء "بنك لقاح" لقاحات جديدة للتنفيذ في حالة فيروس كوروني آخر يحدث تفشي المرض.[18][19]
وبحلول أواخر مارس ، تم تسجيل 536 دراسة سريرية مع منصة تسجيل التجارب السريرية الدولية لمنظمة الصحة العالمية لتطوير علاجات ما بعد العدوى لعدوى COVID-19,[20][21] مع العديد من المركبات المضادة للفيروسات القائمة لعلاج العدوى الأخرى تحت الأبحاث السريرية ليتم إعادة استخدامها.[11][22][23][24][25] في مارس ، شرعت منظمة الصحة العالمية في "تجربة التضامن" في 10 دول ، حيث قامت بتسجيل آلاف الأشخاص المصابين بـ COVID-19 لتقييم آثار العلاج لأربعة مركبات مضادة للفيروسات موجودة بأكثر فعالية واعدة.[6][26] تم إجراء مراجعة ديناميكية ومنهجية في أبريل 2020 لتتبع تقدم التجارب السريرية المسجلة للقاح COVID-19 والأدوية العلاجية.[21]
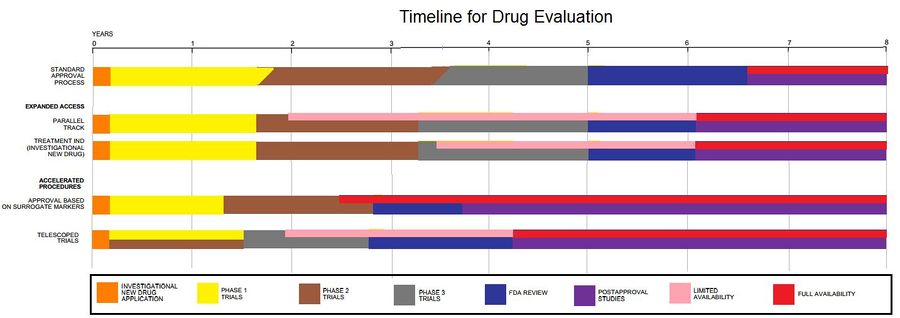
تطوير اللقاحات والأدوية هو عملية متعددة الخطوات ، تتطلب عادةً أكثر من خمس سنوات لضمان سلامة وفعالية المركب الجديد.[5][27] في فبراير 2020 ، قالت منظمة الصحة العالمية إنها لا تتوقع أن يصبح اللقاح ضد السارس - CoV - 2 - الفيروس المسبب لـ COVID-19 - متاحًا في أقل من 18 شهرًا [28] والتقديرات المحافظة على الوقت اللازم لإثبات لقاح آمن وفعال سنة واحدة.[29] وافقت العديد من الوكالات التنظيمية الوطنية ، مثل EMA و FDA ، على إجراءات لتسريع الاختبارات السريرية.[8][30]
بحلول أواخر مارس 2020 ، كانت أربع علاجات محتملة مضادة للفيروسات - فاڤيپيراڤير و رمدسيڤير و لوبيناڤير و هيدروكسيكلوروكين (أو كلوروكين) – في المرحلة النهائية من الاختبار البشري [1][2][24][31] – المرحلة السريرية من III إلى IV - وقد دخلت العديد من اللقاحات المحتملة المرحلة الأولى من تقييم سلامة الإنسان .[1][4][11][19] المرحلة الأولى. في 21 مارس ، أصدرت مراكز السيطرة على الأمراض والوقاية منها (CDC) في الولايات المتحدة استشارة الطبيب بشأن رمدسيڤير للأشخاص الذين تم إدخالهم إلى المستشفى بسبب الالتهاب الرئوي بسبب COVID-19: "في حين أن التجارب السريرية حاسمة لإثبات السلامة والفعالية من هذا الدواء ، قد يطلب الأطباء الذين لا يستطيعون إجراء تجربة سريرية استخدام رمدسيڤير للاستخدام الموسع من خلال الشركة المصنعة للمرضى المصابين بالالتهاب الرئوي السريري. "[32]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
عملية التطوير
Dتطوير الأدوية هو عملية جلب لقاح جديد للأمراض المعدية أو دواء علاجي إلى السوق بمجرد تحديد المركب الرئيسي من خلال عملية اكتشاف الأدوية.[27] يتضمن البحث المختبري حول الكائنات الحية الدقيقة والحيوانات ، وتسجيل الحالة التنظيمية ، مثل عن طريق إدارة الغذاء والدواء والأدوية FDA ، للحصول على دواء جديد تجريبي لبدء التجارب السريرية على البشر ، وقد يتضمن خطوة الحصول على موافقة تنظيمية مع تطبيق دوائي جديد لتسويق الدواء.[33][34] تستغرق العملية بأكملها - من المفهوم إلى الاختبار قبل السريري في المختبر إلى تطوير التجارب السريرية ، بما في ذلك تجارب المرحلة الأولى إلى الثالثة - إلى اللقاح أو الدواء المعتمد عادةً أكثر من عقد.[27][33][34]
التركيبات الكيميائية الجديدة
يبدأ تطوير لقاح COVID-19 أو دواء علاجي مضاد للفيروسات بمطابقة مفهوم كيميائي مع الآلية الوقائية المحتملة للقاح المستقبل أو النشاط المضاد للفيروسات في الجسم الحي.[33][34][35]
تصميم الدواء والاختبار المعملي
الكيانات الكيميائية الجديدة (NCEs ، والمعروفة أيضًا باسم الكيانات الجزيئية الجديدة أو NMEs) هي مركبات تنبثق من عملية اكتشاف الأدوية لتحديد لقاح أو مرشح علاجي مضاد للفيروسات. هذا له نشاط واعد ضد هدف بيولوجي يتعلق بمرض COVID-19. في بداية تطوير اللقاح أو الدواء ، لا يُعرف إلا القليل عن السلامة والسمية والحركية الدوائية والاستقلاب لـ NCE في البشر.[27][33][34] إنها وظيفة والتزام تطوير الدواء لتقييم جميع هذه المتثابتات قبل التجارب السريرية البشرية لإثبات السلامة والفعالية. هناك هدف رئيسي آخر لتطوير الدواء هو التوصية بالجرعة والجدول الزمني للاستخدام الأول في تجربة سريرية بشرية ("الأول في الإنسان" [FIH] أو الجرعة البشرية الأولى [FHD] ، التي كانت تُعرف سابقًا باسم "الأول في -رجل "[FIM]).
بالإضافة إلى ذلك ، يجب أن يظهر تطوير الأدوية الخصائص الفيزيائية الكيميائية لـ NCE: تركيبتها الكيميائية واستقرارها وقابليتها للذوبان. يجب على الشركات المصنعة تحسين العملية التي يستخدمونها لصنع المادة الكيميائية حتى يتمكنوا من التوسع الكيميائي الطبي الذي ينتج مليغرامات ، إلى التصنيع على مقياس الكيلوغرام والطن[33][34] كما يقومون بفحص المنتج للتأكد من ملاءمته للتعبئة على شكل كبسولات أو أقراص أو أيروسول أو حقن عضلية أو حقن تحت الجلد أو تركيبات وريدية. تُعرف هذه العمليات معًا في التطور قبل السريري والسريري بالكيمياء والتصنيع والتحكم (CMC).[33]
تركز العديد من جوانب تطوير الأدوية على تلبية المتطلبات التنظيمية لهيئات ترخيص الدواء.[27] تشكل هذه الاختبارات عمومًا اختبارات مصممة لتحديد السميات الرئيسية لمركب جديد قبل الاستخدام الأول في البشر.[27][33] من المتطلبات التنظيمية إجراء تقييم لسمية الجسم الرئيسية (التأثيرات على القلب والرئتين والدماغ والكلى والكبد والجهاز الهضمي) ، بالإضافة إلى التأثيرات على أجزاء أخرى من الجسم التي قد تتأثر بالدواء ( على سبيل المثال ، الجلد إذا تم توصيل اللقاح الجديد عن طريق حقن الجلد). يتم إجراء هذه الاختبارات بشكل متزايد باستخدام طرق مختبرية (على سبيل المثال ، مع الخلايا المعزولة) ، ولكن لا يمكن إجراء العديد من الاختبارات إلا باستخدام حيوانات تجريبية لتوضيح التفاعل المعقد لعملية الاستقلاب و السمية عند التعرض للدواء.[33]
يتم جمع المعلومات من هذا الاختبار قبل السريري ، بالإضافة إلى معلومات حول CMC ، وإرسالها إلى السلطات التنظيمية (في الولايات المتحدة ، إلى إدارة الغذاء والدواء ، كدواء استقصائي جديد (IND) أو طلب ترخيص بيولوجي لتطبيق لقاح.[27][33][34][35] إذا تمت الموافقة على IND ، ينتقل التطوير إلى المرحلة السريرية ,[27] ويتم مراقبة تقدم الأداء في البشر - إذا كان اللقاح قيد التطوير في الولايات المتحدة - يتم مراقبته من قِبل إدارة الأغذية والأدوية FDA في "عملية الموافقة على اللقاح"[37]
مراحل التجارب السريرية
تتضمن برامج التجارب السريرية ثلاث مراحل متعددة السنوات نحو الموافقة على المنتج ، ومرحلة رابعة بعد الموافقة لمراقبة السلامة المستمرة للقاح أو العلاج الدوائي:[27][38]
- تجارب المرحلة الأولى ، عادة في المتطوعين الأصحاء ،تحدد السلامة والجرعات.
- تُستخدم تجارب المرحلة الثانية لتأسيس قراءة أولية للفعالية واستكشاف المزيد من السلامة في أعداد صغيرة من الأشخاص الذين يعانون من المرض المستهدف من قبل NCE.
- تجارب المرحلة الثالثة هي تجارب محورية كبيرة لتحديد السلامة والفعالية في أعداد كبيرة بما فيه الكفاية من الأشخاص المصابين بعدوى COVID-19. إذا تم إثبات السلامة والفعالية بشكل مناسب ، فقد يتوقف الاختبار السريري عند هذه الخطوة ويتقدم NCE إلى مرحلة تطبيق الدواء الجديد (NDA) لبدء التسويق..[27]
- تجارب المرحلة الرابعة هي تجارب ما بعد الموافقة التي قد تكون حالة مرفقة من قِبل إدارة الغذاء والدواء FDA ، وتسمى أيضًا دراسات المراقبة بعد التسويق. حتى يتم توفير لقاح لعامة السكان ، تظل جميع الأحداث الضائرة المحتملة غير محددة ، مما يتطلب أن تخضع اللقاحات لدراسات المرحلة الرابعة مع تقارير منتظمة من قبل الشركة المصنعة لنظام الإبلاغ عن الأحداث الضائرة للقاحات (VAERS) لتحديد المشاكل بعد بدء الاستخدام في السكان..[37]
لا تتوقف عملية تحديد خصائص الدواء بمجرد تقدم NCE في التجارب السريرية البشرية. بالإضافة إلى الاختبارات المطلوبة لنقل لقاح جديد أو دواء مضاد للفيروسات إلى العيادة لأول مرة ، يجب على الشركات المصنعة التأكد من أن أي سمية طويلة أو مزمنة معروفة جيدًا ، بما في ذلك التأثيرات على الأنظمة التي لم يتم رصدها مسبقًا (الخصوبة ، التكاثر ، الجهاز المناعي ، من بين أمور أخرى)..[33][37] إذا ظهر مرشح اللقاح أو المركب المضاد للفيروسات من هذه الاختبارات مع ملف السمية والسلامة المقبول ، ويمكن للشركة المصنعة أن تثبت كذلك أن له التأثير المطلوب في التجارب السريرية، فيمكن عندئذٍ تقديم مجموعة أدلة NCE للموافقة على التسويق في مختلف البلدان حيث تخطط الشركة المصنعة لبيعها.[27] في الولايات المتحدة ، تسمى هذه العملية "تطبيق دواء جديد" أو NDA.[27][33]
التصميمات العتمدة لتجارب كوڤيد-19
قد يتم تعديل تصميم التجارب السريرية الجاري على أنه "تصميم تلاؤمي" إذا كان تجميع البيانات في التجربة يوفر نظرة ثاقبة حول الفعالية الإيجابية أو السلبية للعلاج.[39] قد تؤدي التصميمات التلاؤمية في التجارب السريرية الجارية في المرحلة الثانية إلى الثالثة بشأن العلاجات المرشحة لـ COVID-19 إلى تقصير فترات التجربة واستخدام عدد أقل من المواضيع ، مما قد يعجل في قرارات الإنهاء المبكر أو النجاح.[20][40][41][42] تقوم تجربة الاكتشاف الأوروبية للأشخاص في المستشفى الذين يعانون من عدوى COVID-19 الحادة بإجراء تغييرات سريعة في تصميم التجربة مع ظهور نتائج الاستراتيجيات العلاجية التجريبية الأربعة..[40]
معدل الإخفاق
يفشل معظم مرشحي الأدوية الجدد (NCEs) أثناء تطوير الدواء ، إما لأن لديهم سمية غير مقبولة أو لأنهم ببساطة لا يثبتون فعاليتهم على المرض المستهدف ، كما هو موضح في التجارب السريرية للمرحلة الثانية والثالثة.[27][33] تشير المراجعات النقدية لبرامج تطوير الأدوية إلى فشل التجارب السريرية للمرحلة الثانية والثالثة بسبب الآثار الجانبية السامة غير المعروفة (فشل 50 ٪ في التجارب القلبية من المرحلة الثانية) ، وبسبب عدم كفاية التمويل أو ضعف تصميم التجربة أو تنفيذ التجربة السيئ..[41][43]
وجدت دراسة تغطي الأبحاث السريرية في الثمانينيات والتسعينيات من القرن العشرين أن 21.5 ٪ فقط من المرشحين للأدوية الذين بدأوا تجارب المرحلة الأولى تمت الموافقة عليهم في النهاية للتسويق.[44] خلال 2006-15 ، كان معدل نجاح الحصول على الموافقة من المرحلة الأولى لتجارب المرحلة الثالثة الناجحة أقل من 10٪ في المتوسط ، و 16.2٪ على وجه التحديد للقاحات.[45] يشار إلى معدلات الفشل العالية المرتبطة بالتطوير الصيدلاني باسم "معدل الاستنزاف" ، الأمر الذي يتطلب اتخاذ قرارات خلال المراحل المبكرة من تطوير الأدوية "لوقف" المشاريع في وقت مبكر لتجنب الفشل المكلف.[45][46]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التكلفة
قامت إحدى الدراسات لعام 2010 بتقييم كل من التكاليف الرأسمالية والنفقات الشخصية لجلب دواء جديد واحد إلى السوق بحوالي 1.8 مليار دولار أمريكي و 870 مليون دولار على التوالي.[47] كان متوسط التكلفة التقديرية لتجارب 2015-16 لتطوير 10 أدوية مضادة للسرطان 648 مليون دولار.[48] في عام 2017 ، كان متوسط تكلفة التجربة المحورية عبر جميع المؤشرات السريرية 19 مليون دولار..[49]
كان متوسط التكلفة (2013 دولارًا) لكل مرحلة من مراحل البحث السريري 25 مليون دولار أمريكي لدراسة سلامة المرحلة الأولى ، و 59 مليون دولار لدراسة فعالية عشوائية مضبوطة للمرحلة الثانية و 255 مليون دولار لتجربة المرحلة الثالثة المحورية لإثبات تكافؤها أو تفوقها إلى دواء معتمد موجود,[50] ربما يصل إلى 345 مليون دولار.[49] كان متوسط تكلفة إجراء تجربة المرحلة الثالثة المحورية 2015-16 على مرشح دواء للأمراض المعدية 22 مليون دولار..[49]
التكلفة الكاملة لجلب دواء جديد (أي كيان كيميائي جديد) إلى السوق - من الاكتشاف إلى التجارب السريرية إلى الموافقة - معقدة ومثيرة للجدل.[33][34][49][51] في مراجعة عام 2016 لـ 106 من مرشحي الأدوية الذين تم تقييمهم من خلال التجارب السريرية ، بلغ إجمالي الإنفاق الرأسمالي لشركة مصنعة لديها دواء تمت الموافقة عليه من خلال تجارب المرحلة الثالثة الناجحة 2.6 مليار دولار (في دولارات 2013) ، وهو مبلغ يزداد بمعدل سنوي 8.5٪..[50] خلال الفترة من 2003 إلى 2013 بالنسبة للشركات التي وافقت على 8-13 دواء ، يمكن أن ترتفع تكلفة الدواء إلى 5.5 مليار دولار ، ويرجع ذلك أساسًا إلى التوسع الجغرافي الدولي للتسويق والتكاليف الجارية لتجارب المرحلة الرابعة للمراقبة المستمرة للسلامة..[52]
تهدف بدائل تطوير الأدوية التقليدية إلى تعاون الجامعات والحكومات والصناعات الدوائية وتحسين الموارد..[53]
العلاجات المرشحة
التجارب ثلاثية ورباعية المراحل
تقيم تجارب المرحلة الثالثة المحورية ما إذا كان الدواء المرشح له فعالية على وجه التحديد ضد المرض ، وفي حالة الأشخاص الذين دخلوا المستشفى مصابين بعدوى COVID-19 الشديدة ، اختبروا مستوى الجرعة الفعالة لمرشح الدواء المعاد استخدامه أو الجديد لتحسين المرض (في المقام الأول الالتهاب الرئوي) من عدوى COVID-19.[6][20][54] بالنسبة لعقار تمت الموافقة عليه بالفعل (مثل هيدروكسيكلوروكين للملاريا) ، تحدد تجارب المرحلة الثالثة والرابعة في مئات الآلاف من المصابين بـ COVID-19 إمكانية الاستخدام الموسع لدواء معتمد بالفعل لعلاج عدوى COVID-19.[31][54]
لا يتم تضمين العديد من الأدوية المرشحة قيد الدراسة كعلاجات "داعمة" لتخفيف الانزعاج أثناء المرض ، مثل مضادات التهاب لاستيرويدية أو موسعات الشعب الهوائية ، في الجدول أدناه. كما يتم استبعاد الآخرين في تجارب المرحلة الثانية من المرحلة المبكرة ، مثل BDB-1 و brilacidin و APN01 ، أو العديد من المرشحين للعلاج في تجارب المرحلة الأولى,[1][31] حقق المرشحون للأدوية في تجارب المرحلة الثانية معدل نجاح منخفض (أقل من 12٪) للموافقة النهائية..[33][41]
| كوڤيد-19: الأدوية المرشحة في التجارب ثلاثية ورباعية المراحل | ||||||
|---|---|---|---|---|---|---|
| الدواء المرشح | الوصف | المرض المعتمد حالياً | رعاة التجربة | الموقع | النتائج المتوقعة | الملاحظات، الهوامش[55] |
| رمدسيڤير | مثبطات البروتياز المضادة للفيروسات ضد فيروس كورونا | استقصائي[56] | گلعاد للعلوم, منظمة الصحة العالمية, إنسرم | الصين واليابان في البداية ؛ تم توسيعه ليشمل دولًا متعددة في أوروبا وأمريكا الشمالية في التجارب العالمية للتضامن والاكتشاف | أبريل (التجارب الصينية واليابانية) حتى منتصف 2020 | [1][31][40][57][58] يتم توفيره بشكل انتقائي من قبل گلعاد للعلوم للأتاحة في الطوارئ COVID-19. |
| هيدروكسيكلوروكين أو كلوروكين (پلاكنل ، أرالـِن) | مضاد للفيروسات ، عام تم تصنيعه بواسطة باير و نوڤارتس و مايلان و تيفا وغيرهما | الملاريا ، التهاب المفاصل الرثياني ، الذئبة (عالمي) | تحالف ابتكارات التأهب للوباء(CEPI), منظمة الصحة العالمية(ًًWHO),إنسرم | مواقع متعددة في الصين ؛ التضامن العالمي ومحاكمات الاكتشاف ، أوروبا ، الدولية | أبريل 2020 (التجارب الصينية) ؛ منتصف 2020 | آثار جانبية متعددة ، بعضها شديد. التفاعلات الدوائية الضارة المحتملة ؛ |
| فاڤيپيراڤير (أڤيگان) | مضاد للفيروسات ضد الأنفلونزا | الانفلونزا (الصين))[61] | فوجيفيلم | الصين | أبريل 2020 | [1][12][31][62] |
| لوپيناڤير + ريتوناڤير مع أو بدون ربيف | مضاد للفيروسات ، تثبيط مناعي | تركيبة استقصائية تم الموافقة علي ريتوناڤير- لوپيناڤير | CEPI, WHO,الحكومة البريطانية, جامعة أكسفورد, INSERM | التضامن العالمي وتجارب الاكتشاف ، بلدان متعددة | منتصف-2020 | [1][31][40] |
| ساريلوماب (كيفزارا) | جسم مضاد وحيد النسيلة ضد مستقبل إنترلوكين-6 | التهاب المفاصل الرثياني (الولايات المتحدة وأوروبا) | ريجينرون-سانوفي | بلدان متعددة | ربيع 2020 | [1][65] |
| ASC-09 + ريتوناڤير (قرص فموي) | مضاد للفيروسات | تركيبة غير معتمدة ؛ تم الموافقة علي ريتونافير على فيروس نقص المناعة البشرية | اسكليتس فارما | مواقع متعددة في الصين | ربيع 2020 | [1][66] |
| توسيليزوماب ( أتليزوماب, أستيرما) | جسم مضاد وحيد النسيلة ضد مستقبل إنترلوكين-6 | تثبيط المناعة ، والتهاب المفاصل الرثياني (الولايات المتحدة وأوروبا)[67] | جينتك-هوفمان-لا روش | بلدان متعددة | منتصف-2020 | [1][31][68] |
الهيدروكسيكلوروكين والكلوروكوين
في 28 مارس 2020 ، أتاحت إدارة الغذاء والدواء الأمريكية من استخدام أقراص عن طريق الفم من فوسفات الكلوروكين أو كبريتات هيدروكسي كلوروكوين بموجب ترخيص للاستخدام في حالات الطوارئ وفقًا لتقدير الأطباء الذين يعالجون الأشخاص الذين يعانون من COVID-19.[69] صرح مسئول إدارة الغذاء والدواء الأمريكية "أنه من المعقول أن نعتقد أن الفوائد المعروفة والمحتملة لفوسفات الكلوروكين وكبريتات الهيدروكسي كلوروكين ، عند استخدامها لعلاج السارس - CoV - 2 واستخدامها بشكل متسق مع نطاق الترخيص لهذه الرسالة (القسم الثاني) ، تفوق المخاطر المعروفة والمحتملة لهذه المنتجات"[69]
وقد وجدت النتائج الأولية أن الكلوروكين قد يكون فعالًا وآمنًا في علاج الالتهاب الرئوي المرتبط بـ COVID-19.[32][70][71] أصدرت إدارة العلوم والتكنولوجيا بمقاطعة گوانگدونگ ولجنة الصحة والصحة بمقاطعة گوانگدونگ تقريرًا يفيد بأن فوسفات الكلوروكين "يحسن معدل نجاح العلاج ويقصر مدة إقامة المريض بالمستشفى" وأوصى به للأشخاص الذين تم تشخيصهم بمرض خفيف ومعتدل الحالات الشديدة من الالتهاب الرئوي الفيروسي التاجي..[72]
وقد أوصت السلطات الصحية الصينية والكورية الجنوبية والإيطالية بالكلوروكين لعلاج COVID-19 ,[73] على الرغم من أن هذه الوكالات ومركز السيطرة على الأمراض والوقاية منها في الولايات المتحدة لاحظوا موانع للأشخاص الذين يعانون من أمراض القلب أو داء السكري.[32][74] في فبراير 2020 ، ثبت أن كلا العقارين يقللان بشكل فعال من مرض COVID-19.[71][75] لكن دراسة أخرى خلصت إلى أن هيدروكسي كلوروكوين كان أكثر فعالية من الكلوروكين ولديه ملف أمان أكثر تحملاً. أوضحت النتائج الأولية للتجربة أن الكلوروكين فعال وآمن في الإصابة بالالتهاب الرئوي COVID-19 ، "تحسين نتائج تصوير الرئة ، وتعزيز التحول السلبي للفيروس ، وتقصير مسار المرض[70] يتوفر هيدروكسي كلوروكين بشكل أكثر شيوعًا من الكلوروكين في الولايات المتحدة.[32]
وفقًا لمركز السيطرة على الأمراض في الولايات المتحدة ، يوصى باستخدام الكلوروكين أو هيدروكسي كلوروكوين لعلاج الأشخاص المصابين في المستشفى المصابين بـ COVID-19 في العديد من البلدان ، على الرغم من عدم وجود مثل هذه الأدلة من التجارب السريرية في الولايات المتحدة ، اعتبارًا من مارس 2020 [32][69] التجارب السريرية الأولية لتقييم التخطيط لسلامة وفعالية هيدروكسي كلوروكوين لعلاج عدوى COVID-19 في الولايات المتحدة ، لكن مركز السيطرة على الأمراض ذكر أن "استخدام أو جرعات أو مدة هيدروكسي كلوروكوين للوقاية أو علاج عدوى السارس- CoV-2" لم يثبت بعد .[32]
يحتوي هيدروكسي كلوروكوين والكلوروكين على العديد من الآثار الجانبية الخطيرة ، مثل اعتلال الشبكية و نقص گلوكوز الدم أو اعتلال عضلة القلب الذي يهدد الحياة.[59] كلا العقاقير لها تفاعلات واسعة النطاق مع الأدوية الموصوفة ، مما يؤثر على الجرعة العلاجية وتخفيف المرض.[59][60] بعض الناس لديهم حساسية تجاه هذه الأدوية.[59][60]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الأبحاث ما قبل السريرية للعلاجات المحتملة لكوڤيد-19
يتم تعريف مصطلح "البحث قبل السريري" من خلال الدراسات المختبرية في المختبر وفي الجسم الحي ، مما يشير إلى مرحلة بداية لتطوير لقاح أو علاج مضاد مضاد للفيروسات أو جسم مضاد وحيد النسيلة,[11] مثل التجارب لتحديد الجرعات الفعالة والسمية ، قبل تطوير المركب المرشح مهمة لتقييم السلامة والفعالية في البشر.[35][76] لإكمال المرحلة قبل السريرية من تطوير الدواء - ثم اختبارها من أجل السلامة والفعالية في عدد كاف من الأشخاص المصابين بـ COVID-19 (مئات الآلاف في بلدان مختلفة) - عملية من المحتمل أن تتطلب 1-2 سنوات للقاحات وعلاجات COVID-19 ، وفقًا لعدة تقارير في أوائل عام 2020.[13][28][29][77][78][79] وعلى الرغم من هذه الجهود ، فإن معدل نجاح المرشحين للأدوية للوصول إلى الموافقة التنظيمية في نهاية المطاف من خلال عملية تطوير الأدوية لعلاج الأمراض المعدية هو 19٪ ، وبالنسبة لمرشحي اللقاحات على وجه التحديد ، 11.5٪ فقط .
.[45]
في 2 أبريل 2020 ، أبلغ باحثون في جامعة كولومبيا البريطانية عن اكتشاف دواء تجريبي يمكن أن يمنع بشكل كبير المراحل المبكرة من مرض COVID-19 في الأنسجة البشرية المهندسة.[80][81]
المثبطات

في مارس 2020 ، تم تحديد البروتياز الرئيسي لفيروس سارس - CoV - 2 كهدف للأدوية بعد الإصابة. هذا الإنزيم ضروري للخلية المضيفة لتكوين الحمض النووي الريبي للفيروس. للعثور على الإنزيم ، استخدم العلماء الجينوم الذي نشره الباحثون الصينيون في يناير 2020 لعزل البروتياز الرئيسي.[82] مثبطات البروتياز المعتمدة لعلاج فيروسات نقص المناعة البشرية (HIV) – لوبينافير و ريتونافير - لديها أدلة أولية على نشاط ضد فيروس كورونا والسارس و متلازمة الشرق الأوسط التنفسية.[6][22] كعلاج مركب محتمل ، يتم استخدامها معًا في ذراعي المرحلة الثالثة من مشروع التضامن العالمي لعام 2020 على COVID-19.[6] لم تجد دراسة أولية في الصين ان لوبينافير وريتونافير مجتمعين لهما أي تأثير على الأشخاص الذين دخلوا المستشفى لـ COVID-19..[83]
مضادات الڤيروسات، الأدوية المناعية والأجسام المضادة
وأشار أحد التقارير إلى أن 29 تجربة سريرية متقدمة لمرشحي الأدوية بعد الإصابة في المستشفيات في الصين سيتم الإبلاغ عنها في أبريل.[31] اعتبارًا من مارس 2020 ، تم تطوير الفا-إنترفيرون و أوميفينوفير في أبحاث المرحلة المبكرة كعوامل مضادة للفيروسات بعد الإصابة.[1][12][22][23][24] العديد من المرشحين الآخرين ، بما في ذلك العلاج المناعي ومركبات الأجسام المضادة ، قيد التطوير.[1][4][11][13][17][31][84]
في 23 أكتوبر 2020، أعلنت شركة گلعاد الإسرائيلية تُعلن اعتماد دواء رمدسيڤير لعلاج كوڤيد-19 في الولايات المتحدة، بعد أن كان يستعمل بشروط، ليكون بذلك العقار الوحيد الذي يحصل على ترخيص كامل. وكان الرئيس الأمريكي دونالد ترمپ تلقى جرعات من هذا الدواء لخمسة أيام عندما أصيب بكوڤيد-19 بداية أكتوبر. وحصلت أدوية أخرى منذ أشهر على تراخيص لكن للاستخدام في الحالات الطارئة فقط.[85]
وحصلت عقارات أخرى منذ أشهر على تراخيص لكن للاستخدام في الحالات الطارئة فقط. ويمكن مع نهاية حال الطوارئ الصحية إلغاء هذه التراخيص التي منحت بناء على قواعد بيانات غير مكتملة. وسمحت أوروپا ودول أخرى منذ الربيع باستعمال رمدسيڤير بشكل مؤقت.
ويمكن إعطاء العقار للراشدين والأطفال فوق سن الثانية عشرة ووزن 40 كگ، بشرط أن يكونوا في المستشفيات أو في بيئة مشابهة. وأعطي أيضاً ترخيص طارئ لاستعمال العقار للأطفال الذين سنهم أدنى من 12 عاماً ويتجاوز وزنهم 3.5 كگ.
الدراسات الميدانية الفاشلة
في البالغين الذين يعانون من COVID-19 الحاد في المستشفى في ووهان ، الصين ، لم يوفر العلاج باستخدام مجموعة من الأدوية المضادة للفيروسات المضادة للفيروسات - لوبينافير - ريتونافير (علاجات فيروس نقص المناعة البشرية / الإيدز) - أي فائدة كبيرة (عند تجربتها بمفردها).
.[83]
الاستراتيجيات
إعادة استخدام الأدوية المعتمدة
أثناء تفشي COVID-19 ، يعد إعادة استخدام الأدوية (أو "إعادة التموضع") عملية بحث سريري للفحص السريع وتحديد سلامة وفعالية الأدوية الحالية المعتمدة بالفعل لأمراض أخرى لاستخدامها مع الأشخاص المصابين بعدوى COVID-19.[22][25][86] في عملية تطوير الدواء المعتادة ,[27] سيستغرق تأكيد إعادة استخدام أغراض علاج الأمراض الجديدة سنوات عديدة من البحث السريري - بما في ذلك التجارب السريرية للمرحلة الثالثة المحورية - على الدواء المرشح لضمان سلامته وفعاليته خصيصًا لعلاج عدوى COVID-19.[22][86] في حالة طوارئ جائحة COVID-19 المتزايد ، تم تسريع عملية إعادة استخدام الدواء خلال مارس 2020 لعلاج الأشخاص الذين دخلوا المستشفى باستخدام COVID-19.[6][22][25]
قد تستغرق التجارب السريرية التي تستخدم العقاقير المعاد استخدامها والآمنة بشكل عام للأشخاص الذين يعانون من COVID-19 في المستشفى وقتًا أقل وتكون التكاليف الإجمالية أقل للحصول على نقاط نهاية تثبت السلامة (غياب الآثار الجانبية الخطيرة) والفعالية بعد الإصابة ، ويمكن الوصول بسرعة إلى إمدادات الأدوية الحالية سلاسل التصنيع والتوزيع في جميع أنحاء العالم.[6][22][87] In في محاولة دولية لالتقاط هذه المزايا ، بدأت منظمة الصحة العالمية في منتصف مارس 2020 تجارب دولية سريعة للمرحلة الثانية والثالثة على أربعة خيارات علاجية واعدة - تجربة تضامنية[6][88][89] مع العديد من الأدوية الأخرى التي يمكن إعادة استخدامها في استراتيجيات علاج الأمراض المختلفة ، مثل العلاجات المضادة للالتهابات ، والكورتيكوستيرويد ، والأجسام المضادة ، والمناعة ، وعوامل النمو ، من بين أمور أخرى ، يتم تطويرها في تجارب المرحلة الثانية أو الثالثة خلال عام 2020.[1][22][23][86][90]
الوقاية بعد التعرض
بناءً على الخبرة في مضادات الميكروبات ، قد يكون العلاج الوقائي قبل التعرض والوقاية بعد التعرض (PEP) للأدوية المضادة للفيروسات إجراءات فعالة لتقليل الإصابة بـ COVID-19.[87] توصي منظمة الصحة العالمية باستخدام PEP باستخدام المضاد الحيوي ، ريفامپيسين ، للأشخاص المعرضين لخطر الإصابة قبل أو بعد التعرض لوباء الإنفلونزا.[87] الأدوية المضادة للفيروسات التي يتم إعطاؤها بعد فترة وجيزة من ظهور أعراض عدوى COVID-19 قد تقلل من المرض وتقلل من خطر الإصابة بالعدوى عن طريق الحد من سفك الفيروس في إفرازات الجهاز التنفسي..[32][87]
مبادرات من أجل التجارب السريرية
انظر أيضاً
المصادر
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص "COVID-19 treatment and vaccine tracker" (PDF). Milken Institute. 6 April 2020. Retrieved 6 April 2020.
{{cite web}}: Unknown parameter|lay-url=ignored (help) - ^ أ ب Carey, Karen (February 26, 2020). "Increasing number of biopharma drugs target COVID-19 as virus spreads". BioWorld. Retrieved 1 March 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Garde, Damian (19 March 2020). "An updated guide to the coronavirus drugs and vaccines in development". STAT. Retrieved 21 March 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب ت "Draft landscape of COVID-19 candidate vaccine" (PDF). World Health Organization. 13 March 2020. Retrieved 21 March 2020.
- ^ أ ب Knapp, Alex (13 March 2020). "Coronavirus Drug Update: The Latest Info On Pharmaceutical Treatments And Vaccines". Forbes. Retrieved 21 March 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب ت ث ج ح خ د Kupferschmidt, Kai; Cohen, Jon (22 March 2020). "WHO launches global megatrial of the four most promising coronavirus treatments". Science Magazine. doi:10.1126/science.abb8497. Retrieved 27 March 2020.
- ^ "First regulatory workshop on COVID-19 facilitates global collaboration on vaccine development". European Medicines Agency. 18 March 2020. Retrieved 21 March 2020.
- ^ أ ب "Coronavirus (COVID-19) Update: FDA Continues to Facilitate Development of Treatments". US Food and Drug Administration. 19 March 2020. Retrieved 21 March 2020.
- ^ "China approves first anti-viral drug against coronavirus Covid-19". Clinical Trials Arena. 18 February 2020. Retrieved 21 March 2020.
- ^ "Chinese Vaccine Approved for Human Testing at Virus Epicenter". Bloomberg News. 19 March 2020. Retrieved 21 March 2020.
- ^ أ ب ت ث ج Dhama K, Sharun K, Tiwari R, Dadar M, Malik YS, Singh KP, et al. (March 2020). "COVID-19, an emerging coronavirus infection: advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics". Human Vaccines and Immunotherapeutics: 1–7. doi:10.1080/21645515.2020.1735227. ISSN 2164-5515. PMC 7103671. PMID 32186952.
- ^ أ ب ت Zhang L, Liu Y (March 2020). "Potential interventions for novel coronavirus in China: A systematic review". Journal of Medical Virology. 92 (5): 479–90. doi:10.1002/jmv.25707. ISSN 0146-6615. PMID 32052466.
- ^ أ ب ت Fox, Maggie (19 March 2020). "Drug makers are racing to develop immune therapies for Covid-19. Will they be ready in time?". Stat. Retrieved 21 March 2020.
- ^ Chan, Minnie (19 March 2020). "Chinese military scientists ordered to win global race to develop coronavirus vaccine". South China Morning Post. Retrieved 22 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19". Coalition for Epidemic Preparedness Innovations, Oslo, Norway. 6 March 2020. Retrieved 23 March 2020.
- ^ Kelland, Kate (10 March 2020). "Epidemic response group ups coronavirus vaccine funding to $23.7 million". Reuters. Retrieved 21 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب "Government of Canada funds 49 additional COVID-19 research projects – Details of the funded projects". Government of Canada. 23 March 2020. Retrieved 23 March 2020.
- ^ أ ب Abedi, Maham (23 March 2020). "Canada to spend $192M on developing COVID-19 vaccine". Global News. Retrieved 24 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب Cillian O'Brien (31 March 2020). "Vaccine watch: These are the efforts being made around the world". CTV News. Retrieved 1 April 2020.
- ^ أ ب ت COVID-19 Clinical Research Coalition (2020). "Global coalition to accelerate COVID-19 clinical research in resource-limited settings". The Lancet. doi:10.1016/s0140-6736(20)30798-4. ISSN 0140-6736. PMID 32247324.
{{cite journal}}: CS1 maint: numeric names: authors list (link) - ^ أ ب Maguire, Brittany J.; Guérin, Philippe J. (2 April 2020). "A living systematic review protocol for COVID-19 clinical trial registrations". Wellcome Open Research. 5: 60. doi:10.12688/wellcomeopenres.15821.1. ISSN 2398-502X.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج ح خ د Li G, De Clercq E (March 2020). "Therapeutic options for the 2019 novel coronavirus (2019-nCoV)". Nature Reviews: Drug Discovery. 19 (3): 149–150. doi:10.1038/d41573-020-00016-0. PMID 32127666.
- ^ أ ب ت Li, G.; De Clercq, E. (2020). "Therapeutic options for the 2019 novel coronavirus (2019-nCoV) - Supplementary Table 1: Summary of antiviral compounds against human coronaviruses". Nature Reviews: Drug Discovery. 19 (3): 149–150. doi:10.1038/d41573-020-00016-0. PMID 32127666.
- ^ أ ب ت Dong, Liying; Hu, Shasha; Gao, Jianjun (2020-02-29). "Discovering drugs to treat coronavirus disease 2019 (COVID-19)". Drug Discoveries and Therapeutics. 14 (1): 58–60. doi:10.5582/ddt.2020.01012. ISSN 1881-7831. PMID 32147628.
- ^ أ ب ت Harrison, Charlotte (2020-02-27). "Coronavirus puts drug repurposing on the fast track". Nature Biotechnology. doi:10.1038/d41587-020-00003-1. ISSN 1087-0156. PMID 32205870.
- ^ Cheng, Matthew P.; Lee, Todd C. Lee; Tan, Darrell H.S.; Murthy, Srinivas (26 March 2020). "Generating randomized trial evidence to optimize treatment in the COVID-19 pandemic" (PDF). Canadian Medical Association Journal: cmaj.200438. doi:10.1503/cmaj.200438. ISSN 0820-3946. Retrieved 27 March 2020.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض "The Drug Development Process". US Food and Drug Administration. 4 January 2018. Retrieved 21 March 2020.
- ^ أ ب Grenfell, Rob; Drew, Trevor (17 February 2020). "Here's Why It's Taking So Long to Develop a Vaccine for the New Coronavirus". ScienceAlert. Archived from the original on 28 February 2020. Retrieved 26 February 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب Preston, Elizabeth (19 March 2020). "Why will a coronavirus vaccine take so long?". The Boston Globe. Retrieved 21 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "Call to pool research resources into large multi-centre, multi-arm clinical trials to generate sound evidence on COVID-19 treatments". European Medicines Agency. 19 March 2020. Retrieved 21 March 2020.
- ^ أ ب ت ث ج ح خ د ذ ر Selina Koch; Winnie Pong (13 March 2020). "First up for COVID-19: nearly 30 clinical readouts before end of April". BioCentury Inc. Retrieved 1 April 2020.
- ^ أ ب ت ث ج ح خ د "Information for clinicians on therapeutic options for COVID-19 patients". US Centers for Disease Control and Prevention. 21 March 2020. Retrieved 22 March 2020.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض Strovel, Jeffrey; Sittampalam, Sitta; Coussens, Nathan P.; Hughes, Michael; Inglese, James; Kurtz, Andrew; Andalibi, Ali; Patton, Lavonne; Austin, Chris; Baltezor, Michael; Beckloff, Michael; Weingarten, Michael; Weir, Scott (July 1, 2016). "Early Drug Discovery and Development Guidelines: For Academic Researchers, Collaborators, and Start-up Companies". Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. PMID 22553881.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب ت ث ج ح خ Taylor, David (2015). "The Pharmaceutical Industry and the Future of Drug Development". Issues in Environmental Science and Technology. Royal Society of Chemistry: 1–33. doi:10.1039/9781782622345-00001. ISBN 978-1-78262-189-8.
- ^ أ ب ت "Vaccine Testing and the Approval Process". US Centers for Disease Control and Prevention. 1 May 2014. Retrieved 21 March 2020.
- ^ Kessler DA, Feiden KL (March 1995). "Faster Evaluation of Vital Drugs". Scientific American. 272 (3): 48–54. Bibcode:1995SciAm.272c..48K. doi:10.1038/scientificamerican0395-48. PMID 7871409.
- ^ أ ب ت "Vaccine Product Approval Process". US Food and Drug Administration. 30 January 2018. Retrieved 21 March 2020.
- ^ Kaiser J., Aziz (1 April 2018). "FDA update (2018) – The FDA's new drug approval process: Development and premarket applications". Drug Development and Delivery. Retrieved 25 March 2020.
- ^ "Adaptive Designs for Clinical Trials of Drugs and Biologics: Guidance for Industry". US Food and Drug Administration. 1 November 2019. Retrieved 3 April 2020.
- ^ أ ب ت ث ج "Launch of a European clinical trial against COVID-19". INSERM. 22 March 2020. Retrieved 5 April 2020.
The great strength of this trial is its "adaptive" nature. This means that ineffective experimental treatments can very quickly be dropped and replaced by other molecules that emerge from research efforts. We will therefore be able to make changes in real time, in line with the most recent scientific data, in order to find the best treatment for our patients
- ^ أ ب ت Van Norman, Gail A. (2019). "Phase II trials in drug development and adaptive trial design". Journal of the American College of Cardiology: Basic to Translational Science. 4 (3): 428–437. doi:10.1016/j.jacbts.2019.02.005. ISSN 2452-302X. PMC 6609997. PMID 31312766.
- ^ Sato, A.; Shimura, M.; Gosho, M. (2018). "Practical characteristics of adaptive design in phase 2 and 3 clinical trials". Journal of Clinical Pharmacy and Therapeutics. 43 (2): 170–180. doi:10.1111/jcpt.12617. ISSN 0269-4727. PMID 28850685.
- ^ Fogel DB (7 August 2018). "Factors associated with clinical trials that fail and opportunities for improving the likelihood of success: A review". Contemporary Clinical Trials Communications. 11: 156–64. doi:10.1016/j.conctc.2018.08.001. ISSN 2451-8654. PMC 6092479. PMID 30112460.
- ^ "R&D costs are on the rise". Medical Marketing and Media. 38 (6): 14. June 1, 2003. Archived from the original on October 18, 2016.
- ^ أ ب ت "Clinical development success rates: 2006-2015" (PDF). BIO Industry Analysis. June 2016.
- ^ Wang Y (2012). "Extracting knowledge from failed development programmes". Pharmaceutical Medicine. 26 (2): 91–96. doi:10.1007/BF03256897.
- ^ Paul SM, Mytelka DS, Dunwiddie CT, Persinger CC, Munos BH, Lindborg SR, et al. (March 2010). "How to improve R&D productivity: The pharmaceutical industry's grand challenge". Nature Reviews Drug Discovery. 9 (3): 203–14. doi:10.1038/nrd3078. PMID 20168317.
- ^ Prasad V, Mailankody S (1 October 2017). "Research and development spending to bring a single cancer drug to market and revenues after approval". JAMA Internal Medicine. 177 (11): 1569–1575. doi:10.1001/jamainternmed.2017.3601. ISSN 2168-6106. PMC 5710275. PMID 28892524.
- ^ أ ب ت ث Moore TJ, Zhang H, Anderson G, Alexander GC (1 October 2018). "Estimated costs of pivotal trials for novel therapeutic agents approved by the US Food and Drug Administration, 2015-2016". JAMA Internal Medicine. 178 (11): 1451–1457. doi:10.1001/jamainternmed.2018.3931. ISSN 2168-6106. PMC 6248200. PMID 30264133.
- ^ أ ب DiMasi JA, Grabowski HG, Hansen RW (May 2016). "Innovation in the pharmaceutical industry: New estimates of R&D costs". Journal of Health Economics. 47: 20–33. doi:10.1016/j.jhealeco.2016.01.012. ISSN 0167-6296. PMID 26928437.
- ^ Sertkaya A, Wong HH, Jessup A, Beleche T (April 2016). "Key cost drivers of pharmaceutical clinical trials in the United States". Clinical Trials. 13 (2): 117–26. doi:10.1177/1740774515625964. PMID 26908540.
- ^ Herper, Matthew (11 August 2013). "The cost of creating a new drug now $5 billion, pushing Big Pharma to change". Forbes. Retrieved 17 July 2016.
- ^ Maxmen A (2016). "Busting the billion-dollar myth: how to slash the cost of drug development". Nature. 536 (7617): 388–90. Bibcode:2016Natur.536..388M. doi:10.1038/536388a. PMID 27558048.
- ^ أ ب "What are the phases of clinical trials?". American Cancer Society. 2020. Retrieved 4 April 2020.
- ^ أ ب "Emergency access to remdesivir outside of clinical trials". Gilead Sciences. 1 April 2020. Retrieved 7 April 2020.
- ^ "Remdesivir approval status". Drugs.com. 24 March 2020. Retrieved 6 April 2020.
- ^ Pagliarulo, Ned (5 March 2020). "A closer look at the Ebola drug that's become the top hope for a coronavirus treatment". BioPharma Dive. Retrieved 19 March 2020.
There's only one drug right now that we think may have real efficacy. And that's remdesivir." said Bruce Aylward, a senior advisor and international leader of the World Health Organization's joint mission to China
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "Gilead starts late-stage trials in the UK of potential COVID-19 therapy". PharmaTimes. 2 April 2020. Retrieved 6 April 2020.
- ^ أ ب ت ث ج "Hydroxychloroquine sulfate". Drugs.com. 31 March 2020. Retrieved 5 April 2020.
- ^ أ ب ت ث "Chloroquine phosphate". Drugs.com. 31 March 2020. Retrieved 5 April 2020.
- ^ "Fujifilm Announces the Start of a Phase III Clinical Trial of Influenza Antiviral Drug Avigan (favipiravir) on COVID-19 in Japan and Commits to Increasing Production". Drugs.com via Fujifilm Toyama Chemical Co., Ltd. 31 March 2020. Retrieved 6 April 2020.
- ^ Gregory, Andy (18 March 2020). "Coronavirus: Japanese anti-viral drug effective in treating patients, Chinese official says". The Independent. Retrieved 19 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب "Ritonavir". Drugs.com. 2020. Retrieved 6 April 2020.
- ^ "Kevzara". Drugs.com. 7 March 2019. Retrieved 6 April 2020.
- ^ Richard Staines (31 March 2020). "Sanofi begins trial of Kevzara against COVID-19 complications". PharmaPhorum. Retrieved 6 April 2020.
- ^ Jenny McGrath (2 April 2020). "All the COVID-19 vaccines and treatments currently in clinical trials". Digital Trends. Retrieved 6 April 2020.
- ^ "Tocilizumab". Drugs.com. 7 June 2019. Retrieved 6 April 2020.
- ^ Hannah Slater (26 March 2020). "FDA approves Phase III clinical trial of tocilizumab for COVID-19 pneumonia". Cancer Network, MJH Life Sciences. Retrieved 28 March 2020.
- ^ أ ب ت Denise M Hinton (28 March 2020). "Request for Emergency Use Authorization For Use of Chloroquine Phosphate or Hydroxychloroquine Sulfate Supplied From the Strategic National Stockpile for Treatment of 2019 Coronavirus Disease". US Food and Drug Administration. Retrieved 30 March 2020.
- ^ أ ب Gao J, Tian Z, Yang X (February 2020). "Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies". Bioscience Trends. 14 (1): 72–73. doi:10.5582/bst.2020.01047. PMID 32074550.
- ^ أ ب Cortegiani, Andrea; Ingoglia, Giulia; Ippolito, Mariachiara; Giarratano, Antonino; Einav, Sharon (2020-03-10). "A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19". Journal of Critical Care. doi:10.1016/j.jcrc.2020.03.005. ISSN 0883-9441. PMID 32173110.
- ^ Multicenter collaboration group of Department of Science and Technology of Guangdong Province and Health Commission of Guangdong Province for chloroquine in the treatment of novel coronavirus pneumonia (February 2020). "[Expert consensus on chloroquine phosphate for the treatment of novel coronavirus pneumonia] (abstract in English; article in Chinese)". Chinese Journal of Tuberculosis and Respiratory Diseases (in الصينية). 43: E019. doi:10.3760/cma.j.issn.1001-0939.2020.0019. ISSN 1001-0939. PMID 32075365.
- ^ Sung-sun, Kwak (2020-02-13). "Physicians work out treatment guidelines for coronavirus". Korea Biomedical Review. Retrieved 2020-03-18.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "Plaquenil (hydroxychloroquine sulfate) dose, indications, adverse effects, interactions... from PDR.net". Physicians' Desk Reference. Retrieved 2020-03-19.
- ^ Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al. (2020). "In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2)". Clinical Infectious Diseases. doi:10.1093/cid/ciaa237. PMC 7108130. PMID 32150618.
- ^ "Step 2: Preclinical Research". US Food and Drug Administration. 4 January 2018. Retrieved 23 March 2020.
- ^ Gates, Bill (28 February 2020). "Responding to Covid-19 — A Once-in-a-Century Pandemic?". New England Journal of Medicine. doi:10.1056/nejmp2003762. ISSN 0028-4793. PMID 32109012.
- ^ Spinney, Laura (18 March 2020). "When will a coronavirus vaccine be ready?". The Guardian. Retrieved 18 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Deese, Kaelan (26 February 2020). "Health official says coronavirus vaccine will take 'at least a year to a year and a half' to develop". The Hill. Retrieved 23 March 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ University of British Columbia (2 April 2020). "Trial drug can significantly block early stages of COVID-19 in engineered human tissues - 'There is hope for this horrible pandemic,' says UBC scientist Dr. Josef Penninger". EurekAlert!. Retrieved 4 April 2020.
- ^ Monteil, Vanessa; et al. (April 2020). "Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2" (PDF). Cell. doi:10.1016/j.cell.2020.04.004 (inactive 2020-04-05). Retrieved 4 April 2020.
{{cite journal}}: CS1 maint: DOI inactive as of أبريل 2020 (link) - ^ Zhang, Linlin; Lin, Daizong; Sun, Xinyuanyuan; Curth, Ute; Drosten, Christian; Sauerhering, Lucie; Becker, Stephan; Rox, Katharina; Hilgenfeld, Rolf (2020-03-20). "Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors". Science: eabb3405. doi:10.1126/science.abb3405. ISSN 0036-8075. PMID 32198291.
- ^ أ ب Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. (March 2020). "A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19". New England Journal of Medicine. doi:10.1056/nejmoa2001282. ISSN 0028-4793. PMID 32187464.
- ^ Bennett, Nelson (23 March 2020). "Vancouver biotech identifying antibodies for COVID-19". Business Vancouver. Retrieved 24 March 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "الولايات المتحدة ترخص كليا باستخدام دواء ريمديسيفير في معالجة المصابين بفيروس كورونا". فرانس 24. 2020-10-23. Retrieved 2020-10-23.
- ^ أ ب ت Kruse, Robert L. (31 January 2020). "Therapeutic strategies in an outbreak scenario to treat the novel coronavirus originating in Wuhan, China (Review)". F1000Research. 9: 72. doi:10.12688/f1000research.22211.1. ISSN 2046-1402. PMC 7029759. PMID 32117569.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث Mitjà, Oriol; Clotet, Bonaventura (2020). "Use of antiviral drugs to reduce COVID-19 transmission". The Lancet Global Health. Elsevier BV. doi:10.1016/s2214-109x(20)30114-5. ISSN 2214-109X. PMC 7104000. PMID 32199468.
- ^ "UN health chief announces global 'solidarity trial' to jumpstart search for COVID-19 treatment". United Nations - News. World Health Organization. 18 March 2020. Retrieved 29 March 2020.
- ^ Kupferschmidt, Kai; Cohen, Jon (26 March 2020). "Race to find COVID-19 treatments accelerates". Science. 367 (6485): 1412–1413. doi:10.1126/science.367.6485.1412. ISSN 0036-8075. PMID 32217705.
- ^ "COVID-19 drug development: Landscape analysis of therapeutics (table)" (PDF). United Nations, World Health Organization. 21 March 2020. Retrieved 29 March 2020.
قراءات إضافية
- McCreary, Erin K; Pogue, Jason M (23 March 2020). "COVID-19 Treatment: A Review of Early and Emerging Options". Open Forum Infectious Diseases. doi:10.1093/ofid/ofaa105. ISSN 2328-8957.
وصلات خارجية
| Find more about تطوير دواء كوڤيد-19 at Wikipedia's sister projects | |
| Definitions from Wiktionary | |
| Media from Commons | |
| News stories from Wikinews | |
| Travel guide from Wikivoyage | |
| Database entry Q81068910 on Wikidata | |
| Taxonomy of Severe acute respiratory syndrome coronavirus 2 from Wikispecies | |
- COVID-19 (Questions & Answers) by the World Health Organization
- COVID-19 (Q&A) by the US Centers for Disease Control and Prevention (CDC)
- Coronaviruses by US National Institute for Allergy and Infectious Diseases
- COVID-19 (Q&A) by the European Centre for Disease Prevention and Control
- COVID-19 by the China National Health Commission
- CS1 errors: unsupported parameter
- CS1 maint: numeric names: authors list
- CS1 maint: unflagged free DOI
- CS1 الصينية-language sources (zh)
- CS1 maint: DOI inactive as of أبريل 2020
- صفحات بالمعرفة فيها قوالب حماية خاطئة
- صفحات شبه محمية للأبد في المعرفة
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Anti-influenza agents
- Clinical research
- كوڤيد-19
- اكتشاف الأدوية
- Drugs
- National agencies for drug regulation
- صناعات دوائية
- Regulators of biotechnology products
- لقاحات